Журнал физической химии, 2020, T. 94, № 4, стр. 521-527
Термодинамические функции в бинарной системе производное фуллерена C60–метионин–Н2О
К. Н. Семенов a, b, Н. А. Чарыков a, d, А. В. Куриленко a, В. А. Кескинов a, c, *, Ж. К. Шаймарданов c, Б. К. Шаймарданова c, Н. А. Куленова c, М. Ю. Матузенко a, В. В. Клепиков a
a Санкт-Петербургский государственный технологический институт (технический университет)
190013 Санкт-Петербург, Россия
b Санкт-Петербургский государственный университет
199034 Санкт-Петербург, Россия
c Восточно-Казахстанский государственный технический университет им. Д. Серикбаева
Усть-Каменногорск, Казахстан
d Санкт-Петербургский государственный электротехнический университет “ЛЭТИ”
197376 Санкт-Петербург, Россия
* E-mail: keskinov@mail.ru
Поступила в редакцию 14.05.2019
После доработки 14.05.2019
Принята к публикации 15.06.2019
Аннотация
Температура начала кристаллизации льда (∆Т) определена для бинарных водных растворов водорастворимого трис-аддукта легкого фуллерена с метионином: С60(C5H11NO2S)3 в температурном интервале 272.58–273.15 K. Установлено, что концентрация бис-аддукта в шкале мольной доли варьировалась в широком диапазоне x = 0.000–7.71 × 10–5 отн. ед. Температуры ликвидуса определены с помощью термометра Бекмана с линейным разрешением шкалы прибора ∆T/∆h ≈ 0.01 K/мм. Рассчитаны парциальные молярные избыточные функции для H2O. Для термодинамического описания подобных систем разработана оригинальная полуэмпирическая модель VD-AS, основанная на вириальном разложении молярной энергии Гиббса по мольным долям компонентов в растворе. С помощью модели VD-AS рассчитаны парциальные молярные функции и бис-аддукта. Рассчитана избыточная и полная средние молярные энергии Гиббса растворов и концентрационные области несмешиваемости. Сделан вывод, что модель VD-AS точно описывает процессы предрасслаивания или образования микрогетерогенной структуры.
Статья является продолжением исследований, посвященных синтезу, идентификации и исследованию физико-химических и некоторых биологических свойств водорастворимых производных легких фуллеренов С60 и С70, таких как: сложные эфиры двухосновных карбоновых кислот (малонатов, оксалатов), полигидроксилированных форм (фуллеренолов), аддуктов с аминокислотами (aргинином, треонином, лизином, метионином и т.д.) [1–39 ]. В этих работах, в частности, изучались такие физико-химические свойства водных растворов производных легких фуллеренов, как концентрационные зависимости: объемных свойств (плотности, парциальных объемов компонентов и средних молярных объемов), рефракционных свойств (показателя преломления, удельной и молярной рефракции растворов и нанокластеров), явлений электропереноса (удельной и молярной электропроводности, водородного показателя, кажущихся степени и констант диссоциации), явлений ассоциации нанокластеров (размеров и типов ассоциатов, электрокинетических ζ-потенциалов), поверхностного натяжения и некоторых других.
Исследования поведения избыточных термодинамических функций (активностей, коэффициентов активности, избыточных энергий Гиббса (энтальпий, энтропий и т.п.), насколько известно авторам, практически не проводилось, за исключением нескольких оригинальных работ [40–43]. Этому имеется объяснение. Экспериментальное исследование подобных систем осложнено достаточно малой растворимостью последних (мольная доля нанокластеров в насыщенных растворах не превышает 0.001 отн. ед., что определяет низкую информативность наиболее точных и часто применяемых экспериментальных методов, например изопиестического. С точки зрения модельных построений, указанные системы ведут себя крайне необычно. Для них характерна иерархическая ассоциация с последовательным образованием ассоциатов первого, второго и, иногда, третьего порядка. Системы характеризуются гигантскими положительными отклонениями от идеальности, описать которые стандартными полуэмпирическими моделями (например, моделью Питцера для водных растворов электролитов [44, 45]) также не представляется возможным. В работах [40–43] на примере водных растворов водорастворимых производных легких фуллеренов проведены криометрические исследования, определены температуры начала кристаллизации льда, рассчитаны активности воды, а затем численным интегрированием уравнения Гиббса–Дюгема рассчитаны активности нанокластеров. В работах [40, 41] предложена оригинальная модель VD-AS (Virial Decomposition Asymmetric Model) для количественного описания подобных систем, и также рассчитаны концентрационные области диффузионной неустойчивости (микрогетерогенности) растворов.
Криометрические данные в бинарной системе С60(С5Н11NO2S)3–Н2О при 272.58–273.15 K
Понижение температур начала кристаллизации льда (∆T) была определена в системе трис-аддукт легкого фуллерена С60(С5Н11NO2S)3–Н2О при 272.58–273.15 K. Концентрации растворов (в мольных долях) варьировались в пределах Хnano-cluster = 0.000–7.71 × 10–5 отн. ед. Температуры ликвидуса определены с помощью термометра Бекмана с линейной разрешающей способностью ∆T/∆h ≈ 0.01 K/мм (h – высота поднятия Hg в капилляре). Криометрические данные ΔT(Хnano-cluster) представлены на рис. 1 и в табл. 1.
Рис. 1.
Концентрационная зависимость понижения температуры начала кристаллизации льда (температуры ликвидуса) (∆T) для бинарной системы: С60(С5Н11NO2S)3–H2O при 272.58–273.15 K. Стрелка демонстрирует ∆T для идеального раствора недиссоциирующего компонента (неэлектролита).
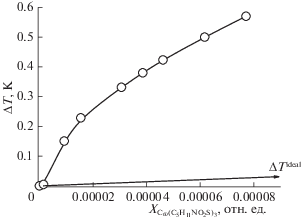
Таблица 1.
Криометрические данные и избыточные термодинамические функции в бинарной системе трис-аддукт легкого фуллерена С60(С5Н11NO2S)3–Н2О при 272.58–273.15 K (М = 1167 г/моль). При расчетах использована модель VD-AS
| ${{X}_{{{{{\text{С}}}_{{{\text{60}}}}}{{{{\text{(}}{{{\text{С}}}_{{\text{5}}}}{{{\text{Н}}}_{{{\text{11}}}}}{\text{N}}{{{\text{O}}}_{{\text{2}}}}{\text{S)}}}}_{{\text{3}}}}}}}$ × 105, отн. ед. | ∆T (K), отн. ед. | $ - \ln {{a}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}$ × 103, отн. ед. | $ - \ln {{\gamma }_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}$ ×103, отн. ед. | $\ln \gamma _{{{{{\text{С}}}_{{{\text{60}}}}}{{{{\text{(}}{{{\text{С}}}_{{\text{5}}}}{{{\text{Н}}}_{{{\text{11}}}}}{\text{N}}{{{\text{O}}}_{{\text{2}}}}{\text{S)}}}}_{{\text{3}}}}}}^{{{\text{as}}}}$, отн. ед. |
|---|---|---|---|---|
| 0.000 | 0.000 | 0.000 | 0.000 | 0.000 |
| 0.154 | 0.005 | 0.0556 | 0.0541 | 29.10 |
| 0.925 | 0.150 | 1.68 | 1.67 | 150.0 |
| 1.54 | 0.230 | 2.55 | 2.53 | 217.4 |
| 3.08 | 0.325 | 3.7 | 3.66 | 272.5 |
| 3.85 | 0.380 | 4.24 | 4.20 | 239.0 |
| 4.62 | 0.415 | 4.72 | 4.68 | 167.8 |
| 6.16 | 0.500 | 5.58 | 5.52 | –100.1 |
| 7.71 | 0.570 | 6.37 | 6.29 | –524.2 |
На рис. 1 видно, что зависимость $\Delta T({{X}_{{{{{\text{С}}}_{{{\text{60}}}}}{{{{\text{(}}{{{\text{С}}}_{{\text{5}}}}{{{\text{Н}}}_{{{\text{11}}}}}{\text{N}}{{{\text{O}}}_{{\text{2}}}}{\text{S)}}}}_{{\text{3}}}}}}})$ существенно нелинейна, сама система демонстрирует очень сильные положительные отклонения от идеальности, даже в случае очень разбавленных растворов. На рис. 1 также стрелкой представлено ∆T для идеального раствора недиссоциирующего компонента (неэлектролита) – ∆Тideal. В значения ∆Т превосходят ∆Тideal на один–два порядка.
Расчет избыточных термодинамических функций H2О в растворе
Для расчета активности воды нами использовано хорошо известное уравнение, получаемое из равенства химических потенциалов H2O в однокомпонентном льду и водном жидком растворе [40–43]:
(1)
$[--\Delta H_{{\text{W}}}^{{\text{f}}}\Delta T\,--\,\Delta {{C}_{P}}\Delta {{T}^{2}}]{\text{/}}[R(T_{0}^{{\text{f}}}\,--\,\Delta T)T_{0}^{{\text{f}}}]\, = \,\ln {{a}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}},$(2)
${{a}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{O}}}}}({{Х}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{O}}}}} = 1) = {{\gamma }_{{{{{\text{Н}}}_{{\text{2}}}}{\text{O}}}}}({{Х}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{O}}}}} = 1) = 1,$(3)
$\begin{gathered} {{X}_{{{{{\text{С}}}_{{{\text{60}}}}}{{{{\text{(}}{{{\text{С}}}_{{\text{5}}}}{{{\text{Н}}}_{{{\text{11}}}}}{\text{N}}{{{\text{O}}}_{{\text{2}}}}{\text{S)}}}}_{{\text{3}}}}}}}({{Х}_{{{{{\text{С}}}_{{{\text{60}}}}}{\text{(}}{{{\text{С}}}_{{\text{5}}}}{{{\text{Н}}}_{{{\text{11}}}}}}}}_{{{\text{N}}{{{\text{O}}}_{{\text{2}}}}{\text{S}}{{{\text{)}}}_{{\text{3}}}}}} = 1) = \\ = {{\gamma }_{{{{{\text{С}}}_{{{\text{60}}}}}{{{{\text{(}}{{{\text{С}}}_{{\text{5}}}}{{{\text{Н}}}_{{{\text{11}}}}}{\text{N}}{{{\text{O}}}_{{\text{2}}}}{\text{S)}}}}_{{\text{3}}}}}}}({{Х}_{{{{{\text{С}}}_{{{\text{60}}}}}{{{{\text{(}}{{{\text{С}}}_{{\text{5}}}}{{{\text{Н}}}_{{{\text{11}}}}}{\text{N}}{{{\text{O}}}_{2}}{\text{S)}}}}_{3}}}}} = 1) = 1, \\ \end{gathered} $Рис. 2.
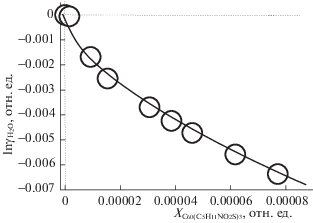
Концентрационная зависимость логарифма активности Н2О ($\ln {{a}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}$) для бинарной системы С60(С5Н11NO2S)3–H2O в интервале температур 272.58–273.15 K.
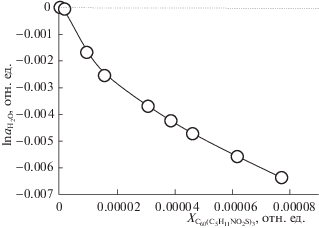
Ранее авторы [42, 43] рассчитывали концентрационные зависимости $\ln {{\gamma }_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}$ и производных $d\ln {{\gamma }_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}$/dXnano-cluster (численно). Далее авторы [42, 43] получали зависимости dln γnano-cluster/Хnano-cluster, (согласно уравнению Гиббса–Дюгема), а затем также численным интегрированием рассчитывали зависимости ln γnano-cluster(Хnano-cluster). В результате, как и ожидалось, были получены гигантские положительные отклонения от идеальности: ln γnano-cluster ≈ n(100–101–102 отн. ед. Для изучаемой системы С60(С5Н11NO2S)3–H2O в области диффузионной стабильности растворов отмечен аналогичный результат (табл. 1 и ниже – рис. 3). Естественно, что для описания таких гигантских отклонений от идеальности оказались неприменимыми классические полуэмпирические модели растворов. Для этих целей авторами в [40, 41] была разработана оригинальная модель VD-AS, которая вполне успешно справилась с описанием водных растворов производных легких фуллеренов.
Модель VD-AS
Полуэмпирическая модель VD-AS (Virial Decomposition Asymmetric Model) основана на вириальном разложении избыточной молярной энергии Гиббса раствора по мольным долям компонентов. Этот прием и ранее часто использовался при описании систем различной природы: растворов электролитов [44–47], расплавов неэлектролитов (полупроводников) [48–51], твердых растворов изовалентного замещения [52–54]. Если в подобном разложении ограничиться только одним членом (см. ниже) реализуется хорошо известная модель строго регулярных растворов – RSM. При учете температурной зависимости этого единственного вириального коэффициента модель RSM переходит в модель квазирегулярных растворов – QRSM. Если использовать третьи вириальные коэффициенты в разложении (см. ниже) реализуется модель субрегулярных растворов – SRSM. Наконец, при учете вклада неспецифических электростатических взаимодействий в избыточные функции раствора (согласно теории Дебая–Хюккеля) реализуется модель Питцера в различных вариантах.
Пусть: 1 – номер растворенного компонента (в нашем случае нанокластера), 2 – номер растворителя (H2O). Постулируем следующее уравнение:
(4)
$\begin{gathered} {{G}^{{{\text{ex}}}}}{\text{/}}RT = ({{n}_{1}} + {{n}_{2}}){{\Sigma }_{{i = 1}}}{{\Sigma }_{{j = 1}}}Х_{1}^{i}Х_{2}^{j}{\kern 1pt} *{\kern 1pt} {{\lambda }_{{ij}}} = \\ = ({{\Sigma }_{{i = 1}}}{{\Sigma }_{{j = 1}}}n_{1}^{i}n_{2}^{j}{\kern 1pt} *{\kern 1pt} {{\lambda }_{{ij}}}){\text{/}}{{({{n}_{1}} + {{n}_{2}})}^{{i + j--}}}^{1}, \\ \end{gathered} $Рассчитаем теперь избыточные функции компонентов: lnγi:
(5.1)
$\begin{gathered} \ln {{\gamma }_{1}} = \partial ({{G}^{{{\text{ex}}}}}{\text{/}}RT){\text{/}}\partial {{n}_{1}} = \\ = {{\Sigma }_{{i = 1}}}{{\Sigma }_{{j = 1}}}[i--(i + j--1){{X}_{1}}]X_{1}^{{i - 1}}X_{2}^{j}{{\lambda }_{{ij}}}, \\ \end{gathered} $(5.2)
$\begin{gathered} \ln {{\gamma }_{2}} = \partial ({{G}^{{{\text{ex}}}}}{\text{/}}RT){\text{/}}\partial {{n}_{2}} = \\ = {{\Sigma }_{{i = 1}}}{{\Sigma }_{{j = 1}}}[j--(i + j--1){{X}_{2}}]X_{1}^{i}X_{2}^{{j - 1}}{{\lambda }_{{ij}}}. \\ \end{gathered} $(7.1)
$\ln {{\gamma }_{1}} \approx {{\Sigma }_{{i = 1}}}iX_{1}^{{i - 1}}{{\Sigma }_{{j = 1}}}{{\lambda }_{{ij}}},$(7.2)
$\ln {{\gamma }_{2}} \approx {{\Sigma }_{{i = 1}}}(1 - i)X_{1}^{i}{{\Sigma }_{{j = 1}}}{{\lambda }_{{ij}}} = {{\Sigma }_{{i = 2}}}(1 - i)X_{1}^{i}{{\Sigma }_{{j = 1}}}{{\lambda }_{{ij}}}.$(8.2)
$\begin{gathered} {{X}_{1}}{{\Sigma }_{{i = 1}}}i(i - 1)X_{1}^{{i - 2}}{{\lambda }_{{ij}}}d{{X}_{1}} + \\ + \;{{\Sigma }_{{i = 1}}}(1 - i)iX_{1}^{{i - 1}}{{\lambda }_{{ij}}}d{{X}_{1}} = 0. \\ \end{gathered} $(10.2)
$\ln {{\gamma }_{2}} \approx {{\Sigma }_{{i = 1}}}(1 - i){{\Lambda }_{i}}X_{1}^{i} = {{\Sigma }_{{i = 2}}}(1 - i){{\Lambda }_{i}}X_{1}^{i}.$(11.1)
$\ln \gamma _{1}^{0} = {{\Lambda }_{1}} \ne 0,\quad {{\gamma }_{1}}({{Х}_{1}} \to 0) = \gamma _{1}^{0} \ne 1,$(12.3)
$\ln \gamma _{1}^{{{\text{ass}}}} \approx {{\Sigma }_{{i = 2}}}i{{\Lambda }_{i}}X_{1}^{{i - 1}},$(12.4)
$\ln \gamma _{2}^{{{\text{ass}}}} \approx {{\Sigma }_{{i = 2}}}(1 - i){{\Lambda }_{i}}X_{1}^{i},$Рассмотрим функцию Gmix/RT (приведенную к RT молярную энергию Гиббса смешения) и вторую производную от Gmix/RT, которая численно совпадает со второй производной от полной молярной свободной энергии Гиббса, отнесенной к RT – Gmix/RT
(13.1)
$\begin{gathered} {{G}^{{{\text{mix}}}}}{\text{/}}RT = {{X}_{1}}\ln {{X}_{1}} + {{X}_{2}}\ln {{X}_{2}} + \\ + \;{{X}_{1}}\ln {{\gamma }_{1}} + {{X}_{2}}\ln {{\gamma }_{2}}, \\ \end{gathered} $(13.2)
$\begin{gathered} \partial [{{G}^{{{\text{mix}}}}}{\text{/}}RT]{\text{/}}\partial {{X}_{1}} = 1{\text{/}}{{X}_{1}} + 1{\text{/}}{{X}_{2}}--(\ln {{X}_{2}} + 1) + \\ + \;{{\Sigma }_{{i = 1}}}{{i}^{2}}{{\Lambda }_{i}}{{X}_{1}}{{^{{i - }}}^{1}} + {{\Sigma }_{{i = 2}}}(1 - i){{\Lambda }_{i}}[i(i - 1)X_{1}^{{i - 2}} - \\ --\;(i + 1)X_{1}^{{i - 1}}], \\ \end{gathered} $(13.3)
${{\partial }^{2}}[{{G}^{{{\text{mix - ass}}}}}{\text{/}}RT]{\text{/}}\partial X_{1}^{2}\, \approx \,1{\text{/}}{{X}_{1}}\, + \,{{\Sigma }_{{i = 2}}}i(i\, - \,1){{\Lambda }_{i}}X_{1}^{{i - 2}}.$(14)
$\begin{gathered} 1{\text{/}}RT(\partial {{\mu }_{1}}{\text{/}}\partial {{X}_{1}}) = (\partial \ln {{a}_{{\text{1}}}}{\text{/}}\partial {{X}_{1}}) \approx \\ \approx 1{\text{/}}{{X}_{1}} + {{\Sigma }_{{i = 2}}}i(i - 1){{\Lambda }_{i}}X_{1}^{{i = 2}}. \\ \end{gathered} $(15)
$\begin{gathered} G_{{11}}^{{{\text{mix - ass}}}} = {{\partial }^{2}}[{{G}^{{{\text{mix - ass}}}}}{\text{/}}RT]{\text{/}}\partial X_{1}^{2} = \\ = (\partial \ln {{a}_{1}}{\text{/}}\partial {{X}_{1}}) \approx 1{\text{/}}{{X}_{1}} + {{\Sigma }_{{i = 2}}}i(i - 1){{\Lambda }_{i}}X_{1}^{{i - 2}} = 0. \\ \end{gathered} $Применение модели VD-AS к описанию избыточных функций производных легких фуллеренов в системе С60(С5Н11NO2S)3–H2O. Области диффузионной неустойчивости
Предварительные расчеты показали, что трехчленной аппроксимации в модели VD-AS – (i.e. i = 2, 3, 4) вполне достаточно для достаточно точного описания избыточных функций в системе С60(С5Н11NO2S)3–H2O, как и ранее в иных подобных системах [42, 43]:
(16.1)
$\ln \gamma _{1}^{{{\text{ass}}}} \approx 2{{\Lambda }_{2}}{{X}_{1}} + 3{{\Lambda }_{3}}X_{1}^{2} + 4{{\Lambda }_{4}}X_{1}^{3},$(16.2)
$\ln \gamma _{2}^{{{\text{ass}}}} \approx - {{\Lambda }_{2}}X_{1}^{2} - 2{{\Lambda }_{3}}X_{1}^{3} - 3{{\Lambda }_{4}}X_{1}^{4}.$(16.3)
$12{{\Lambda }_{4}}X_{1}^{3} + 6{{\Lambda }_{3}}X_{1}^{2} + 2{{\Lambda }_{2}}{{X}_{1}} + 1 = 0.$(17)
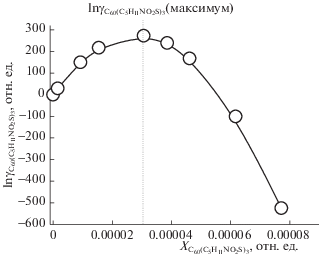
$\begin{gathered} \ln {{\gamma }_{2}} = \ln {{\gamma }_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}} = \ln {{a}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}--\ln {{X}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}} = \\ = \ln {{a}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}--\ln (1--{{X}_{1}}). \\ \end{gathered} $Далее, согласно уравнению (16.1), мы рассчитали концентрационные зависимости $\ln \gamma _{1}^{{{\text{ass}}}}$(Х1) (табл. 1 и рис. 4). Из рис. 4 видно, что зависимость $\ln \gamma _{1}^{{{\text{ass}}}}$(Х1) проходит через максимум при: Х1 ≈ 3 × 10–5 отн. ед. Установить положение максимума по уравнению (16.1) легко, решая квадратное уравнение:
(18)
$(1{\text{/}}2)d(\ln \gamma _{1}^{{{\text{ass}}}}{\text{/}}d{{X}_{1}}) = {{\Lambda }_{2}} + 3{{\Lambda }_{3}}{{X}_{1}} + 6{{\Lambda }_{4}}X_{1}^{2} = 0,$(19)
${{X}_{1}} = [--1.5{{\Lambda }_{3}} \pm {{(4.5\Lambda _{3}^{2} - 12{{\Lambda }_{2}}{{\Lambda }_{4}})}^{{1/2}}}]{\text{/}}{{\Lambda }_{2}}.$Рис. 4.
Концентрационная зависимость логарифма коэффициента активности С60(С5Н11NO2S)3 для бинарной системы С60(С5Н11NO2S)3–H2O в интервале температур 272.58–273.15 K.
Согласно уравнению (16.3) определили границы диффузионной устойчивости – Xdiff-instab (табл. 2 и рис. 5), решая кубическое уравнение:
(20)
$F = 12{{\Lambda }_{4}}X_{1}^{3} + 6{{\Lambda }_{3}}X_{1}^{2} + 2{{\Lambda }_{2}}{{X}_{1}} + 1 = 0.$Рис. 5.
Концентрационная зависимость функции диффузионной неустойчивости: F = 12Λ4$X_{1}^{3}$ + 6Λ3$X_{1}^{2}$ + + 2Λ2X1 + 1 для бинарной системы С60(С5Н11NO2S)3–H2O в интервале температур 272.58–273.15 K.

Процессы ассоциации в системах водорастворимое производное легкого фуллерена–Н2О изучались неоднократно методом динамического светорассеяния (см., в частности работы [22–24, 26, 40]). Установлено, что с ростом концентраций последовательно образуются из мономерных молекул ассоциаты первого порядка, из них – ассоциаты второго порядка и, наконец, из них – ассоциаты третьего порядка. В связи с этим представляется уместным, с точки зрения, факта потери раствором диффузионной устойчивости, с одной стороны, и линейных размеров превалирующих ассоциатов, с другой стороны, разделить концентрационный интервал на 4 зоны:
I. Первая зона при ${{Х}_{{{{{\text{С}}}_{{{\text{60}}}}}{{{{\text{(}}{{{\text{С}}}_{{\text{5}}}}{{{\text{Н}}}_{{{\text{11}}}}}{\text{N}}{{{\text{O}}}_{{\text{2}}}}{\text{S)}}}}_{{\text{3}}}}}}}$ → 0 (бесконечно разбавленный раствор), где присутствуют только мономеры с линейными размерами около 2 нм. Этой зоны мы в эксперименте не наблюдали ни в одной из изученных систем [22–24, 26, 40]. Растворы истинные и абсолютно стабильные.
II. Во второй зоне при ${{Х}_{{{{{\text{С}}}_{{{\text{60}}}}}{{{{\text{(}}{{{\text{С}}}_{{\text{5}}}}{{{\text{Н}}}_{{{\text{11}}}}}{\text{N}}{{{\text{O}}}_{{\text{2}}}}{\text{S)}}}}_{{\text{3}}}}}}}$ < < $Х_{{{{{\text{С}}}_{{{\text{60}}}}}{{{{\text{(}}{{{\text{С}}}_{{\text{5}}}}{{{\text{Н}}}_{{{\text{11}}}}}{\text{N}}{{{\text{O}}}_{{\text{2}}}}{\text{S)}}}}_{{\text{3}}}}}}^{{{\text{diff - instab}}}}$ ≈ 3.1 × 10–5 отн. ед. в растворе образуются “малые ассоциаты” (с линеными размерами десятки – первые сотни нм). Растворы становятся наноколлоидными.
III. В третьей зоне при ${{Х}_{{{{{\text{С}}}_{{{\text{60}}}}}{{{{\text{(}}{{{\text{С}}}_{{\text{5}}}}{{{\text{Н}}}_{{{\text{11}}}}}{\text{N}}{{{\text{O}}}_{{\text{2}}}}{\text{S)}}}}_{{\text{3}}}}}}}$ ≈ ≈ $Х_{{{{{\text{С}}}_{{{\text{60}}}}}{{{{\text{(}}{{{\text{С}}}_{{\text{5}}}}{{{\text{Н}}}_{{{\text{11}}}}}{\text{N}}{{{\text{O}}}_{{\text{2}}}}{\text{S)}}}}_{{\text{3}}}}}}^{{{\text{diff - instab}}}}$ ≈ 3.1 × 10–5 отн. ед. в добавление к “малым ассоциатам” в растворе появляются “большие ассоциаты” с линейными размерами последние сотни нм вплоть до 1 мкм. Растворы становятся микроколлоидными и начинают терять диффузионную устойчивость, т.е. предрасслаиваться.
В четвертой зоне при ${{Х}_{{{{{\text{С}}}_{{{\text{60}}}}}{{{{\text{(}}{{{\text{С}}}_{{\text{5}}}}{{{\text{Н}}}_{{{\text{11}}}}}{\text{N}}{{{\text{O}}}_{{\text{2}}}}{\text{S)}}}}_{{\text{3}}}}}}}$ > > $Х_{{{{{\text{С}}}_{{{\text{60}}}}}{{{{\text{(}}{{{\text{С}}}_{{\text{5}}}}{{{\text{Н}}}_{{{\text{11}}}}}{\text{N}}{{{\text{O}}}_{{\text{2}}}}{\text{S)}}}}_{{\text{3}}}}}}^{{{\text{diff - instab}}}}$ или ${{Х}_{{{{{\text{С}}}_{{{\text{60}}}}}{{{{\text{(}}{{{\text{С}}}_{{\text{5}}}}{{{\text{Н}}}_{{{\text{11}}}}}{\text{N}}{{{\text{O}}}_{{\text{2}}}}{\text{S)}}}}_{{\text{3}}}}}}}$ ≫ $Х_{{{{{\text{С}}}_{{{\text{60}}}}}{{{{\text{(}}{{{\text{С}}}_{{\text{5}}}}{{{\text{Н}}}_{{{\text{11}}}}}{\text{N}}{{{\text{O}}}_{{\text{2}}}}{\text{S)}}}}_{{\text{3}}}}}}^{{{\text{diff - instab}}}}$ появляются “суперассоциаты” с линейными размерами несколько мкм. Растворы быстро теряют диффузионную устойчивость, становятся реальными коллоидными или гетерогенными.
Работа выполнена при поддержке Российского фонда фундаментальных исследований (коды проектов №№ 18-08-00143 А, 19-015-00469 А, 19-016-00003 А).
Список литературы
Li J., Takeuchi A., Ozawa M. et al. // J. Chem. Soc. Chem. Commun. 1993. V. 23. P. 1784.
Chiang L.Y., Bhonsle J.B., Wang L. et al. // Tetrahedron. 1996. V. 52. P. 4963.
Chiang L.Y., Upasani R.B., Swirczewski J.W. // J. Am. Chem. Soc. 1992. V. 114. P. 10154.
Meier M.S., Kiegiel J. // Org. Lett. 2001. V. 3. P. 1717.
Szymanska L., Radecka H., Radecki J. et al. // Biosens. Bioelectron. 2001. V. 16. P. 911.
Mirkov S.M., Djordjevic A.N., Andric N.L. et al. // Nitric Oxide. 2004. V. 11. P. 201.
Kokubo K., Matsubayashi K., Tategaki H. et al. // ACS Nano. 2008. V. 2. № 2. P. 327.
Yang J.M., He W., Ping H. et al. // Chinese. J. Chem. 2004. V. 22. № 9. P. 1008.
Sheng W., Ping H., Jian_Min Z. et al. // Synthetic Communications. 2005. V. 35. № 13. P. 1803.
Chiang Long Y. Fullerene Derivatives as Free_Radical Scavengers. US patent 5648523. July 15. 1997.
Lamparth I., Hirsch A. // J. Chem. Soc. Chem. Commun. 1994. P. 1727.
Liang Bing Gan, Chu Ping Luo // Chinese Chemical Letters .1994. V. 5. № 4. P. 275.
Kotelnikova R.A., Kotelnikov A.I., Bogdanov G.N. et al. // FEBS Lett. 1996. V. 389. P. 111.
Hu Z., Guan W., Wang W. et al. // Carbon. 2008. V. 46. P. 99.
Kumar A., Rao M.V., Menon S.K. // Tetrahedron Lett. 2009. V. 50. P. 6526.
Jiang G., Yin F., Duan J., Li G. // J. Mater. Sci: Mater. Med. 2015.V. 26. P. 1.
Grigoriev V.V., Petrova L.N., Ivanova T.A. et al. // Biology Bull. 2011. V. 38. P. 125.
Kotel’nikova R.A., Faingol’d I.I., Poletaeva D.A. et al. // Rus. Chem. Bull. 2011. V. 6. P. 1172.
Leon A., Jalbout A.F., Basiuk V.A. // Chem. Phys. Lett. 2008. V. 452. P. 306.
Hu Y.H., Ruckenstein E. // Mol. Struct. Theochem. 2008. V. 865. P. 94.
Semenov K.N., Charykov N.A., Postnov V.N. et al. // Rus. Chem. Rev. 2016. V. 85. P. 38.
Semenov K.N., Charykov N.A., Murin I.V. et al. // J. Molecular Liquids. 2015. V. 202. P. 50.
Semenov K.N., Charykov N.A., Murin I.V. et al. // J. Molecular Liquids. 2015. V. 202. P. 1.
Manyakina O.S., Semenov K.N., Charykov N.A. et al. // J. Molecular Liquids. 2015. V. 211. P. 487.
Semenov K.N., Charykov N.A., Keskinov V.A. et al. // Rus. J. Phys. Chem. V. 85. № 6. P. 1009.
Semenov K.N., Charykov N.A., Keskinov V.A. et al. // J. Chem. Eng. Data. 2011. V. 56. P. 230.
Lushin A.I., Charykov N.A., Semenov K.N. et al. // Industrial and Engineering Chemical Research. 2013. V. 52. P. 14583.
Semenov K.N., Charykov N.A., Keskinov V.A. et al. // Ibid. 2013. V. 52. P. 16095.
Shestopalova A.A., Semenov K.N., Charykov N.A. et al. // J. Molecular Liquids. V. 211. 2015. P. 301.
Semenov K.N., Postnov V.N., Charykov N.A. et al. // Rus. J. Appl.Chem. 2011. T. 84. № 1. P. 44.
Semenov K.N., Letenko D.G., Charykov N.A. et al. // Ibid. 2010. V. 83. P. 1948.
Семенов К.Н., Иванова Н.М., Чарыков Н.А. и др. // Журн. физ. химии. 2017. Т. 91. № 2. С. 318.
Semenov K.N., Meshcheriakov A.A., Charykov N.A. et al. // RSC Advances. 2017. № 7. P. 15189.
Noskov B.A., Timoshen K.A., Akentiev Al.V. et al. // Colloids and Surfaces A: Physicochemical and Engineering Aspects. 2017. V. 529. P. 1.
Lelet M.I., Semenov K.N., Andrusenko El.V. et al. // J. Chem. Thermodynamics. 2017. V. 115. P. 7.
Semenov K.N., Charykov N.A., Meshcheriakov A.A. et al. // J. Molecular Liquids. 2017. V. 242. P. 940.
Semenov K.N., Andrusenko El.V., Charykov N.A. et al. // Progress in Solid State Chemistry. 2017. V. 47–48. P. 1.
Serebryakov E.B., Semenov K.N., Stepanyuk I.V. et al. // J. Molecule Liquids. 2018. V. 256. P. 507.
Yur'ev G.O., Lelet M.I., Pochkayeva E.A. et al. // J. Chem. Thermodynamics 2018. V. 127. P. 39.
Charykov N.A., Semenov K.N., López En.R. et al. // J. Molecule Liquids. 2018. V. 256. P. 305.
Safyannikov N.M., Charykov N.A., Garamova P.V. et al. // Nanosystems: Physics, Chemistry, Mathematics. 2018. V. 9. № 1. P. 46.
Matuzenko M.Yu., Shestopalova A.A., Semenov K.N. et al. // Nanosystems: Physics, Chemistry, Mathematics. 2015. V. 6. № 5. P. 715.
Matuzenko M.Yu., Tyurin D.P., Manyakina O.S. et al. // Ibid. 2015. V. 6. № 4. P. 704.
Pitzer K.S. // J. Phys. Chem. 1973. V. 77. № 2. P. 268.
Pitzer K.S., Kim J.J. // J. Amer. Chem. Soc. 1974. V. 96. № 18. P. 5701.
Filippov V.K., Charykov N.A., Rumyantsev A.V. // Rep. Rus. Acad. Sciences. Seria: Physics-Chemistry. 1987. V. 296. № 3. P. 665.
Чарыкова М.В., Чарыков Н.А. Термодинамическое моделирование процессов эвапоритовой седиментации. СПб.: Наука, 2003.
Charykov N.A., Litvak A.M., Mikhailova M.P. et al. // Rus. Phys. and Tech. Semic. 1997. V. 31. № 4. P. 410.
Litvak A.M., Charykov N.A. // Rus. J. Phys. Chem. 1990. V. 64. № 9. P. 2331.
Litvak A.M., Moiseev K.D., Charykov N.A. et al. // Rus. Tech. Phys. Lett. 1990. V. 16. № 13. P. 41.
Baranov A.N., Guseinov A.A., Litvak A.M. et al. // Ibid. 1990. V. 16. № 5. P. 33.
Stringfellow G.B. J. Elecrctron. Mat. 1981. V. 10. № 5. P. 919–936.
Stringfellow G.B. // J. Cryst. Growth. 1982. V. 58. P. 194.
Litvak A.M., Charykov N.A. // Rus. J. Neorg. Chem. 1990. V. 35. № 12. P. 3059.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии