Журнал физической химии, 2020, T. 94, № 4, стр. 516-520
Объемные свойства водных растворов ацетамида в интервале температур 274.15–333.15 K
Д. М. Макаров a, *, Г. И. Егоров a, А. М. Колкер a
a Российская академия наук, Институт химии растворов им. Г.А. Крестова
Иваново, Россия
* E-mail: dmm@isc-ras.ru
Поступила в редакцию 15.02.2019
После доработки 15.02.2019
Принята к публикации 17.09.2019
Аннотация
Измерены плотности водных растворов ацетамида до мольной доли x2 = 0.3875 в широком интервале температур 274.15–333.15 K при атмосферном давлении. Рассчитаны парциальные мольные объемы воды и ацетамида, парциальные мольные изобарные расширяемости компонентов, а также предельные парциальные свойства ацетамида в воде. В области низких температур рассчитан сдвиг температуры максимальной плотности воды. Полученные результаты обсуждены с учетом взаимодействий растворенное вещество – растворитель и растворенное вещество – растворенное вещество.
Межмолекулярное связывание воды с функциональными фрагментами белков определяет трехмерную структуру и их биологическую активность [1]. Из-за большого количества и разнообразия таких взаимодействий возникают трудности выделения конкретных вкладов, ответственных за стабилизацию белка в условиях стресса. Поэтому до сих пор нет общепринятого механизма, который охарактеризовал бы термодинамическую устойчивость нативной структуры белка. В настоящее время один из действенных подходов – изучение модельных соединений, имеющих изолированный тип функциональной группы, которые встречаются в биологических системах, таких как аминокислоты, небольшие пептиды и их производные [2, 3]. Составление схемы аддитивности из таких функциональных групп дает возможность оценить термодинамические свойства полностью развернутой полипептидной цепи белка [4].
Амиды уксусной кислоты: ацетамид и N-метилацетамид представляют собой упрощенный пример пептидной связи и имеют несколько функциональных групп в белках и нуклеиновых кислотах. Например, они служат модельной системой для пептидной группы, боковых цепей аспарагина и глутамина. Понимание того, как эти группы могут взаимодействовать друг с другом и с окружающими их молекулами воды, может дать ценную информацию, объясняющую формирование нативной структуры белков.
Ацетамид и его водные растворы были широко изучены экспериментально с помощью ИК-спектроскопии [5], рамановской спектроскопии [6], диэлектрической релаксации [7] и осмометрии [8], а также расчетными методами молекулярной динамики [9] и квантовой химии [10, 11]. В литературе экспериментальных данных по объемным характеристикам водных растворов ацетамида представлено мало. Плотности этого раствора ранее были изучены в широком концентрационном интервале лишь при двух температурах: 293.15 [12, 13] и 298.15 K [13, 14]. В работах [15–20] изучали только сильно разбавленные растворы ацетамида в воде при 298.15 K.
В настоящей работе эксперимент выполнен в широких концентрационных и температурных интервалах и продолжает наши ранние исследования объемных свойств водных растворов биологически активных веществ с различным характером межмолекулярного взаимодействия в зависимости от состава, температуры и давления [21–23].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Ацетамид (Acros, массовая доля 0.995) использовали без дальнейшей очистки. Содержание воды в амиде проверяли титрованием по методу Фишера, оно не превышало 5 × 10–5 мол. доли. Бидистиллированную и дегазированную воду с электропроводностью <2 × 10–6 См см–1 использовали для приготовления растворов гравиметрическим методом с точностью ±5 × 10–5 г. По оценкам, ошибка в определении мольной доли ацетамида (x2) составляла ±1 × 10–4. Плотности измеряли с помощью плотномера Anton Paar DMA-4500. Перед каждым измерением плотномер калибровали сухим воздухом и бидистиллированной водой. Все измерения проводили при атмосферном давлении, (p = 101.3 ± 1.0 кПа), в интервале температур 274.15–333.15 K. При температурах 278.15, 288.15, 298.15, 308.15, 323.15 и 333.15 K измерения проводили для области составов до x2 = 0.3875. В интервале 274.15–277.15 K с шагом в 0.5 K плотности измеряли для разбавленных растворов до мольной доли ацетамида в воде x2 = 0.0499. Температуру поддерживали в пределах 0.01 K. Воспроизводимость значений плотности составляла 1 × 10–5 г см–3. Общая неопределенность при измерении плотности не превышала 1 × 10–4 г см–3.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Плотности водного раствора ацетамида при различных температурах представлены в табл. 1. Величины плотности увеличиваются с ростом концентрации ацетамида и уменьшаются при увеличении температуры.
Таблица 1.
Плотность (ρ, г см–3) водных растворов ацетамида при разных концентрациях и температурах
| x2 | 274.15 K | 274.65 K | 275.15 K | 275.65 K | 276.15 K |
|---|---|---|---|---|---|
| 0.0000 | 0.99990 | 0.99992 | 0.99994 | 0.99995 | 0.99996 |
| 0.0045 | 1.00115 | 1.00115 | 1.00116 | 1.00117 | 1.00117 |
| 0.0070 | 1.00183 | 1.00183 | 1.00183 | 1.00184 | 1.00183 |
| 0.0125 | 1.00336 | 1.00335 | 1.00334 | 1.00333 | 1.00331 |
| 0.0221 | 1.00599 | 1.00596 | 1.00595 | 1.00590 | 1.00586 |
| 0.0370 | 1.01000 | 1.00994 | 1.00988 | 1.00982 | 1.00976 |
| 0.0499 | 1.01330 | 1.01323 | 1.01316 | 1.01308 | 1.01299 |
| x2 | 276.65 К | 277.15 К | 277.65 К | 278.15 К | 288.15 К |
| 0.0000 | 0.99997 | 0.99997 | 0.99997 | 0.99996 | 0.99910 |
| 0.0045 | 1.00117 | 1.00116 | 1.00115 | 1.00113 | 1.00013 |
| 0.0070 | 1.00182 | 1.00181 | 1.00179 | 1.00177 | 1.00068 |
| 0.0125 | 1.00329 | 1.00327 | 1.00324 | 1.00321 | 1.00193 |
| 0.0221 | 1.00582 | 1.00578 | 1.00573 | 1.00568 | 1.00408 |
| 0.0370 | 1.00968 | 1.00961 | 1.00955 | 1.00947 | 1.00737 |
| 0.0499 | 1.01290 | 1.01281 | 1.01272 | 1.01261 | 1.01012 |
| 0.0607 | 1.01511 | 1.01230 | |||
| 0.0796 | 1.01924 | 1.01592 | |||
| 0.0946 | 1.02232 | 1.01865 | |||
| 0.1128 | 1.02582 | 1.02171 | |||
| 0.1325 | 1.02934 | 1.02481 | |||
| 0.1590 | 1.03354 | 1.02850 | |||
| 0.1991 | 1.03857 | 1.03299 | |||
| 0.2503 | 1.04375 | 1.03761 | |||
| 0.3039 | 1.04106 | ||||
| 0.3455 | 1.04319 |
| x2 | 298.15 K | 308.15 K | 323.15 K | 333.15 K |
|---|---|---|---|---|
| 0.0000 | 0.99704 | 0.99403 | 0.98803 | 0.98319 |
| 0.0045 | 0.99795 | 0.99484 | 0.98872 | 0.98381 |
| 0.0070 | 0.99845 | 0.99528 | 0.98909 | 0.98415 |
| 0.0125 | 0.99955 | 0.99627 | 0.98994 | 0.98493 |
| 0.0221 | 1.00145 | 0.99797 | 0.99140 | 0.98629 |
| 0.0370 | 1.00439 | 1.00060 | 0.99365 | 0.98830 |
| 0.0499 | 1.00682 | 1.00279 | 0.99548 | 0.98993 |
| 0.0607 | 1.00875 | 1.00454 | 0.99695 | 0.99124 |
| 0.0796 | 1.01195 | 1.00737 | 0.99936 | 0.99338 |
| 0.0946 | 1.01435 | 1.00949 | 1.00116 | 0.99500 |
| 0.1128 | 1.01706 | 1.01189 | 1.00322 | 0.99686 |
| 0.1325 | 1.01979 | 1.01432 | 1.00531 | 0.99872 |
| 0.1590 | 1.02307 | 1.01725 | 1.00778 | 1.00101 |
| 0.1991 | 1.02709 | 1.02083 | 1.01087 | 1.00380 |
| 0.2503 | 1.03118 | 1.02452 | 1.01396 | 1.00663 |
| 0.3039 | 1.03429 | 1.02728 | 1.01634 | 1.00873 |
| 0.3455 | 1.03618 | 1.02897 | 1.01776 | 1.01004 |
| 0.3875 | 1.03752 | 1.03020 | 1.01881 | 1.01098 |
На основе экспериментальных значений плотности рассчитаны парциальные мольные объемы воды (${{V}_{1}}$) и ацетамида (${{V}_{2}}$), которые были определены из уравнений:
(1)
${{V}_{1}} = {{V}_{m}} - {{x}_{2}}\left( {\frac{{\partial {{V}_{m}}}}{{\partial {{x}_{2}}}}} \right),$(2)
${{V}_{2}} = {{V}_{m}} + \left( {1 - {{x}_{2}}} \right)\left( {\frac{{\partial {{V}_{m}}}}{{\partial {{x}_{2}}}}} \right),$Рис. 1.
Концентрационные зависимости парциального мольного объема воды в водном растворе при различных температурах: 1 – 278.15, 2 – 288.15, 3 – 298.15, 4 – 308.15 , 5 – 323.15 и 6 – 333.15 K.

Рис. 2.
Концентрационные зависимости парциального мольного объема ацетамида в водном растворе при различных температурах; 1–6 – см. рис. 1.
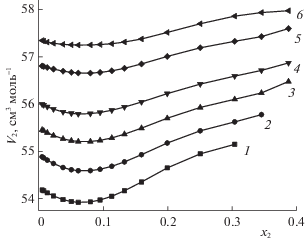
В соответствии с соотношением Гиббса–Дюгема, концентрационная зависимость парциального мольного объема воды ${{V}_{1}}$ в области минимума ${{V}_{2}}$ проходит через слабовыраженный максимум при всех изученных температурах (рис. 1).
Парциальные мольные изобарные расширяемости компонентов раствора были вычислены по уравнению:
Зависимости парциальных мольных изобарных расширяемостей воды (${{E}_{{p,1}}}$) и ацетамида (${{E}_{{p,2}}}$) от состава раствора представлены на рис. 3 и 4 соответственно. На рис. 3 в разбавленной области растворенного вещества отсутствует область “отрицательной расширяемости”, т.е. нет уменьшения парциального объема воды вследствие приращения температуры. Парциальная “отрицательная расширяемость”, как аномалия, характерна для гидрофобных молекул, таких как трет-бутанол [27], а также наблюдалась для растворенных в воде амфифильных молекул – 1,2-пропандиола [28] и этилендиамина [29]. Отсутствие на представленной зависимости такой области ставит этот амид в один ряд с растворенными в воде гидрофильными молекулами, такими как этиленгликоль [30] и глицерин [31], у которых парциальная мольная расширяемость воды положительна.Рис. 3.
Концентрационные зависимости изобарной мольной расширяемости воды в водном растворе при различных температурах; 1–6 – см. рис. 1.

Рис. 4.
Концентрационные зависимости изобарной мольной расширяемости ацетамида в водном растворе при различных температурах; 1–6 – см. рис. 1.
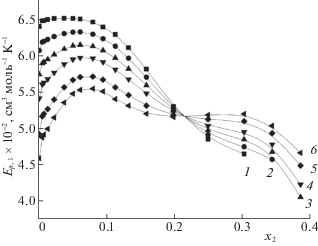
Зависимость ${{E}_{{p,2}}} = f({{x}_{2}})$ характеризуется наличием максимума при x2 ≈ 0.07 и инверсией температурного коэффициента при x2 ≈ 0.2, что указывает на особенности взаимодействия ацетамид–ацетамид в растворе при данных составах.
Предельный парциальный мольный объем ацетамида в воде, ${V_{{\text{2}}}^{\infty }}$, соответствует кажущемуся мольному объему при бесконечном разбавлении, ${V_{{\varphi {\text{,2}}}}^{\infty }}$. Эти величины были описаны уравнением первого порядка кажущегося мольного объема от моляльности (m) с последующей экстраполяцией его на бесконечное разбавление:
где bV – коэффициент предельного наклона. Полученные величины предельных парциальных мольных объемов ацетамида, ${V_{{\text{2}}}^{\infty }}$ представлены в табл. 2. Из табл. 2 видно, что полученные величины ${V_{{\text{2}}}^{\infty }}$ монотонно возрастают с ростом температуры, а также они хорошо согласуются с литературными данными при 298.15 K [15–18, 20]. Относительное отклонение между литературными и данными этой работы не превышает 1%. Изменения молярной изобарной расширяемости при бесконечном разбавлении, ${E_{{P{\text{,2}}}}^{\infty }}$= (${\partial V_{{\text{2}}}^{\infty }}$/∂T)p, ацетамида в воде при различных температурах показаны в табл. 2. Значения ${E_{{P{\text{,2}}}}^{\infty }}$ положительны и уменьшаются с повышением температуры.Таблица 2.
Предельный парциальный мольный объем ацетамида (${V_{{\text{2}}}^{\infty }}$, см3 моль–1) и предельная изобарная расширяемость ацетамида (${E_{{P{\text{,2}}}}^{\infty }}$, см3 моль–1 K–1) в воде при различных температурах
| Т, K | ${V_{{\text{2}}}^{\infty }}$ | ${E_{{P{\text{,2}}}}^{\infty }}$ |
|---|---|---|
| 274.15 | 54.04 | 0.0652 |
| 274.65 | 54.1 | 0.0651 |
| 275.15 | 54.14 | 0.0650 |
| 275.65 | 54.17 | 0.0648 |
| 276.15 | 54.22 | 0.0647 |
| 276.65 | 54.25 | 0.0646 |
| 277.15 | 54.29 | 0.0644 |
| 277.65 | 54.33 | 0.0643 |
| 278.15 | 54.37 | 0.0642 |
| 288.15 | 54.99 | 0.0616 |
| 55.57, 55.4 [15] | ||
| 55.61 [16], 55.824 [17] | ||
| 298.15 | 55 [18], 55.6 [20] | 0.0589 |
| 308.15 | 56.13 | 0.0563 |
| 323.15 | 56.95 | 0.0524 |
| 333.15 | 57.49 | 0.0498 |
Дополнительную информацию о гидратации ацетамида можно получить с помощь уравнения Хеплера [32], основанного на выражении:
(5)
${{(\partial C_{{P,2}}^{\infty }{\text{/}}\partial p)}_{T}} = - T{{({{\partial }^{2}}V_{2}^{\infty }{\text{/}}\partial {{T}^{2}})}_{p}},$Сдвиг температуры максимальной плотности (ТМП) водных растворов способен продемонстрировать характер действия этого вещества на структуру воды [33, 34]. Сдвиг ТМП ($\Delta \theta $) представляет собой разность значений для водного раствора и чистой воды. Ее зависимость от концентрации растворенного вещества, как правило, линейна и может быть описана линейным уравнением [35]:
где KD – константа. Отрицательный сдвиг или отрицательная величина KD связаны с разрушающими действиями растворенного вещества на структуру воды. Положительная величина константы относится к веществам, стабилизирующим структуру воды [36].Добавки ацетамида к воде приводят к понижению ТМП, увеличивающемуся с возрастанием концентрации растворенного вещества. Уравнение (6) принимает вид: $\Delta \theta = - 216{{x}_{2}}$. Отрицательные значения константы показывают, что ацетамид оказывает разрушающее воздействие на структуру воды.
Измерения плотности были выполнены на оборудовании центра коллективного пользования “Верхневолжский региональный центр физико-химических исследований” ИХР РАН(http://www.isc-ras.ru/ru/struktura/ckp).
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований (№ 17-03-00309a и № 18-43-370010-р_центр_а).
Список литературы
Levy Y., Onuchic J.N. // Annu. Rev. Biophys. Biomol. Struct. 2006. V. 35. P. 389.
Hedwig G.R., Hinz H.J. // Biophys. Chem. 2002. V. 100. P. 239.
Межевой И.Н., Баделин В.Г., Тюнина Е.Ю., Камкина С.В. // Журн. физ. химии. 2018. Т. 92. № 3. С. 399.
Lee S., Shek Y.L., Chalikian T.V. // Biopolymers. 2010. V. 93. № 10. P. 86.
Panuszko A., Gojło E., Zielkiewicz J., Smiechowski M., Krakowiak J., Stangret J. // J. Phys. Chem. B. 2008. V. 112. P. 2483.
D’Amico F., Rossi B., Camisasca G. et al. // Phys. Chem. Chem. Phys. 2015. V. 17. № 16. P. 10987.
Lyashchenko A.K., Lileev A.S., Kharkin V.S., Goncharov V.S., BorinaA. F. // Mendeleev Commun. 1997. V. 7. № 5. P. 169.
Romero C.M., Gonzalez M.E. // J. Therm. Anal. Calorim. 2008. V. 92. № 3. P. 705.
Das S., Biswas R., Mukherjee B. // J. Phys. Chem. B. 2015.V. 119. № 1. P. 274.
Copeland C., Menon O., Majumdar D., Roszak S., Leszczynski J. // Phys. Chem. Chem. Phys. 2017. V. 19. P. 24866.
Krestyaninov M.A., Odintsova E.G., Kolker A.M., Kiselev M.G. // J. Mol. Liq. 2018. V. 264. P. 343.
Jelinska-Kazimierczuk M., Szydlowski J. // J. Solution Chem. 2001. V. 30. № 7. P. 623.
Christoffers H.J., Kegeles G. // J. Am. Chem. Soc. 1963. V. 85. № 17. P. 2562.
Егоров Г.И., Сырбу А.А., Колкер А.М. // Журн. физ. химии. 1999. Т. 73. № 12. С. 2160.
Herskovits T.T., Kelly T.M. // J. Phys. Chem. 1973. V. 77. № 3. P. 381.
Kiyohara O., Perron G., Desnoyers J.E. // Can. J. Chem. 1975. V. 53. № 21. P. 3263.
Giaquinto A.R., Lindstrom R.E., Swarbrick J., Lo Surdo A. // J. Solution Chem. 1977. V. 6. № 10. P. 687.
Shahldi F., Farreil P.G., Edward J.T. // J. Chem. Soc., Faraday Trans. 1. 1977. V. 73. P. 715.
Lo Surdo A., Shin C., Millero F.J. // J. Chem. Eng. Data. 1978. V. 23. № 3. P. 197.
Tasker I.R., Spitser J.J., Surl S.K., Wood R.H. // J. Chem. Eng. Data. 1983. V. 28. № 2. P. 266.
Egorov G.I., Makarov D.M. // J. Mol. Liq. 2018. V. 254. P. 154.
Makarov D.M., Egorov G.I. // J. Chem. Thermodyn. 2018. V. 120. P. 164.
Egorov G.I., Makarov D.M. // J. Mol. Liq. 2019. V. 278. P. 279.
Franks F.Ed. Water: A Comprehensive Treatise. New York: Plenum, 1972. V. 1 to 1980 V. 7.
Tan M.L., Cendagorta J.R., Ichiye T. // J. Am. Chem. Soc. 2013. V. 135. P. 4918.
Ashbaugh H.S., Barnett J.W., Saltzman A., Langrehr M., Houser H. // J. Phys. Chem. B. 2018. V. 122. № 13. P. 3242.
Egorov G.I., Makarov D.M. // J. Chem. Thermodyn. 2011. V. 43. P. 430.
Makarov D.M., Egorov G.I., Kolker A.M. // J. Mol. Liq. 2016. V. 222. P. 656.
Egorov G.I., Makarov D.M., Kolker A.M. // Thermochim. Acta. 2016. V. 639. P. 148.
Егоров Г.И., Макаров Д.М., Колкер А.М. // Журн. общ. химии. 2010. Т. 80. С. 1267.
Egorov G.I., Makarov D.M., Kolker A.M. // Thermochim. Acta. 2013. V. 570. P. 16.
Hepler L.G. // Can. J. Chem. 1969. V. 47. № 24. P. 4613.
Wada G., Umeda S. // Bull. Chem. Soc. Jpn. 1962. V. 35. P. 646.
Franks F., Watson B. // Trans. Faraday Soc. 1967. V. 63. P. 329.
Torres A.F., Romero C.M. // J. Chem. Thermodyn. 2017. V. 105. P. 173
Белоусов В.П., Панов М.Ю. Термодинамика водных растворов неэлектролитов. Л.: Химия, 1983. 264 с.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии


