Журнал физической химии, 2020, T. 94, № 4, стр. 557-563
Молекулярные взаимодействия l-гистидина в водном буферном растворе в интервале температур 288–313 K
Е. Ю. Тюнина a, *, В. Г. Баделин a, А. А. Курицына b
a Российская академия наук, Институт химии растворов им. Г.А. Крестова
153045 Иваново, Россия
b Ивановский государственный химико-технологический университет
153000 Иваново, Россия
* E-mail: tey@isc-ras.ru
Поступила в редакцию 23.05.2019
После доработки 17.09.2019
Принята к публикации 20.09.2019
Аннотация
Методами денсиметрии и дифференциальной сканирующей калориметрии изучены особенности поведения L-гистидина (His) в водном буферном растворе (рН 7.4). Получены значения плотности и удельной теплоемкости растворов аминокислоты в интервале температур (288.15–313.15) K при концентрациях His от 0.00215 до 0.03648 моль кг–1. Определены кажущиеся и парциальные молярные параметры L-гистидина в буферном растворе, выявлены особенности их температурных и концентрационных зависимостей. Показано, что парциальные молярные свойства переноса аминокислоты из воды в буферный раствор имеют положительные значения как для объема, так и для теплоемкости в изученном интервале температур. Рассмотрены различные типы молекулярных взаимодействий между растворенным веществом и растворителем с использованием модели Гэрни.
Большинство биохимических процессов протекает в водных растворах, что стимулирует проведение исследований физико-химических свойств биологически активных веществ именно в жидких фазах [1–6]. Особую актуальность вызывает использование буферных систем, приближающих раствор к физиологическим средам [7, 8]. Аминокислотные остатки, входящие в состав белков плазмы крови, могут взаимодействовать друг с другом, окружающими молекулами воды или с другими компонентами раствора (электролитами, лекарственными средствами и т.д.) за счет невалентных взаимодействий (образование водородных связей, π–π-стэкинг, электростатические и Ван дер Ваальсовы взаимодействия). Исследование термодинамических свойств аминокислот в водных буферных растворах имеет существенное значение для понимания молекулярных основ конформационной стабильности и функциональной активности более сложных белковых образований в организме.
До сих пор актуальны исследования поведения аминокислот, молекулы которых содержат полярную боковую цепь [1, 6, 9–11]. К их числу относится гетероциклическая аминокислота L-гистидин, характеризующаяся наличием имидазольной функциональной группы, которая может служить как донором, так и акцептором образования водородных связей, и проявлять свойства как кислоты, так и основания в зависимости от диапазона pH. Гистидиновые остатки идентифицируются как активные сайты для ∼50% всех белковых ферментов [12, 13]. Данная аминокислота является предшественником в биосинтезе гистамина, способствует росту и восстановлению тканей. Гистидин – составная часть многих витаминных комплексов; он используется при лечении глазных заболеваний, ревматоидных артритов, аллергий, язв и анемии [14].
В литературе отсутствуют данные по плотности и теплоемкости системы L-гистидин – водный фосфатный буфер (рН 7.4). Задачей настоящего исследования является использование методов денсиметрии и дифференциальной сканирующей калориметрии для выявления особенностей межмолекулярных взаимодействий His в водном буферном растворе (рН 7.4) в широком интервале температур и концентраций.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали L-гистидин (Sigma-Aldrich, Japan, CAS 63-91-2). Содержание основного вещества составляло >99%. Аминокислоту сушили в вакуумном шкафу при 343 K в течение 48 ч непосредственно перед использованием. Исследования проводили в водных буферных растворах (рН 7.4), содержащих NaH2PO4 и Na2HPO4, что приближает среду к условиям реальных биологических систем. Значения рН растворов фиксировали цифровым рН-метром Mettler Toledo, модель Five-Easy. Все растворы приготовлены весовым методом, используя весы Sartorius-ME215S (с точностью взвешивания 1 × × 10–5 г). Концентрацию аминокислоты варьировали в пределах (0.00215–0.03648) моль⋅кг–1.
Измерения плотности исследуемых растворов выполнены на цифровом вибрационном денсиметре DMA-5000M (Anton Paar, Австрия) при температурах (288.15, 298.15, 303.15, 308.15 и 313.15) K. Два встроенных платиновых термометра Pt100 в сочетании с элементами Пельтье обеспечивали термостатирование образца внутри ячейки с погрешностью 5 × 10–3 K. Стандартная погрешность измерения плотности исследуемых растворов не превышала 0.00001 г⋅см–3.
Для измерения удельной теплоемкости (Сp) системы His-буфер использовали дифференциальный сканирующий микрокалориметр SCAL-1 (“Биоприбор”, Пущино, Россия). Интегральная чувствительность детектора калориметра составляет 33.218 нВт/мВ, калибровочная мощность – 25 мкВт, скорость сканирования – 1 K/мин, постоянная времени – 20 с. Прибор, детальное описание которого приведено в [15], был протестирован по теплоемкости водных растворов хлорида натрия, рекомендованного в качестве стандарта для сканирующей калориметрии растворов [16]. Стандартная погрешность измерения удельной теплоемкости исследованных растворов находилась в пределах ±7 × 10–3 Дж K–1 г–1. Измерения удельной теплоемкости исследуемых растворов выполнены при температурах (288.15, 298.15, 303.15, 308.15 и 313.15) K.
Полученные экспериментальные данные по плотности (ρ) и удельной теплоемкости (Сp) исследуемых растворов приведены в табл. 1 и 2. Как видно из таблиц, значения ρ уменьшаются с температурой и возрастают с концентрацией аминокислоты, в то время как температурные и концентрационные изменения значений Сp проявляют возрастающие тенденции.
Таблица 1.
Плотность (ρ) водных буферных растворов L-гистидина при разных концентрациях и температурах
| m, моль кг–1 | 288.15 K | 298.15 K | 303.15 K | 308.15 K | 313.15 K |
|---|---|---|---|---|---|
| ρa, кг м–3 | |||||
| 0 | 1029.289 | 1026.562 | 1024.859 | 1023.023 | 1021.012 |
| 0.0022 | 1029.406 | 1026.674 | 1024.969 | 1023.129 | 1021.115 |
| 0.0071 | 1029.658 | 1026.922 | 1025.209 | 1023.357 | 1021.329 |
| 0.0104 | 1029.810 | 1027.064 | 1025.339 | 1023.489 | 1021.462 |
| 0.0125 | 1029.890 | 1027.141 | 1025.424 | 1023.565 | 1021.539 |
| 0.0177 | 1030.096 | 1027.332 | 1025.604 | 1023.749 | 1021.726 |
| 0.0198 | 1030.153 | 1027.409 | 1025.676 | 1023.807 | 1021.794 |
| 0.0219 | 1030.231 | 1027.486 | 1025.739 | 1023.878 | 1021.854 |
| 0.0249 | 1030.331 | 1027.582 | 1025.830 | 1023.977 | 1021.934 |
| 0.0320 | 1030.570 | 1027.817 | 1026.054 | 1024.185 | 1022.140 |
| 0.0364 | 1030.705 | 1027.946 | 1026.192 | 1024.295 | 1022.254 |
Таблица 2.
Удельная теплоемкость (Сp) водных буферных растворов L-гистидина при разных концентрациях и температурах
| m, моль кг–1 | 288.15 K | 298.15 K | 303.15 K | 308.15 K | 313.15 K |
|---|---|---|---|---|---|
| $С_{p}^{{\text{a}}}$, Дж K–1 г–1 | |||||
| 0 | 4.0160 | 4.0220 | 4.0260 | 4.0300 | 4.0350 |
| 0.0022 | 4.0147 | 4.0219 | 4.0257 | 4.0303 | 4.0357 |
| 0.0071 | 4.0198 | 4.0265 | 4.0307 | 4.0359 | 4.0424 |
| 0.0104 | 4.0294 | 4.0389 | 4.0424 | 4.0478 | 4.0528 |
| 0.0125 | 4.0371 | 4.0492 | 4.0528 | 4.0591 | 4.0639 |
| 0.0198 | 4.0683 | 4.0806 | 4.08675 | 4.0916 | 4.0958 |
| 0.0218 | 4.0773 | 4.0901 | 4.0949 | 4.0998 | 4.1046 |
| 0.0249 | 4.0899 | 4.1014 | 4.1086 | 4.1107 | 4.1164 |
| 0.0320 | 4.1214 | 4.1294 | 4.1322 | 4.1362 | 4.1386 |
| 0.0364 | 4.1322 | 4.1409 | 4.1441 | 4.1484 | 4.1513 |
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Гистидин является основной аминокислотой с гетероциклической полярной боковой цепью. В зависимости от рН среды His находится в различных ионных состояниях и может образовывать три разных протонированных комплекса [17, 18]. Для определения долевого распределения разных форм аминокислоты в зависимости от рН среды была использована компьютерная программа RRSU [19], в основу которой заложен модифицированный метод Бринкли. Как видно из полученной нами диаграммы (рис. 1), в условиях выбранной буферной среды (рН 7.4) His находится преимущественно в цвиттерионной форме ([HL]±), при этом вероятность наличия его катионной формы ([H2L]+) составляет менее 5%.
Объемные свойства растворов
Кажущийся молярный объем His (φV) вычислен по уравнению на основе экспериментальных данных по плотности:
где ρ0 и ρ – плотности растворителя и раствора (г⋅см–3), m – моляльная концентрация His (моль⋅кг–1), М – его молекулярная масса. Растворителем в бинарных водных растворах (His–буфер) является фосфатный буферный раствор. На рис. 2 представлены зависимости кажущихся молярных объемов аминокислоты от ее концентрации при разных температурах.Рис. 2.
Концентрационные зависимости кажущихся молярных объемов L-гистидина (φV) в водном буферном растворе при температурах: 1 – 288.15 K, 2 – 298.15 K, 3 – 303.15 K, 4 – 308.15 K, 5 – 313.15 K.

Концентрационные зависимости φV = f(m) для His в воде описываются линейной функцией [1, 20, 21], а в буферном растворе хорошо аппроксимируются полиномом второй степени:
где φV° – предельное значение кажущегося молярного объема, равное парциальному молярному объему при бесконечном разбавлении, B1, B2 – постоянные коэффициенты. Получены положительные значения φV° (табл. 3). Для сравнения там же приведены данные для водного раствора L-гистидина [20]. Как видно из табл. 3, значения φV° для His в воде и буферном растворе увеличиваются с ростом температуры, что согласуется с данными для других аминокислот в водных растворах [1, 2, 15, 20–22].Таблица 3.
Предельные кажущиеся молярные объемы (φV°) L-гистидина (His) и значения его производной по температуре (∂φV°/∂T)p в водном буферном растворе и воде при разных температурах
| T, K | His–буфер | His–вода | ||
|---|---|---|---|---|
| φV° × 106, м3 моль–1 | (∂φV°/∂T)p × 106 [35], м3 моль–1 K–1 | φV° × 106 [35], м3 моль–1 | (∂φV°/∂T)p × 106*, м3 моль–1 K–1 | |
| 288.15 | 97.36 ± 0.41 | 0.109 ± 0.096 | – | – |
| 298.15 | 99.46 ± 0.39 | 0.268 ± 0.090 | 98.26 ± 0.10 | 0.266 ± 0.091 |
| 303.15 | 100.60 ± 0.32 | 0.349 ± 0.102 | 99.53 ± 0.12 | 0.271 ± 0.068 |
| 308.15 | 102.77 ± 0.24 | 0.427 ± 0.103 | 100.93 ± 0.14 | 0.275 ± 0.042 |
| 313.15 | 105.10 ± 0.23 | 0.508 ± 0.106 | 102.32 ± 0.14 | 0.280 ± 0.043 |
Значения парциального молярного объема His в воде меньше, чем в водном буферном растворе. Это свидетельствует о том, что в присутствии буфера усиливаются взаимодействия между растворенной аминокислотой и растворителем, в качестве которого выступает фосфатный буферный раствор. Изменения парциального молярного объема (Δtr$V_{\varphi }^{^\circ }$) при переносе His из воды в буферный раствор вычислены по соотношению:
(3)
${{\Delta }_{{{\text{tr}}}}}V_{\varphi }^{^\circ } = {}^{\varphi }V^\circ ({\text{His}}{\kern 1pt} --{\kern 1pt} {\text{буфер}})--{}^{\varphi }V^\circ ({\text{His}}{\kern 1pt} --{\kern 1pt} {\text{вода}}).$Величины Δtr$V_{\varphi }^{^\circ }$ чувствительны к сольватационным эффектам, и в соответствии с моделью Гэрни о перекрывания гидратных сфер [23], увеличение объема (Δtr$V_{\varphi }^{^\circ }$ > 0) происходит, если взаимодействия обусловлены электростатическими силами, водородными связями и др. Понижение объема (Δtr$V_{\varphi }^{^\circ }$ < 0) имеет место в случае участия во взаимодействии неполярных групп (гидрофобные силы) [23–27]. Полученные положительные изменения объема Δtr$V_{\varphi }^{^\circ }$ свидетельствуют о том, что в системе His–буфер электростатические взаимодействия и образование водородных связей доминируют над ион-гидрофобными взаимодействиями (между ионами/цвиттерионами и неполярными группами аминокислоты) в условиях существующей конкуренции различных типов молекулярных взаимодействий в исследуемых растворах.
Температурная зависимость парциальных молярных объемов φV° L-гистидина в буфере описывается уравнением:
где α, β и γ – константы, T – температура. Парциальные молярные объемы аминокислоты увеличиваются с температурой, и, кроме того, полученные кривые вогнуты вниз как для водных, так и буферных растворов. Такое поведение типично для водных растворов электролитов или гидрофильных неэлектролитов [28]. В табл. 3 приведены рассчитанные первые производные (∂φV°/∂T)p, положительные значения которых указывают на высвобождение электрострикционно сжатой воды из гидратных сфер аминокислоты в процессе растворения в буфере, что сопровождается увеличением объема системы. Показано, что величины (∂φV°/∂T)p увеличиваются с температурой в случае системы His–буфер, тогда как для водного раствора аминокислоты их значения меняются не столь значительно.На основе использования уравнения Хеплера [28]:
(5)
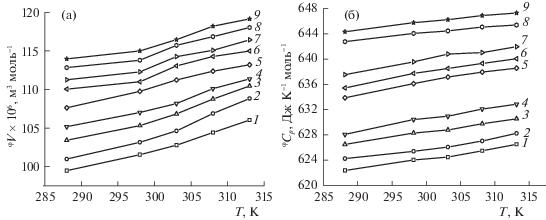
${{(\partial C_{p}^{^\circ }{\text{/}}\partial P)}_{T}} = --T{{({{\partial }^{{2\varphi }}}V^\circ {\text{/}}\partial {{T}^{2}})}_{p}}$Температурные зависимости кажущихся молярных объемов φV(T) His в буферном растворе приведены на рис. 3а. Наблюдается монотонная последовательность в расположении изоконцентрационных кривых φV(T) с ростом концентрации аминокислоты, что указывает на отсутствие процессов образования комплексов между His и компонентами буферного растворителя.
Теплоемкостные свойства растворов
Для определения кажущейся молярной теплоемкости растворенного вещества (ϕCp) в буферном растворе было использовано уравнение:
где Сp и $C_{p}^{^\circ }$ – удельные теплоемкости, соответственно, раствора и растворителя (Дж K–1 г–1), m – моляльная концентрация растворенного вещества (моль⋅кг–1), M – молярная масса растворенного вещества His (г моль–1). Как известно [29, 30], теплоемкость растворов чувствительна к особенностям взаимодействия между компонентами растворов. В случае отсутствия изменений во взаимодействиях растворенное вещество – растворитель и растворенное вещество – растворенное вещество концентрационные зависимости теплоемкостных свойств раствора будут носить линейный характер. Полученные концентрационные зависимости кажущихся молярных теплоемкостей ϕCp His в буферном растворе, представленные на рис. 4, аппроксимируются полиномом третьей степени во всем изученном диапазоне параметров (m, Т):(7)
$^{\phi }{{C}_{p}}(m) = {}^{\phi }C_{p}^{^\circ } + {{A}_{1}}m + {{A}_{2}}{{m}^{2}} + {{A}_{3}}{{m}^{3}}.$Рис. 4.
Концентрационные зависимости кажущихся молярных теплоемкостей L-гистидина (ϕCp) в водном буферном растворе при температурах: 1 – 288.15 K, 2 – 298.15 K, 3 – 303.15 К, 4 – 308.15 K, 5 – 313.15 K.
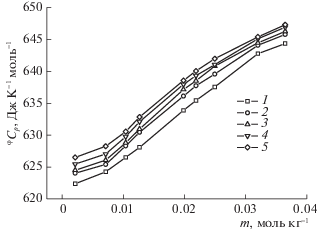
Таблица 4.
Предельные кажущиеся молярные теплоемкости ($^{\phi }C_{p}^{^\circ }$) L-гистидина (His) и значения его производной по температуре (${{\partial }^{\varphi }}C_{p}^{^\circ }$/∂T)p в водном буферном растворе и воде при разных температурах
| T, K | His–буфер | His–вода | ||
|---|---|---|---|---|
| $^{\phi }C_{p}^{^\circ }$, Дж K–1 моль–1 | (${{\partial }^{\phi }}C_{p}^{^\circ }$/∂T)p, Дж K–2 моль–1 | $^{\phi }C_{p}^{^\circ }$ [45 ] , Дж K–1 моль–1 | (${{\partial }^{\phi }}C_{p}^{^\circ }$/∂T)p, Дж K–2 моль–1 | |
| 288.15 | 621.58 ± 0.50 | 0.2004 ± 0.036 | 212.20 ± 0.09 | 2.3301 ± 0.006 |
| 298.15 | 623.31 ± 0.61 | 0.1522 ± 0.045 | 232.90 ± 0.08 | 1.9324 ± 0.008 |
| 303.15 | 623.96 ± 0.53 | 0.1281 ± 0.046 | – | – |
| 308.15 | 624.74 ± 0.60 | 0.1040 ± 0.046 | – | – |
| 313.15 | 625.03 ± 0.50 | 0.0799 ± 0.051 | 258.10 ± 0.10 | 1.3360 ± 0.010 |
| 328.15 | – | – | 273.21 ± 0.10 | 0.7396 ± 0.015 |
Обычно возрастание значений кажущейся молярной теплоемкости растворенного вещества отражает увеличение степеней свободы и интенсивности молекулярных движений, что ведет к разрушению структуры растворителя, а их уменьшение свидетельствует об образовании более упорядоченных структур, если отсутствует воздействие других факторов, и прежде всего дегидратации молекул растворенных веществ [30–32]. По-видимому, в случае растворения His в водном буферном растворе можно говорить о преобладающем вкладе эффекта дегидратации молекул в общую теплоемкость раствора.
Парциальная молярная теплоемкость переноса His из воды в буферный раствор (Δtr$C_{p}^{^\circ }$) определена по соотношению:
(8)
${{\Delta }_{{{\text{tr}}}}}C_{p}^{^\circ } = {}^{\phi }C_{p}^{^\circ }({\text{His}}{\kern 1pt} --{\kern 1pt} {\text{буфер}})--{}^{\phi }C_{p}^{^\circ }({\text{His}}{\kern 1pt} --{\kern 1pt} {\text{вода}}).$Температурные зависимости предельной кажущейся молярной теплоемкости ($^{\phi }C_{p}^{^\circ }$) His в воде и буферном растворе описываются полиномами второй степени (коэффициент корреляции R = = 0.9987):
где Т – температура (K), a, b1 и b2 – константы. Значения полученных первых производных (${{\partial }^{\phi }}C_{p}^{^\circ }$/∂T)p приведены в табл. 4. На рис. 3б представлены температурные зависимости кажущихся молярных теплоемкостей ϕCp(T) His в буферном растворе при разных концентрациях. Показано, что нарушения в порядке расположения изоконцентрат не наблюдаются, значения ϕCp возрастают как с ростом температуры, так и с увеличением концентрации аминокислоты в растворе.Таким образом, методами денсиметрии и дифференциальной сканирующей калориметрии получены экспериментальные значения плотности и удельной теплоемкости буферных растворов, содержащих L-гистидин, в интервале концентраций от 0.00215 до 0.03648 моль⋅кг–1 и температур (288.15–313.15) K. Определены кажущиеся и парциальные молярные свойства (φVHis, ϕCp) L-гистидина, а также предельные кажущиеся молярные свойства его переноса из воды в буферный раствор. Наблюдаемые положительные значения свойств переноса (Δtr$V_{\varphi }^{^\circ }$, Δtr$C_{p}^{^\circ }$) His из воды в буфер при всех изученных температурах являются результатом, прежде всего, эффектов гидратации и взаимодействия между гидратированными молекулами и ионами, соответственно, L-гистидина и электролитов буферного раствора через электростатические силы и образование водородных связей.
Определены параметры (${{\partial }^{\phi }}C_{p}^{^\circ }$/∂T)p, (∂φV°/∂T)p и (∂2φV°/∂T2)p для His в буферном растворе и воде. Выявленная тенденция в изменении значений (∂φV°/∂T)p и (∂2φV°/∂T2)p при разных температурах показывает, что L-гистидин способствует укреплению структуры раствора. Показано, что по сравнению с водным раствором, структурно-образующие эффекты His усиливаются в водном буферном растворе.
Измерения плотности и удельной теплоемкости выполнены на оборудовании центра коллективного пользования “Верхневолжский региональный центр физико-химических исследований” ИХР РАН (http://www.isc-ras.ru/ru/struktura/ckp).
Список литературы
Yasuda Y., Tochio N., Sakurai M., Nitta K. // J. Chem. Eng. Data. 1998. V. 43. P. 205.
Kumar D., Lomesh S.K., Nathan V. // J. Mol. Liq. 2017. V. 247. P. 75.
Privalov P.L. // J. Solution Chem. 2015. V. 44. P. 1141.
Akhtar Y., Ibrahim S.F. // Arabian J. Chem. 2011. V. 4. P. 487.
Banipal T.S., Kaur N., Banipal P.K. // J. Chem. Thermodynamics. 2015. V. 82. P. 12.
Nain A.K., Pal R., Sharma R.K. // J. Mol. Liq. 2012. V. 165. P. 154.
Kumar H., Singla M., Jindal R. // J. Chem. Thermodynamic. 2014. V. 70. P. 190.
Taha M., Lee M.-J. // J. Chem. Thermodynamic. 2009. V. 41. P. 705.
Jardine J.J., Call T.G., Patterson B.A., Origlia-Luster M.L., Woolley E.M. // J. Chem. Thermodynamics. 2001. V. 33. P. 1419.
Riyazuddeen, Altamash T. // Thermochimica Acta. 2010. V. 501. P. 72.
Banipal T.S., Singh K., Banipal P.K. // J. Solution Chem. 2007. V. 36. P. 1635.
Hansena A.L., Kaya L.E. // PNAS. 2014. P. E1705. www.pnas.org/cgi/doi/10.1073/pnas.1400577111
Oya-Ohta Y., Ochi T., Komoda Y., Yamamoto K. // Mutation Research. 1995. V. 326. P. 99.
Чернова Р.К., Варыгина О.В., Березкина Н.С. // Изв. Сарат. ун-та. Нов. сер. Сер. Химия. Биология. Экология. 2015. Т. 15. № 4. С. 15.
Tyunina E.Yu., Badelin V.G., Mezhevoi I.N. // J. Solution Chem. 2017. V. 46. P. 249.
Clarke E.C.W., Glew D.N. // J. Phys. Chem. Ref. Data. 1985. V. 14. P. 490.
Miao Y., Cross T.A., Fu R. // J. Magnetic Resonance. 2014. V. 245. P. 105.
Bretti C., Cigala R.M., Giuffrè O., Lando G., Sammartano S. // Fluid Phase Equilibr. 2018. V. 459. P. 51.
Васильев В.П., Бородин В.А., Козловский Е.В. Применение ЭВМ в химико-аналитических расчетах. М.: Высшая школа, 1993. 112 с.
Sawheney N., Kumar M., Sharma A.K., Sharma M. // J. Chem. Thermodynamics. 2017. V. 115. P. 156.
Stefaniu A., Iulian O. // J. Solution Chem. 2013. V. 42. P. 2384.
Badeline V.G., Tyunina E.Yu., Mezhevoi I.N., Tarasova G.N. // Russ. J. Phys. Chem. A. 2015. V. 89. P. 2229.
Gurney R.W. Ionic processes in solution. New York: McGraw Hill, 1953.
Franks F. Water: A comprehensive treatise, vol. 3. New York: Plenum Press, 1973.
Kumar H., Kaur K. // J. Chem. Thermodynamics. 2012. V. 5. P. 86.
Terekhova I.V., Kulikov O.V. // Mendeleev Comm. 2002. V. 3. P. 1.
Lepori L., Gianni P. // J. Solution Chem. 2000. V. 29. P. 405.
Hepler L.G. // Can. J. Chem. 1969. V. 47. P. 4613.
Васильев В.П. Термодинамические свойства растворов электролитов. М.: Высшая школа. 1982.
Латышева В.А. // Успехи химии. 1973. Т. XLII. С. 1757.
Marriott R.A. Thermodynamic investigations of some aqueous solutions through calorimetry and densimetry: University of Lethbridge Theses, Faculty of Arts and Science, 1999. P. 1–237. University of Lethbridge Research Repository, OPUS, No. MQ49132 (https://hdl.handle.net/10133/91)
Тюнина Е.Ю. // Журн. физ. химии. 2019. Т. 93. № 3. С. 373.
Bhuiyan M.M.H., Hakin A.W., Liu J.L. // J. Solution Chem. 2010. V. 39. P. 877.
Madan B., Sharp K.A. // J. Phys. Chem. B. 2001. V. 105. P. 2256.
Banipal P.K., Banipal T.S., Ahluwalia J.C., Lark B.S. // J. Chem. Thermodynamics. 2002. V. 34. P. 1825.
Jasra R.V., Ahluwalia J.C. // J. Solution Chem. 1982. V. 11. P. 325.
Madan B., Sharp K.A. // Biophys. J. 2001. V. 81. P. 1881.
Lark B.S., Patyar P., Banipal T.S., Kishore N. // J. Chem. Eng. Data. 2004. V. 49. P. 553.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии