Журнал физической химии, 2020, T. 94, № 4, стр. 564-567
Структура водных растворов диметилсульфоксида по данным статической диэлектрической проницаемости
Е. С. Верстаков a, С. А. Коробкова a, Т. А. Носаева a, *
a Волгоградский государственный медицинский университет
Волгоград, Россия
* E-mail: nosaeva.ta@gmail.com
Поступила в редакцию 28.05.2019
После доработки 23.09.2019
Принята к публикации 23.09.2019
Аннотация
Измерена статическая диэлектрическая проницаемость (Д.П.) смесей вода–ДМСО в интервале (293–323) K во всем концентрационном диапазоне смесей вода–ДМСО. Значения статической Д.П. смесей показывают отклонение от аддитивности, максимум которых находится в области (0.3–0.4) мольных долей ДМСО, где могут формироваться комплексы 1ДМСО–2Н2О за счет водородных связей. Рассчитанные значения корреляционного фактора Кирквуда gk указывают на антипараллельную ориентацию диполей ДМСО, особенно в области высоких концентраций ДМСО (0.7–1.0) мол. доли.
Известно из работ [1–5], что водные растворы диметилсульфоксида (ДМСО) давно привлекают к себе внимание, как с точки зрения теории [6], так и практического применения [7]. Диметилсульфоксид (ДМСО) – органическое соединение, а именно апротонный растворитель, т.е. растворитель, который при разложении в растворе не образует свободный ион водорода H+ (протон). Жидкий ДМСО и его водные растворы относятся к наиболее распространенным растворителям в органической химии и тонкой химической технологии. Кроме того, помимо традиционных применений в медицине и фармакологии [1] водные растворы ДМСО используются также в оптике, в том числе при изготовлении полимерных оптических волокон [7]. Отметим, что 30% водный раствор ДМСО замерзает при 150°С. Учитывая, что вода замерзает при 0°С, а ДМСО – при 18°С. Этому уникальному свойству смесей ДМСО–Н2О посвящено достаточно много исследований особенно в [8], но вопрос “что же образуется, когда эти две жидкости смешиваются” дискутируется до настоящего времени.
В данной работе предпринята попытка расширить рамки тех исследований по этой тематике, которые были проведены в работах [9, 10], а также исследовать энергетику взаимодействия молекул воды и ДМСО, имеющими обширную сетку водородных связей, а также структурные характеристики этих взаимодействий.
При рассмотрении диэлектрических свойств растворов электролитов, в смешанных растворителях, одним из компонентов которых является вода, как правило, возникают проблемы понимания изменения свойств растворителя с его составом, а именно, какое свойство растворителя использовать для корреляции с измеряемыми параметрами; какие характеристики взаимодействующих частиц являются определяющими при рассмотрении влияния ионов на скорость релаксации; какова структура применяемого смешанного растворителя? Именно поэтому, прежде чем рассматривать особенности растворов электролитов, в смешанных растворителях, крайне необходимо иметь их данные в широком диапазоне концентраций и температур.
Результаты исследования водных растворов диметилсульфоксида во всем концентрационном интервале, а также обсуждение полученных результатов приводятся в данной работе.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
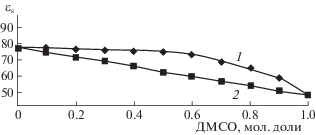
Измерение статической Д.П. (εs) в широком температурном диапазоне (293–323 K) проведены методом, описанном в статье [11], очистка ДМСО осуществлялась в соответствии с методикой описанной в работе [12]. По данной методике экспериментально определенные величины статической Д.П. (εs) водных растворов ДМСО при различных температурах приведены в табл. 1, а при температуре 25°С на графике (рис. 1).
Таблица 1.
Статическая Д.П. водных растворов ДМСО при различных температурах (293–323) K
| Т, K | Мольные доли ДМСО | |||||||
|---|---|---|---|---|---|---|---|---|
| 0 | 0.15 | 0.25 | 0.35 | 0.5 | 0.7 | 0.9 | 1.0 | |
| 293 | 80.1 | 76.8 | 73.9 | 70.1 | 65.8 | 57.2 | 49.8 | 47.1 |
| 298 | 78.1 | 75.1 | 72.5 | 69.4 | 64.3 | 56.1 | 49 | 46.3 |
| 303 | 76.1 | 73.3 | 70.8 | 67.7 | 63.1 | 55.2 | 48.5 | 45.9 |
| 313 | 73.3 | 70.0 | 67.8 | 64.8 | 60.6 | 53.3 | 47.1 | 44.5 |
| 323 | 70.1 | 67.0 | 65.1 | 61.9 | 58.1 | 51.4 | 45.6 | 43.3 |
Известно [13], что отклонение статической Д.П. растворов неэлектролитов от аддитивности является признаком межмолекулярного взаимодействия в них. На рис. 2 представлены концентрационные зависимости отклонений Δε статической Д.П. от аддитивности для смесей вода – ДМСО при 25°С
(1)
$\Delta \varepsilon = \varepsilon _{s}^{{\exp }} - [{{X}_{{{\text{ДМСО}}}}}\varepsilon _{s}^{{{\text{ДМСО}}}} + (1 - {{X}_{{{\text{ДМСО}}}}})\varepsilon _{s}^{w}],$(2)
$\Delta \varepsilon = \varepsilon _{s}^{{\exp }} - [{{\varphi }_{{{\text{ДМСО}}}}}\varepsilon _{s}^{{{\text{ДМСО}}}} + (1 - {{\varphi }_{{{\text{ДМСО}}}}})\varepsilon _{s}^{w}],$Рис. 2.
Зависимость разности Δε диэлектрической проницаемости от аддитивности смесей вода–ДМСО (25°С).

Из рис. 2 видно, что максимальные экспериментальные значения εs смесей ДМСО–вода показывают относительно небольшие отклонения от линейности (≈4.5% для концентраций в мольных долях (Х); ≈19% для концентраций в объемных долях φ), которые могут считаться несколько неожиданными, учитывая различную структуру чистых жидкостей. Вода – одна из самых структурированных жидкостей из-за наличия обширной сети межмолекулярных водородных связей [14], в то время как ДМСО – практически мономолекулярная жидкость, являющаяся следствием определенной структуры молекулы этого соединения и такое структурное различие должно делать эти две жидкости исключительными, как в чистом виде, так и в смесях с точки зрения физико-химических свойств.
Как видно из рис. 2 максимум отклонения εs от аддитивности вполне отчетливо указывает в этих случаях на соответствующий ему состав смеси вода–ДМСО (XДМСО ≈ 0.35). Экстремальные отклонения в этой области наблюдаются и в других физических свойствах, таких как вязкость, плотность, коэффициент диффузии и другие. Данные по этим отклонениям приведены в табл. 2 с указанием направления отклонения от аддитивности [15–17].
Таблица 2.
Экстремумы на кривых, свойство-состав, смесей H2O–ДМСО при 25°С*
| Свойство | Вид экстремума | ДМСО, мол. доли | Литера-тура |
|---|---|---|---|
| Вязкость | макс. (+) | 0.35 | [5, 15] |
| Теплота смещения | макс. (+) | 0.35 | [16] |
| Плотность | макс. (+) | 0.66 | [5] |
| Адиабатическая сжимаемость | мин. (–) | 0.15–0.3 | [17] |
| Скорость звука | макс. (+) | 0.15–0.3 | [17] |
| Отклонения Д.П. от аддитивности | макс. (+) | 0.3–0.4 | [15] |
* Знак и величина для соответствующего свойства определяются по аналогичным формулам (1) и (2).
Такой факт неслучайный и особенность состава смеси с концентрацией XДМСО ≈ 0.35 состоит в том, что структуру этой смеси можно рассматривать, как имеющую определенную особенность, заключающуюся в том, что молекулы воды образуют водородные связи с молекулами ДМСО, формируя комплексы 1ДМСО–2H2O, но дипольный момент этого комплекса определить экспериментально весьма затруднительно, хотя эмпирические методы оценивают его величиной ≈4.6 D.
Необходимо отметить, что по всей видимости, во всем диапазоне концентраций происходят реакции типа $n{\text{ДМСО}} + m{{{\text{H}}}_{{\text{2}}}}{\text{O}} \leftrightarrow {{({\text{ДМСО}})}_{n}} + {{({{{\text{H}}}_{{\text{2}}}}{\text{O}})}_{m}}$, n, m = (1, 2), которые должны дать определенный вклад не только в отклонения Д.П. от аддитивности, но и в диэлектрические релаксационные спектры, в частности, влиять на параметры функции распределения времен релаксации в широком диапазоне частот и температур.
Анализ опубликованного теоретического материала по данной тематике [18, 19] показывает, что расчет статической Д.П. представляет собой достаточно сложную проблему, тем более для смешанных растворов, так как большинство расчетов статической Д.П. основаны на теории Кирквуда для полярных диэлектриков.
Полная теория, связывающая статическую Д.П. смесей воды и ДМСО с соответствующими дипольными моментами µвода и µДМСО должна включать все возможные корреляционные ориентации этих диполей, как растворителя, так и растворенного вещества. В работе [20] сделана попытка произвести расчеты статической Д.П. смесей вода–ДМСО, вычислив корреляционный фактор gk в температурном интервале (298–318) K, но ограничив концентрационный диапазон ДМСО в смеси от 0.4 мол. доли до чистого ДМСО. Величина gk при этом незначительно зависит от температуры и составила ≈0.75 (для 0.4 м.д. ДМСО) и ≈0.5 (для чистого ДМСО).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Нами предпринята попытка вычислить корреляционный фактор gk во всем концентрационном интервале, используя уравнение Кирквуда–Фрелиха [21]:
(3)
${{\varepsilon }_{s}} - {{\varepsilon }_{\infty }} = \frac{{3{{\varepsilon }_{s}}}}{{2{{\varepsilon }_{s}} + {{\varepsilon }_{\infty }}}}\frac{{4\pi N}}{{3{{k}_{{\text{Б}}}}TV}}\frac{{{{{({{\varepsilon }_{\infty }} + 2)}}^{2}}{{\mu }^{2}}}}{9}{{g}_{k}},$Величина дипольного момента для чистого ДМСО принята равной 3.9 D [9], а для каждой смеси рассчитывается по формуле $\mu = \sqrt {{{X}_{{\text{B}}}}\mu _{{\text{B}}}^{2} + {{X}_{{{\text{ДМСО}}}}}\mu _{{{\text{ДМСО}}}}^{2}} $, где ХВ и ХДМСО – молярные доли каждого компонента. Результаты расчетов приведены в виде графика на рис. 3. Из данного рисунка видно, что корреляционный фактор gk для чистого ДМСО ≈ 0.6 и достаточно хорошо совпадает с данными по МД-моделированию в [22] и экспериментом в [23], где авторы оперируют отношением Dε/Dµ, величина которого характеризует ориентационную корреляцию диполей ДМСО.
Численно отношение Dε/Dµ в [9] изменяется от 1.0 до ≈0.5, а расчеты авторов [9] показывают, что при gDMСO, DMCO ≈ 0.5 имеет место антипараллельная корреляция диполей и именно такая величина (0.5) должна идентифицироваться с вышеуказанным ориентационным корреляционным фактором. Если действительно другими эффектами корреляционной ориентации можно было бы пренебречь в смесях вода–ДМСО (${{g}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O,S}}}}}$, gSS, gDMCO-S), то должно соблюдаться равенство Dε = = Dµ, которое не наблюдается, а другие возможные корреляции при Dε/Dµ < 1 установить пока не представляется возможным. Очевидно, такой антипараллельный порядок расположения диполей ДМСО имеет преобладание во всей области значительных концентраций ДМСО. Более того, автор в [23] представляет плюсовой допуск на величину gK в пределах ≈(1.0–3.1) для чистой воды и ≈(0.5–1.7) для чистого ДМСО при условии 1.1n2 ≤ ≤ ε∞ ≤ 4.3.
Такое расположение диполей ДМСО завершает процесс их антипараллельной ориентации и которая действительно наблюдается в смесях при увеличении концентрации ДМСО. Увеличение корреляционного фактора в наших исследованиях до 1.2 (рис. 3) указывает на преобладание водородных связей в смесях с высокой концентрацией воды.
Список литературы
Кукушкин Ю.Н. // Соровский образовательный журнал. 1997. № 9. С. 54–59.
Верстаков Е.С. Диэлектрические и структурные свойства смешанных растворителей и растворов электролитов в них: дис. … канд. физ.-мат. наук. Москва: Московский областной педагогический институт имени Н.К. Крупской, 1975.
C.D. Leake (ed.) New York: Academy of Science, 1967.
Jacob S.W., Herschler R. // Annalls of NY Academy of Science. 1975. V. 243. P. 5.
Cowie J.M.G., Toporowski P.M. // Can. J. Chem. 1961. V. 39. P. 2240.
Luzar A. // J. Mol. Liq. 1990. V. 46. P. 221.
Акмаров К.А. Оптические свойства водных растворов диметилсульфоксида и рефрактометрические средства их контроля при производстве полимерных волокон: дис. … канд. тех. наук. Санкт-Петербург: С.-Петербургский национальный исследовательский университет информационных технологий и оптики, 2013.
Iwona Plowas, Jolanta Swiergiel, Jan Jadzyn // J. Chem. Engineer. 2013. P. A–F.
Kaatze U., Potter R., Scliafer M. // J. Phys. Chem. 1989. V. 93. P. 5623.
Li-Jun Yang, Xiao-Oing Yang, Ka-Ma Huang et al. // Int. J. Mol. Sci. 2009. V. 10. P. 1261.
Кесслер Ю.М., Емелин В.П., Толубеев Ю.С. и др. // Журн. структур. химии. 1972. № 13. С. 210.
Клеменкова З.С., Новскова Т.А., Лященко А.К. // Журн. физ. химии. 2008. Т. 82. № 4. С. 668.
Douheret G., Morenas M. // C.R. Acad. Sci. Paris. 1967. V. 264C. P. 729.
Эйзенберг Д., Кауцман В. Структура и свойства воды. Ленинград: Гидрометеоиздат, 1975.
Martin D., Hauthal H.G. Dimetilsulfoxid // B. Akad. Verl. 1971.
Kenttamaa J., Zindberg J.J. // Suomen Kenistill. 1960. V. B33. P. 32.
Сырбу В.А. Акустическая спектроскопия уксусной кислоты, диметилсульфоксида и их водных растворов: дис. …канд. хим. наук. Москва: Московский государственный университет, 1973.
Inava A. Borin, Munir S. Skaf // J. Chem. Phys. 1999. V. 110. № 13. P. 6412.
Munir S. Skaf // J. Chem. Phys. 1997. V. 107. № 15. P. 7996.
Lu Z., Manias E., Lanagan M. et al. // ECS Transactions. 2010. V. 28(18). P. 11.
Фрелих Г. Теория диэлектриков. Москва: Изд-во иностранной литературы, 1960.
Daryl B. Wong, Kathleen P. Sokolowsky, Musa I. El-Barghouthi et al. // J. Phys. Chem. B. 2012. P. 5479.
Kaatze U. // Int. J. Thermophys. 2014. V. 35. P. 20171–2087.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии