Журнал физической химии, 2020, T. 94, № 5, стр. 706-712
Квантово-химическое и ИК-спектроскопическое исследование ионной ассоциации в растворах LiCF3SO3 в ацетонитриле
А. М. Эркабаев a, *, Т. В. Ярославцева a, О. В. Бушкова a, b
a Российская академия наук, Уральское отделение, Институт химии твердого тела
Екатеринбург, Россия
b Российская академия наук, Институт проблем химической физики
Черноголовка, Россия
* E-mail: aerkabaev@mail.ru
Поступила в редакцию 29.07.2019
После доработки 29.07.2019
Принята к публикации 17.09.2019
Аннотация
Методами квантовой химии и инфракрасной спектроскопии (ИКС) с фурье-преобразованием исследована ассоциация ионов в растворах трифторметансульфоната лития в ацетонитриле. Квантово-химические расчеты выполнены методом присоединенных молекул с учетом влияния поляризуемой среды растворителя для сольватированных нейтральных ионных ассоциатов {Li+CF3SO$_{3}^{ - }$}m(CH3CN)n (где m = 1 (ионная пара) и 2 (ионный квадруполь)). Колебательные спектры, рассчитанные методом RHF + MP2/6-311G** + SMD, использованы для идентификации ионных ассоциатов при ИК-спектроскопических исследованиях растворов LiCF3SO3 в ацетонитриле (25°С, интервал концентраций 0.05–1.28 моль/кг). Ионные пары {Li+CF3SO$_{3}^{ - }$}(CH3CN)3 обнаружены во всех изученных растворах; при концентрациях ≥0.55 моль/кг отмечено формирование ионных квадруполей {Li+CF3SO$_{3}^{ - }$}2(CH3CN)2. Идентифицированы характеристические изменения в спектрах многоатомного аниона CF3SO$_{3}^{ - }$, вызванные образованием сольватированных ионных ассоциатов различного сорта (ионные пары, квадруполи).
Одновременное использование колебательной спектроскопии и квантово-химических расчетов – наиболее плодотворный подход при исследовании ионной структуры неводных растворов электролитов, позволяющий избежать многих ошибок при интерпретации экспериментальных спектров. Сочетание метода присоединенных молекул с методом поляризуемой среды дает наиболее реалистичные результаты при исследовании структур ближнего порядка в растворах, так как позволяет рассмотреть различные варианты геометрического строения комплексов при одновременном учете влияния объема окружающего растворителя. Этот подход был успешно использован нами ранее при исследовании сольватации и ассоциации в растворах ионных солей в ацетонитриле [1, 2].
Цель данной работы – изучение ассоциации ионов в растворе LiCF3SO3 в ацетонитриле (АН). Несмотря на широкое использование в лабораторной практике, число публикаций, относящихся к бинарной системе LiCF3SO3–АН, невелико [3–6], неизвестна ее фазовая диаграмма [4], а вопрос о составе и конфигурации ассоциированных ионных частиц остается открытым. Анализ экспериментальных спектров растворов LiCF3SO3 в АН до сих пор был основан на соображениях симметрии; расчеты, выполненные в работах [7, 8] для ионных ассоциатов без учета сольватации и влияния среды растворителя, не обеспечивают необходимой точности и согласия с экспериментальными данными. Вместе с тем, углубленное квантово-химическое исследование кластеров, образованных ионами соли и молекулами растворителя позволяет определить все устойчивые конфигурации и одновременно выявить специфические для каждой из частиц изменения в спектрах аниона. Это открывает новые возможности для ИК-спектроскопических исследований ионной ассоциации в системе АН–LiCF3SO3.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Ацетонитрил (НПК “Криохром”, сорт 0) перегоняли по стандартной методике [9]; LiCF3SO3 (99.995%, “Sigma-Aldrich”) сушили 2 сут при 120°С в вакуумном сушильном шкафу. Полноту удаления воды из LiCF3SO3 контролировали синхронным термическим анализом с масс-спектрометрией (STA 449 F1 Jupiter, QMS 403 C). Растворы LiCF3SO3 в АН (0.05–1.28 моль/кг) готовили в двухперчаточном боксе “MBraun” в атмосфере сухого аргона. Спектроскопические исследования растворов LiCF3SO3 в АН проводили с помощью ИК-спектрометра с фурье-преобразованием Bruker Vertex 70 при 25°С в интервале 370–4000 см–1 с разрешением 2 см–1 при 16-кратном сканировании. Исследуемый раствор помещали в разборную жидкостную кювету Pike с окнами из KBr (толщина слоя раствора 15 мкм). Для минимизации погрешности, связанной с толщиной поглощающего слоя, использовали метод внутреннего стандарта. В качестве последнего использовали полосу поглощения ν3 ацетонитрила (1376 см–1), положение и интенсивность которой не изменялись при растворении LiCF3SO3 и варьировании концентрации. Для разделения перекрывающихся полос поглощения использовали программный комплекс Opus; полосы поглощения аппроксимировали лоренцовскими функциями.
МЕТОДИКА РАСЧЕТОВ
Стартовую геометрию кластеров {Li+CF3SO$_{3}^{ - }$}m (CH3CN)n (где m = 1 (ионная пара) или 2 (ионный квадруполь), n = 1–3) выбирали из соображений симметрии с учетом структуры свободной молекулы CH3–C≡N и аниона CF3SO$_{3}^{ - }$. Оценка устойчивости кластера включала в себя нахождение минимума его полной энергии и расчет колебательного спектра оптимизированной структуры. Кластер считали устойчивым, если в равновесной структуре он не обладал мнимыми частотами колебаний, т.е. найденный минимум энергии был локальным.
Для расчета полной энергии, колебательного спектра и равновесной структуры частиц использовали одни и те же модель и базисный набор. Расчеты проводили в рамках неэмпирического метода МО LCAOSСF Рутана–Хартри–Фока (RHF) [10] с учетом корреляционных поправок Меллера–Плессе (MP2) [11] с использованием базисного набора 6-311G** для всех атомов [12, 13] и модели поляризуемой среды в варианте SMD [14] с помощью комплекса квантово-химических программ GAMESS (US) [15]. Энергию образования всех устойчивых кластеров рассчитывали по уравнению:
где ${{E}_{{cluster}}}$ – полная энергия кластера {Li+CF3SO$_{3}^{ - }$}m (CH3CN)n в равновесной конфигурации; ${{E}_{{component}}}$ – полная энергия всех входящих в его состав ионов и молекул в их равновесных конфигурациях.ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Обладающий симметрией ${{C}_{{3{v}}}}$ свободный анион CF3SO$_{3}^{ - }$ имеет 18 нормальных колебаний, из них шесть дважды вырожденных (E) [16, 17]:
в ИК-спектре активны 5A1 и 6E. Среди них практический интерес представляют три наиболее интенсивных и хорошо различимых в ИК-спектрах полосы поглощения, наблюдаемые в интервале 1000–1300 см–1: ν2 вблизи 1033 см–1 (симметричное валентное колебание группы SO3), ν7 вблизи 1150 см–1 (антисимметричное валентное колебание группы CF3) и ν6 вблизи 1270 см–1 (антисимметричное валентное колебание группы SO3). В этот же интервал попадает и менее интенсивная узкая полоса поглощения вблизи 1225 см–1, которую относят к симметричному валентному колебанию группы CF3, смешанному с другими модами [5, 16, 18]. Рассчитанные значения частот нормальных колебаний свободного CF3SO3- приведены в табл. 1 в сравнении с экспериментальными данными для 0.1 m раствора (Bu4N)CF3SO3 (соли, не склонной к ассоциации) в АН. Можно видеть, что выбранный нами метод MP2/6-311G**+SMD дает практически идеально совпадающие с экспериментальными значения частот валентных колебаний ν2 и ν6 группы SO3 (погрешность не превышает ±2 см); для полосы ν7 погрешность расчета оказалась на порядок больше и составила 21 см–1. Рассчитанные значения длин связей (1.843 Å для C–S, 1.468 Å для S–O и 1.343 Å для C–F) очень хорошо согласуются с экспериментальными значениями [16, 19].Таблица 1.
Рассчитанные значения основных частот колебаний трифторметансульфонат-аниона в виде свободной частицы и в составе ионных ассоциатов (приближение MP2/6-311G** + SMD), см–1
| Полоса поглоще-ния* | Свободный анион CF3SO$_{3}^{ - }$ |
Контактные ионные пары {Li+CF3SO$_{3}^{ - }$}(CH3CN)n |
Ионные квадруполи {Li+CF3SO$_{3}^{ - }$}2(CH3CN)n |
|||||
|---|---|---|---|---|---|---|---|---|
| Эксперимент | Расчет | n = 0 | n = 1 | n = 2 | n = 3 | n = 0 | n = 2 | |
| ν2 (Δν2) | 1033 | 1031 | 1010 (–21) | 1015 (–16) | 1029 (–2) | 1029 (–2) | 1020 (–11) | 1027 (–4) |
| ν7 (Δν7) | 1155 | 1174 | 1155 (–19) 1205 (+31) |
1168 (–6) 1203 (+29) |
1186 (+12) 1202 (+28) |
1186 (+12) 1189 (+15) |
1166 (–8) 1213 (+39) |
1176 (+2) 1199 (+25) |
| ν6 (Δν6) | 1271 | 1273 | 1215 (–58) 1334 (+61) |
1211 (–62) 1328 (+55) |
1227 (–46) 1318 (+45) |
1227 (–46) 1306 (+33) |
1220 (–53) 1318 (+45) |
1224 (–49) 1304 (+31) |
Ранее [7, 8] было показано, что при образовании контактной ионной пары катион Li+ взаимодействует с многоатомным анионом CF3SO$_{3}^{ - }$ через атомы кислорода группы SO3, имеющей форму немного приплюснутой тригональной пирамиды. Ион Li+ может быть координирован анионом CF3SO$_{3}^{ - }$ тремя способами: монодентатно (через один атом кислорода), бидентатно (через два) и тридентатно (через три). Наши расчеты показали, что несольватированная контактная ионная пара устойчива в среде поляризуемого растворителя только в бидентатной конфигурации. Присоединение одной молекулы АН не меняет типа координации аниона к катиону в контактной ионной паре {Li+CF3SO$_{3}^{ - }$}(CH3CN); ион Li+ в таком комплексе находится в треугольном окружении из атома азота и двух атомов кислорода. Присоединение второй молекулы АН также не меняет типа координации, однако в комплексе {Li+CF3SO$_{3}^{ - }$}(CH3CN)2 окружение Li+ из двух атомов О и двух атомов N становится близким к тетраэдрическому. При увеличении n до трех молекулы АН вытесняют один атом кислорода группы SO3 из первой координационной сферы Li+, что сопровождается частичным (незавершенным) смещением типа координации в комплексе {Li+CF3SO$_{3}^{ - }$}(CH3CN)3 от бидентатного к монодентатному. Как и при n = 2, катион Li+ находится в тетраэдрическом окружении трех атомов N и одного атома О (рис. 1). Таким образом, расчеты указывают на устойчивость контактных ионных пар при варьировании числа сольватации от 0 до 3.
Рис. 1.
Оптимизированные структуры сольватированных ионных пар с числами сольватации 2 и 3 (вверху) и сольватированного квадруполя (внизу).
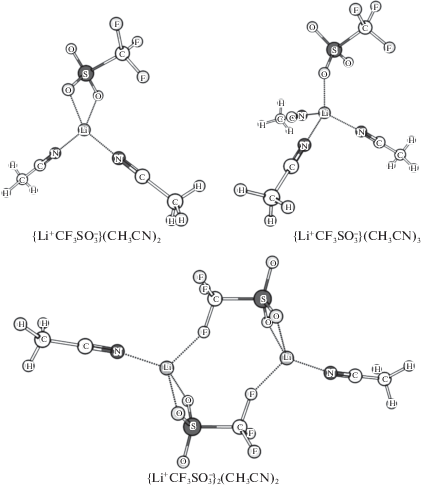
При исследовании ассоциированных ионных частиц в среде АН мы не рассматривали ионные тройники {Li+CF3SO$_{3}^{ - }$Li+} и {CF3SO$_{3}^{ - }$Li+CF3SO3}, считая более вероятным появление в концентрированных растворах нейтральных ионных ассоциатов (в соответствии с [20–22]). Дополнительным основанием для такого выбора служат литературные данные относительно низкой ионной проводимости растворов LiCF3SO3 в АН в сравнении с другими солями лития [23, 24] и повышенных значениях констант ассоциации для этой соли [25]. Поэтому следующим типом ионных ассоциатов были ионные квадруполи или димеры. В несольватированном квадруполе {Li+CF3SO$_{3}^{ - }$}2 каждый из двух катионов Li+ взаимодействует с двумя атомами кислорода группы SO3 и одним атомом фтора группы CF3. Присоединение молекул АН не меняет типа координации Li+ к CF3SO$_{3}^{ - }$ в комплексах {Li+CF3SO$_{3}^{ - }$}2(CH3CN)n, из которых устойчивым оказался только один, c числом сольватации n = 2 и тетраэдрическим окружением Li+ (рис. 1).
Взаимодействие CF3SO$_{3}^{ - }$ с Li+ и молекулами АН с образованием комплексов {Li+CF3SO$_{3}^{ - }$}(CH3CN)n (ионная пара) и {Li+CF3SO$_{3}^{ - }$}2(CH3CN)2 (квадруполь) понижает симметрию аниона и приводит к расщеплению дважды вырожденных колебаний ν6 и ν7 и их сдвигу по частоте; невырожденное колебание ν2 претерпевает только сдвиг по частоте. Расчетные значения фундаментальных частот колебаний аниона, входящего в состав устойчивых ионных ассоциатов различного состава, а также их сдвигов в сравнении со свободным анионом суммированы в табл. 1.
На рис. 2 в качестве примера представлены разностные спектры растворов LiCF3SO3 в ацетонитриле с концентрациями 0.05 (a) и 0.94 (б) моль/кг в диапазоне 1000–1300 см–1. Сложные полосы в областях 1000–1060 см–1 и 1240–1330 см–1 относятся к колебаниям ν2 и ν6 группы SO3, в области 1140–1190 см–1 – к колебанию ν7 группы CF3. Наблюдаемые полосы в области 1215–1235 см–1 не анализировали, так как они имеют небольшую интенсивность и относятся к составным частотам [17].
Рис. 2.
Разделение сложных полос поглощения триформетансульфонат-аниона в разностных спектрах растворов LiCF3SO3 в ацетонитриле с концентрациями 0.05 (а) и 0.94 (б) моль/кг (Разностные спектры получены путем вычитания нормированного спектра растворителя (ацетонитрил) из нормированного спектра раствора; все спектры нормированы относительно внутреннего стандарта – полосы поглощения 1374 см–1, не изменяющейся с концентрацией соли).
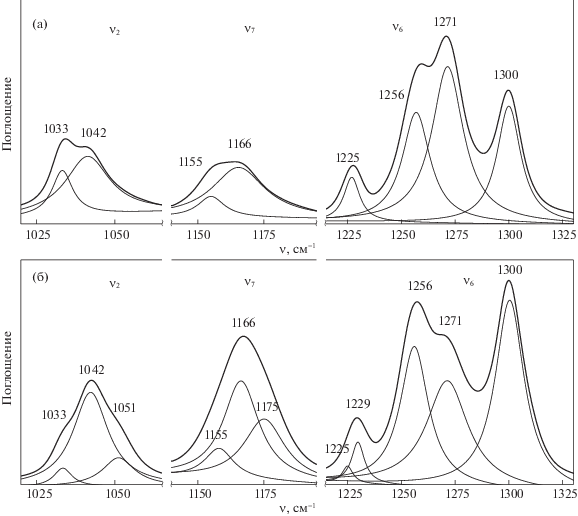
Анализ концентрационных изменений полосы ν2 показал, что если при малых концентрациях она разделяется на две компоненты (1033 и 1042 см–1) (рис. 2а), то при содержании соли 0.55 моль/кг и выше появляется дополнительное плечо в высокочастотной области, обусловленное колебанием с максимумом при 1051 см–1 (рис. 2б). При этом интенсивность компоненты, относящейся к свободным анионам CF3SO$_{3}^{ - }$ (1033 см–1), слабо растет с концентрацией, тогда как интенсивность двух новых полос, не меняющих своего положения, значительно возрастает. Указанные изменения в области невырожденного колебания ν2 свидетельствуют о появлении в растворе, помимо свободного аниона, новых ионных частиц двух видов, причем одна из них обнаруживается только при концентрациях ≥0.55 моль/кг.
Контур сложной полосы ν7 также существенно изменяется с концентрацией. Ниже 0.55 моль/кг разделение перекрывающихся полос дает две компоненты с максимумами при 1155 (свободный анион) и 1166 см–1 (ионный ассоциат) (рис. 2а); при достижении этого предела и выше к ним добавляется новая компонента с максимумом при 1175 см–1 (рис. 2б), что указывает на появление второго типа ионных ассоциатов. Концентрационные зависимости компонент аналогичны наблюдаемым в предыдущей области.
Наконец, в области ν6 во всем изученном диапазоне концентраций обнаруживаются три компоненты с максимумами при 1256, 1271 и 1300 см–1. Их интенсивности растут с увеличением концентрации соли; одновременно существенно изменяется их соотношение. Если при малых концентрациях доминирует полоса с максимумом при 1271 см–1 (рис. 2а), то с ростом концентрации более интенсивными становятся две других (рис. 2б).
Таким образом, концентрационные изменения спектров растворов LiCF3SO3 в АН указывают на присутствие во всем изученном диапазоне концентраций 0.05–1.28 моль/кг, помимо свободного аниона CF3SO$_{3}^{ - }$, еще двух сортов ионных частиц, один из которых присутствует во всех растворах, а второй появляется только при концентрациях ≥0.55 моль/кг. Если относительно ассоциатов с полосами поглощения при 1042 (Δν2 = = +9), 1166 (Δν7 = +11), 1256 (Δν6 = –15) и 1300 см–1 (Δν6 = +29) в литературе существует мнение, что это – контактные ионные пары (с неустановленной конфигурацией и неизвестным числом сольватации), то принадлежность полос с максимумами при 1051 (Δν2 = +18) и 1175 см–1 (Δν7 = +20), появляющихся при концентрациях ≥0.55 моль/кг, не определена. Авторы [8] предполагают, что наряду с контактными ионными парами в растворах LiCF3SO3 в диполярных апротонных растворителях могут появляться заряженные ионные ассоциаты {Li2CF3SO3}+ и {Li3CF3SO3}2+ c монодентатно координированными дополнительными ионами лития, однако приведенные в [8] расчетные характеристики спектров этих частиц очень далеки от экспериментально наблюдаемых, а предположение об образовании заряженных частиц противоречит экспериментальным данным о проводимости растворов LiCF3SO3 в АН. Более реалистично предположение авторов [5] о том, что рост концентрации соли может привести к уменьшению числа сольватации контактной ионной пары в концентрированных растворах, которое приводит к появлению дополнительных полос поглощения. Эта гипотеза заслуживает внимания, наряду с вероятным образованием квадруполей.
При анализе спектров несольватированные ионные пары, ионные пары с n = 1 и несольватированные квадруполи можно сразу исключить из рассмотрения, так как для них расчеты дают разнонаправленные сдвиги двух новых полос в области ν7 (табл. 1), чего не наблюдается в спектрах растворов. Остаются три возможных сценария: 1) образование ионных пар {Li+CF3SO$_{3}^{ - }$}(CH3CN)3 во всем изученном диапазоне концентраций и уменьшение их числа сольватации до n = 2 в растворах с концентрацией ≥0.55 моль/кг; 2) образование ионных пар {Li+CF3SO$_{3}^{ - }$}(CH3CN)3 и появление ионных квадруполей {Li+CF3SO$_{3}^{ - }$}2(CH3CN)2 с ростом концентрации; 3) образование ионных пар {Li+CF3SO$_{3}^{ - }$}(CH3CN)2 и появление ионных квадруполей {Li+CF3SO$_{3}^{ - }$}2(CH3CN)2 в концентрированных растворах.
Следует отметить, что область ν6 не может дать информацию для идентификации ионных частиц. Согласно расчетам, дважды вырожденное колебание ν6 должно расщепляться на два сдвинутых в сторону более низких и более высоких частот при понижении симметрии CF3SO$_{3}^{ - }$ вследствие координации с Li+ при образовании ионных ассоциатов, причем величины сдвигов очень близки для всех рассматриваемых частиц – ионных пар с числами сольватации 2 и 3 и сольватированных квадруполей (табл. 1). С учетом погрешности расчетов в экспериментальных спектрах полосы этих частиц могут совпадать. Действительно, в указанной области во всем изученном диапазоне концентраций обнаруживаются только две разнонаправлено сдвинутых новых полосы, положение которых не изменяется с концентрацией (Δν6 составляет –15 и +29 см–1), а интенсивность растет. Таким образом, в области ν6 ионные ассоциаты разного сорта неразличимы.
К сольватированным ионным парам очевидно относятся новые полосы при 1042 см–1 (Δν2 = = +9 см–1) и 1166 см–1 (Δν7 = +11 см–1), наблюдаемые во всем диапазоне концентраций. Сделать выбор в пользу комплекса с числом сольватации 2 или 3 можно только на основании анализа области ν7, так как для невырожденного колебания ν2 расчеты предсказывают совершенно одинаковый и практически нулевой сдвиг для обеих возможных конфигураций ионных пар (погрешность расчета Δν2 по сравнению с экспериментом составляет 11 см–1). Колебание ν7 свободного аниона дважды вырождено и расщепляется на два при образовании контактных ионных пар (табл. 1). Анализ расчетных значений Δν7 и сопоставление с экспериментальными данными приводят к заключению об образовании ионной пары с максимальным значением числа сольватации {Li+CF3SO$_{3}^{ - }$}2(CH3CN)3: для такой частицы два колебания с близкими значениями сдвигов +12 и +15 см–1, по-видимому, совпадают и дают одну полосу при 1166 см–1 (Δν7 = +11 см–1). (Погрешность расчета Δν7 составляет 1 и 4 см–1). В случае образования ионных пар с n = 2 в этой области спектра во всем диапазоне концентраций должны были бы появляться две хорошо различимых новых полосы, чего не наблюдается в действительности.
Изменения в спектрах концентрированных растворов скорее свидетельствуют в пользу появления квадруполей {Li+CF3SO$_{3}^{ - }$}2(CH3CN)2, чем о снижении числа сольватации ионной пары с 3 до 2. Согласно данным табл. 1, значения Δν7 в таком комплексе составляют +2 и +25 см–1, т.е. с учетом погрешности расчета квадруполь может вносить свой вклад в полосу поглощения ν7 свободного аниона при 1155 см–1 и одновременно давать новую полосу при 1175 см–1 (сдвиг +20 см–1). Правильность такого отнесения подтверждается тем фактом, что при малых концентрациях интенсивность компоненты с максимумом при 1155 см–1 меньше интенсивности полосы поглощения ν2 свободного аниона при 1033 см–1, тогда как при высоких концентрациях имеет место обратная картина (рис. 2). Если бы обе эти полосы относились только к свободным анионам, не наблюдалось бы перераспределения их интенсивностей. Погрешность расчетных значений Δν7 по сравнению с экспериментальными для квадруполя составляет 2 и 5 см–1; для Δν2 она выше и равна 22 см–1.
Возвращаясь к области ν6, следует отметить, что экспериментально установленные значения высокочастотного сдвига этой полосы для квадруполя {Li+CF3SO$_{3}^{ - }$}2(CH3CN)2 и ионной пары {Li+CF3SO$_{3}^{ - }$}2(CH3CN)3 практически совпадают с расчетными (различие 2 и 4 см–1 соответственно), тогда как низкочастотные сдвиги переоценены на 20–30 см–1.
Таким образом, на основании квантово-химических расчетов идентифицирована конфигурация ионных пар в растворах LiCF3SO3 в АН и предположено образование сольватированных ионных квадруполей с ростом концентрации.
Работа выполнена при поддержке Российского научного фонда (проект № 18-19-00014).
Список литературы
Эркабаев А.М., Ярославцева Т.В., Попов С.Э., Бушкова О.В. // Журн. физ. химии. 2015. Т. 89. № 1. С. 76. https://doi.org/10.1134/S0036024415010057
Erkabaev A.M., Yaroslavtseva T.V., Popov S.E., Bushkova O.V. // Vib. Spectrosc. 2014. V. 75. P.19. https://doi.org/10.1016/j.vibspec.2014.08.010
Brooks N.R., Henderson W.A., Smyrl W.H. // Acta Cryst. 2002. V. E58. P. m176. https://doi.org/10.1107/S1600536802005895
Seo D.M., Borodin O., Balogh D. et al. // J. Electrochem. Soc. 2013. V. 160. P. A1061. https://doi.org/10.1149/2.018308jes
Alía J.M., Diaz de Mera Y., Edwards H.G.M. et al. // J. Mol. Struct. 1997. V. 408/409. P. 439.
Bernson A., Lindgren J. // Solis State Ionics. 1993. V. 60. P. 37.
Gejji S.P., Hermansson K., Tegenfeldt J., Lindgren J. // J. Phys. Chem. 1993. V. 97. P. 11402.
Huang W., Frech R., Wheeler R.A. // J. Phys. Chem. 1994. V. 98. P. 100.
Гордон А., Форд Р. Спутник химика. М.: Мир, 1976. 541 с.
Roothaan C.C.J. // Rev. Mod. Phys. 1951. V. 23. P. 69.
Head-Gordon M., Pople J.A., Frisch M.J. // Chem. Phys. Lett. 1988. V. 153. P. 503.
Krishnan R., Binkley J.S., Seeger R. et al. // J. Chem. Phys. 1980. V. 72. P. 650.
Curtiss L.A., McGrath M.P., Blandeau J.-P. et al. // J. Chem. Phys. 1995. V. 103. P. 6104.
Marenich A.V., Cramer C.J., Truhlar D.G. // J. Phys. Chem. B. 2009. V. 113. P. 6378.
Schmidt M.W., Baldridge K.K., Boatz J.A. et al. // J. Comput. Chem. 1993. V. 14. P. 1347.
Huang W., Wheeler R.A., Frech R. // Spectrochim. Acta. 1994. V. 50A. P. 985.
Gejji S.P., Hermansson K., Lindgren J. // J. Phys. Chem. 1993. V. 97. P. 3712.
Johnston D.H., Shriver D.F. // Inorg. Chem. 1993. V. 32. P. 1045.
Tremayne M., Lightfoot P., Mehta M.A. et al. // J. Solid State Chem. 1992. V. 100. P. 191.
Pettit L.D., Bruckenstein S. // J. Am. Chem. Soc. 1966. V. 88. P. 4783.
Сухотин А.М. Вопросы теории растворов электролитов в средах с низкой диэлектрической проницаемостью. Л.: Госхимиздат, 1959. 96 с.
Стокс Р., Робинсон Р. Растворы электролитов. M.: Изд-во иностр. лит., 1963. 647 с.
Ue M., Ida K., Mori S. // J. Electrochem. Soc. 1994. V. 141. № 11. P. 2989.
Henderson W.A. Nonaqueous Electrolytes: Advances in Lithium Salts // In: Jow T.R., Xu K., Borodin O., Ue M. (Eds.), Electrolytes for Lithium and Lithium-Ion Batteries. New York: Springer, 2014. P. 1–92.
Ue M. // J. Electrochem. Soc. 1994. V. 141. № 12. P. 3336.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии


