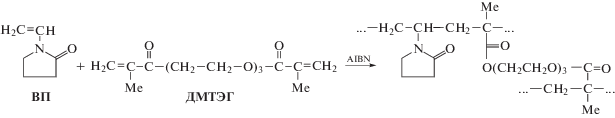Журнал физической химии, 2020, T. 94, № 5, стр. 713-718
Квантово-химическое моделирование строения комплексов сополимера n-винилпирролидона с диметакрилатом триэтиленгликоля с метформином в водных растворах
В. М. Игнатьев a, b, *, Н. С. Емельянова a, b, Н. В. Фадеева b, С. В. Курмаз b
a Московский государственный университет имени М.В. Ломоносова, Факультет фундаментальной физико-химической инженерии
Москва, Россия
b Институт проблем химической физики Российской академии наук
Черноголовка, Россия
* E-mail: ignvm@74.ru
Поступила в редакцию 17.07.2019
После доработки 17.07.2019
Принята к публикации 17.09.2019
Аннотация
С помощью метода DFT (программный пакет Gaussian 09, функционал TPSSh, базисный набор 6-31G*//6-311++G**) и модели QTAIM (программный пакет AIMALL) было изучено строение комплексов метформина (диметилбигуанида) с сополимером N-винилпирролидона с диметакрилатом триэтиленгликоля в водных растворах. Показано, что метформин как и молекулы воды координируется по кислороду С=O-связи лактамного кольца, и этот процесс является экзотермическим. На одном кислороде может координироваться одна–две молекулы воды; при этом кроме обычной терминальной координации молекула воды может образовывать мостики, связывая между собой две соседние C=O-группы. Кроме первой гидратной оболочки возможно образование второй гидратной оболочки за счет цепного присоединения молекул воды, ее строение зависит от взаимной ориентации С=О-групп. Показано, что метформин ориентируется относительно электронодонорных групп строго определенным образом и способен вытеснять воду при координации с сополимером.
Одним из актуальных направлений современной биомедицинской химии является разработка новых лекарственных препаратов путем введения в полимерные матрицы биологически активных молекул [1], что облегчает их доставку к мишеням за счет более эффективного проникновения в клетки. Метформин (диметилбигуанид) – объект многочисленных исследований, в том числе и с помощью квантово-химических методов [2]. Это соединение широко используется как лекарственное средство при лечении сахарного диабета второго типа [3]. К тому же, существуют данные, которые показывают, что метформин может иметь и противоопухолевое действие [4]. Именно это свойство делает метформин перспективным объектом для получения комплексов с молекулами-носителями биологически активных веществ (БАВ).
Благодаря развитию методов полимерной химии были синтезированы сополимеры N-винилпирролидона разветвленного строения, размеры, топологию и плотность ветвления которых можно легко варьировать в процессе синтеза [5]. В последнее время перспективным объектом исследований являются амфифильные сополимеры N-винилпирролидона с диметакрилатом триэтиленгликоля (ВП–ДМТЭГ). Они обладают подходящей молекулярной массой и степенью дифильности, задаваемой содержанием диметакрилата, чтобы образовывать в полярных средах полимерные наночастицы мицеллярного типа, имеющие ядро из гидрофобных ветвящихся фрагментов. Они хорошо растворимы в полярных средах, малотоксичны, и способны к эффективному проникновению в клетки [6]. Благодаря этим свойствам данный сополимер может использоваться в качестве носителя биологически активных соединений, имеющих медицинское значение [1].
Изучение процессов комплексообразования в растворах сополимеров не следует ограничивать рассмотрением лишь взаимодействия БАВ с ВП–ДМТЭГ. Данные ИК-спектроскопии (сдвиг полосы поглощения валентных колебаний С=О-группы лактамного цикла ВП звеньев сополимера) и термогравиметрии (потеря массы при нагревании до 200°C) показывают, что даже в “сухих” сополимерах содержится сорбированная вода. Именно поэтому исследование взаимодействия воды с сополимером ВП–ДМТЭГ может дать больше информации о строении комплексов сополимера с БАВ. В данном случае, квантово-химическое моделирование является удобным и полезным инструментом для интерпретации экспериментальных данных, предсказания строения и свойств системы. Подобные объекты уже исследовались квантово-химическими методами. В работе [7] обнаружено, что поли-N-винилпирролидон, выделенный из водных растворов, образует Н-связанные комплексы различного стехиометрического состава. Как показывают расчеты, водородная связь с водой, образуемая карбонильными группами двух колец ВП-звеньев, довольно прочная (в системе наблюдается перенос заряда). На основе полученных данных предполагается, что поли-N-винилпирролидон в реакциях комплексообразования с гостевыми молекулами БАВ участвует в гидратированном состоянии через связанную воду. При этом вода может стабилизировать образующиеся комплексы сополимера.
Целью данной работы является проведение теоретических расчетов возможных структур участков сополимера с молекулами воды и моделирование строения комплекса гидратированного сополимера с метформином для установления наиболее выгодных структур и расчета энергии связи гостевой молекулы с сополимером.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Имеющиеся в коммерческом доступе вещества использовались без дополнительной очистки. Все растворители были очищены по методике, указанной в [8]. Сополимер ВП–ДМТЭГ был синтезирован по схеме, описанной в работе [9]. ИК-спектры порошков сополимера регистрировали на ИК-Фурье-спектрометре “Bruker α” в диапазоне 4000–400 см–1 в режиме НПВО.
Квантово-химические расчеты проводились в рамках теории функционала плотности (DFT) с полной оптимизацией геометрии исходных молекул и их комплексов в программе Gaussian 09 [10]. В качестве метода и базиса использовались гибридный функционал TPSSh [11] и базисный набор 6-311++G**//6-31G*.
Следует отметить, что, при выборе оптимального метода для квантово-химических расчетов нам с самого начала пришлось отказаться от методов ab initio. При попытке произвести расчеты с помощью пост-хартри-фоковского метода MP2, время работы процессора превысило 300 часов на 12-ядерном компьютере, что при объеме данных, требующих обработки, непозволительно много. Для примера, расчет той же задачи в методах DFT занимает около 5 ч.
В рамках DFT сравнивали гибридные методы B3LYP, с помощью которого в современной квантовой химии реализуется подавляющее большинство вычислений, и TPSSh [11]. При сопоставимых затратах времени на расчет, метод TPSSh оказался предпочтительней, поскольку показал лучший масштабирующий множитель для наших объектов (0.972 против 0.965)11.
Также учитывалось влияние растворителя с помощью модели поляризуемого континуума (PCM). В результатах расчетов отсутствуют мнимые частоты колебаний, все оптимизированные структуры соответствуют минимуму потенциальной энергии. Относительные энергии стабилизации комплексов расчитывались из данных полученных с помощью метода TPSSh и базиса 6‑311++G**. Все термодинамические величины посчитаны с учетом энергии нулевых колебаний. Для анализа волновой функции с помощью метода QTAIM использовался программный пакет AIMALL (версия 10.05.04) [12]. Волновые функции структур рассчитывались в тех же приближениях, что и оптимизация геометрии. Энергии межмолекулярных связей рассчитывались из данных, полученных с помощью метода QTAIM по формуле Ea–b ≈ 1/2νe(r) [13], где Ea–b – энергия связи A–B, а νe(r) – плотность потенциальной энергии в критической точке связи A–B. Теоретические ИК-спектры обрабатывались в программе ChemCraft (версия 1.8) [14].
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Гидратные комплексы сополимера ВП–ДМТЭГ
На рис. 1 представлена схема синтеза сополимера ВП–ДМТЭГ методом радикальной сополимеризации, инициируемой азо-бис-изобутиронитрилом, в толуоле.
Было проведено квантово-химическое моделирование различных статистически возможных участков сополимера, а именно: ВП–ВП–ВП, ВП–ВП–ДМТЭГ и ДМТЭГ–ВП–ДМТЭГ. В первую очередь, были рассмотрены возможности отдельных функциональных групп, входящих в состав участков сополимера, к взаимодействию с молекулами воды. Обнаружено, что вода может образовывать относительно устойчивую водородную связь с карбонильным атомом кислорода ВП (а) и с эфирным (б) и карбоксильным (в) атомами кислорода ДМТЭГ (рис. 2).
Рис. 2.
Оптимизированные геометрии комплексов участка сополимера ВП–ВП–ДМТЭГ с одной молекулой воды.
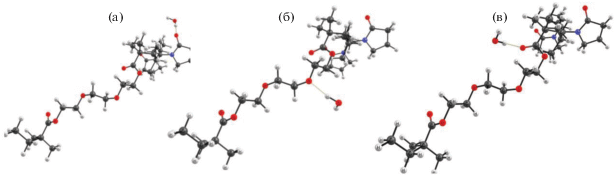
Расчет энергий связей показал, что присоединение воды к карбонильной группе ВП и эфирной группе ДМТЭГ (энергии связи 8.65 и 8.63 ккал/моль соответственно) намного выгоднее присоединения воды к карбонильной группе ДМТЭГ (6.94 ккал/моль). К тому же, в работе [1] показано, что амфифильный сополимер в водных растворах образует мицеллы, гидрофильная оболочка которых состоит из полимерных цепей, содержащих ВП-звенья. Вследствие этого, гидратацией ДМТЭГ-звеньев пренебрегали и рассматривали только Н-комплексы воды с ВП-звеньями.
При исследовании гидратных комплексов участков сополимера типа ВП–ВП–ВП учитывали различное расположение С=О-групп пирролидоновых колец: “транс” и “цис” – для направленных, соответственно в разные и в одну сторону. Согласно расчетам, цис-конформер лежит ниже по энергии всего на 3.2 ккал/моль. В связи с этим было проведено квантово-химическое моделирование гидратных комплексов на основе обоих конформеров, и рассчитаны энергии водородных связей (табл. 1).
Таблица 1.
Энергии стабилизации (Е, ккал/моль) различных гидратных комплексов участка сополимера ВП–ВП–ВП. (Tpssh/6-311++G**). Е = E(комплекс) – ‒ E(полимер) – nE(H2O)
| n | Комплексы транс-конформера | Комплексы цис-конформера |
|---|---|---|
| 1 | –3.85 | –6.80 |
| 2 | –7.86 | –12.57 |
| 3 | –11.87 | –16.43 |
| 4 | –20.32 | –22.98 |
| 5 | –24.71 | –33.88 |
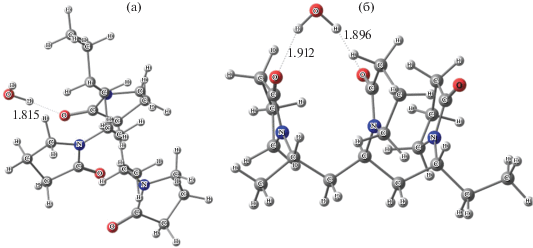
На рис. 3 представлены оптимизированные геометрии гидратных комплексов рассматриваемого участка с одной молекулой воды. Очевидно, что в случае цис-конформера существует возможность образования гидратного мостика между C=O-группами и это приводит к более прочной структуре. Как показал расчет, такая мостиковая бидентантная координация молекулы воды на поверхности участка сополимера на 2.5 ккал/моль выгоднее терминальной.
Рис. 3.
Оптимизированные геометрии присоединения одной молекулы воды к транс- (а) и цис- (б) конформациям С=О-группы пирролидоновых колец. Длины связей даны в ангстремах.
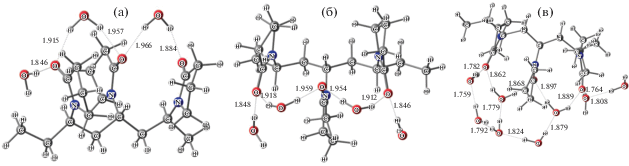
На рис. 4 представлены комплексы с различным количеством молекул присоединенной воды. Как показали расчеты, на кислороде С=О-группы ВП фрагмента может координироваться не более двух молекул воды, как в терминальной, так и в мостиковой координации. Кроме того, молекулы воды могут образовывать водородные связи не только с кислородом карбонильной группы, но и между собой. В этом случае образуется вторая гидратная оболочка (рис. 4в).
Рис. 4.
Оптимизированные геометрии ВП участка гидратированного сополимера с присоединенными тремя (а), четырьмя (б) и восемью (в) молекулами воды.
Как показал эксперимент, частота полосы поглощения карбонильной группы ВП-звеньев сополимера зависит от растворителя, из которого он был выделен. Для сополимера, выделенного из хлороформа, значение частоты в максимуме полосы поглощения равно ∼1680 см–1, а для сополимера, выделенного из водного раствора, – 1650 см–1. То есть, присоединение молекул воды к карбонильной группе вызывает сдвиг полосы поглощения карбонильной группы винилпирролидона в низкочастотную область. Такой сдвиг наблюдается и в теоретических ИК-спектрах. Присоединение воды к сополимеру приводит к смещению этой полосы поглощения в область меньших значений за счет взаимодействия карбонильной группы с гидратной оболочкой. При последовательном введении молекул воды в координационную сферу сополимера каждая последующая добавленная молекула сдвигает полосу колебаний С=О-группы на все меньшее значение, до тех пор пока смещения не будет наблюдаться вовсе. Отсутствие сдвига полосы карбонильного атома ВП в коротковолновую область при присоединении большого количества молекул воды, свидетельствует о том, что эти молекулы воды уже никак не связаны с карбонильным атомом кислорода, и присоединение этих молекул воды к гидратному комплексу не выгодней существования их в свободном виде. Таким образом, можно заключить, что существование стабильных гидратных оболочек высшего порядка (например, третьей) невозможно.
Комплексы метформина с сополимером ВП–ДМТЭГ
В первую очередь при рассмотрении комплексов метформина с сополимером изучали расположение его молекул относительно атомов кислорода, с которыми будут образовываться водородные связи за счет NH2 групп метформина. Очевидно, что бидентантная, когда метформин образует две межмолекулярные водородные связи, ориентация будет стабильнее монодентантной, когда образуется одна водородная связь примерно на 2 ккал/моль, в зависимости от типа ориентации. Возможны два типа бидентантной ориентации метформина при его координации с ВП–ДМТЭГ-соседними NH2-группами (I) и удаленными NH2-группами (II) (рис. 5).
Рис. 5.
Структуры, представляющие различные способы ориентации метформина в комплексах с сополимером, расстояния даны в Å. Обозначения см. текст.
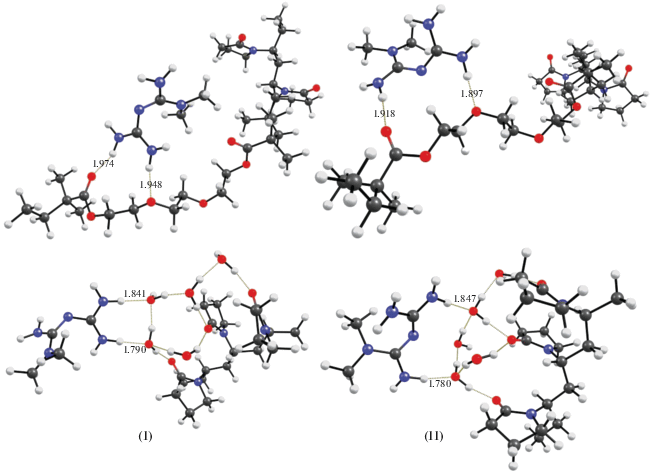
Как видно из рис. 5, метформин может образовывать водородные связи со всеми типами атомов кислорода ВП–ДМТЭГ, это могут быть карбонильные атомы кислорода ВП, карбонильные атомы кислорода сложной эфирной группы или атомы кислорода простой эфирной группы ДМТЭГ. Также он легко координируется на гидратной оболочке, строение которой рассмотрено нами выше. В табл. 2 рассмотрены комплексы, в которых метформин координируется за счет NH2-групп в различных типах рассматриваемых нами координаций I и II и на различные атомы кислорода. Как и в случае молекул воды, наиболее прочное связывание происходит с ВП–ВП–ВП фрагментом за счет атомов кислорода лактамового кольца (табл. 2). Очевидно, что координация I оказывается несколько более выгодной, причем эта закономерность не зависит от типа атома кислорода (табл. 2).
Таблица 2.
Энергии связей (Е, ккал/моль) метформина с звеньями ДМТЭГ и ВП
| Комплексы с ориентацией метформина I | Комплексы с ориентацией метформина II | ||
|---|---|---|---|
| Ea–b, (QTAIM) | Е (DFT) | Ea–b, (QTAIM) | Е (DFT) |
| ВП–ВП–ВП + метформин (O(ВП)–О(ВП)) | |||
| 19.26 | –10.20 | 12.32 | –8.18 |
| ВП–ВП–ДМТЭГ + метформин, (О(ВП)СОО(ДМТЭГ) | |||
| 11.60 | –7.43 | – | – |
| ВП–ВП–ДМТЭГ + метформин, (О(ВП)–СОС(ДМТЭГ) | |||
| 12.79 | –8.44 | – | – |
| ВП–ВП–ДМТЭГ + метформин СОО (ДМТЭГ)–СОС(ДМТЭГ) | |||
| 13.37 | –6.11 | 9.61 | –4.13 |
| ВП–ВП–ДМТЭГ + метформин СОС(ДМТЭГ) | |||
| – | – | 7.44 | –3.75 |
Примечание. Энергия связей вычислена по формуле Ea–b ≈ ≈ 1/2νe(r) [13] (ккал/моль) из метода QTAIM. Энергия стабилизации Е = E(комплекс) – E(полимер) – E(метформин).
Очевидно, что метформин, имеющий гидрофильную природу может координироваться на гидратной оболочке сополимера ВП с ДМТЭГ (рис. 5). При самом выгодном способе ориентации I суммарная энергия водородных связей при координации метформина на атомах кислорода молекул воды, вычисленная из QNAIM, составляет 19.80 ккал/моль, что практически не отличается от координации метформина непосредственно на сополимере при том же типе ориентации, так как в том случае (см. табл. 2), при вычислении суммарной энергии связи с помощью QTAIM, мы получили 19.26 ккал/моль.
В то же время, при расчете энергии комплексов выяснилось, что комплекс сополимера с метформином лежит ниже по энергии, чем комплекс сополимера с тремя молекулами воды примерно на 3.4 ккал/моль. То есть, метформин может не только координироваться на поверхности гидратной оболочки сополимера, но и замещать молекулы воды в ее составе.
С учетом полученных результатов, можно сделать следующие выводы. Согласно расчетам, процесс координации воды на участке сополимера, содержащего три ВП-звена, является экзотермическим и протекает с выделением энергии. Координация проходит по кислороду С=O-связи лактамного кольца. На одном кислороде может координироваться одна–две молекулы воды. Молекула воды может кроме обычной терминальной координации образовывать мостики, связывая между собой две соседние C=O-группы. Кроме этой первой гидратной оболочки, возможно и образование второй гидратной оболочки за счет цепного присоединения молекул воды, причем энергии связей в ней незначительно слабее, чем в первой. Ее строение зависит от взаимной ориентации С=О-групп. Метформин во всех комплексах с сополимером ВП–ДМТЭГ в водных растворах ориентируется определенным образом. При связывании с сополимером молекулы метформина координируются преимущественно на C=O-группе лактамного цикла звеньев ВП. Предполагается, что в растворах метформин способен вытеснять воду из гидратных комплексов сополимера.
Работа выполнена по теме государственного задания (Рег. № АААА-А19-119071890015-6).
Список литературы
Kurmaz S.V., Obraztsova N.A., Ivanchikhina A.V. // Khimiya Vysokikh Energii. 2014. V. 48. № 1. P. 63.
Mondal S., Samajdar R.N., Mukherjee S. et al. // J. Phys. Chem. B. 2018. V. 122. P. 2227.
Diabetes Prevention Program Research Group. Reduction in the incidence of type 2 diabetes with lifestyle intervention or metformin // N. Engl. J. Med. 2002. 346, 393 403.
Li D., Yeung S.C., Hassan M.M., Konopleva M. et al. // Gastroenterology. 2009. V. 137. № 2. P. 482.
Kurmaz S.V., Obraztsova N.A., Perepelitsina E.O. et al. // Mater. Today Comm. 2015. V. 4. № 9. P. 130.
Курмаз С.В., Орразцова Н.А., Балакина А.А. и др. // Изв. АН. Сер. Хим. 2014. Т. 65. № 8. С. 2097.
Лебедева Т.Л., Фельдштейн М.М., Купцов С.А. и др. // Высокомолекулярные соединения. Серия А. 2000. Т. 42. № 9. С. 1504.
Weissberger A., Proskauer E., Riddick J.A. et al. Organic solvents: physical properties and methods of purification. New York: Wiley, 1955.
Курмаз С.В., Пыряев А.Н. // Высокомолекулярные соединения. Серия Б. 2010. Т. 52. № 1–2. С. 1.
Frisch M.J., Trucks G.W., Schlegel H.B. et al. Gaussian, Inc., Wallingford CT, 2009.
Tao J.M., Perdew J.P., Staroverov V.N. et al. // Phys. Rev. Lett. 2003. V. 91. № 14. P. 146401.
AIMAll (Version 10.05.04), Todd A. Keith, T.K Gristmill Software, Overland Park KS, USA, 2010 (aim.tkgristmill.com).
Espinosa E., Molins E., Lecomte C. // Chem. Phys. Lett. 1998. V. 285. № 3–4. P. 170.
Chemcraft – graphical software for visualization of quantum chemistry computations. https://www.chemcraftprog.com.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии