Журнал физической химии, 2020, T. 94, № 6, стр. 873-880
Механизм самосборки донорно-акцепторных триад на основе порфиринового комплекса кобальта(ii) и фуллеро[60]пирролидинов по данным методов спектроскопии и электрохимии
Н. Г. Бичан a, *, Е. Н. Овченкова a, В. А. Мозгова a, b, Н. О. Кудрякова a, М. С. Груздев a, Т. Н. Ломова a
a Российская академия наук, Институт химии растворов им. Г.А. Крестова
Иваново, Россия
b Ивановский государственный химико-технологический университет
Иваново, Россия
* E-mail: bng@isc-ras.ru
Поступила в редакцию 28.06.2019
После доработки 28.06.2019
Принята к публикации 17.09.2019
Аннотация
Изучены кинетика и равновесия реакций 5,10,15,20-(тетра-4-изопропилфенил)21Н,23Н-порфирина кобальта(II) (CoTIPP) с 1-метил-2-(4-(1H-имидазол-1'-ил)фенил)- и 1-метил-2-(пиридин-4'-ил)-3,4-фуллеро[60]пирролидинами (ImC60 и PyC60 соответственно), заканчивающихся образованием донорно-акцепторных супрамолекулярных триад (ImC60)2CoTIPP/(PyC60)2CoTIPP. Химическая структура триад установлена методами УФ-, видимой, ИК-, 1H ЯМР-спектроскопии, окислительно-восстановительное поведение – методом циклической вольтамперометрии. Показано, что образование триад сопровождается сдвигом окислительно-восстановительных потенциалов прекурсоров, указывающим на наличие взаимодействий между π-системами донора и акцептора. Сделан вывод, что полученные результаты необходимо учитывать в дальнейших исследованиях донорно-акцепторных систем с прогнозируемой устойчивостью для фотовольтаических ячеек.
Для получения супрамолекулярных систем с заданными свойствами часто используется комплексообразование металл–пиридин/имидазол [1]. Данный подход применяется для формирования фотоактивных порфириносодержащих систем [2]. Аксиальная координация лигандов, содержащих фуллереновые фрагменты, металлопорфиринами позволяет получить супрамолекулы, способные к фотоиндуцированному разделению разноименных зарядов – фундаментальному процессу, необходимому как для естественного фотосинтеза, так и для преобразования солнечной энергии [3]. В таких надмолекулярных системах металлопорфирины выступают в качестве донорных платформ [4]. Большое количество исследований проведено для порфирин/фталоцианин-фуллереновых систем, в которых в качестве доноров электронов выступают порфирины/фталоцианины цинка [5–10].
Перспективным подходом для расширения возможностей дизайна фотоактивных надмолекулярных систем является использование порфириновых/фталоцианиновых комплексов других металлов [11–16], в том числе кобальта [17–20]. Авторы работы [11] в качестве донорной платформы для получения супрамолекул с фуллеренами используют фталоцианин рутения. Использование фталоцианинов рутения(II) вместо соответствующих комплексов цинка(II) позволяет обеспечить подавление потери энергии и нежелательной рекомбинации зарядов. Использование порфирина алюминия позволяет получать супрамолекулы, в которых дополнительные доноры электронов и акцепторы могут быть ковалентно связаны с центральным атомом алюминия. В триаде, полученной в работе [12], дополнительный донор электронов – тетрафенилэтиламин (TPE) связан ковалентно, а акцептор ImC60 – через координационные связи. Показано, что данная триада способна к поэтапному, индуцированному светом разделению зарядов сначала между TPE и порфирином алюминия(III) (AlP) до образования ${{({\text{TPE}})}^{{ \bullet + }}}$-${{({\text{AlP}})}^{{ \bullet - }}}$ ← ImC60, затем до конечного состояния с разделением заряда ${{({\text{TPE}})}^{{ \bullet + }}}$-AlP ← ← ${\text{Im}}{{({{{\text{C}}}_{{60}}})}^{{ \bullet - }}}$ с временем жизни 25 нс. Примечательно, что оба состояния с разделением заряда имеют высокие энергии: 2.14 и 1.78 эВ, соответственно. Поэтому авторы сообщают, что данная триада перспективна в области искусственного фотосинтеза и фотовольтаики.
Авторами [13] проведено спектроскопическое исследование процесса самосборки 5,10,15,20-(тетрафенил)-21Н,23Н-порфирина магния(II) (MgTPP) и ImC60. Выявлено образование диады (ImC60)MgTPP с достаточно высокой константой устойчивости (1.5 ± 0.3) × 104 л моль–1, однако ожидаемая триада (ImC60)2MgTPP не наблюдалась. Диада (ImC60)MgTPP способна к фотоиндуцированному разделению зарядов, скорость прямого переноса электронов характеризуется константой kCS = 1.1 × 1010 c–1, константа скорости рекомбинации заряда kCS = 8.3 × 107 c–1.
В продолжение наших исследований реакций образования и свойств супрамолекулярных систем на основе кобальтовых комплексов в данной работе представлены данные по формированию донорно-акцепторных комплексов на основе 5,10,15,20-(тетра-4-изопропилфенил)21Н,23Н-порфирина кобальта(II) (CoTIPP) и 1-метил-4-(1H-имидазол-1'-ил)фенилфуллеро[60 ] пирролидина (ImC60)/1-метил-2-(пиридин-4'-ил)-3,4-фуллеро[60 ] пирролидина (PyC60). Полученные данные об устойчивости этих систем, об их электронно-оптических и электрохимических свойствах позволят получить зависимости типа “структура–свойство”, необходимые для продолжения исследований в области разработки систем с прогнозируемой устойчивостью для фотоэлектрохимических ячеек.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
5,10,15,20-(тетра-4-изопропилфенил)21Н,23Н-порфин (Н2TIPP) синтезировали по методике [21]. К 100 мл кипящей пропионовой кислоты при постоянном перемешивании последовательно по каплям добавляли пиррол (3.39 г, 32 ммоль) и 4‑изопропилбензальдегид (4.74 г, 32 ммоль). После добавления альдегида реакционную массу кипятили при перемешивании 30 мин. Раствор охлаждали до комнатной температуры и помещали в морозильную камеру на 12 ч. Выпавший осадок отфильтровывали, промывали метанолом (3 раза по 10 мл) и горячей водой (3 раза по 30 мл). Полученные пурпурные кристаллы высушивали на воздухе, а затем в вакууме. Выход 20.25%. ЭСП в CHCl3 (λmax, нм): 420, 450, 515, 555, 670. Спектр 1H ЯМР (CDCl3), δ, м.д.: –2.75 с.уш. (2H, NH), 1.55 м (24Н, СН3), 3.29–3.24 м (4H, СН), 7.61 д (8Hм, J 7.6 Гц), 8.14 д (8Ho, J 7.84 Гц), 8.87 с (8Hβ). Масс-спектр MALDI-TOF, m/z (Iотн, %): 782 (95) [M]+.
(5,10,15,20-(тетра-4-изопропилфенил)21Н,23Н-порфинато)кобальт(II), (CoTIPP) получали реакцией соответствующего порфирина (64 мг, 0.082 ммоль) с Co(AcO)2 · 4H2O (105 мг, 0.42 ммоль) в кипящем диметилформамиде (ДМФА) в течение 40 мин. После окончания реакции содержимое реакционной колбы охлаждали и экстрагировали продукты в хлороформ. Раствор в CHCl3 многократно промывали дистиллированной водой для удаления ДМФА. Растворитель частично отгоняли, продукт хроматографировали на колонке с Al2O3 (II степень активности по Брокману) с использованием хлороформа. Получали основную оранжевую зону, соответствующую CoTIPP. Выход составил 82%. ЭСП в толуоле (λmax, нм (lg ε)): 415 (5.21), 531 (3.97), 615 (2.93). ИК-спектр (KBr) ν, см–1: 377, 447, 503, 572, 717, 753, 799, 813, 837, 853, 1002, 1032, 1055, 1074, 1097, 1140, 1165, 1185, 1206, 1245, 1272, 1298, 1351, 1382, 1406, 1459, 1505, 1547, 1608, 1687, 1726, 1804, 1910, 2869, 2927, 2959, 3022 . 1H ЯМР (CDCl3), δ, м. д.: 2.79 с (24H, СН3), 4.73 с (4H, СН), 9.82 с (8Hм), 13.21 уш.с. (8Ho), 16.06 уш.с. (8Hβ). Масс-спектр MALDI-TOF, m/z (Iотн, %): 840.05 (100) [M]+.
1-метил-2-(пиридин-4'-ил)-3,4-фуллеро[60 ] пирролидин (PyС60) синтезировали по методике, представленной в работе [22]. ЭСП в толуоле (λmax, нм): 312, 328, 433. ИК-спектр (KBr) ν, см-1: 404, 431, 448, 479, 504, 527, 553, 574, 598, 635, 664, 707, 737, 767, 785, 824, 840, 910, 940, 989, 1034, 1067, 1083, 1109, 1123, 1179, 1215, 1246, 1268, 1314, 1334, 1409, 1430, 1463, 1561, 1595, 1736, 2783, 2845, 2920, 2948. 1H ЯМР (CDCl3), δ, м. д.: 2.83 с (3H), 4.96 с (1H), 4.31 д (1H, J 9.77 Гц), 5.02 д (1H, J 9.77 Гц), 7.82 м (2H), 8.71 д (2H, J 5.49 Гц). Масс-спектр MALDI-TOF, m/z (Iотн, %): 853 (99) [M–H]+, 854 (76) [M]+.
1-метил-2-(4-(1H-имидазол-1'-ил))фенилфуллеро[60 ] пирролидин (ImC60) синтезировали по методике, представленной в работе [22]. С60 (100 мг, 0.14 ммоль), 4-(1H-имидазол-1-ил)бензальдегид (120 мг, 0.70 ммоль) и N-метилглицин (40 мг, 0.45 ммоль) перемешивали в 90 мл толуола при температуре кипения в течение 2 ч, затем растворитель удаляли вакуумной отгонкой. Реакционную смесь хроматографировали на колонке с Al2O3 (II степень активности по Брокману) с использованием толуола для первой зоны из непрореагировавшего С60, метанола – для непрореагировавшего альдегида и смеси толуол–этилацетат (4 : 1) – для третьей зоны, содержащей ImC60. Выход 51%. ЭСП в толуоле (λmax, нм): 312, 329, 434. ИК-спектр (KBr) ν, см–1: 376, 399, 430, 464, 476, 527, 544, 553, 562, 566, 575, 583, 599, 606, 617, 656, 694, 706, 727, 737, 746, 759, 767, 771, 789, 802, 833, 842, 863, 901, 908, 962, 1018, 1033, 1053, 1091, 1099, 1107, 1143, 1151, 1163, 1179, 1215, 1233, 1243, 1259, 1282, 1301, 1320, 1333, 1357, 1367, 1429, 1447, 1463, 1483, 1521, 1540, 1610, 2328, 2346, 2779, 2839, 2919, 2946, 3114. 1H ЯМР (CDCl3), δ, м. д.: 2.82 с (3H), 4.29 д (1H, J = 4.28 Гц), 5.00 м (2H), 7.17 м (1H), 7.32 т (1H, J 1.35 Гц), 7.48 д ( 1H, J 8.41 Гц), 7.90 м (2H). Масс-спектр MALDI-TOF, m/z (Iотн, %): 920.75 (100) [M]+.
Толуол марки “ЭКОС” осушали гидроксидом калия и перед использованием перегоняли (tкип = = 110.6°С). Содержание воды определяли титрованием по Фишеру, оно не превышало 0.01%.
Кинетику двухсторонней реакции CoTIPP с ImC60/PyС60 в толуоле изучали спектрофотометрически при 298 K в диапазоне концентраций ImC60 5.88 × 10–5–1.57 × 10–4 моль/л, PyС60 4.38 × × 10–5–1.17 × 10–4 моль/л методом избыточных концентраций. Растворы CoTIPP и ImC60/PyС60 в свежеперегнанном толуоле готовили непосредственно перед использованием во избежание образования пероксидов в среде растворителя. Измерения оптической плотности для серии растворов с постоянной концентрацией CoTIPP (6.28 × × 10–6 моль/л) и переменной концентрацией замещенного фуллерена проводили на рабочей длине волны 415 нм сразу после смешивания реагентов и во времени. ЭСП реагирующей системы снимали с использованием в качестве нулевой линии спектр ImC60/PyС60 той же концентрации, что и в рабочем растворе. Растворы термостатировали при 298 ± 0.1 K в закрытых кварцевых кюветах в специальной ячейке спектрофотометра. Константы скорости реакции рассчитывали по уравнению
Равновесие реакции CoTIPP с ImC60/PyС60 в толуоле исследовали при 298 K в диапазоне концентраций PyС60 1.46 × 10–6–1.31 × 10–4 моль/л, ImC60 1.37 × 10–6–1.57 × 10–4 моль/л времязависимым спектрофотометрическим титрованием методом молярных отношений. Константы равновесия (K) определяли по уравнению
ЭСП, ИК-, ЯМР- и масс-спектры регистрировали соответственно на спектрофотометре Agilent 8453, спектрометрах VERTEX 80v, Bruker Avance III-500 и масс-спектрометре Shimadzu Confidence.
Электрохимические измерения проводили при 298 K в анаэробных условиях в трехэлектродной ячейке с помощью импульсного потенциостата ПИ 50-Pro-3 с программным обеспечением PS Pack 2. Вольтамперометрические кривые снимали при скорости развертки потенциала 100 мВ/с. В качестве рабочего электрода и противоэлектрода использовали соответственно платиновый электрод и платиновую проволоку. Электрод сравнения – насыщенный каломельный электрод. Исследования электрохимических свойств CoTIPP, PyС60/ImС60 и донорно-акцепторных триад на их основе проводили в их свежеприготовленных растворах в дихлорметане с добавлением вспомогательного электролита (0.1 моль/л (n-Bu)4NClO4) под током аргона.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Спектральный анализ синтезированных соединений CoTIPP, фуллеро[60 ] пирролидинов (ImC60, PyC60) надежно характеризует их химические структуры. ЭСП фуллеро[60 ] пирролидинов имеют характерное поглощение в области 430 нм [22, 23]. ЭСП комплекса двухвалентного кобальта CoTIPP содержит полосу Соре (1a1g → 2eu) при 415 нм и Q-полосу (1a1g → 1eu) при 531 нм [24].
Исследование реакции CoTIPP с ImC60 проводили спектрофотометрическим методом. Для процессов, протекающих при взаимодействии CoTIPP с ImC60, удается обнаружить установление двух равновесий: первое – устанавливается мгновенно после сливания растворов реагентов, а второе – во времени с измеримой скоростью. Используя подход, основанный на спектрофотометрическом времязависимом титровании (обработка данных по спектрофотометрическому титрованию при τ = 0 и τ = ∞ после прохождения медленной реакции при всех составах смеси), удается количественно описать оба равновесия и скорость второй стадии реакции. Схема образования супрамолекулярных порфирин-фуллереновых комплексов CoTIPP с ImС60 представлена на рис. 1.
Спектральные проявления взаимодействия CoTIPP с ImС60 на первой стадии (в нулевой момент времени) представлены на рис. 2. На первой стадии после установления равновесий при всех составах реакционных смесей дальнейшее медленное взаимодействие в системе CoTIPP–ImC60 сопровождается постепенным уменьшением интенсивности поглощения полосы Соре при 415 и появлением новой полосы при 436 нм. Динамика спектра однозначно подтверждает образование гексакоординационного комплекса кобальта [25]. Второе равновесие в системе порфирин кобальта(II)–замещенный фуллерен устанавливается во времени, которое зависит от концентрации фуллерена в растворе и составляет в среднем 10–15 мин (рис. 3). Состав образующихся донорно-акцепторных систем CoTIPP с ImC60 на первой и второй ступенях определяли из линейных зависимостей $\lg I{\kern 1pt} --{\kern 1pt} \lg {{C}_{{{\text{Im}}{{{\text{C}}}_{{60}}}}}}$. Тангенс угла наклона (tg α) данных прямых на первой и второй ступенях равен 1.02 и 1.27 соответственно. Уравнения реакций, численные значения констант равновесий и общая константа устойчивости (образования) (β) триады (ImC60)2CoTIPP представлены в табл. 1.
Рис. 2.
Изменение электронного спектра поглощения CoTIPP в толуоле при 298 K с добавкой ImC60, возрастающей от 0 до 1.57 × 10–4 моль/л при τ = 0. На вставке – соответствующая кривая спектрофотометрического титрования, полученная на рабочей длине волны 415 нм.

Рис. 3.
Изменение электронного спектра поглощения CoTIPP в толуоле при 298 K с возрастающей добавкой ImC60 от 1.37 × 10–6 до 1.76 × 10–4 моль/л в толуоле при τ = ∞ (при полном окончании реакций). На вставке – соответствующая кривая спектрофотометрического титрования, полученная на рабочей длине волны 415 нм.
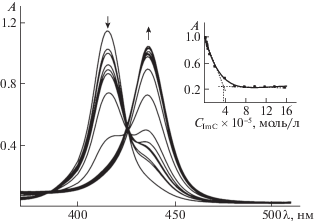
Таблица 1.
Уравнения реакций кобальт(II)порфирина c фуллеро[60 ] пирролидинами и соответствующие константы устойчивости
| Уравнение реакции | Kn, л/моль (lg Kn) | β = K1K2, л2 моль–2 (lg β) |
|---|---|---|
| CoTIPP + ImC60$\overset {{{K}_{1}}} \leftrightarrows $ (ImC60)CoTIPP (1) | (3.29 ± 0.49) × 104 (4.52) | (2.05 ± 0.35) × 109 (9.31) |
| (ImC60)CoTIPP + ImC60$\overset {{{K}_{2}}} \leftrightarrows $ (ImC60)2CoTIPP (2) | (6.23 ± 0.61) × 104 (4.79) | |
| CoTIPP + PyC60$\overset {{{K}_{1}}} \leftrightarrows $ (PyC60)CoTIPP (3) | (1.59 ± 0.45) × 104 (4.20) | (3.21 ± 0.95) × 109 (9.51) |
| (PyC60)CoTIPP + PyC60$\overset {{{K}_{2}}} \leftrightarrows $ (PyC60)2CoTIPP (4) | (2.02 ± 0.38) × 105 (5.31) | |
| CoTPP + PyC60$\overset {{{K}_{1}}} \leftrightarrows $ (PyC60)CoTPP | (5.43 ± 1.21) × 104 (4.73) | (4.69 ± 1.23) × 109 (9.67) |
| (PyC60)CoTPP + PyC60$\overset {{{K}_{2}}} \leftrightarrows $ (PyC60)2CoTPP [27] | (8.69 ± 1.39) × 104 (4.94) | |
| CoTBPP + PyC60$\overset {{{K}_{1}}} \leftrightarrows $ (PyC60)CoTBPP | (1.04 ± 0.11) × 104 (4.02) | (1.34 ± 0.12) × 1010 (10.13) |
| (PyC60)CoTBPP + PyC60$\overset {{{K}_{2}}} \leftrightarrows $ (PyC60)2CoTBPP [28] | (1.21 ± 0.32) × 106 (5.91) | |
| CoP + PyC60$\overset {{{K}_{1}}} \leftrightarrows $ (PyC60)CoP | (1.79 ± 0.33) × 104 (4.25) | (1.04 ± 0.12) × 1010 (10.02) |
| (PyC60)CoP + PyC60$\overset {{{K}_{2}}} \leftrightarrows $ (PyC60)2CoP [18] | (5.76 ± 0.60) × 105 (5.76) | |
| CoP + Py3C60$\overset {{{K}_{1}}} \leftrightarrows $ (Py3C60)CoP | (9.30 ± 0.80) × 103 (3.97) | (5.58 ± 0.16) × 108 (8.75) |
| (Py3C60)CoP + Py3C60$\overset {{{K}_{2}}} \leftrightarrows $ (Py3C60)2CoP [19] | (6.0 ± 1.2) × 104 (4.78) |
В ходе изучения кинетики медленной прямой реакции второй равновесной стадии (уравнение (2) в табл. 1) определен первый порядок по (ImC60)CoTIPP, а значит, и по CoTIPP (квазиравновесие). Эффективные константы скорости представлены в табл. 2. Линейная зависимость lg k2эф–$\lg {{C}_{{{\text{Im}}{{{\text{C}}}_{{60}}}}}}$ имеет тангенс угла наклона (порядок реакции по концентрации ImC60) близкий к 1 (tg α = 0.90, R2 = 0.99). Численное значение константы скорости k2 для реакции (2), найденное с помощью оптимизации зависимости lg k2эф–$\lg {{C}_{{{\text{Im}}{{{\text{C}}}_{{60}}}}}}$, равно 40.55 моль–1 л с–1.
Таблица 2.
Эффективные константы скорости (k2эф) реакции (ImС60)CoTIPP с ImС60/(PyС60)CoTIPP с PyС60 в толуоле при 298 K
| ${{C}_{{{\text{Im}}{{{\text{C}}}_{{60}}}}}}$ × 105, моль/л | (k2эф ± δk2эф) × × 103, с–1 | ${{С}_{{{\text{Py}}{{{\text{C}}}_{{{\text{60}}}}}}}}$ × 105, моль/л | (k2эф ± δk2эф) × × 103, с–1 |
|---|---|---|---|
| 5.88 | 6.41 ± 0.45 | 4.38 | 6.46 ± 0.60 |
| 7.83 | 8.09 ± 0.43 | 5.83 | 8.17 ± 0.23 |
| 9.80 | 9.75 ± 0.23 | 7.29 | 10.90 ± 0.82 |
| 11.80 | 11.90 ± 1.04 | 8.75 | 12.80 ± 0.79 |
| 13.70 | 13.70 ± 0.87 | 10.02 | 14.0 ± 0.94 |
| 15.70 | 15.30 ± 1.04 | 11.70 | 15.90 ± 1.05 |
Для изучения влияния химического строения фуллеро[60 ] пирролидинов на устойчивость донорно-акцепторных комплексов на основе порфирина кобальта(II) была изучена реакция CoTIPP с 1-метил-2-(пиридин-4'-ил)-3,4-фуллеро[60 ] пирролидином (PyC60). Реакция CoTIPP с PyC60 изучалась аналогично описанной выше, в толуоле (СCoTIPP = 5.31 × 10–6 моль/л, ${{С}_{{{\text{Py}}{{{\text{C}}}_{{{\text{60}}}}}}}}$ изменяется от 0 до 1.31 × 10–4 моль/л). Эта реакция также представляет собой последовательную двухстадийную координацию молекул PyC60 на атоме кобальта в составе порфиринового комплекса (значение tg α линейных зависимостей lg I–$\lg {{С}_{{{\text{Py}}{{{\text{C}}}_{{{\text{60}}}}}}}}$ на первой и второй ступенях равно 1.17 и 1.06 соответственно), закачивающуюся образованием супрамолекулярного 1: 2 комплекса (PyC60)2CoTIPP. Уравнения реакций, численные значения констант равновесий и общая константа устойчивости (PyC60)2CoTIPP представлены в табл. 1. Эффективные константы скорости медленной прямой реакций второй равновесной стадии (уравнение (4) в табл. 1) представлены в табл. 2. Линейная зависимость lg k2эф–$\lg {{С}_{{{\text{Py}}{{{\text{C}}}_{{{\text{60}}}}}}}}$ характеризуется tg α, равным 0.93 (R2 = 0.99). Численное значение константы скорости k2 для реакции (4), найденное с помощью оптимизации зависимости lg k2эф–$\lg {{С}_{{{\text{Py}}{{{\text{C}}}_{{{\text{60}}}}}}}}$, равно 81.32 моль–1 л с–1.
Образование супрамолекулярных триад (ImC60)2CoTIPP/(PyC60)2CoTIPP было дополнительно подтверждено данными ИК-, 1H ЯМР-спектроскопии и циклической вольтамперометрией. В ИК-спектре CoTIPP проявляются сигналы характеристических колебаний связей макроцикла, пропильных заместителей (в области 2950–2850, 1381 см–1) и сигнал с частотой 446 см–1, характерный для координационных связей Co–N (рис. 4а). При образовании донорно-акцепторных триад (ImC60)2CoTIPP/(PyC60)2CoTIPP проявляются новые сигналы по сравнению со спектром CoTIPP, относящиеся к координированным фуллеро[60 ] пирролидинам. Так, в ИК-спектре (ImC60)2CoTIPP появляются полосы при 2851, 2782, 1522, 1485, 1431, 1333, 1261, 1244, 1109, 1032, 963, 842, 771, 767, 747, 726, 657, 620, 599, 583, 553, 527, 487, 476 см–1 (рис. 4в). В ИК-спектре (PyС60)2CoTIPP следующие сигналы соответствуют колебаниям N-связанного PyC60: 2786, 2329, 1429, 1335, 1282, 1268, 1232, 1163, 1060, 963, 909, 832, 767, 747, 737, 541, 486, 479, 451, 447 см–1. Колебательные частоты пропильных заместителей макроциклического лиганда в области 2950–2850 см–1 при образовании донорно-акцепторных комплексов понижаются на 1–3 см–1 по сравнению с исходным CoTIPP. В области проявления колебаний связей кобальт–азот в ИК-спектрах супрамолекул от 440 до 460 см–1 для триады (PyС60)2CoTIPP наблюдаются три сигнала с частотами 443, 447, 451 см–1, а для (ImC60)2CoTIPP наблюдается уширение сигнала при 447 см–1. Все эти изменения дополнительно подтверждают образование донорно-акцепторных комплексов.
Спектр 1H ЯМР CoTIPP имеет вид, характерный для парамагнитных комплексов [26]. Сигналы β-протонов и орто-протонов фенильных заместителей проявляются в виде уширенных синглетов при 16.02 и 13.21 м.д. соответственно. Сигнал мета-протонов фенильного кольца проявляется в виде синглета при 9.82 м.д., большее удаление данного сорта протонов от парамагнитного центрального атома кобальта (3d7) не приводит к его уширению. Протоны пропильных заместителей H–CH и ${{{\text{H}}}_{{ - {\text{C}}{{{\text{H}}}_{3}}}}}$ проявляются также в виде синглетов при 4.73 и 2.79 м.д. соответственно. Образование донорно-акцепторной триады (ImC60)2CoTIPP сопровождается сильнопольным смещением сигналов β- и орто-протонов (табл. 3), как и в случае, когда в качестве донорной платформы в супрамолекуле с PyС60 выступает CoTPP [27]. Такие изменения в 1H ЯМР спектре триады можно объяснить изменением эффекта кольцевого тока порфиринового кольца вследствие образования супрамолекул с фуллеро[60 ] пирролидинами.
Таблица 3.
Химические сдвиги Hβ и Hо порфириновых комплексов кобальта и супрамолекулярных систем с фуллеро[60 ] пирролидинами
Как видно из табл. 1, устойчивость полученных супрамолекул зависит от природы заместителей как макроцикла, так и фуллеро[60 ] пирролидина. Самыми устойчивыми донорно-акцепторными триадами являются (PyC60)2CoTBPP [28] и (PyC60)2CoP [18]. По-видимому, наличие электронодонорных алкильных заместителей в порфириновом лиганде стабилизирует донорно-акцепторные супрамолекулы. Константы устойчивости супрамолекул на основе CoTPP и CoTIPP можно считать соизмеримыми, учитывая погрешность эксперимента.
Величины констант скорости образования супрамолекулярных комплексов на основе CoTIPP приблизительно соизмеримы с таковыми для реакций образования донорно-акцепторных систем (PyС60)2CoTBPP [28], (PyС60)2CoP [18], (Py3С60)2CoP [19] на основе порфиринов, содержащих донорные заместители по периферии макроцикла и превышают в 4 и 8 раз константу для триады (PyС60)2CoTPP.
Видно, что более заметное влияние на скорость процесса оказывают заместители макроцикла, а не химическая структура фуллеро[60 ] пирролидинов. Константы скорости k–2 для процессов (2) и (4) равны 6.51 × 10–4 с–1 (40.55 моль–1 л с–1/6.23 × 104 л моль–1) и 4.03 × × 10–4 с–1 (81.32 моль–1 л с–1/2.02 × 105 л моль–1). Соотношение констант скоростей прямых и обратных реакций (k2 и k–2) указывает на допустимость пренебрежения обратной реакцией при изучении кинетики двухсторонних процессов на второй стадии реакций CoTIPP с фуллеро[60 ] пирролидинами (PyС60, ImC60).
Супрамолекулярные системы (PyС60)2CoTIPP/(ImC60)2CoTIPP и их компоненты исследовались методом циклической вольтамперометрии. На рис. 5 представлены циклические вольтамперограммы для PyC60 и ImC60, которые схожи по форме и показывают три пары пиков, характерные для фуллеро[60 ] пирролидинов [29, 30]. В области отрицательных потенциалов для ImC60 наблюдаются три пика восстановления фуллерена (–0.66, –1.01, –1.60 В) и сопряженные с ними пики окисления (–1.53, –1.02, –0.60 В), что согласуется с данными [12]. ЦВА PyC60 описана в работе [27]. Эксперимент для получения ЦВА донорно-акцепторных комплексов (PyС60)2CoTIPP/(ImC60)2CoTIPP выполнен в условиях соблюдения молярного соотношения в точке эквивалентности в спектрофотометрическом эксперименте титрования. ЦВА диад (рис. 5в, 5г), по существу представляет собой сумму пиков CoTIPP и фуллеро[60 ] пирролидина. В области положительных потенциалов для обеих диад (PyС60)2CoTIPP/(ImC60)2CoTIPP наблюдаются два пика, относящихся к окислению порфириновой части диады, 0.85, 1.17 и 1.09, 1.32 В соответственно, тогда как для свободного CoTIPP проявляются три пика окисления, с потенциалами 0.82, 0.95, 1.14 В. В области отрицательных потенциалов наблюдаются пики, относящиеся к процессам, протекающим на фуллереновой части диады. Анализ значений пиков показывает, что образование донорно-акцепторных комплексов сопровождается сдвигом окислительно-восстановительных потенциалов как фуллеро[60 ] пирролидина, так и порфирина кобальта, что является еще одним подтверждением образования супрамолекул и наличием в них взаимодействий между π-системой донора и акцептора.
Рис. 5.
Циклические вольтамперограммы PyC60 (${{С}_{{{\text{Py}}{{{\text{C}}}_{{{\text{60}}}}}}}}$ = 4.03 × 10–4 моль/л) (а); ImC60 (${{C}_{{{\text{Im}}{{{\text{C}}}_{{60}}}}}}$ = 5.2 × 10–4 моль/л) (б); (PyС60)2CoTIPP (в); (ImC60)2CoTIPP (г) в дихлорметане с 0.1 моль/л (n-Bu)4NClO4. Скорость развертки потенциала 100 мВ/с.

Таким образом, получены супрамолекулярные триады (ImC60)2CoTIPP/(PyС60)2CoTIPP, реакции их образования изучены методами химической кинетики и термодинамики. Описаны спектральные и электрохимические характеристики данных донорно-акцепторных комплексов. Константы устойчивости для (PyС60)2CoTIPP/(ImC60)2CoTIPP равны (3.21 ± 0.95) × 109 и (2.05 ± 0.35) × 109 л2 моль–2 соответственно. Рассмотрена корреляция констант устойчивости донорно-акцепторных систем на основе порфиринов кобальта (табл. 1) с их химическим строением. Выявлено, что на скорость процесса образования супрамолекул наибольшее влияние оказывает природа заместителей макроцикла. Полученные данные необходимы для дальнейших исследований супрамолекулярных систем с прогнозируемой устойчивостью для фотовольтаических ячеек.
Работа выполнена на оборудовании Центра коллективного пользования научным оборудованием “Верхневолжский региональный центр физико-химических исследований” в рамках Программы государственных академий наук (Тема № 0092-2014-0002) в части изучения кинетики самосборки супрамолекулярных триад; при финансовой поддержке РФФИ и Правительства Ивановской области № 18-43-370022 (синтез парамагнитного комплекса CoTIPP), № 18-43-370023 (синтез и получение спектральных, электрохимических характеристик триад).
Список литературы
Waterloo A.R., Lippert R., Jux N., Tykwinski R.R. // J. Coord. Chem. 2015. V. 68. № 17–18. P. 3088. https://doi.org/10.1080/00958972.2015.1057711
Zhang Q., Wu F.-Y., Liu J.-C. et al. // Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy. 2018. V. 191. № . P. 398. https://doi.org/10.1016/j.saa.2017.10.046
Trukhina O., Rudolf M., Bottari G. et al. // J. Amer. Chem. Soc. 2015. V. 137. № 40. P. 12914. https://doi.org/10.1021/jacs.5b06454
Kc C.B., D’Souza F. // Coord. Chem. Rev. 2016. V. 322. P. 104. https://doi.org/10.1016/j.ccr.2016.05.012
D’Souza F., Ito O. // Chemical Communications. 2009. V. . № 33. P. 4913. https://doi.org/10.1039/b905753f
Santos L.J., CarvalhoDa-Silva D., Rebouças J.S. et al. // Tetrahedron. 2011. V. 67. № 1. P. 228. https://doi.org/10.1016/j.tet.2010.10.066
Bottari G., Trukhina O., Ince M., Torres T. // Coord. Chem. Rev. 2012. V. 256. № 21. P. 2453. https://doi.org/10.1016/j.ccr.2012.03.011
D’Souza F., Deviprasad G.R., Zandler M.E. et al. // J. Phys. Chem. A. 2002. V. 106. № 13. P. 3243. https://doi.org/10.1021/jp013165i
Stangel C., Schubert C., Kuhri S. et al. // Nanoscale. 2015. V. 7. № 6. P. 2597. https://doi.org/10.1039/c4nr05165c
Subbaiyan N.K., Obraztsov I., Wijesinghe C.A. et al. // J. Phys. Chem. C. 2009. V. 113. № 20. P. 8982. https://doi.org/10.1021/jp900507s
Rodríguez-Morgade M.S., Plonska-Brzezinska M.E., Athans A.J. et al. // J. Amer. Chem. Soc. 2009. V. 131. № 30. P. 10484. https://doi.org/10.1021/ja902471w
Zarrabi N., Agatemor C., Lim G.N. et al. // J. Phys. Chem. C. 2019. V. 123. № 1. P. 131. https://doi.org/10.1021/acs.jpcc.8b09500
D'Souza F., El-Khouly M.E., Gadde S., McCarty A.L., Karr P.A., Zandler M.E., Araki Y., Ito O. // J. Phys. Chem. B. 2005. V. 109. № 20. P. 10107. https://doi.org/10.1021/jp050591l
Zhao H., Zhu Y., Chen C., Zheng J. // Polymer. 2014. V. 55. № 8. P. 1913. https://doi.org/10.1016/j.polymer.2014.02.058
Ovchenkova E.N., Bichan N.G., Kudryakova N.O. et al. // Dyes and Pigments. 2018. V. 153. № P. 225. https://doi.org/10.1016/j.dyepig.2018.02.023
Motorina E.V., Lomova T.N., Klyuev M.V. // Mendeleev Comm. 2018. V. 28. № 4. P. 426. https://doi.org/10.1016/j.mencom.2018.07.029
To C.T., Chan K.S. // New J. Chem. 2018. V. 42. № 10. P. 7599. https://doi.org/10.1039/c7nj05081j
Bichan N.G., Ovchenkova E.N., Kudryakova N.O. et al. // Ibid. 2018. V. 42. № 15. P. 12449. https://doi.org/10.1039/c8nj00887f
Bichan N.G., Ovchenkova E.N., Kudryakova N.O., Lomova T.N. // J. Coord. Chem. 2017. V. 70. № 14. P. 2371. https://doi.org/10.1080/00958972.2017.1335867
Ovchenkova E.N., Bichan N.G., Kudryakova N.O., Lomova T.N. // J. Mol. Liq. 2019. V. 280. P. 382. https://doi.org/10.1016/j.molliq.2019.01.025
Adler A.D., Longo F.R., Finarelli J.D. et al. Goldmacher J., Assour J., Korsakoff L. // J. Organ. Chem. 1967. V. 32. № 2. P. 476. https://doi.org/10.1021/jo01288a053
Prato M., Maggini M., Giacometti C. et al. // Tetrahedron. 1996. V. 52. № 14. P. 5221. https://doi.org/10.1016/0040-4020(96)00126-3
Troshin P.A., Peregudov A.S., Mühlbacher D., Lyubovskaya R.N. // Eur. J. Organ. Chem. 2005. V. 2005. № 14. P. 3064. https://doi.org/10.1002/ejoc.200500048
Mack J., Stillman M.J., Kobayashi N. // Coord. Chem. Rev. 2007. V. 251. № 3. P. 429. https://doi.org/10.1016/j.ccr.2006.05.011
Terazono Y., Patrick B.O., Dolphin D.H. // Inorgan. Chim. Acta. 2003. V. 346. P. 265. https://doi.org/10.1016/S0020-1693(02)01392-0
Walker F.A. in “Handbook of Porphyrin Science”. V. 6. World Scientific Publishing Company, 2010. P. 1.
Бичан Н.Г., Овченкова Е.Н., Мозгова В.А. и др. // Журн. неорган химии. 2019. Т. 64. № 5.https://doi.org/10.1134/S0044457X19050027
Бичан Н.Г., Овченкова Е.Н., Груздев М.С., Ломова Т.Н. // Журн. структур. химии. 2018. Т. 59. № 3. С. 734. https://doi.org/10.26902/JSC20180332
Troshin P.A., Peregudov A.S., Troyanov S.I., Lyubovskaya R.N. // Russ. Chem. Bull. 2008. V. 57. № 5. P. 887. https://doi.org/10.1007/s11172-008-0126-4
D’Souza F., Deviprasad G.R., Zandler M.E. et al. // J. Phys. Chem. A. 2003. V. 107. № 24. P. 4801. https://doi.org/10.1021/jp030363w
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии




