Журнал физической химии, 2020, T. 94, № 6, стр. 881-887
Температурные зависимости спектров водных растворов хлоридов щелочных металлов в среднем ик-диапазоне
А. В. Королева a, *, В. К. Матвеев b
a Московский государственный университет имени М.В. Ломоносова,
Физический факультет
119991 Москва, Россия
b Московский государственный университет имени М.В. Ломоносова,
Химический факультет
119991 Москва, Россия
* E-mail: koroleva.phys@mail.ru
Поступила в редакцию 09.07.2019
После доработки 09.07.2019
Принята к публикации 17.09.2019
Аннотация
Исследованы температурные зависимости спектров водных растворов LiCl, KCl, RbCl, CsCl концентрации 3 М в средней ИК-области в диапазоне температур от 39 до 2°С. Получены значения средней скорости температурного смещения волнового числа $\frac{{\Delta \nu }}{{\Delta T}}$ максимума полос поглощения валентных (ν1, 2ν2, ν3), составного ν2+νL и деформационного ν2 колебаний молекулы воды для изучаемых растворов хлоридов щелочных металлов. На основании полученных закономерностей смещения указанных полос поглощения с температурой сделан вывод относительно структурных изменений в данных растворах. Проведено сравнение величин $\frac{{\Delta \nu }}{{\Delta T}}$ для растворов с аналогичными величинами для дистиллированной воды, которое позволило сделать выводы о различиях в структурных изменениях с температурой в воде и в изучаемых растворах. Рассчитаны численные значения энергии и длины водородных связей между молекулами воды при понижении температуры для всех исследуемых растворов; при уменьшении температуры энергия водородных связей увеличивается, в то время как их длина уменьшается для всех изучаемых растворов.
Хлориды щелочных металлов играют существенную роль в жизненно важных процессах в организмах людей и животных, поэтому их водные растворы – важные объекты изучения. Водные растворы хлоридов щелочных металлов нашли широкое применение в медицине: физиологический раствор, а также гипертонический раствор, используемый при кровоизлияниях мозга. Изменение температуры окружающей среды будет вызывать изменения в структуре водных растворов солей. Поэтому актуально изучение водных растворов солей при различных температурах. Такие исследования удобно проводить методом ИК-спектроскопии, поскольку он позволяет изучать структурные перестройки в водных растворах.
Исследования температурных зависимостей спектров воды в средней ИК-области проводились во многих работах [1–9]. Было получено, что в диапазоне положительных температур средняя скорость изменения волнового числа максимума валентной полосы поглощения (ν1, 2ν2, ν3) (3340 см–1) с температурой составляет $\frac{{\Delta \nu }}{{\Delta T}} = 0.68$ см–1/K [7, 8], для составной полосы поглощения ν2 + νL (2090 см–1): –0.7 ± 0.1 см–1/K, для деформационной полосы ν2 (1640 см–1) : ‒0.15 см–1/K [7, 9]. Полученные закономерности смещения полос в указанных направлениях обусловлены усилением водородных связей между молекулами воды при понижении температуры. При этом скорости изменения волновых чисел максимумов полос поглощения с температурой не определялись для водных растворов солей щелочных металлов. Поэтому установление этих величин для водных растворов галогенидов щелочных металлов, а также сравнение полученных значений с аналогичными величинами для воды актуальны.
В данной работе исследованы температурные зависимости ИК-спектров водных растворов хлоридов щелочных металлов (LiCl, KCl, RbCl, CsCl концентрации 3 М) в диапазоне от 39 до 2°С. Происходящие изменения в спектрах водных растворов позволили сделать выводы относительно структурных перестроек в них при понижении температуры. Изменения в структуре растворов были объяснены в рамках теории космотропов и хаотропов [10]. Существует классификация ионов в растворе с точки зрения их воздействия на структуру воды. Упорядочивающие структуру воды ионы были названы космотропами, а разупорядочивающие – хаотропами. Космотропы проявляют более сильные взаимодействия с молекулами воды, чем молекулы воды друг с другом, и, следовательно, способны разрушать водородные связи между водными молекулами. Хаотропы же демонстрируют более слабые взаимодействия с молекулами воды, чем молекулы воды друг с другом, и, таким образом, мало влияют на водородные связи окружающей воды. К космотропам относятся маленькие или многократно-заряженные ионы, с большой зарядовой плотностью (к примеру, SO$_{4}^{{2 - }}$, HPO$_{4}^{{2 - }}$, Mg2+, Ca2+, Li+, Na+, H+, OH–), к хаотропам – большие однократно-заряженные ионы, с низкой зарядовой плотностью (к примеру, SCN–, H2PO$_{4}^{ - }$, HSO$_{4}^{ - }$, HCO$_{3}^{ - }$, I–, Cl–, NO$_{3}^{ - }$, NH$_{4}^{ + }$, Cs+, K+). Однако, эта терминология может иногда быть неполной, так как данные свойства ионов могут изменяться в зависимости от условий, метода определения или исследуемых сольватационных оболочек.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для получения спектров использовали ИК-фурье-спектрометр “MIDAC M4000” (“MIDAC Corporation”, США). Исследования проводили методом нарушенного полного внутреннего отражения (с многократным отражением света – 10 раз). Для обеспечения данного метода применяли специальное HATR-устройство и ячейку для исследуемых образцов (“Pike Technologies”, США). Использовали ячейку с кристаллом германия (Ge). При ее использовании рабочая область спектрометра находится в диапазоне 780–4000 см–1. Спектры получали с разрешением 8 см–1. Для установки температуры исследуемого образца до необходимого значения применяли термостатирующий металлический блок, который помещали на ячейку для исследуемого образца. Блок охлаждали пропусканием сквозь него хладагента от жидкостного низкотемпературного термостата “KRIO-VT-01” (“Термэкс”, Россия), с которым он соединен с помощью шлангов. Температуру образца измеряли с помощью бесконтактного ИК-термометра “Кельвин-ИКС с индикатором” (ЗАО “Евромикс”, Россия), погрешность которого 0.5 K. Для исследований использовали дистиллированную воду, полученную на дистилляторе “ДЭ-4” (“Завод “ЭМО”, Россия). Все используемые реактивы солей были марки “х. ч.” (“Лабтех”, Россия). Подробное описание экспериментальной установки приведено в работах [11, 12].
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Добавление в воду солей приводит к ослаблению водородных связей в воде, их разрушению, внедрению в структуру воды катионов и анионов. В ИК-спектре это проявляется в смещении полос поглощения. Валентная полоса (ν1, 2ν2, ν3) растворов хлоридов щелочных металлов по сравнению со спектром чистой водой смещается в область бóльших волновых чисел, составная ν2 + νL – в область меньших, волновое число максимума деформационной полосы поглощения ν2 незначительно уменьшается.
Проведенное в работе исследование температурных зависимостей ИК-спектров водных растворов хлоридов щелочных металлов (LiCl, KCl, RbCl, CsCl концентрации 3 М) в диапазоне от 39 до 2°С позволило определить значения волновых чисел максимумов полос поглощения при каждой из температур. Волновые числа максимумов полос поглощения определяли с высокой точностью с помощью разработанной программы [13, 14]. Для каждой из полос поглощения рассчитывали производную. Волновое число максимума полосы определяли по точке пересечения производной с осью волнового числа, точность определения ±2 см–1.
Для водных растворов LiCl, KCl, RbCl, CsCl концентрации 3 М при понижении температуры в области ее положительных значений наблюдалась такая же тенденция изменения волновых чисел максимумов полос поглощения, как и для воды: волновые числа составной и деформационной полос увеличивались. Однако для деформационной полосы наблюдался меньший сдвиг. Волновое число валентной полосы уменьшалось (рис. 1). Такая тенденция наблюдалась для всех изучаемых растворов.
Рис. 1.
ИК-спектры водного раствора LiCl концентрации 3 М (полосы поглощения: а – валентных колебаний (ν1, 2ν2, ν3), б – составного колебания ν2 + νL, в – деформационного колебания ν2) при различных температурах: 1 – 39, 2 – 20, 3 – 2°С.

Температурные зависимости волновых чисел для каждой из полос поглощения аппроксимировали линейной зависимостью (y = ax + b, где x – температура, y – волновое число), определенной методом наименьших квадратов (рис. 2–4). Коэффициент a в данном случае показывает усредненную скорость изменения волнового числа с температурой $\frac{{\Delta \nu }}{{\Delta T}}$ (в см–1/K). Полученные зависимости обусловлены тем, что при понижении температуры происходит усиление водородных связей, как в воде, так и в растворе, вовлечение несвязанных молекул воды в сетку водородных связей. Для раствора хлорида калия наблюдается наименьший сдвиг волнового числа максимума валентной полосы поглощения при понижении температуры в изучаемом диапазоне. Возможно, это обусловлено действием иона калия как хаотропа, для которого свойственна меньшая сила водородных связей между молекулами воды в растворе.
Рис. 2.
Температурные зависимости волнового числа максимума валентной полосы поглощения для растворов хлорида лития (а), хлорида калия (б), хлорида рубидия (в) и хлорида цезия (г).

Рис. 3.
Температурные зависимости волнового числа максимума составной полосы поглощения для растворов хлорида лития (а), хлорида калия (б), хлорида рубидия (в) и хлорида цезия (г).
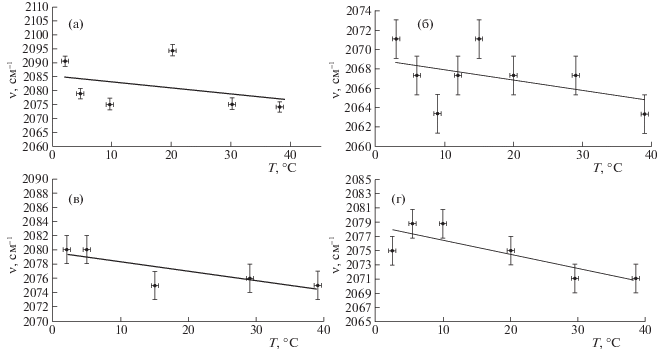
Рис. 4.
Температурные зависимости волнового числа максимума деформационной полосы поглощения для растворов хлорида лития (а), хлорида калия (б), хлорида рубидия (в) и хлорида цезия (г).

Для раствора LiCl при понижении температуры до 2°С волновое число максимума полосы поглощения валентных колебаний достигает наименьшего значения (3363 см–1), по сравнению с волновыми числами максимума данной полосы для других исследуемых растворов. Наибольшие значения волновых чисел максимумов составной и деформационной полос поглощения при понижении температуры до 2°С наблюдаются для раствора LiCl (2090 см–1 для составной полосы и 1643 см–1 для деформационной полосы) по сравнению с волновыми числами максимумов данных полос для остальных изучаемых растворов хлоридов щелочных металлов. Эти факты могут указывать на большее усиление водородных связей в растворе хлорида лития при уменьшении температуры, чем в остальных изучаемых растворах. Возможно, это связано с меньшим размером ионов лития по сравнению с ионами остальных щелочных металлов, вследствие чего ионы лития меньше препятствуют образованию водородных связей между молекулами воды по сравнению с остальными ионами щелочных металлов. Ион лития относится к космотропам, для которых в целом наблюдается бóльшая сила водородных связей между молекулами воды в растворе.
Средняя скорость изменения волнового числа максимума полосы поглощения валентных колебаний $\frac{{\Delta \nu }}{{\Delta T}}$ (коэффициент a, см–1/K) для водных растворов хлоридов щелочных металлов концентрации 3 М принимает следующие значения: 0.6 ± 0.2 (LiCl), 0.16 ± 0.07 (KCl), 0.67 ± 0.12 (RbCl), 0.5 ± 0.2 (CsCl). Таким образом, средняя скорость изменения волнового числа максимума полосы поглощения валентных колебаний для изучаемых растворов хлоридов щелочных металлов (кроме раствора KCl) не претерпевает изменений в пределах ошибки измерений по сравнению со значением для воды.
Средняя скорость изменения волнового числа максимума полосы поглощения составного колебания $\frac{{\Delta \nu }}{{\Delta T}}$ (коэффициент a, см–1/K) для изучаемых растворов хлоридов щелочных металлов принимает следующие значения: ‒0.22 ± 0.27 (LiCl), ‒0.11 ± 0.09 (KCl), –0.14 ± 0.05 (RbCl), ‒0.20 ± 0.07 (CsCl). Таким образом, средняя скорость изменения волнового числа максимума полосы поглощения составного колебания для всех изучаемых растворов по абсолютному значению меньше, чем аналогичная величина для воды. При этом для всех рассматриваемых растворов коэффициент а для составной полосы в пределах ошибки измерений совпадает. Эти факты обусловлены тем, что в растворах на межмолекулярное либрационное колебание влияют присутствующие ионы, которых нет в воде.
Средняя скорость изменения волнового числа максимума полосы поглощения деформационного колебания $\frac{{\Delta \nu }}{{\Delta T}}$ (коэффициент a, см–1/K) для растворов LiCl и CsCl равна –0.12 ± 0.03 и –0.13 ± ± 0.03 соответственно. Таким образом, средняя скорость изменения волнового числа максимума полосы поглощения деформационного колебания для растворов LiCl и CsCl сохраняет свое значение, как и для воды. Для растворов KCl и RbCl в изучаемом температурном диапазоне наблюдается постоянство волнового числа максимума деформационной полосы (1639 cм–1). Последний факт, возможно, обусловлен тем, что размер ионов калия и рубидия больше, чем ионов лития, вследствие чего они в большей мере препятствуют образованию водородных связей при понижении температуры. Кроме того, ионы калия и рубидия являются хаотропами, для которых сила водородных связей между молекулами воды в растворе меньше.
По формулам Иогансена:
(где $\Delta \nu = {{\nu }_{0}} - \nu ,$ $\nu $ – частота колебания связанных OH-групп, ${{\nu }_{0}}$ – частота колебания свободных OH-групп [15], ${{\nu }_{0}}$ = 3600 см–1 [16]) были рассчитаны энергии и длины водородных связей между молекулами воды для всех изучаемых растворов при понижении температуры. Как видно из табл. 1–4 при понижении температуры энергия водородных связей возрастает, а их длина уменьшается для всех исследуемых растворов.Таблица 1.
Зависимость энергии и длины водородных связей между молекулами воды раствора LiCl от температуры
| Т, °С | –EH, кДж/моль | RH, Å |
|---|---|---|
| 39.0 | 16.98 | 1.84 |
| 30.0 | 18.16 | 1.82 |
| 20.0 | 18.39 | 1.81 |
| 9.5 | 18.39 | 1.81 |
| 4.5 | 18.39 | 1.81 |
| 2.0 | 18.62 | 1.81 |
Таблица 2.
Зависимость энергии и длины водородных связей между молекулами воды раствора KCl от температуры
| Т, °С | –EH, кДж/моль | RH, Å |
|---|---|---|
| 39.0 | 16.48 | 1.85 |
| 29.0 | 16.98 | 1.84 |
| 20.0 | 16.98 | 1.84 |
| 15.0 | 16.73 | 1.85 |
| 12.0 | 16.98 | 1.84 |
| 9.0 | 16.98 | 1.84 |
| 6.0 | 16.98 | 1.84 |
| 3.0 | 16.98 | 1.84 |
Таблица 3.
Зависимость энергии и длины водородных связей между молекулами воды раствора RbCl от температуры
| Т, °С | –EH, кДж/моль | RH, Å |
|---|---|---|
| 39.0 | 16.73 | 1.85 |
| 29.0 | 17.49 | 1.83 |
| 15.0 | 18.16 | 1.82 |
| 5.0 | 18.28 | 1.82 |
| 2.0 | 18.28 | 1.82 |
Таблица 4.
Зависимость энергии и длины водородных связей между молекулами воды раствора CsCl от температуры
| Т, °С | –EH, кДж/моль | RH, Ǻ |
|---|---|---|
| 38.5 | 16.98 | 1.84 |
| 29.5 | 16.98 | 1.84 |
| 20.0 | 16.98 | 1.84 |
| 10.0 | 17.70 | 1.83 |
| 5.5 | 18.16 | 1.82 |
| 2.5 | 17.70 | 1.83 |
Таким образом, для водных растворов LiCl, KCl, RbCl, CsCl (концентрации 3 М) смещение максимумов полос поглощения деформационного ν2, составного ν2 + νL и валентных (ν1, 2ν2, ν3) колебаний при изменении температуры в диапазоне ее положительных значений происходит в тех же направлениях, что и для дистиллированной воды. Это свидетельствует о схожих структурных перестройках в воде и растворах при понижении температуры, а именно усилении водородных связей между молекулами воды, вовлечении одиночных молекул в сетку водородных связей. Для раствора хлорида калия наблюдается наименьшая сила водородных связей между молекулами воды, что связано с его воздействием на структуру воды как хаотропа. Наибольшая сила водородных связей наблюдается для раствора хлорида лития, что обусловлено его воздействием как космотропа.
Список литературы
Praprotnik M., Janežič D., Mavri J. // J. Phys. Chem. A. 2004. V. 108. № 50. P. 11056. https://doi.org/10.1021/jp046158d
Wagner R., Benz S., Möhler O. et al. // J. Phys. Chem. A. 2005. V. 109. № 32. P. 7099. https://doi.org/10.1021/jp051942z
Mallamace F., Broccio M., Corsaro C. et al. // Proc. Natl. Acad. Sci. U. S. A. 2007. V. 104. № 2. P. 424. https://doi.org/10.1073/pnas.0607138104
Zasetsky A.Yu., Khalizov A.F., Sloan J.J. // J. Chem. Phys. 2004. V. 121. № 14. P. 6941. https://doi.org/10.1063/1.1787494
Draegert D.A., Stone N.W., Curnutte B. et al. // J. Opt. Soc. Am. 1966. V. 56. № 1. P. 64. https://doi.org/10.1364/JOSA.56.000064
Fishman E., Saumagne P. // J. Phys. Chem. 1965. V. 69. № 10. P. 3671. https://doi.org/10.1021/j100894a516
Юхневич Г.В. Инфракрасная спектроскопия воды. М.: Наука, 1973. С. 208.
Wyss H.R., Falk M. // Can. J. Chem. 1970. V. 48. № 4. P. 607. https://doi.org/10.1139/v70-100
Юхневич Г.В., Ветров А.А. // Докл. АН СССР. 1970. V. 194. № 3. P. 557.
Chaplin M. London South Bank University. “Water structure and science”. Page last updated March 29 2019. http://www1.lsbu.ac.uk/water/kosmotropes_chaotropes.html [accessed May 8 2019]
Хахалин А.В., Королева А.В., Ширшов Я.Н. // Сб. тр. науч.-прак. конф. “Фундаментальные и прикладные аспекты инновационных проектов Физического факультета МГУ”, 11 октября 2011 г., Москва, Россия, Типография МГУ, 2011. С. 180.
Хахалин А.В., Королева А.В., Ширшов Я.Н. // Приборы и техника эксперимента. 2013. V. 6. С. 1.
Хахалин А.В., Королева А.В., Хамидуллина Р.Ф. // Вестн. Моск. ун-та. Серия 3. Физика. Астрономия. 2015. № 5. С. 68.
Королева А.В. Новый метод исследования инфракрасных спектров фазовых состояний водных систем при различных температурах: Автореф. дис. … канд. физ.-мат. наук. М.: МГУ, 2016. 25 С.
Соколов Н.Д. Водородная связь. Сборник статей. М.: Наука, 1981. С. 288.
Карякин А.В., Кривенцова Г.А. Состояние воды в органических и неорганических соединениях. М.: Наука, 1973. С. 176.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии


