Журнал физической химии, 2020, T. 94, № 6, стр. 866-872
“Металличность” химических связей, ее роль в их систематизации и влияние на структуру и свойства веществ
Р. О. Сироткин a, *, О. С. Сироткин a
a Казанский государственный энергетический университет
Казань, Россия
* E-mail: rsir@mail.ru
Поступила в редакцию 15.06.2019
После доработки 25.07.2019
Принята к публикации 03.09.2019
Аннотация
В рамках развития универсальных подходов к систематизации основных разновидностей химических связей элементов и соединений на их основе сделан обзор попыток решения данной проблемы. Обоснована теоретическая и практическая значимость учета металличности в гомо- и гетероядерных связях элементов как в плане обязательного дополнения этой компонентой связи любого типа химического взаимодействия элементов, так и в плане ее значимости для более корректного описания строения химических соединений и оценки их химических, физических, физико-химических и механических свойств. Показана необходимость и важность совместного количественного учета степени металличности связи в дополнение к ее ковалентности и ионности в совокупности с составом химических веществ для объединения смешанных типов химического взаимодействия элементов в рамках единой химической системы в виде “химического треугольника”.
Несмотря на то, что элементный состав – базовый фактор, определяющий химическую структуру и свойства вещества, его влияние не всегда является прямым. Этот вывод опирается на факт существования веществ одного и того же элементного состава, характеризуемых наличием нескольких аллотропных или полиморфных форм, когда элементный состав напрямую не определяет особенности их химической структуры и свойств. Например, аллотропные модификации гомоядерных соединений углерода образуют ряд различных по химической структуре веществ (алмаз, графит, графен, карбин, карбен и т.д.), характеризуемых значительным различием их свойств. Эти вещества отличаются друг от друга не элементным составом, а особенностями химического связывания элементов, т.е. характером распределения электронной плотности между ними.
При описании гомоядерных связей напрашивается вывод о необходимости учета их металличности, так как общеизвестный рост металлических свойств простых веществ при изменении элементного состава справа налево в периодах и сверху вниз в группах периодической системы Д.И. Менделеева нельзя объяснить изменением лишь одной ковалентности (как степени локализации связующих электронов на оси, соединяющей ядра элементов). Ионность, как степень локализации связующих электронов в сторону более электроотрицательного элемента, не может использоваться в этом случае, так как она присуща только гетероядерным связям. С другой стороны, при образовании гетероядерной химической связи “металл–неметалл”, типа Na–Cl также следует учитывать вклад металлической составляющей в эту связь, обусловленную наличием в ней, прежде всего, металлического элемента (натрия). Естественно, в этом случае металличность должна учитываться в дополнение к ковалентности и ионности. А так как свойства вещества определяются особенностями его структуры, то ответ на вопрос о необходимости учета металличности химической связи элементов представляется чрезвычайно актуальным.
Цель настоящей работы – анализ данных, посвященных характеристике понятия “металличность химической связи” и обоснованию необходимости ее учета в гомо- (наряду с ковалентностью) и гетероядерных (наряду с ковалентностью и ионностью) связях элементов для более корректного их описания, систематизации и оценки комплексного влияния на структуру и свойства веществ не только элементного состава, но и смешанного типа химической связи.
Любая наука предполагает наличие системного взгляда на объект своего исследования, в случае химии – необходимость одновременной качественной и количественной оценки влияния состава и смешанного типа химической связи на структуру и свойства различных классов химических соединений. Описание химической связи в значительной степени сводится к характеристике распределения электронной плотности в межъядерном пространстве и с этой задачей количественно великолепно справляется квантовая механика. Однако, универсальность подходов квантовой механики не позволяет оценить различие между индивидуальным атомом и химическим соединением элементов. В результате квантовые подходы не могут предложить качественную основу для систематизации химических связей и образуемых ими соединений в соответствии с теоретическими достижениями классической химии, подтвержденными экспериментально. На эти недостатки квантовой механики указывает и ряд исследователей (см., например, [1, 2]. В частности, А.Р. Черкасов в своей докторской диссертации указывает на то, что “несмотря на развитие компьютерной техники и квантово-химических подходов, по-прежнему недостаточная эффективность, большая трудоемкость и высокая стоимость расчетов ab initio оставляют их использование недоступным или нецелесообразным для большинства современных реакционных серий. Известная альтернатива квантово-химическим расчетам – эмпирическая формализация соотношений “структура–свойство”, остающаяся одним из наиболее популярных методов описания внутримолекулярных взаимодействий, изучения механизмов реакций и молекулярного моделирования” [2]. В свою очередь, классическая химия описывает химическую связь на качественном уровне с ее разделением на три предельных типа — ковалентная, металлическая и ионная (включая способность системно описывать влияние типа химической связи на структуру и свойства веществ). Однако, в классической химии существует проблема количественного описания химической связи. Как правило, для этого используются квантовые подходы. Следовательно, необходимо разумное сочетание обоих подходов, что, например, подчеркивается Н.Ф. Степановым: “Квантовая химия – это раздел теоретической химии, в котором строение и свойства химических соединений, их взаимодействия и превращения рассматриваются на основе представлений квантовой механики и экспериментально установленных закономерностей, в том числе описываемых классической теорией химического строения” [3, с. 3].
Для решения поставленной задачи необходимо обратиться к истории возникновения понятия “металличность” химических связей и методов ее оценки, что должно послужить основой для последующей их систематизации. В рамках описания химической связи как промежуточной между ее предельными типами иногда дискуссионным моментом является само признание наличия металлической компоненты связи, особенно в веществах, не проявляющих металлических свойств [4]. Г. Льюис первым предложил учитывать третий (дополнительно к ковалентному и ионному) тип химического взаимодействия – металлический, а также предположил возможность существования веществ со смешанным типом химической связи [4, 5]. Позднее на это же указывал Л. Полинг [6, с. 406], который отмечал общую природу ковалентной и металлической связей, а также качественное отличие последней от ковалентной – дополнительная свобода движения (делокализация) электронов. На необходимость учета металлической компоненты связи указывали позднее и другие авторы, например, У. Харрисон [7, Т. 1, с. 58]. А Е.В. Поляков в своей монографии [8, с. 65] отмечает, что “…для более полного описания характера химической связи необходимо учитывать не только сдвиг максимума электронной плотности в направлении межатомной связи, но и его смещение по нормали к линии связи: смещение первого типа традиционно рассматривается как изменение степени ионности – ковалентности, тогда как смещение второго типа можно интерпретировать как проявление металлических свойств”. В результате под металличностью следует понимать степень делокализации обобществленных (валентных) связующих электронов “вдоль оси X, перпендикулярно оси Y, соединяющей центры химически связанных ядер” элементов [9]. Далее Поляков указывает [8] на необходимость попытки с единых позиций рассмотреть вопрос количественного соотношения между ионностью и металличностью. Ранее А.А. Годовиков [10] также указывал на недостаточность представлений о степени ионности по Л. Полингу [6] для характеристики типа химической связи, особенно в гомоядерных соединениях (так называемых простых веществах). В них в силу нулевой разности электроотрицательности образующих химическую связь элементов различные гомоядерные связи характеризуются якобы одинаковой 100%-ной степенью ковалентности, что противоречит различию в структуре и свойствах металлов и неметаллов.
При этом различные авторы используют, как правило, собственные методики расчета компонент связи, включая металлическую [7, 10–17]. Главный недостаток этих попыток – отсутствие методик, позволяющих системно оценивать количественный вклад перечисленных компонент химической связи, включая металличность, в гомо- и гетероядерные связи элементов.
Необходимо отметить, что попытки определенным образом систематизировать химические связи и образуемые ими вещества предпринимаются уже давно. Чаще всего это делается в виде треугольной диаграммы, в вершинах которой расположены вещества с предельно ковалентной, металлической и ионной связями. Впервые подобную диаграмму в 1928 г. представил Х. Гримм [18]. Далее появились треугольники ван Аркеля [19], Кетелаара [20] и др. Промежуточный характер гомо- и гетероядерных связей в них демонстрируется, например, треугольником Джолли (рис. 1) [21]. Традиционно эти диаграммы в химической литературе называют треугольниками ван Аркеля–Кетелаара [4]. Отметим, что, несмотря на развитие в них идей систематизации химических связей, эти треугольники являются, по существу, качественными.
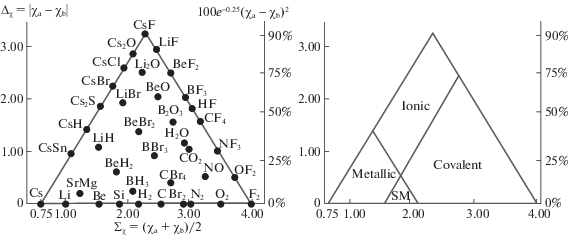
В последние десятилетия в рамках треугольных диаграмм предпринимались попытки полуколичественно охарактеризовать смешанные типы связи и вещества на их основе [22–25]. Для этого обычно строится зависимость разности электроотрицательностей (или Δχ) двух химически связанных элементов от их полусуммы (Σχ). В частности, Аллен [26] и Дженсен [27], независимо друг от друга, на основе этих характеристик построили (рис. 2) треугольники ван Аркеля–Кетелаара [28]. При этом величина Σχ служит мерой ковалентности связи, а Δχ – мерой ее ионности. Однако авторы этих работ не оценивают количественно металлическую компоненту связи, что не позволяет оценить ее вклад в химическую связь и влияние на структуру и свойства веществ. Например, без учета изменения степени металличности невозможно объяснить рост металлических свойств в ряду интерметаллидов со связями Mg–C, Mg–Si, Mg–Ge, Mg–Sn и Mg–Pb [9]. Кроме того, данная методика не оценивает количественно каждую из компонент химической связи (в %), что, в свою очередь, не позволяет обеспечить систематизацию гомо- и гетероядерных связей в рамках единой химической системы. В результате использование такой методики приводит к ошибочному допущению, что для всех соединений, лежащих (рис. 2) на правой стороне треугольника (ось “ионность” – “ковалентность”), связи характеризуются нулевой степенью металличности. Еще более некорректно, с химической точки зрения, допущение существования связей с нулевой степенью ковалентности [9], лежащих (рис. 2) на левой стороне треугольника (ось “металличность” – “ионность”).
Рис. 2.
Треугольники ван Аркеля–Кетелаара на основе значений разности электроотрицательностей (Δχ) и средней электроотрицательности, (Σχ). Выделены области существования ковалентных, металлических, ионных и “полуметаллических” (полупроводниковых) веществ (SM) [28].
По мере развития и утверждения квантовых подходов к описанию структуры веществ, а также накопления расчетных и экспериментальных данных о свойствах “малых молекул” вопрос “о переходе от периодической системы атомов к периодической системе молекул” [29] возник снова, теперь уже в квантовой химии, хотя и применительно лишь к двухатомным молекулам [29, 30]. В частности, за прошедшие десятилетия свои варианты периодической системы двухатомных молекул предложили Ф.-А. Конг [31] и Р. Хефферлин c сотр. [32–34]. Далее некоторые из этих систем были модифицированы и распространены на трехатомные молекулы [35–37]. Другие исследователи оперировали молекулярными структурами, не ограниченными определенным числом атомов [38–43]. Е.В. Бабаев и Р. Хефферлин [44] предложили “гиперпериодическую” систему, включающую в себя многие из приведенных выше. Однако, по существу, данные работы имели один общий недостаток: они ориентировались, прежде всего, на свойства веществ, и в них, как правило, пытались систематизировать лишь отдельные классы соединений, причем преимущественно низкомолекулярные (двух- и трехатомные), не охватывая при этом немолекулярные металлические и ионные соединения. И самое главное, предложенные до настоящего времени системы или подходы к систематизации связей не оценивали влияние последних на постепенность трансформации химической структуры при переходе от низко- к олиго- и высокомолекулярным веществам и далее к немолекулярным, преимущественно металлическим или ионным, соединениям при изменении их химического состава.
Для достижения поставленной цели авторы настоящей статьи опирались на рассмотренные выше попытки систематизации химических связей и веществ, а также на сочетание классических химических, квантово-механических и физических подходов Льюиса, Гайтлера и Лондона, Л. Полинга, Фока и др. [6, 44]. Предложен следующий вариант описания их трех разновидностей [9] с обязательным количественным учетом (в отличие от Полинга) металличности как в гетеро-, так и в гомоядерных связях:
(1)
${{\Psi }_{{{\text{ОЭ}}}}} = {{С}_{1}}{{\Psi }_{{{\text{А}} \div {\text{Б}}}}} + {{С}_{2}}{{\Psi }_{{{{{\text{А}}}^{ + }}-- \uparrow --{{{\text{Б}}}^{ + }}}}} + {{С}_{3}}{{\Psi }_{{{{{\text{А}}}^{ + }} \div \to {{{\text{Б}}}^{ - }}}}},$В случае гомоядерной связи элементов А–А уравнение (1) упрощается за счет отсутствия в нем третьего члена, учитывающего вклад ионной компоненты. Это свидетельствует о том, что с точки зрения универсальности металлическая компонента химической связи (подобно ковалентности и в отличие от ионности) является обязательной составляющей как гомо-, так и гетероядерной связи.
Был также предложен метод количественной оценки ковалентной, металлической и ионной компонент-связи исходя из уточненной шкалы электроотрицательностей Полинга [9, 45], результаты которой были подтверждены квантовыми расчетами через анализ распределения электронной плотности [46, 47]. Выбор в качестве основы шкалы Полинга связан с тем, что она характеризует реальную электроотрицательность элемента, так как оценивается через энергию химически связанного элемента, а не потенциальную (абсолютную) электроотрицательность индивидуальных атомов, например, по шкалам Малликена и Пирсона.
В результате, используя полученные данные, с учетом СМ, авторы систематизировали гомо- и бинарные гетероядерные связи и соединения в рамках своего “химического треугольника” (ХТ) [9, 48–51], где они впервые расположены строго (рис. 3) в соответствии с количественными значениями компонент связи и лишены недостатков рассмотренных выше треугольников ван Аркеля–Кетелаара.
Рис. 3.
“Химический треугольник” (ХТ) – система химических связей и соединений (СХСС), объединяющая гомо- и гетероядерные бинарные химические соединения в виде немолекулярных металлических и ионных, а также моно-, олиго- и макромолекулярных соединений и полимерных тел, где ХСД – химические соединения дискретного (молекулярного), а ХСН – непрерывного (немолекулярного) типов.

Отличительная особенность ХТ – не только дополнительный количественный учет СМ химических связей в соответствии с формулой (1), но и пунктирное изображение части его сторон (нижняя, правая и часть левой стороны около вершины М). Это связано с тем, что СК и СМ в гомо- и гетероядерных связях не могут быть равными нулю (за исключением вершины К, где, например, в гомоядерной связи фтор – фтор значения СМ, как и СИ, равны нулю). Таким образом, все смешанные виды связей и соединения элементов лежат на левой стороне и площади внутри ХТ.
Закономерное изменение строения и свойств веществ при изменении их состава и характеристик химической связи иллюстрируется (рис. 3) тем фактом, что по мере перехода по левой и правой сторонам, а также заключенной между ними площади ХТ, снизу вверх (от вершин М и И к вершине К) имеют место [9, 48–53]:
▪ рост локализации в межъядерном пространстве ОЭ и соответственно СК (с одновременным уменьшением металличности и ионности), приводящий к закономерному изменению длины и энергии химической связи;
▪ постепенное закономерное преобразование типично металлических и ионных кристаллических немолекулярных химических структур и соединений бертоллидного типа (нижняя половина ХТ) в молекулярные (высоко- и низкомолекулярные) дальтонидного типа и полимерные тела (верхняя половина ХТ);
▪ снижение способности твердых тел к кристаллизации и повышение способности к аморфизации и стеклообразованию;
▪ понижение их электро- и теплопроводности, плотности;
▪ преобразование таких свойств, приписываемых обычно определенным классам твердых веществ, как пластичность металлов или хрупкость неметаллических немолекулярных веществ, в эластичность или высокоэластичность, характерных для высокомолекулярных соединений;
▪ закономерное изменение агрегатного состояния веществ в ряду: твердое–жидкое–газообразное.
Теоретическая и практическая значимость, а также перспективность разработанных и развиваемых авторами подходов и методик оценки влияния СК, CМ, СИ на строение и свойства различных химических веществ и материалов подтверждается соответствующими ссылками и использованием их в работах других авторов, например [54–62].
При этом отметим, что, несмотря на отмеченные выше недостатки треугольников ван Аркеля–Кетелаара (отсутствующие в “химическом треугольнике”, рис. 3) их значимость для подготовки химиков в области общей, физической и неорганической химии подтверждается, в частности, тем, что они входят в учебную программу подготовительных курсов Кембриджского университета (Великобритания) [63].
Совокупность рассмотренных в настоящей работе данных подтверждает актуальность обсуждаемых проблем и необходимость их решения.
Список литературы
Santilli R.M. Foundations of Hardronic Chemistry. With Applications to New Clean Energies and Fuels. Boston–Dordrecht–London: Kluwer Academic Publishers, 2001. 554 p.
Черкасов А.Р. Трехмерный корреляционный анализ – новый способ количественного описания эффектов заместителей в химии органических и элементоорганических соединений: Дис. … докт. хим. наук. Казань: Казанский гос. ун-т, 2000. 316 с.
Степанов Н.Ф. Квантовая механика и квантовая химия. М.: Мир, 2001. 519 с.
Jensen W.B. // J. Chem. Educ. 2009. V. 86. P. 278.
Lewis G.N. // J. Am. Chem. Soc. 1913. V. 35. P. 1148.
Паулинг Л. Природа химической связи. М.: Госхимиздат, 1947. 440 с.
Харрисон У. Электронная структура и свойства твердых тел: Физика химической связи. М.: Мир, 1983. Т. 1. 381 с., Т. 2. 332 с.
Поляков Е.В. Соотношение периодичности и монотонности в системе химических элементов. Екатеринбург: УрО РАН, 1997. 234 с.
Сироткин О.С., Сироткин Р.О., Трубачева А.М. // Журн. неорган. химии. 2005. Т. 50. № 1. С. 71.
Годовиков А.А. О связи элементов со структурой и свойствами минералов. М.: Наука, 1989. 118 с.
Duffy J.A. // J. Sol. State Chem. 1986. V. 62. P. 145–157.
Torrance J., Lacorro Ph., Asavaroengchai Ch. et al // J. Sol. State Chem. 1991. V. 90. P. 168.
Mooser E., Pearson W.B. // J. Electronics. 1956. № 1. P. 629.
Бацанов С.С. // Журн. структур. химии. 1971. Т. 12. № 5. С. 883.
Бацанов С.С. // Журн. неорган. химии. 1979. Т. 24. С. 282.
Бацанов С.С. // Там же. 2004. Т. 49. № 4. С. 617.
Юрьева Э.И., Плетнев Р.Н. // Электр. научн. журн. “Исследовано в России”. 2005. № 8. С. 1156.
Grimm H.G. // Z. Elekrochem. 1928. V. 34. P. 430.
van Arkel A.E. Molecules and Crystals. L.: Butterworths, 1949. 234 p.
Ketelaar J.A.A. Chemical Constitution – An Introduction to the Theory of the Chemical Bond. New York: Elsevier Publ. Co., 1953. 406 p.
Jolly W.L. Modern Inorganic Chemistry. N.Y.: McGraw Hill, 1984. 610 p.
Alcock N.W. Bonding and Structure: Structural Principles in Inorganic and Organic Chemistry. Chichester: Horwood, 1990. 321 p.
Allen L.C., Capitani J.F., Kolks G.A. et al. // J. Mol. Sci. 1993. V. 300. P. 647.
Sproul G.D. // J. Phys. Chem. 1994. V. 98. P. 6699.
Sproul G.D. // Ibid. 1994. V. 98. P. 13221.
Allen L.C. // J. Am. Chem. Soc. 1992. V. 144. P. 1510.
Jensen W.B. // J. Chem. Educ. 1995. V. 72. P. 395.
Leach M.R. // Found. Chem. 2013. V. 15. Iss. 1. P. 13.
Сыркин Я.К. Периодическая система и проблема валентности. Сто лет периодического закона химических элементов. М.: Наука, 1971. С. 85–102.
Hefferlin R., Kuhlman H. // J. Quant. Spectrosc. and Radiat. Transfer. 1980. V. 24. № 5. P. 379.
Kong F. // J. Mol. Struct. 1982. V. 90. P. 17.
Hefferlin R., Campbel D., Gimbel et al. // Quant. Spectrosc. Radiat. Transfer. 1979. V. 21. № 4. P. 315.
Burdick G.W., Hefferlin R. Ch. 7. Data Location in a Four-Dimensional Periodic System of Diatomic Molecules. Chemical Information and Computational Challenges in the 21st Century / Mihai V. Putz, Ed. NOVA, 2011. P. 197–212.
Zhuvikin G.V., Hefferlin R. // Vestnik Leningradskovo Universiteta. 1983. V. 16. P. 10.
Carlson C.M., Cavanaugh R.J., Hefferlin R.A. et al // Chem. Inf. Comp. Sci. 1996. V. 36. P. 396.
Hefferlin R. // Comb. Chem. High Through. Screen. 2008. V. 11. P. 690.
Kong F., Wu W. // Scientia Sinica Chimica. 2012. V. 42. № 6. P. 784.
Gorski A. // Roczniki Chemii. 1971. V. 45. P. 1981.
Gorski A. // Ibid. 1973. V. 47. P. 211.
Dias J.R. // Chem. Inf. Comput. Sci. 1982. V. 22. P. 15.
Dias J.R. // New J. Chem. 1994. V. 18. P. 667.
Haas A. // Chemicker–Zeitung. 1982. V. 106. P. 239.
Haas A. // Kontakte (Darmstadt). 1988. V. 3. P. 3.
Babaev E.V., Hefferlin R. The Concepts of Periodicity and Hyper-periodicity: from Atoms to Molecules / Ed. by D.H. Rouvray, E.C. Kirby. Concepts in Chemistry, L.: Research Studies Press Limited, 1996. P. 24–81.
Сироткин О.С., Сироткин Р.О. // ХХ Менделеевский съезд по общей и прикладной химии: Tез. докл. Екатеринбург: Уральское отделение Российской академии наук, 2016. Т. 1. С. 322.
Сироткин О.С., Глухов Д.В., Назмутдинов Р.Р. // Изв. вузов. Химия и хим. технология. 2004. Т. 47. Вып. 8. С. 149.
Сироткин О.С., Трубачева А.М., Глухов Д.В., Сироткин Р.О. // Сб. мат.-лов IX Всерос. конф. “Структура и динамика молекулярных систем”, Уфа: УНЦ РАН, 2002. Т. 2. С. 132.
Sirotkin O.S., Sirotkin R.O. // J. Mater. Sci. and Eng. A. 2016. V. 6. № 2. P. 71.
Sirotkin R.O., Sirotkin O.S. // IOP Conf. Series: Mater. Sci. and Eng. 2018. V. 327. P. 042119.
Сироткин О.С., Сироткин Р.О. Химия (Основы единой химии): учебник. М.: КНОРУС, 2017. 364 с.
Сироткин Р.О. Физикохимия гомо- и гетероядерных бинарных веществ и материалов на их основе. М.: Русайнс, 2018. 236 с.
Sirotkin R.O., Sirotkin O.S., Ivshin I.V. et al. // ARPN J. Eng. and Appl. Sci. 2016. V. 11. № 16. P. 9664.
Сироткин О.С., Сироткин Р.О., Шибаев П.Б. // Журн. неорган. химии. 2011. Т. 56. № 7. С. 1167.
Молчан Н.В., Фертиков В.И. // Заводская лаборатория. Диагностика материалов. 2016. Т. 82. № 5. С. 39.
Молчан Н.В., Фертиков В.И. // Техника и технология силикатов. 2016. Т. 23. № 2. С. 8.
Протопопов Е.А., Вальтер А.И., Протопопов А.А., Маленко П.И. // Металлы. 2015. № 4. С. 64.
Протопопов Е.А., Вальтер А.И., Протопопов А.А. и др. // Пробл. черн. металлургии и материалов. 2015. № 2. С. 44.
Протопопов Е.А., Трофимова Ю.В., Протопопов А.А. и др. // Фундамент. пробл. совр. материаловед. 2017. Т. 14. № 3. С. 403.
Молчан Н.В., Кривобородов Ю.Р., Фертиков В.И. // Техника и технология силикатов. 2017. Т. 24. № 1. С. 11.
Протопопов Е.А. // Технол. машиностр. и материаловед. 2018. № 2. С. 74.
Аверина Ю.М., Ветрова М.А., Калякина Г.Е. и др. // Успехи в химии и хим. технол. 2018. Т. 32. № 14 (210). С. 35.
Моисеев Г.К., Ивановский А.Л. // Журн. физ. химии. 2007. Т. 81. № 8. С. 1370.
Cambridge International Pre-U Chemistry (Principal) 9791. Syllabus for examination in 2016, 2017 and 2018, Cambridge International Examinations 2013. 54 p.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии



