Журнал физической химии, 2020, T. 94, № 6, стр. 823-828
Особенности формирования дисперсной полиметаллической системы Fe–Al–Mo–W в водных растворах
А.Ф. Дресвянников a°, *, М.Е. Колпаков a, Е.А. Ермолаева a
a Казанский национальный исследовательский технологический университет
Казань, Россия
* E-mail: alfedr@kstu.ru
Поступила в редакцию 22.05.2019
После доработки 20.10.2019
Принята к публикации 12.11.2019
Аннотация
Изучено совместное восстановление ионов Fe(III), MoO$_{4}^{{2 - }}$, WO$_{4}^{{2 - }}$ в хлоридсодержащих водных растворах в присутствии 2-гидроксипропан-1,2,3-трикарбоновой кислоты на суспендированном в растворе дисперсном алюминии. Показано, что в процессе восстановления происходит соосаждение молибдена и вольфрама совместно с элементным железом, при этом установлен факт преимущественного выделения молибдена по сравнению с вольфрамом. Выявлено, что формирование осадка протекает на поверхности частиц алюминия с сохранением очертаний и размеров исходной алюминиевой матрицы. Экспериментально установлено, что для получения частиц с более гладкой поверхностью предпочтительнее присутствие в растворе вольфрамат-ионов; в синтезированных полиметаллических дисперсных образцах содержатся соответствующие металлы в составе твердых растворов Fe + Mo и Fe + W, а также элементные железо и алюминий.
В настоящее время интенсивно развиваются методы “мягкой химии”, позволяющие получать дисперсные предшественники объемных материалов, в частности, металлических. Такой подход позволяет имитировать традиционные материалы, но в то же время существенно варьировать их свойства за счет введения целевых элементов в заданном количественном соотношении в синтезируемые неорганические композиции-предшественники.
Дисперсный алюминий является мягким твердофазным восстановителем, позволяющим легко регулировать глубину редокс-процесса, в результате протекания которого происходит формирование новых металлических фаз [1]. Проведенные ранее исследования показали, что выделение металлов семейства железа в водных растворах на дисперсном алюминии позволяет получать композиции, преимущественно состоящие из элементных металлов и содержащие малое количество оксидов этих металлов [2].
Поверхность дисперсного алюминия не является абсолютно гладкой, а имеет дефекты в виде пор и трещин, возникающие вследствие существенного различия коэффициентов термического расширения металла и поверхностного оксидно-гидроксидного слоя. Взаимодействие поверхности алюминия в водных растворах с галогенид-ионами приобретает дефектность, облегчающую транспорт ионов других металлов, за счет специфической адсорбции хлорид-ионов с образованием растворимого поверхностного комплекса [3]. Растворение последнего, равно как и повышение дефектности внешнего слоя металла, способствует облегчению транспорта ионов раствора непосредственно к поверхности частиц алюминия. Формирование слоя элементных металлов семейства железа на поверхности алюминия в растворах позволяет создавать дисперсные системы с разным количественным соотношением указанных элементов.
Для улучшения механических свойств и коррозионной стойкости дисперсной системы Fe–Al используется так называемый эффект третьего элемента, в качестве которого вводят хром [4]. Однако электролиты, содержащие ионы хрома, агрессивны и канцерогенны, поэтому альтернативой хромсодержащим сплавам могут служить полиметаллические системы на основе металлов семейства железа, молибдена и вольфрама [5–7].
Перспективными в данном случае считаются электрохимические методы получения металлических порошков, отличающиеся от металлургических, химико-термических и прочих методов тем, что позволяют регулировать в пределах требуемого состав, диапазон размера и формы частиц посредством изменения условий осаждения [8].
Получение металлических вольфрама и молибдена из водных растворов затруднено ввиду их высокой химической активности по отношению к растворителю, поэтому для электрохимического осаждения вольфрамовых и молибденовых сплавов используют “индуцированное соосаждение” с металлами семейства железа [9]. Наиболее эффективным лигандом при соосаждении молибдена, вольфрама и металлов семейства железа является лимонная кислота [9, 10]. При этом железо выполняет роль индуктора, инициирующего восстановление ионов других металлов, содержащихся в растворе. В связи с этим цель данного исследования – выявление возможности получения сложных (четырехкомпонентных) металлических систем за счет сопряженных процессов, протекающих в водных растворах в контакте с дисперсной (суспендированной) матрицей. Такой сложный редокс-процесс протекает с выделением водорода, который насыщает реакционную смесь и аккумулируется осадком [9], что обеспечивает создание некой защитной атмосферы, способствующей сохранению поверхности новообразованных металлических фаз в малоокисленном состоянии.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез дисперсных образцов основан на электрохимическом процессе совместного восстановления ионов Fe(III), MoO$_{4}^{{2 - }}$, WO$_{4}^{{2 - }}$ в присутствии 2-гидроксипропан-1,2,3-трикарбоновой кислоты на суспензионном алюминиевом электроде [8, 9]. Процесс протекает в кислой хлоридсодержащей среде со значительным выделением водорода. Большая экзотермичность ионизации алюминия при достаточно малых средних размерах частиц и достижении высоких скоростей превращения приводит к саморазогреву реакционной смеси в ходе редокс-процесса.
Исследования проводили c водными растворами реактивов квалификации не ниже “ч.д.а.”: FeCl3 · 6H2O, Na2MoO4 · 2H2O, Na2WO4, C6H8O7, приготовленными на дистиллированной воде. Дисперсный алюминий марки АСД-0 (фракция 71–100 мкм) брали в состоянии поставки. Мольное соотношение Al : (Fe + Mo + W) в реакционной смеси составляло 1.5 : 1. Условия получения дисперсных металлических систем представлены в табл. 1. Значение рН исходного раствора поддерживали в пределах 1.0 ± 0.1, корректируя водородный показатель добавлением хлороводородной кислоты (1 : 1). Полученный осадок отделяли от маточного раствора магнитной сепарацией, промывали этанолом, бидистиллятом до нейтральной реакции и сушили под вакуумом.
Таблица 1.
Условия получения дисперсных металлических систем
| № образца | Концентрация, моль/л | |||
|---|---|---|---|---|
| Fe(III) | MoO$_{4}^{{2 - }}$ | WO$_{4}^{{2 - }}$ | C6H8O7 | |
| 1 | 1.50 | 0.15 | – | 0.30 |
| 2 | – | 0.15 | ||
| 3 | 0.15 | 0.15 | ||
Кинетику процесса изучали методом отбора проб через фиксированные промежутки времени и их последующего анализа рентгенофлуоресцентным методом. Полноту превращения прекурсора до металла оценивали по изменению концентрации ионов соответствующих элементов в растворе. Относительная погрешность эксперимента определяется использованными методами анализа и не превышает 5%.
Синтезированные образцы полиметаллических систем исследовали рентгенофлуоресцентным и рентгенофазовым (РФА) методами анализа на установках D2 PHAZER (Bruker) и S1 TITAN (Bruker) соответственно для получения информации о фазовом и элементном составах. При расшифровке рентгеновских дифрактограмм использовали базу данных PDF-4. Микросъемку частиц синтезированных образцов проводили с помощью электронного сканирующего микроскопа “Mini-SEM SX-3000” (EVEX).
Информацию о распределении частиц по размерам получали посредством лазерного анализатора Mastersizer 2000 (Malvern). Диспергирование и подачу синтезированного образца через зону измерения проточной кюветы осуществляли при помощи специального модуля со встроенной мешалкой (2500 об./мин) и ультразвуковым титановым зондом. Удельную поверхность синтезированных образцов определяли методом тепловой адсорбции азота с помощью анализатора NOVA 2200 (Quantachrome).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В результате проведенных исследований обнаружено, что осаждение Mo(0) и W(0) из водных растворов возможно в присутствии ионов железа при введении комплексанта (2-гидроксипропан-1,2,3-трикарбоновой кислоты) [9, 11, 12]:
- восстановление Fe(III) протекает ступенчато
- восстановление MO$_{4}^{{2 - }}$ (M = Mo, W) – через стадию образования интермедиата
При совместном присутствии ионов Fe(III), MoO$_{4}^{{2 - }}$, WO$_{4}^{{2 - }}$ и 2-гидроксипропан-1,2,3-трикарбоновой кислоты в исходном растворе в процессе взаимодействия с дисперсным алюминием происходит соосаждение молибдена и вольфрама совместно с элементным железом, о чем свидетельствуют данные рентгенофлуоресцентного анализа осадка (табл. 2). Из реакционной смеси при эквимолярном количестве изначально присутствующих в ней вольфрамат- и молибдат-ионов одновременно с элементным железом соосаждается большее количество молибдена, нежели вольфрама, таким образом, имеет место преимущественное индуцированное соосаждение молибдена (относительно вольфрама), что согласуется с литературными данными об электролитическом осаждении сплавов этих металлов [5, 6]. Наличие примесей (Co, Cu, Ti и др.) в осадках обусловлено их изначальным присутствием в используемых реагентах.
Таблица 2.
Результаты рентгенофлуоресцентного анализа образцов (номера соответствуют табл. 1)
| Элемент | Содержание элементов в образцах, мас. % | ||
|---|---|---|---|
| 1 | 2 | 3 | |
| Fe | 70.3 | 85.3 | 47.7 |
| Al | 6.1 | 3.0 | 12.6 |
| Mo | 22.2 | – | 25.3 |
| W | – | 11.2 | 12.4 |
| Σ(Co, Ti, S, P, Cu) | 1.4 | 0.5 | 2.0 |
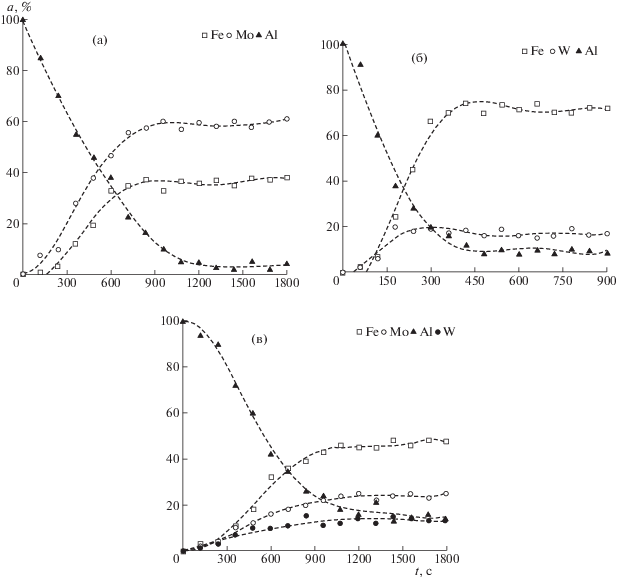
Судя по кинетическим кривым (рис. 1), степень выделения молибдена существенно выше (рис. 1а), чем вольфрама (рис. 1б) при равенстве концентраций соответствующих соединений в исходном растворе (или реакционной смеси в нулевой момент времени процесса). Совместное присутствие вольфрамат- и молибдат-ионов приводит с существенному снижению степени выделения молибдена и вольфрама (рис. 1в). Указанное явление косвенно подтверждает факт конкуренции между ионами молибдена(VI), вольфрама(VI) в процессе их восстановления из гетероядерных комплексов [6].
Рис. 1.
Кинетика выделения Fe(0), Mo(0), W(0) и ионизации Al: а – образец 1, б – образец 2, в – образец 3 (номера соответствуют табл. 1).
С помощью рентгеновской дифрактометрии установлено, что в синтезированных полиметаллических дисперсных образцах содержатся соответствующие металлы в составе твердых растворов Fe + Mo и Fe + W, а также элементные железо и алюминий (рис. 2). При этом обнаружено, что частицы указанных полиметаллических систем содержат менее 0.2 мас. % гидроксидной и оксидной фаз. Как было отмечено выше, это связано с сопряженной реакцией выделения водорода в ходе формирования осадков металлов. Насыщение водородом электролита и осадка создает восстановительную среду, позволяющую проводить синтез без дополнительной операции по удалению растворенного кислорода из раствора, что способствует сохранению металлической фазы практически в неокисленном состоянии. Последнее подтверждается результатами рентгенофазового и элементного анализов. Фазовый состав синтезированных образцов идентифицирован удовлетворительным совпадением характеристик дифрактограмм с данными базы PDF-4.
Частицы дисперсного образца системы Fe‒Al–Mo представляют собой микроразмерные сферические каркасные структуры, в свою очередь, состоящие из наноразмерных сферолитов (рис. 3а). Образец системы Fe–Al–W представлен частицами с более гладкой поверхностью, на которой присутствует относительно небольшое количество зародышей (рис. 3б). Экспериментально установлено, что присутствие вольфрама в осадке способствует сглаживанию поверхности частиц, что косвенно подтверждается данными [6].
Рис. 3.
Микрофотографии частиц: а – образец 1, б – образец 2, в – образец 3 (номера соответствуют табл. 1).

На поверхности частиц системы Fe–Al–Mo–W присутствует большое количество зародышей разной формы и размеров (рис. 3в), частицы при этом покрыты трещинами. Наличие в осадке вольфрама, как и в случае второго образца (рис. 3б), приводит к некоторому сглаживанию поверхности частиц и отсутствию открытых каркасных структур. При этом поверхность синтезированных частиц системы Fe–Al–Mo–W является существенно более шероховатой, чем поверхность частиц дисперсного алюминия, и характеризуется значениями удельной поверхности ∼3.5–7.0 м2/г.
По результатам гранулометрических исследований методом лазерной дифракции и электронной микроскопии установлено, что формирование осадка протекает на поверхности частиц алюминия с сохранением контуров и геометрических размеров исходной матрицы (рис. 4), т.е. имеет место одновременное растворение алюминия и образование сферических зародышей новой фазы. Уменьшение размеров частиц образца 1, по сравнению с исходным алюминием (рис. 4а), подтверждает результаты микроскопического исследования и обусловлено частичным разрушением формирующихся каркасных структур (рис. 3а).
Рис. 4.
Распределение частиц по размерам: а – образец 1; б – образец 2; в – образец 3 (номера соответствуют табл. 1).

Таким образом, применение дисперсного алюминия позволяет получать из водных растворов соответствующих соединений железа(III), молибдена(VI), вольфрама(VI) в присутствии хлорид-ионов сложные полиметаллические системы, состоящие из элементных Fe, Al, а также Mo и W, причем последние идентифицированы как твердые растворы указанных металлов в железе. Установлено, что содержание оксидных и гидроксидных фаз в осадках не превышает 0.2%. Выявлено, что формирование осадка протекает на поверхности частиц алюминия с сохранением очертаний и размеров исходной алюминиевой матрицы. Показано, что сформированные частицы имеют достаточно развитую поверхность, обусловленную высокой пористостью и наличием зародышей новой фазы.
Работа выполнена при поддержке гранта РНФ № 17-13-01274 на оборудовании ЦКП “Наноматериалы и нанотехнологии” ФГБОУ ВО “КНИТУ”.
Список литературы
Li W., Cochell T., Manthiram A. // Sci. Rep. 2013. № 3. P. 1229. https://doi.org/10.1038/srep01229
Дресвянников А.Ф., Колпаков М.Е. // Журн. физ. химии. 2006. Т. 80. № 2. С. 321.
Попов Ю.А. // Успехи химии. 2005. Т. 74. № 5. С. 435.
Niu Y., Wang S., Gao F. et al. // Corros. Sci. 2008. V. 50. № 2. P. 345. https://doi.org/10.1016/j.corsci.2007.06.019
Sun S., Bairachna T., Podlaha E.J. // J. Electrochem. Soc. 2013. V. 160. № 10. P. D434. https://doi.org/10.1149/2.014310jes
Yar-Mukhamedova G., Ved’ M., Sakhnenko N., Karakurkchi A. // Appl. Surf. Sci. 2016. V. 383. P. 346. https://doi.org/10.1016/j.apsusc.2016.04.046
Ved' M., Yermolenko I., Sachanova Yu., Sakhnenko N. // Mater. Today: Proceedings. 2019. V. 6. № 2. P. 121. https://doi.org/10.1016/j.matpr.2018.10.084
Дресвянников А.Ф., Колпаков М.Е. // Защита металлов. 2008. Т. 44. № 1. С. 49.
Дресвянников А.Ф., Колпаков М.Е., Ермолаева Е.А. // Физикохимия поверхности и защита материалов. 2018. Т. 54. № 1. С. 63.
Du J., Xu L., Chen B., Li D. // J. Nanosci. Nanotechnol. 2013. V. 13. № 1. P. 690. https://doi.org/10.1166/jnn.2013.6850
Назмутдинов Р.Р., Зинкичева Т.Т., Колпаков М.Е., Дресвянников А.Ф. // Журн. структур. химии. 2019. Т. 60. № 8. С. 1280.
Seraghni N., Belattar S., Mameri Y. et al. // Int. J. Photoenergy. 2012. V. 2012. Article ID 630425. https://doi.org/10.1155/2012/630425
Podlaha E.J., Landolt D. // J. Electrochem. Soc. 1996. V. 143. № 3. P. 885. https://doi.org/10.1149/1.1836553
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии



