Журнал физической химии, 2020, T. 94, № 6, стр. 817-822
Кинетика взаимодействия тиосоединений с треугольными нанопластинками серебра в водном растворе
А. А. Фурлетов a, В. Д. Зайцев a, В. В. Апяри a, *, А. В. Гаршев a, b, С. Г. Дмитриенко a, И. И. Торочешникова a
a Московский государственный университет имени М.В. Ломоносова, Химический факультет
Москва, Россия
b Московский государственный университет имени М.В. Ломоносова, Факультет наук о материалах
Москва, Россия
* E-mail: apyari@mail.ru
Поступила в редакцию 10.12.2018
После доработки 23.10.2019
Принята к публикации 12.11.2019
Аннотация
Изучены кинетические особенности взаимодействия тиосоединений, отличающихся функциональными группами, с треугольными нанопластинками серебра в водном растворе. Взаимодействие приводит к агрегации нанопластинок, что сопровождается изменением спектров поглощения их растворов. Поведение систем охарактеризовано в рамках кинетических моделей нулевого–третьего порядков. Для выбранных моделей рассчитаны константы скорости агрегации. Показано влияние структуры тиосоединения на агрегацию треугольных нанопластинок серебра и высказаны предположения о причинах этого влияния.
В настоящее время активно изучаются наночастицы серебра [1–4]. В частности, их применяют для разработки недорогих и экспрессных способов определения различных веществ, способных взаимодействовать с наночастицами и вызывать изменение их размера, морфологии или степени агрегации. Особенно большое число работ посвящено исследованию и применению сферических наночастиц серебра и материалов на их основе [5–7]. Значительно меньше внимания уделяется изучению несферических наночастиц серебра – нанокубов [8–10], нанопроволок [11–13], нанодисков [14, 15], наностержней [16–18] и треугольных нанопластинок (ТНП) [19–21]. Между тем, особенности несферических наночастиц, в частности треугольных нанопластинок серебра, связанные с их морфологией, могли бы сыграть решающую роль в разработке принципиально новых способов определения соединений. Высокая чувствительность ТНП серебра в отношении некоторых аналитов в сочетании с относительной простотой получения и нестандартными способами генерации сигнала в этих наноаналитических системах делают их перспективной альтернативой традиционным спектрофотометрическим реагентам.
Использование наночастиц в роли реагентов для химического анализа требует выяснения физико-химических особенностей их взаимодействия с соединениями, отличающимися природой и числом функциональных групп, механизмов этого взаимодействия и возможностей его использования на практике. В этом отношении интересны тиосоединения, способные взаимодействовать с наночастицами серебра за счет образования прочной связи Ag–S, а также за счет электростатических взаимодействий, реализуемых с участием других функциональных групп, входящих в их состав. В числе тиосоединений находятся важные лекарственные препараты, биологически активные добавки и экотоксиканты, поэтому исследование особенностей их взаимодействия с наночастицами актуально и с практической точки зрения.
В настоящей работе проведено изучение кинетических особенностей взаимодействия ТНП серебра с рядом структурно-родственных тиосоединений, различающихся природой и числом функциональных групп, а также формой существования в водном растворе – цистеамином, цистеином, 3‑меркаптопропионовой кислотой и 2-меркаптоэтанолом.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали нитрат серебра (ООО “ПЗЦМ-Втормет”, ч.д.а.), цитрат натрия (Sigma, ≥99.5%), поли(N-винил-2-пирролидон) (Acros Organics, M.W. 58000 г/моль, 99%), пероксид водорода (Sigma-Aldrich, 30%-ный раствор, ACS), борогидрид натрия (Acros Organics, 99%), гидроксид натрия (ООО “АО Реахим”, ч.) и ледяную уксусную кислоту (ООО “ИРЕА 2000”, “х. ч.”). Объектами исследования служили гидрохлорид цистеамина HS–CH2–CH2–NH$_{3}^{ + }$Cl– (Sigma-Aldrich, ≥97.0%), цистеин HS–CH2–CH(COOH)–NH2 (Aldrich, >97.0%), 3-меркаптопропионовая кислота HS–CH2–CH2–COOH (Aldrich, ≥99.0%) и 2‑меркаптоэтанол HS–CH2–CH2–OH (Aldrich, ≥99.0%). Растворы всех реагентов готовили на деионизованной воде.
Синтез треугольных нанопластинок серебра проводили по методике, предложенной в работе [22], с незначительными изменениями. К 0.50 мл 0.01 М раствора AgNO3 прилили 4.30 мл деионизованной воды, а затем при интенсивном перемешивании добавили 2.30 мл 1%-го раствора цитрата натрия, 0.60 мл 2%-го раствора поливинилпирролидона и 1.20 мл 3%-го раствора пероксида водорода. К полученному бесцветному раствору быстро добавили 1.00 мл свежеприготовленного 0.035 М раствора NaBH4. В процессе выдерживания системы в течение 30 мин наблюдали изменение окраски с желтой на синюю, свидетельствующее о формировании ТНП. Полученный коллоидный раствор ТНП серебра хранили при комнатной температуре. Конечная концентрация ТНП в растворе после синтеза составляла 56 мкг/мл (0.52 мМ в пересчете на атомарное серебро).
Для изучения кинетики взаимодействия тиосоединений с ТНП серебра в водном растворе в полипропиленовые пробирки последовательно вносили 1.00 мл 0.1 M уксусной кислоты, 0.50 мл 0.1 M гидроксида натрия, раствор исследуемого тиосоединения и 1.55 мл 0.52 мМ ТНП серебра, после чего интенсивно перемешивали содержимое пробирок. Суммарный объем реагентов во всех случаях составлял 5.0 мл. Регистрацию спектров поглощения растворов осуществляли в течение 20 мин с момента смешения реагентов с интервалом 2.5 мин.
Спектры поглощения и оптическую плотность растворов в диапазоне длин волн 400–1100 нм измеряли на спектрофотометре СФ-103 (Аквилон, Россия). Для измерения pH растворов использовали pH-метр-иономер Эксперт-001 (Эконикс-Эксперт, Россия). Деионизованную воду получали с использованием системы очистки Simplicity (Millipore, США).
Электронно-микроскопические исследования ТНП в растворе проводили с использованием просвечивающего электронного микроскопа с катодом с термополевой эмиссией Libra 200 (Carl Zeiss, Германия) при ускоряющем напряжении 200 кВ. Информационный предел при регистрации изображений в режиме светлопольной просвечивающей микроскопии был лучше 0.1 нм. Для проведения анализа образцы в виде коллоидных растворов наносили на поддерживающую сеточку из меди с пленками из формвара и углерода Formvar®/Carbon Reinforced CopperGrids 3440C-MB (SPI, США). Перед установкой в микроскоп образцы сушили сначала на воздухе в течение 20–30 мин и затем в вакууме с использованием Turbo Pumping Station Model 655 (Gatan, США) в течение 10–12 ч.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Характеризация треугольных нанопластинок серебра. Методом электронной микроскопии показано, что в растворе синтезированных ТНП серебра преобладают частицы, представляющие собой нанопластинки формы, близкой к равностороннему треугольнику с закругленными вершинами (рис. 1а). На микрофотографиях отмечается присутствие и некоторого количества сферических наночастиц. Согласно гистограмме распределения ТНП по размерам, построенной на основании анализа 7 микрофотографий, включающих более 100 частиц (рис. 1б), средняя длина ребра ТНП равна 52 нм; распределение является полимодальным: в образце преобладают частицы с длиной ребра 25 нм (19%) и 55 нм (33%), а также некоторое количество частиц с ребром 95 нм (2%). Средняя толщина ТНП составляет около 4 нм, а средний радиус кривизны угла – 6.5 нм. В спектрах поглощения растворов ТНП наблюдается полоса локализованного поверхностного плазмонного резонанса (ППР) с максимумом в области 550–650 нм.
Рис. 1.
Пример микрофотографии просвечивающей электронной микроскопии треугольных нанопластинок серебра (а) и их распределение по размерам (б).

Для выявления возможностей использования спектрофотометрии для оценки содержания ТНП серебра в растворе в ходе изучения взаимодействия треугольных нанопластинок с тиосоедиениями различной природы проверена применимость основного закона светопоглощения (закона Бугера–Ламберта–Бера). Для этого была построена зависимость оптической плотности при 625 нм растворов ТНП серебра от их концентрации (в расчете на атомарное серебро): А625 = = f(c(ТНП), мМ Ag). Установлено, что в интервале концентраций 0–0.17 мМ Ag данная зависимость имеет вид линейной функции А625 = (8.5 ± ± 0.3)·с. Квадрат коэффициента корреляции r2, оценивающего качество аппроксимации, составляет 0.9986. Полученные результаты свидетельствуют о подчинении системы закону Бугера–Ламберта–Бера в изученном интервале концентраций. Исходя из значения величины тангенса угла наклона полученной зависимости, оценено значение молярного коэффициента поглощения ТНП серебра (в расчете на атомарное серебро): ε = (8.5 ± 0.3) × 103 л (моль Ag)–1 см–1. На основании средних значений длины ребра и толщины ТНП, в предположении правильной формы частицы рассчитано среднее число атомов серебра, приходящееся на частицу, и молярный коэффициент поглощения ТНП в расчете на частицу. Он составил (2.21 ± 0.08) × 109 л моль–1 см–1.
Взаимодействие треугольных нанопластинок серебра с тиосоединениями. Установлено, что при взаимодействии тиосоединений с ТНП серебра происходит значительное изменение спектральных характеристик наночастиц, которое выражается в уменьшении интенсивности полосы ППР ТНП серебра (рис. 2). Кроме того, в ряде случаев наблюдается появление полосы поглощения в длинноволновой части спектра, которая соответствует агрегатам ТНП. Из рисунка также видно, что добавление уже небольших количеств тиосоединений приводит к гипсохромному сдвигу полосы ППР ТНП серебра. Вероятно, механизм взаимодействия ТНП серебра с тиосоединениями включает хемосорбцию аналита по –SH группе на поверхности наночастиц и последующую их агрегацию за счет образования межмолекулярных связей. Интегральные кинетические кривые взаимодействия изученных тиосоединений с ТНП серебра в водном растворе представлены на рис. 3. Образование агрегатов в случае взаимодействия ТНП серебра с цистеином подтверждено с помощью просвечивающей электронной микроскопии в светлом поле (рис. 4).
Рис. 2.
Изменение спектров поглощения водных растворов треугольных нанопластинок серебра в присутствии цистеамина (а), цистеина (б), 3-меркаптопропионовой кислоты (в) и 2-меркаптоэтанола (г) во времени. с(ТНП) = 0.16 мМ Ag, pH 5.0, V = 5.00 мл. (а) с(цистеамин) = 0.12 мкг/мл; (б) с(цистеин) = 0.15 мкг/мл; (в) c(3-меркаптопропионовая кислота) = 0.15 мкг/мл; (г) с(2-меркаптоэтанол) = 0.10 мкг/мл.

Рис. 3.
Зависимость изменения оптической плотности в максимуме полосы поглощения треугольных нанопластинок серебра в растворе, содержащем цистеамин (1), цистеин (2), 3-меркаптопропионовую кислоту (3) и 2-меркаптоэтанол (4), от времени. с(ТНП) = 0.16 мМ Ag, pH 5.0, V = 5.00 мл. (1) с(цистеамин) = 0.12 мкг/мл; (2) с(цистеин) = 0.15 мкг/мл; (3) c(3-меркаптопропионовая кислота) = 0.15 мкг/мл; (4) с(2-меркаптоэтанол) = 0.10 мкг/мл.

Рис. 4.
Пример микрофотографии просвечивающей электронной микроскопии треугольных нанопластинок серебра в присутствии 0.15 мкг/мл цистеина. с(ТНП) = 0.16 мМ Ag, pH 5.0.

Кинетика взаимодействия треугольных нанопластинок серебра с тиосоединениями. В качестве моделей химической кинетики, которые целесообразно рассмотреть для описания кинетических закономерностей взаимодействия тиосоединений с ТНП серебра, на наш взгляд, стоит выделить модели элементарных реакций целого порядка. При этом можно пренебречь взаимодействием ТНП серебра с компонентами ацетатного буферного раствора ввиду их малого влияния на процессы коагуляции наночастиц, не учитывать флуктуации температуры окружающей среды на скорость реакции, а также считать агрегацию наночастиц под действием тиосоединений необратимой реакцией. Порядок реакции в таких моделях применительно к агрегации ТНП серебра будет говорить о числе частиц, которые должны одновременно осуществить соударение для протекания агрегации.
Описание кинетики агрегации ТНП серебра проводили с использованием математических моделей кинетики элементарных реакций целого порядка (в пределах третьего), представленных в табл. 1.
Таблица 1.
Математические модели кинетики элементарных реакций целого порядка, использованные при изучении агрегации треугольных нанопластинок серебра
| Порядок реакции | Кинетическое уравнение | Математическая модель в интегральной форме |
|---|---|---|
| 0 | ${{r}_{0}} = {{k}_{0}}$ | ${{c}_{{{\text{ТНП}}}}} = {{c}_{0}} - {{k}_{0}}t$ |
| 1 | ${{r}_{1}} = {{k}_{1}}{{c}_{{{\text{ТНП}}}}}$ | $\ln {{c}_{{{\text{ТНП}}}}} = \ln {{c}_{0}} - {{k}_{1}}t$ |
| 2 | ${{r}_{2}} = {{k}_{2}}c_{{{\text{ТНП}}}}^{2}$ | $\frac{1}{{{{c}_{{{\text{ТНП}}}}}}} = \frac{1}{{{{c}_{0}}}} - {{k}_{2}}t$ |
| 3 | ${{r}_{3}} = {{k}_{3}}c_{{{\text{ТНП}}}}^{3}$ | $\frac{1}{{c_{{{\text{ТНП}}}}^{2}}} = \frac{1}{{c_{{\text{0}}}^{2}}} - 2{{k}_{n}}t$ |
Для определения порядка агрегации ТНП серебра в присутствии тиосоединений был использован интегральный метод. Рассчитанные исходя из значений оптической плотности растворов концентрации ТНП подставляли в указанные математические модели и сравнивали коэффициенты детерминации линейных аппроксимаций (табл. 2).
Таблица 2.
Коэффициенты детерминации (r2) при описании взаимодействия тиосоединений с треугольными нанопластинками серебра различными кинетическими моделями
| Тиосоединение | Порядок реакции | |||
|---|---|---|---|---|
| 0 | 1 | 2 | 3 | |
Цистеин |
0.9555 | 0.9623 | 0.9684 | 0.9738 |
Цистеамин |
0.9289 | 0.9817 | 0.9868 | 0.9474 |
3-Меркаптопропионовая кислота |
0.9598 | 0.9674 | 0.9742 | 0.9800 |
2-Меркаптоэтанол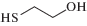 |
0.9928 | 0.9978 | 0.9868 | 0.9606 |
Хотя наблюдаемые отличия коэффициентов детерминации не позволяют однозначно утверждать о порядке взаимодействия, из полученных данных видно, что наблюдается тенденция в изменении кинетической модели, описывающей экспериментальные данные наилучшим образом в зависимости от природы тиосоединения и его зарядового состояния в растворе. Так, видно, что не содержащий ионизирующихся групп 2-меркаптоэтанол вызывает агрегацию, кинетика которой описывается моделью первого порядка. Для агрегации ТНП серебра под воздействием цистеамина, содержащего положительно заряженную аммониевую группу, характерен второй порядок. В случае цистеина и 3-меркаптопропионовой кислоты, молекулы которых содержат карбоксильную группу, порядок реакции равен трем или более.
Значения констант скорости агрегации ТНП серебра в присутствии тиосоединений рассчитывали, исходя из выбранных кинетических моделей. Эти значения, а также времена полупревращения для взаимодействия тиосоединений с ТНП серебра представлены в табл. 3.
Таблица 3.
Константы скорости и времена полупревращения для взаимодействия тиосоединений с треугольными нанопластинками серебра
| Тиосоединение | n | kn | τ1/2, мин |
|---|---|---|---|
| Цистеин | 3 | 5.95 × 105 л2 моль–2 мин–1 | 42 |
| Цистеамин | 2 | 9.66 × 102 л моль–1 мин–1 | 8 |
| 3-Меркаптопропионовая кислота | 3 | 9.20 × 105 л2 моль–2 мин–1 | 22 |
| 2-Меркаптоэтанол | 1 | 3.64 × 10–2 мин–1 | 19 |
Предполагаемый механизм агрегации. Наблюдаемые различия во временах полупревращения и порядках реакций взаимодействия тиосоединений с ТНП серебра, вероятно, связаны с различными механизмами агрегации. Экспериментально установленный первый порядок агрегации ТНП серебра под воздействием 2-меркаптоэтанола, вероятно, свидетельствует о том, что механизм этого процесса включает преимущественную агрегацию индивидуальных ТНП серебра с уже сформировавшимися крупными агрегатами или стенками пробирки. 2-Меркаптоэтанол присутствует в растворе в виде незаряженных молекул, что открывает возможность агрегации ТНП серебра только за счет взаимодействий неэлектростатической природы, таких как взаимодействие меркаптогрупп с атомами серебра и образование водородных связей между гидроксогруппами. В спектрах поглощения ТНП серебра (рис. 2г) наблюдается уменьшение полосы ППР, но при этом не наблюдается появления полосы поглощения малоразмерных агрегатов ТНП серебра в длинноволновой части спектра.
В отличие от 2-меркаптоэтанола, в случае цистеамина наблюдается появление четко выраженной полосы ППР в области 800–900 нм (рис. 2а), а экспериментально установленный порядок агрегации равен 2. Это может указывать на преимущественную агрегацию ТНП “попарно” – образование малоразмерных агрегатов из двух нанопластинок. Возникновение полосы в длинноволновой области спектра характерно для малоразмерных агрегатов наночастиц металлов – золота, серебра. Такие агрегаты относительно устойчивы и способны в течение некоторого времени существовать в растворе. Механизм агрегации в данном случае, по-видимому, включает два типа сильных взаимодействий – образование ковалентных связей Ag–S и электростатическое взаимодействие положительно заряженных аммониевых групп цистеамина с отрицательно заряженными цитрат-ионами на поверхности ТНП. Этим обусловлена высокая скорость агрегации (τ1/2 = 8 мин) и наблюдаемые глубокие спектральные изменения в системе.
Для 3-меркаптопропионовой кислоты и цистеина, молекулы которых содержат карбоксильные группы, характерен высокий порядок агрегации (n ≥ 3), а константы скорости реакции оказываются сопоставимыми. Из-за наличия карбоксильной группы, диссоциирующей в условиях эксперимента до отрицательно заряженного карбоксилат-иона, эти соединения не способны к прочному электростатическому связыванию с поверхностными группами ТНП серебра. В спектре поглощения ТНП серебра при взаимодействии с 3-меркаптопропионовой кислотой наблюдается расщепление полосы ППР (рис. 2в), нехарактерное для наночастиц. Это обстоятельство свидетельствует о протекании в реакционной смеси побочных процессов, которые приводят к изменению морфологии ТНП серебра. В этом случае для выяснения механизма процесса, очевидно, требуются дополнительные экспериментальные данные.
Таким образом, изучены процессы агрегации треугольных нанопластинок серебра в присутствии тиосоединений четырех типов, отличающихся функциональными группами: цистеамина, цистеина, 3-меркаптопропионовой кислоты и 2-меркаптоэтанола. Показано, что агрегация приводит к изменению оптических свойств ТНП серебра. Определен порядок взаимодействия в каждом случае, вычислены константы скорости и времена полупревращения для каждого тиосоединения. Высказаны предположения о возможных механизмах агрегации треугольных нанопластинок серебра под воздействием указанных тиосоединений.
Работа выполнена при финансовой поддержке Российского научного фонда (грант № 18-73-10001). Отдельные эксперименты проведены с использованием оборудования в рамках Программы развития Московского университета.
Список литературы
Крутяков Ю.А., Кудринский А.А., Оленин А.Ю., Лисичкин Г.В. // Успехи химии. 2008. Т. 77. С. 242.
Оленин А.Ю., Лисичкин Г.В. // Успехи химии. 2011. Т. 80. С. 635.
Khodashenas B., Ghorbani H.R. // Arab. J. Chem. 2015. https://doi.org/10.1016/j.arabjc.2014.12.014
Kumar S.S.D., Rajendran N.K., Houreld N.N., Abrahamse H. // Int. J. Biol. Macromol. 2018. V. 115. P. 165.
Терентьева Е.А., Апяри В.В., Кочук Е.В. и др. // Журн. аналит. химии. 2017. Т. 72. С. 978.
Wei L., Lu J., Xu H. et al. // Drug. Discov. Today. 2015. V. 20. P. 595.
Vilela D., González M.C., Escarpa A. // Anal. Chim. Acta. 2012. V. 751. P. 24.
Personick M.L., Langille M.R., Zhang J., Wu J., Li S., Mirkin C.A. // Small. 2013. V. 9. P. 1947.
Rycenga M., McLellan J.M., Xia Y. // Adv. Mater. 2008. V. 20. P. 2416–2420.
Skrabalak S., Au L., Li X., Xia Y. // Nat. Protoc. 2007. V. 2. P. 2182.
Han S.-H., Lee J.-S. // Langmuir. 2012. V. 28. P. 828.
Murphy C.J., Jana N.R. // Adv. Mater. 2002. V. 14. P. 80.
Jiang P., Li S., Xie S., Gao Y., Song L. // Chem. Eur. J. 2004. V. 10. P. 4817.
Kim B.-H., Lee J.-S. // Mater. Chem. Phys. 2015. V. 149–150. P. 678.
Bashir O., Khan Z. // J. Mol. Liq. 2014. V. 199. P. 524.
Zhang J., Langille M.R., Mirkin C.A. // Nano. Lett. 2011. V. 11. P. 2495.
Jana N.R., Gearheart L., Murphy C.J. // Chem. Commun. 2001. V. 7. P. 617.
Hu J.Q., Chen Q., Xie Z.X. et al. // Adv. Funct. Mater. 2004. V. 14. P. 183.
Zhang Q., Li N., Goebl J. et al. // J. Am. Chem. Soc. 2011. V. 133. P. 18931.
Apyari V.V., Gorbunova M.O., Shevchenko A.V. et al. // Talanta. 2018. V. 176. P. 406.
Kelly J.M., Keegan G., Brennan-Fournet M.E. // Acta. Phys. Pol. A. 2012. V. 122. P. 337.
Metraux G.S., Mirkin C.A. // Adv. Mater. 2005. V. 17. P. 412.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии


