Журнал физической химии, 2020, T. 94, № 6, стр. 893-897
Сорбция ионов металлов на анионообменной смоле в растворе ацетата аммония
Н. А. Мирзаев a, b, *, А. П. Маринова a, Х. Ф. Маммадов b, Н. Т. Темербулатова a, Я. Коземпель c, Д. В. Философов a
a Объединенный институт ядерных исследований
141980 Дубна, Россия
b Институт радиационных проблем, Национальная академия наук Азербайджана
AZ 1143 Баку, Азербайджан
c Чешский технический университет, отдел ядерной химии
11519 Прага, Чехия
* E-mail: mirzayev-nicat@mail.ru
Поступила в редакцию 10.06.2019
После доработки 28.08.2019
Принята к публикации 17.09.2019
Аннотация
Представлены коэффициенты распределения на анионообменной смоле Dowex 1×8 для 60 элементов в среде ацетата аммония в диапазоне концентраций от 0.1 до 5.0 М. Полученные значение Kd показаны в виде периодической таблицы элементов. Предложен ряд возможностей разделения элементов для этой системы.
Ионообменные смолы доказали свою значимость для сорбции и разделения элементов в различных средах [1–10]. Эти смолы часто используются при разделении и кондиционировании различных радионуклидов для синтеза радиофармацевтических препаратов, применяемых для диагностики и терапии в ядерной медицине.
Ацетат аммония часто используется в качестве буфера для связывания радионуклида с хелатором, который в свою очередь способствует связыванию радионуклида с активной частью (пептид, антитело и т.п.) радиофармацевтического препарата [11–16]. Обычно ацетатная среда химически и биологически не вредна для организма. Целесообразно рассмотреть сорбционное поведение широкого круга элементов в этой среде.
Данные по коэффициентам распределения в растворах ацетата аммония были доступны только для катионобменной смолы [17, 18]. Чтобы обеспечить основу для планирования будущих экспериментов был проведен общий обзор сорбционного поведения элементов на анионобменной смоле в среде ацетата аммония. В данной работе были определены коэффициенты распределения для 60 элементов в растворе ацетата аммония на анионообменной смоле Dowex 1×8.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалы и методы
Анализ на количество элементов проводили на масс-спектрометре (X7, Thermo Scientific, США), имеющим стандартные параметры: радиочастотный (РЧ) генератор мощностью 1250 Вт; распылитель PolyCon; расход плазмообразующего Ar ‒ 12 л/мин; вспомогательный расход Ar – 0.9 л/мин; скорость потока Ar в распылитель – 0.9 л/мин и скорость потока анализируемого образца – 0.8 мл/мин.
Анионообменная смола Dowex 1×8 в Cl–-форме, содержащая 8% ДВБ, характеризуется водоудерживающей способностью от 39 до 45% и общей обменной емкостью – 1.2 мэкв/мл [19].
Перед использованием анионита смолу из Cl–-формы переводили в CH3COO–-форму: смолу промывали 4 М раствором HCl, 4 М раствором CH3COONH4 и затем бидистиллированной водой. После чего смолу сушили на воздухе 72 ч при комнатной температуре.
Для приготовления исходных растворов использовали три набора многоэлементных стандартов (табл. 1).
Таблица 1.
Многоэлементные стандарты
| Стандарты | Элементы |
|---|---|
| A | Al, As, Ba, Be, B, Cd, Ce, Cs, Cr, Co, Cu, Dy, Er, Eu, Gd, Ga, Ho, In, La, Pb, Li, Lu, Mn, Nd, Ni, Re, Rb, Sm, Sc, Se, Sr, Tl, Th, U, V, Yb, Y, Zn |
| B | Sb, Ge, Hf, Mo, Nb, Si, Ag, Ta, Te, Sn, Ti, W, Zr |
| C | Au, Ir, Os, Pd, Pt, Rh, Ru |
Многоэлементный стандарт (A) – элементы содержатся в 0.3 М азотной кислоте.
Многоэлементный стандарт (B) – элементы содержатся в 0.3 М азотной кислоте + следы HF.
Многоэлементный стандарт (С) – элементы содержатся в 0.6 М соляной кислоте.
Коэффициенты распределения (Kd)
Коэффициент распределения определяли по уравнению:
(1)
${{K}_{{\text{d}}}} = \frac{{{{C}_{1}}}}{{{{C}_{2}}}} = \frac{{({{C}_{{\text{B}}}} - {{C}_{{\text{A}}}}){\text{/}}W}}{{{{C}_{{\text{A}}}}{\text{/}}V}}.$Метод определения Kd
Приготовление образцов. Для определения коэффициентов распределения по 2 мл каждого из стандартов (A, B + C) выпаривали до сухой соли (рис. 1). Каждый из образцов соли растворяли в 2 мл 0.1 М CH3COONH4 и использовали в качестве первичных растворов (I и II).
Также готовили вспомогательный раствор 6 М CH3COONH4. Вторичные растворы объемом 3 мл готовили добавлением к 0.25 мл первичного раствора вспомогательного раствора и воды. Полученные вторичные растворы имели концентрации – 0.1, 0.3, 1, 2, 3, 4 и 5 M CH3COONH4 (рис. 1).
Затем по 1 мл вторичных растворов добавляли к каждому образцу, содержащему 50 мг смолы. Образцы оставляли для достижения равновесия в течение 24 ч и периодически встряхивали.
Приготовление образцов для масс-спектрометра. После достижения равновесия из каждого образца отбирали по 0.5 мл аликвотного раствора, к которому добавляли 0.1 мл 14 M азотной кислоты и разбавляли деионизированной водой до 5 мл.
Концентрации в приготовленных образцах измеряли на масс-спектрометре с индуктивно связанной плазмой.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
На рис. 2 показаны определенные нами коэффициенты распределения для 60 элементов на анионообменной смоле Dowex 1×8 при различных концентрациях раствора CH3COONH4.
Рис. 2.
Коэффициенты распределения (Kd) 60 элементов в логарифмическом масштабе на анионообменной смоле Dowex 1×8 в зависимости от концентрации CH3COONH4.
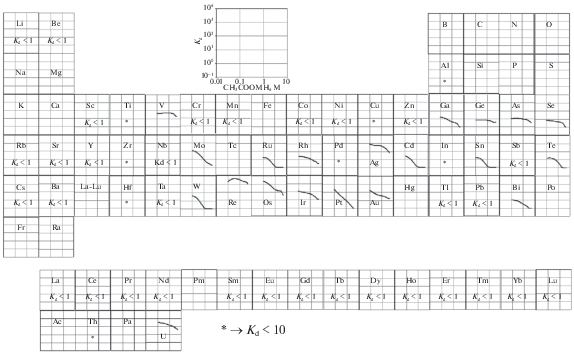
Щелочные, щелочно-земельные и редкоземельные металлы (Li, Na, K, Rb, Cs, Fr)
Для всех концентраций раствора ацетата аммония коэффициенты распределения одновалентных щелочных металлов: Li, Rb и Cs, а также двухвалентных щелочно-земельных металлов: Be, Sr, Ba меньше единицы (Kd < 1).
Трехвалентные лантаноиды: La, Ce, Pr, Nd, Sm, Eu, Gd, Tb, Dy, Ho, Er, Tm, Yb и Lu, а также родственные по свойствам им элементы – Y и Sc, не адсорбируются на смоле.
По-видимому, все эти элементы существуют в виде положительных ионов в исследуемых растворах ацетата аммония, поэтому на анионообменной смоле не происходит практически никакого удержания, что согласуется с данными по сорбции на анионите в растворах уксусной кислоты [20].
Переходные металлы (Sc, Ti, V, Cr, Mn, Fe, Co, Ni, Cu, Zn, Y, Zr, Nb, Mo, Tc, Ag, Cd, Hf, Ta, W, Re, Au, Hg)
Ti, Zr и Hf показывают слабую сорбцию на смоле со значениями Kd < 10. В таких средах для этих элементов весьма вероятны процессы гидролиза. Во всем интервале концентраций раствора ацетата аммония ванадий показывает удерживание на смоле. Известно, что в водном растворе V образует два анионных комплекса, таких как [(VO)2(OH)5]– и [(VO)2(OH)6]2– при рH > 5 [21]. В отличие от ванадия Nb и Ta не показывают адсорбции на смоле, видимо из-за того, что они не образуют отрицательно заряженных соединений.
В диапазоне низких концентраций соли Ag показывает наиболее высокую сорбцию. Известно, что ацетат серебра обладает незначительной растворимостью в водной среде. Сорбцию Ag можно связать с формированием нейтральных форм CH3COOAg [22, 23]. Анионообменная смола имеет пористую форму и поэтому нейтральные молекулы могут сорбироваться непосредственно внутри смолы. Au также в низких концентрациях соли показывает значительную сорбцию. С увеличением концентрации раствора CH3COONH4 значения Kd для Ag и Au уменьшаются. Cu показывает некоторую задержку на смоле со значениями Kd < 10.
Cr, Mn, Co, Ni и Zn образуют катионные комплексы в ацетатном растворе [24]. Коэффициенты распределения для этих элементов меньше единицы (Kd < 1). В низких концентрациях раствора Mo и W хорошо сорбируются на анионообменной смоле. Наблюдалось уменьшение значений Kd для Мо и W с увеличением концентрации раствора CH3COONH4. Аналогичная тенденция наблюдается для Cd.
Высокую адсорбцию Re на смоле во всем диапазоне концентраций раствора CH3COONH4 можно объяснить хорошей сорбцией иона [ReO4]–, образующегося в водных растворах. При низкой концентрации соли значение Kd достигает 103.
Платиновые металлы (Ru, Rh, Pd, Os, Ir, Pt)
Os показывает высокую адсорбцию при низких концентрациях, значение Kd для него при 0.1 М CH3COONH4 превышает 2300. Другие платиновые металлы демонстрируют тенденцию к уменьшению Kd с увеличением концентрации CH3COONH4. Адсорбция Pd существенно ниже на смоле. Вероятно, происходит образование нейтральных ацетатных комплексов палладия, не удерживаемых сорбентом [25].
Постпереходные металлы (Al, Ga, In, Sn, Tl, Pb, Bi)
Al и In проявляют слабые адсорбционные свойства во всем диапазоне концентраций соли. В ацетатных водных средах Al обычно образует положительные ионы, такие как [Me (O2CCH3)]2+ и [Me (O2CCH3)2]+, это объясняет его слабую сорбцию на анионообменной смоле [23, 26]. Значения Kd для Al и In варьируются в пределах от 1 до 10.
T1 демонстрирует адсорбционное поведение, подобное одновалентным щелочным металлам, не адсорбируясь на смоле. Ga показывает слабую сорбцию на смоле, с увеличением концентрации значение Kd уменьшается до единицы. Pb не адсорбируется на смоле. Уменьшение Kd с увеличением концентрации раствора также наблюдается у таких постпереходных металлов как Sn и Bi.
Полуметаллы (B, Si, Ge, As, Se, Sb, Te, Po)
Обычно в водных средах эти элементы образуют нейтральные формы. Возможно поэтому исследуемые нами полуметаллы показывают низкую сорбцию на смоле во всем диапазоне концентраций раствора. Sb не показывает какой-либо сорбции на смоле.
Элементы актинидной группы (Ac, Th, Pa, U)
Была изучена сорбция актинидов – U(VI) и Th(IV) на смоле. При низкой концентрации солей U проявляет хорошую сорбцию. Это можно объяснить хорошо известными ацетатными комплексами урана составов [UO2(CH3COO)3]– и [UO2(CH3COO)4]2 [20]. Th показывает слабую сорбцию на смоле, значение Kd для него не превышает 10. Сорбционное поведение четырехвалентного Th на смоле схоже с поведением Zr и Hf.
Варианты возможных разделений элементов на анионите в среде ацетата аммония
В этой системе особо выделяется сорбция Re, Mo, W, Ag и U. Используя наши данные можно рассматривать их разделение от большинства изученных элементов. Отделение U от Th может быть проведено в достаточной степени путем использования неконцентрированных растворов ацетата аммония, удерживающих U и элюирующих Th. Эта система позволяет разделить Ag и Au от Cu, Ni, Pb и Zn. Последние могут быть элюированы со смолы первыми с использованием растворов с низкими концентрациями соли.
Большинство переходных, платиновых, постпереходных металов, а также полуметаллов демонстрируют удержание на анионообменной смоле. Анионит можно применять для разделения элементов данных групп от элементов, не сорбируемых в системе.
V можно разделять от Nb и Ta в широком диапазоне концентраций рассматриваемых растворов. Также можно интересно рассмотреть отделение Cd от щелочно-земельных элементов. Щелочные, щелочно-земельные и редкоземельные элементы могут быть успешно очищены от сорбирующихся элементов путем элюирования в данной системе.
Таким образом, за редким исключением коэффициенты распределения на анионите Dowex 1×8 для большинства элементов уменьшаются с увеличением концентрации раствора CH3COONH4. По значениям Kd на анионообменной смоле Dowex 1×8 в растворах ацетата аммония элементы можно разделить на четыре группы: а) Максимальные значения Kd < 1, не сорбируемые элементы – щелочные, щелочно-земельные и редкоземельные элементы, Cr, Mn, Co, Ni, Zn, Nb, Ta, Tl, Pb, Sb. Эти элементы, по-видимому, не образуют отрицательные ионы с ацетатом.
б) Максимальные значения Kd < 10, элементы, показывающие слабую сорбцию во всем диапазоне концентраций раствора CH3COONH4 – Ti, Zr, Hf, Pd, Cu, Al, In, Ge, Bi, As, Se, Te, Th.
в) Максимальные значения Kd от 10 до 100, элементы, проявляющие хорошую сорбцию – V, Ru, Rh, Cd, Ga, Sn.
г) Максимальные значения Kd > 100, элементы, проявляющие сильную сорбцию – W, Mo, U, Re, Ag, Au, Ir, Pt, Os.
Авторы работы выражают благодарность Институту проблем технологии микроэлектроники и особо чистых материалов (ИПТМ) РАН (Черноголовка) за проведение МС-ИСП измерений, а также за финансовую поддержку данного проекта в рамках программы сотрудничества между Объединённым институтом ядерных исследований (ОИЯИ) и Чешской Республикой по теме 03-2-1100-2010/2018.
Список литературы
Berman S.S., McBryde W.A.E. // Can. J. Chem. 1958. V. 36. № 5. P. 835. https://doi.org/10.1139/v58-122
Strelow F.W.E. // Anal. Chem. 1960. V. 32. № 9. P. 1185. https://doi.org/10.1021/ac60165a042
Strelow F.W.E., Victor A.H., Zyl C.R., Elof C. // Anal. Chem. 1971. V. 43. № 7. P. 870. https://doi.org/10.1021/ac60302a015
Faris J.P. // Anal. Chem. 1960. V. 32. № 4. P. 520. https://doi.org/10.1021/ac60160a019
Ichikawa F., Uruno S., Imai H. // Bull. Chem. Soc. Jpn. 1961. V. 34. № 7. P. 952. https://doi.org/10.1246/bcsj.34.952
Pourmand A., Dauphas N. // Talanta. 2010. V. 81. № 3. P. 741. https://doi.org/10.1016/j.talanta.2010.01.008
Nelson F., Michelson D.C. // J. Chromatogr. A. 1966. V. 25. P. 414. https://doi.org/10.1016/S0021-9673(01)98260-3
Marsh S.F., Alarid J.E., Hammond C.F. et al. // Los Alamos Sci. Lab. Rep. 1978. LA-7083. No. February.
Nelson F., Rush R.M., Kraus K.A. // J. Am. Chem. Soc. 1960. V. 82. № 2. P. 339. https://doi.org/10.1021/ja01487a021
Marinov G., Marinova A., Milanova M. et al. // Solvent Extr. Ion Exch. 2017. V. 35. № 4. P. 280. https://doi.org/10.1080/07366299.2017.1336404
Harris T.D., Sworin M., Williams N. et al. // Bioconjug. Chem. 1999. V. 10. № 5. P. 808. https://doi.org/10.1021/bc9900237
Baimukhanova A., Radchenko V., Kozempel J. et al. // J. Radioanal. Nucl. Chem. 2018. V. 316. № 1. P. 191. https://doi.org/10.1007/s10967-018-5730-7
Cai H., Li Z., Huang C-W. et al. // Nucl. Med. Biol. 2010. V. 37. № 1. P. 57. https://doi.org/10.1016/j.nucmedbio.2009.09.001
Lewis M.R., Reichert D.E., Laforest R. et al. // Nucl. Med. Biol. 2002. V. 29. № 6. P. 701. https://doi.org/10.1016/s0969-8051(02)00330-x
Mueller D., Klette I., Baum R.P. et al. // Bioconjug. Chem. 2012. V. 23. № 8. P. 1712. https://doi.org/10.1021/bc300103t
Therapeutic Radionuclide Generators: 90Sr/90Y and 188W/188Re Generators. Tec. reports. 2009. № 470. P. 233. Printed by IAEA.
Strelow F.W.E., Weinert C.H.S.W. // Talanta. 1970. V. 17. № 1. P. 1. https://doi.org/10.1016/0039-9140(70)80044-3
Mirzayev N., Marinov G., Marinova A. et al. // J. Rad. Res. 2018. V. 5. № 2.
DOWEXTM Fine Mesh Spherical Ion Exchange Resins For Fine Chemical and Pharmaceutical Column Separations. Tec. report of the Lenntech company. www.lenntech.com
Marhol M. Ion Exchangers in Analytical Chemistry. Their Properties and use in Inorganic Chemistry. Els. Scien. Pub. Com. 1982. V. 14. 585 p.
Gillard R.D., McCleverty J.A. Comprehensive coordination chemistry. Els. Pergamon Press. 1987. V. 3. 1601 p.
Macdougall F.H. // J. Phys. Chem. 1942. V. 46. № 7. P. 738–747 https://doi.org/10.1021/j150421a008
Macdougall F.H., Topol L.E. // J. Phys. Chem. 1952. V. 56. № 9. P. 1090. https://doi.org/10.1021/j150501a014
Caminiti R., Cucca P., Monduzzi M. et al. // J. Chem. Phys. 1984. V. 81. № 1. P. 543. https://doi.org/10.1063/1.447336
Kragten D.D., Van Santen R.A., Crawford M.K. et al. // Inorg. Chem. 1999. V. 38. № 2. P. 331. https://doi.org/10.1021/ic980399g
Shock L.E., Koretsky C.M. // Geochem. et Cosmochim Acta. 1993. V. 57. № 20. P. 4899. https://doi.org/10.1016/0016-7037(93)90128-J
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии



