Журнал физической химии, 2020, T. 94, № 7, стр. 981-988
Особенности термолиза малеатов Li, Na и Cd
Ч. П. Сактхидхаран a, М. А. Полозов a, В. В. Полозова a, С. А. Найферт a, Д. А. Жеребцов a, *, С. В. Таскаев a, b, С. В. Мерзлов a, В. В. Авдин a
a Южно-Уральский государственный университет
Челябинск, Россия
b Челябинский государственный университет
Челябинск, Россия
* E-mail: zherebtsov_da@yahoo.com
Поступила в редакцию 11.04.2019
После доработки 09.12.2019
Принята к публикации 17.12.2019
Аннотация
Исследованы процессы многостадийного разложения в инертной атмосфере малеатов Li, Na и Cd, а также малеиновой кислоты методом синхронного термического анализа с анализом состава выделяющихся газов. Предложены механизмы реакций, соответствующие определенным в ходе термического анализа ступеням потери массы, газообразным продуктам и конечному твердому продукту разложения. Показано, что при нагревании до 700°С в качестве конечных продуктов образуются карбонаты Li и Na, включенные в пористую углеродную матрицу; кадмий выше 350°С восстанавливается из оксида до металла и испаряется с образованием пористого углеродного остатка как единственного продукта термолиза; все углеродные продукты рентгеноаморфны; малеиновая кислота полностью разлагается до газообразных продуктов в интервале 133–239°С. Показано, что в структуре малеата лития малеат-ион оказывается более устойчивым, чем в свободной малеиновой кислоте, а катионы Na и Cd приводят к снижению его устойчивости.
Термолиз акрилатов, малеатов и ацетилендикарбоксилатов металлов – удобный способ получения композитов, состоящих из наночастиц металлов (Zn, Co, Ni, Mn, Fe, Cu, Nd, Ce, Ag) или их оксидов, включенных в углеродную либо в полимерную матрицу [1–8]. Подобные композиты позволяют исследовать магнитные и каталитические свойства наночастиц металлов в зависимости от их размеров, однако исследования процесса термодеструкции карбоксилатов отрывочны [9–13].
В данной работе проведено комплексное исследование механизма термолиза малеатов Li, Na, Cd, а также малеиновой кислоты с привлечением результатов масс-спектрометрического анализа продуктов их разложения в газовой фазе и рентгенофазового, а также элементного анализа твердых продуктов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Термический анализ малеатов проводили в среде аргона в платиновом тигле при скорости нагрева 10 K/мин с помощью синхронного термоанализатора Netzsch STA 449C “Jupiter”, совмещенного с квадрупольным масс-спектрометром Netzsch QMS 403C “Aeolos” для анализа газообразных продуктов разложения.
Все процессы термолиза многоэтапны. Поскольку ступени на кривых ТГ не выходят на горизонтальные участки, то определить по этим кривым точные потери массы на каждом этапе можно лишь приближенно. В связи с этим температуры завершения очередных этапов на термограммах определяли по положению минимальной скорости разложения на кривой ДТГ. Воспроизводимость определения величины ступеней на кривой ТГ по такой методике при проведении нескольких съемок одного и того же вещества находится в пределах 0.05 мас. %.
За температуру плавления принимали температуру начала пика превращения Tonset на кривой ДСК, которую определяли с помощью программы Proteus, входящей в комплект программного обеспечения термоанализатора.
Рентгенофазовый анализ (РФА) исходных веществ и твердых продуктов их термолиза проводили с помощью рентгеновского порошкового дифрактометра Rigaku Ultima IV на излучении CuKα.
В качестве объектов исследования использовали малеиновую кислоту квалификации “ч.д.а.”, а также малеаты, полученные при ее реакции с Li2CO3, Na2CO3, CdCO3 (также квалификации “ч.д.а.”) в концентрированном водном растворе в течение суток при 70°С. Соотношение металла и кислоты выбирали из расчета образования средних солей. Выделившиеся при медленном охлаждении растворов крупные прозрачные кристаллы отделяли от раствора и высушивали при комнатной температуре.
Морфологию и состав твердых продуктов разложения исследовали с помощью растрового электронного микроскопа Jeol JSM-7001F, сопряженного с энергодисперсионным рентгенофлуоресцентным спектрометром Oxford INCA X-max 80.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Для малеатов Cd, Na, Li фазовый состав, определенный по данным РФА, соответствовал кислым солям Cd(C4H3O4)2 · 4H2O [14], LiC4H3O4 · · 2H2O [15] и NaC4H3O4 · 3H2O [16]. Рентгенограммы исходных малеатов приведены на рис. 1а.
Рис. 1.
Рентгенограммы: а – исходных малеатов Na (1), малеиновой кислоты (2), Li (3) и Cd (4); б – твердых продуктов термолиза малеатов Na (1), Li (2) и Cd (3).

Выполненные исследования позволили выявить температурные интервалы термолиза солей и основные закономерности их распада.
На термограмме Cd(C4H3O4)2 · 4H2O (рис. 2) в интервале 59–180°С по данным ДСК, ТГ, ДТГ и масс-спектрометрического анализа состава выделяющихся газов можно выделить три этапа разложения. Первый этап (59–94°С) сопровождается потерей массы 8.16 мас. %, поглощением тепла и выделением в атмосферу единственного газообразного продукта – воды (m/z = 18 а.е.м.). Второй этап (94–131°С) имеет сходный характер: протекает с потерей массы 8.59 мас. %, поглощением тепла и выделением воды. Интерпретация этих двух этапов хорошо согласуется с расчетными изменениями массы для реакций потери последовательно двух молекул кристаллизационной воды на каждом из этапов:
(1)
$\begin{gathered} {\text{Cd}}{{({{{\text{C}}}_{{\text{4}}}}{{{\text{H}}}_{{\text{3}}}}{{{\text{O}}}_{{\text{4}}}})}_{2}} \cdot 4{{{\text{H}}}_{{\text{2}}}}{\text{O}} = \\ = {\text{Cd}}{{({{{\text{C}}}_{{\text{4}}}}{{{\text{H}}}_{{\text{3}}}}{{{\text{O}}}_{{\text{4}}}})}_{2}} \cdot 2{{{\text{H}}}_{{\text{2}}}}{\text{O}} + 2{{{\text{H}}}_{{\text{2}}}}{\text{O}}\;(--8.69\% ), \\ \end{gathered} $(2)
$\begin{gathered} {\text{Cd}}{{({{{\text{C}}}_{{\text{4}}}}{{{\text{H}}}_{{\text{3}}}}{{{\text{O}}}_{{\text{4}}}})}_{2}} \cdot 2{{{\text{H}}}_{{\text{2}}}}{\text{O}} = \\ = {\text{Cd}}{{({{{\text{C}}}_{{\text{4}}}}{{{\text{H}}}_{{\text{3}}}}{{{\text{O}}}_{{\text{4}}}})}_{2}} + 2{{{\text{H}}}_{{\text{2}}}}{\text{O}}\;(--9.52\% ). \\ \end{gathered} $Рис. 2.
Результаты синхронного термического анализа Cd(C4H3O4)2 · 4H2O и анализа состава выделяющихся газов.
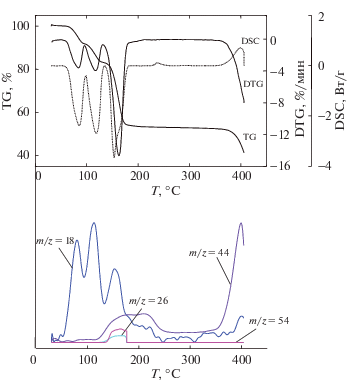
Третий этап (131–181°С) сопровождается потерей массы 29.13 мас. %, поглощением тепла и выделением в атмосферу четырех газообразных продуктов – воды (m/z = 18 а.е.м.), ацетилена (m/z = 26 а.е.м.), углекислого газа (m/z = 44 а.е.м.) и продукта с массовым числом 54. Последний продукт может соответствовать акриловой кислоте (m/z = 72 а.е.м.), которая при ионизации в камере масс-спектрометра разрушается с отщеплением радикалов ОН и Н и потерей электрона и образованием анион-радикала НC=CН–CO• (m/z = 54 а.е.м.). В пользу такого предположения свидетельствуют данные по термолизу малеата кобальта [9], в ходе которого акриловая кислота H2C=CHCOOH была обнаружена в числе газообразных продуктов.
Наблюдаемая потеря массы на третьем этапе является суммой потерь при одновременно протекающих реакциях, включающих деструкцию безводного гидромалеата кадмия с разрывом одной или двух С–С-связей предположительно по схеме:
(3)
$\begin{gathered} 4{\text{Cd}}{{({{{\text{C}}}_{{\text{4}}}}{{{\text{H}}}_{{\text{3}}}}{{{\text{O}}}_{4}})}_{2}} = 4{\text{CdC}}{{{\text{O}}}_{3}} + 13{\text{С}} + \\ + \;2{{{\text{Н}}}_{{\text{2}}}}{\text{C}}{\kern 1pt} = {\kern 1pt} {\text{CН}}{\kern 1pt} --{\kern 1pt} {\text{COOH}} + 2{\text{HC}}{\kern 1pt} \equiv {\kern 1pt} {\text{CH}} + \\ + \;5{\text{C}}{{{\text{O}}}_{2}} + 6{{{\text{Н}}}_{{\text{2}}}}{\text{О}}\;(38.26\% ). \\ \end{gathered} $Можно отметить, что соотношение концентраций ацетилена и акриловой кислоты в атмосфере близко к единице и постоянно при разложении как малеата кадмия, так и малеатов Li, Na, а также малеиновой кислоты.
Образование CdCO3 как основного твердого продукта разложения на третьем этапе не подтверждается рентгенофазовым анализом (рис. 1б) из-за разложения до CdO и последующего восстановления оксида до металла, испарившегося из образца при нагревании до 700°С. О разложении карбоната свидетельствует выделение СО2 при 350–400°С, что соответствует интервалу 330–375°С, известному для разложения чистого CdCO3 [17]. Второй твердый продукт на третьем этапе – черный аморфный высокоуглеродистый полимерный продукт, образующийся параллельно с CdCO3 из Cd(C4H3O4)2. Поскольку для полного протекания реакции (3) расчетный остаток CdO должен составить 30.97 мас. %, а наблюдаемый твердый остаток составил 45.86 мас. %, можно оценить количество углеродистого продукта как 14.89 мас. %. Эта величина сопоставима с потерей массы 29.13 мас. % газообразных продуктов на этом этапе и соответствует переходу в твердый полимер ∼64% всего углерода, содержавшегося в Cd(C4H3O4)2. Аналогично полимерную природу промежуточных углеродистых продуктов разложения установили, например, для малеата кобальта [9] и близкого по молекулярной структуре ацетилендикарбоксилата серебра [2].
В интервале 181–365°С потеря массы незначительна, и лишь выше этой температуры начинает возрастать за счет выделения СО2.
Согласно данным исследования с помощью растрового электронного микроскопа и рентгенофлуоресцентного анализатора, продуктом термолиза является углерод, унаследовавший форму кристаллов малеата кадмия (рис. 3а). Размер пор, образовавшихся при разложении кристаллов карбоната кадмия и дальнейшем восстановлении и испарении металлического кадмия, не превышает 100 нм. Можно отметить, что температура 410°С недостаточна для полного удаления остаточных количеств водорода и кислорода из углеродных материалов, поэтому следует ожидать их присутствия в углеродном продукте.
Известно, что для изоструктурного малеата железа(II) Fe(C4H3O4)2 · 4H2O сообщали неожиданно более высокие температуры потери кристаллизационной воды (177°С), а также разложения безводного малеата (350°С) [18]. Поскольку для малеата кадмия соответствующие температуры составляют всего 60 и 95°С для потери воды и 144°С для разложения безводного малеата, можно предположить, что авторы, не проводившие анализа состава атмосферы, ошибочно отнесли соответствующие эффекты на термограммах. Температура 177°С, вероятно, относится к разложению безводного малеата с образованием FeCO3, а 350°С – к разложению FeCO3 до Fe3O4. Последнее предположение согласуется с измеренной температурой начала разложения FeCO3 (350–400°С [19]).
На термограмме NaC4H3O4 · 3H2O (рис. 4) в интервале 40–720°С можно выделить пять этапов разложения. Первый этап (40–129°С) сопровождается потерей массы 14.26 мас. %, поглощением тепла и выделением в атмосферу воды. Ожидаемая потеря массы при удалении всех трех молекул кристаллизационной воды составляет большую величину:
(4)
$\begin{gathered} {\text{Na}}{{{\text{C}}}_{{\text{4}}}}{{{\text{H}}}_{{\text{3}}}}{{{\text{O}}}_{{\text{4}}}} \cdot 3{{{\text{H}}}_{{\text{2}}}}{\text{O}} = \\ = {\text{Na}}{{{\text{C}}}_{{\text{4}}}}{{{\text{H}}}_{{\text{3}}}}{{{\text{O}}}_{{\text{4}}}} + 3{{{\text{H}}}_{{\text{2}}}}{\text{O}}\;(--28.13\% ). \\ \end{gathered} $Рис. 4.
Результаты синхронного термического анализа NaC4H3O4 · 3H2O и анализа состава выделяющихся газов.

Так как между первым и вторым этапом нет четкой границы по данным ДСК, и лишь приближенно они разделяются по данным ТГ/ДТГ, а вода по данным масс-спектроскопии продолжает выделяться и на втором этапе, то можно сделать вывод, что отделение кристаллизационной воды продолжается и на этапе разложения безводного малеата (второй этап). Второй этап (129–176°С) сопровождается потерей массы 13.53 мас. %, поглощением тепла и выделением в атмосферу четырех газообразных продуктов – воды, ацетилена, углекислого газа и акриловой кислоты.
Третий этап (176–261°С) сопровождается потерей массы 24.73 мас. %, поглощением тепла и выделением в атмосферу тех же четырех газообразных продуктов – воды, ацетилена, углекислого газа и акриловой кислоты. Наличие двух максимумов на кривых ДСК и ДТГ в этом интервале, а также различие в соотношении концентраций газообразных продуктов позволяет предполагать протекание двух последовательных процессов разложения, однако их интерпретация затруднительна. Одни из вероятных процессов на втором и третьем этапах – образование среднего малеата и карбоната натрия:
(5)
$\begin{gathered} {\text{4Na}}{{{\text{C}}}_{{\text{4}}}}{{{\text{H}}}_{{\text{3}}}}{{{\text{O}}}_{{\text{4}}}} = 2{\text{N}}{{{\text{a}}}_{{\text{2}}}}{{{\text{C}}}_{{\text{4}}}}{{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{4}}}} + \\ + \;{{{\text{Н}}}_{{\text{2}}}}{\text{C}}{\kern 1pt} = {\kern 1pt} {\text{CН}}{\kern 1pt} --{\kern 1pt} {\text{COOH}} + {\text{HC}}{\kern 1pt} \equiv {\kern 1pt} {\text{CH}} + \\ + \;3{\text{C}}{{{\text{O}}}_{2}} + {{{\text{H}}}_{2}}\;(--42.04\% ), \\ \end{gathered} $(6)
$\begin{gathered} {\text{N}}{{{\text{a}}}_{{\text{2}}}}{{{\text{C}}}_{{\text{4}}}}{{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}_{4}} = {\text{N}}{{{\text{a}}}_{{\text{2}}}}{\text{C}}{{{\text{O}}}_{3}} + {\text{HC}}{\kern 1pt} \equiv {\kern 1pt} {\text{CH}} + \\ + \;{\text{CO}}\;(--33.77\% ). \\ \end{gathered} $Четвертый этап (261–512°С) сопровождается потерей массы 13.28 мас. %, поглощением тепла и выделением в атмосферу двух газообразных продуктов – углекислого газа и воды. Два максимума на кривых ДСК и ДТГ в этом интервале также свидетельствуют о протекании двух разных процессов разложения, однако их интерпретация неясна. Вероятно, это – процессы разложения углеродистого остатка.
Пятый этап (512–720°С) сопровождается потерей массы 3.29 мас. %, поглощением тепла и выделением в атмосферу углекислого газа и воды. Следует отметить, что после термолиза образец не имел признаков плавления. Образование Na2CO3 как основного твердого продукта разложения на этом этапе подтверждается рентгенофазовым анализом. Вторым твердым продуктом является черный аморфный углеродистый продукт. Поскольку для полного превращения NaC4H3O4 · · 3H2O в Na2CO3 расчетный остаток карбоната натрия должен составить 27.59 мас. %, а наблюдаемый твердый остаток составил 30.91 мас. %, можно оценить количество углеродистого продукта как 3.38 мас. %. Эта величина значительно меньше потери массы газообразных продуктов и соответствует переходу в твердый углерод ∼13% всего углерода, содержавшегося в NaC4H3O4.
Согласно данным электронной микроскопии, продуктом термолиза является композит, представляющий собой кристаллы Na2CO3 (рис. 3б), связанные небольшим количеством углерода. Размер пластинчатых кристаллов Na2CO3 составляет 1.5 мкм.
На термограмме LiC4H3O4 · 2H2O (рис. 5) в интервале 40–720°С по данным ДСК, ТГ и масс-спектрометрического анализа состава выделяющихся газов можно выделить пять этапов разложения.
Рис. 5.
Результаты синхронного термического анализа LiC4H3O4 · 2H2O и анализа состава выделяющихся газов.

Первый этап (40–190°С) сопровождается потерей массы 22.99 мас. %, поглощением тепла и выделением в атмосферу единственного газообразного продукта – воды:
(7)
$\begin{gathered} {\text{Li}}{{{\text{C}}}_{{\text{4}}}}{{{\text{H}}}_{{\text{3}}}}{{{\text{O}}}_{{\text{4}}}} \cdot {\text{2}}{{{\text{H}}}_{{\text{2}}}}{\text{O}} = {\text{Li}}{{{\text{C}}}_{{\text{4}}}}{{{\text{H}}}_{{\text{3}}}}{{{\text{O}}}_{{\text{4}}}} + \\ + \;2{{{\text{H}}}_{{\text{2}}}}{\text{O}}\;(--22.80\% ). \\ \end{gathered} $Как и в случае малеата натрия, этап потери кристаллизационной воды завершается на втором этапе – разложения безводного малеата. Пик на кривой ДСК около 143.5°С может относиться к плавлению кристаллогидрата малеата лития.
Второй этап (190–230°С) сопровождается потерей массы 14.96 мас. %, поглощением тепла и выделением в атмосферу воды, ацетилена, углекислого газа и акриловой кислоты, что может соответствовать образованию Li6(C4H3O4)4С2O4:
(8)
$\begin{gathered} {\text{6Li}}{{{\text{C}}}_{{\text{4}}}}{{{\text{H}}}_{{\text{3}}}}{{{\text{O}}}_{4}} = {\text{L}}{{{\text{i}}}_{{\text{6}}}}{{({{{\text{C}}}_{{\text{4}}}}{{{\text{H}}}_{{\text{3}}}}{{{\text{O}}}_{4}})}_{4}}{{{\text{С}}}_{{\text{2}}}}{{{\text{O}}}_{4}} + \\ + \;{{{\text{Н}}}_{{\text{2}}}}{\text{C}}{\kern 1pt} = {\kern 1pt} {\text{CН}}{\kern 1pt} --{\kern 1pt} {\text{COOH}} + {\text{HC}}{\kern 1pt} \equiv {\kern 1pt} {\text{CH}} + \\ + \;{\text{C}}{{{\text{O}}}_{2}}\;(--19.41\% ). \\ \end{gathered} $За первые два этапа измеренная потеря массы составила 37.95 мас. %, при этом расчет по уравнениям (7), (8) дает близкое значение (37.79 мас. %).
Третий этап (230–260°С) сопровождается потерей массы 17.72 мас. %, поглощением тепла и выделением в атмосферу воды, ацетилена, углекислого газа и акриловой кислоты, что может соответствовать образованию Li6(C4H3O4)2(С2O4)2:
(9)
$\begin{gathered} {\text{L}}{{{\text{i}}}_{6}}{{({{{\text{C}}}_{{\text{4}}}}{{{\text{H}}}_{{\text{3}}}}{{{\text{O}}}_{4}})}_{4}}{{{\text{С}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{4}}}} = {\text{L}}{{{\text{i}}}_{{\text{6}}}}{{{\text{(}}{{{\text{C}}}_{{\text{4}}}}{{{\text{H}}}_{{\text{3}}}}{{{\text{O}}}_{{\text{4}}}}{\text{)}}}_{{\text{2}}}}{{{\text{(}}{{{\text{С}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{4}}}}{\text{)}}}_{{\text{2}}}} + \\ + \;{{{\text{Н}}}_{{\text{2}}}}{\text{C}}{\kern 1pt} = {\kern 1pt} {\text{CН}}{\kern 1pt} --{\kern 1pt} {\text{COOH}} + {\text{HC}}{\kern 1pt} \equiv {\kern 1pt} {\text{CH}} + \\ + \;2{\text{CO}}\;{\text{(}}{\kern 1pt} --{\kern 1pt} {\text{28}}{\text{.16\% }}). \\ \end{gathered} $За первые три этапа измеренная потеря массы составила 55.67 мас. %, при этом расчет по уравнениям (7)–(9) дает близкое значение (55.31 мас. %).
Четвертый и пятый этапы (260–469 и 469–720°С) сопровождаются потерей массы 13.50 и 7.64 мас. %, выделением тепла и выделением в атмосферу воды и углекислого газа. Эти этапы, по-видимому, связаны с разложением Li6(C4H3O4)2(С2O4)2 без образования ацетилена и акриловой кислоты, но с образованием оксалата лития:
(10)
$\begin{gathered} {\text{L}}{{{\text{i}}}_{{\text{6}}}}{{{\text{(}}{{{\text{C}}}_{{\text{4}}}}{{{\text{H}}}_{{\text{3}}}}{{{\text{O}}}_{{\text{4}}}}{\text{)}}}_{{\text{2}}}}{{{\text{(}}{{{\text{С}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{4}}}}{\text{)}}}_{{\text{2}}}} = {\text{3L}}{{{\text{i}}}_{{\text{2}}}}{{{\text{C}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{4}}}} + {{{\text{Н}}}_{{\text{2}}}}{\text{О}} + \\ + \;{\text{C}}{{{\text{Н}}}_{4}} + 3{\text{CO}}\;(--27.86\% ), \\ \end{gathered} $(11)
${\text{L}}{{{\text{i}}}_{{\text{2}}}}{{{\text{C}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{4}}}} = {\text{L}}{{{\text{i}}}_{{\text{2}}}}{\text{С}}{{{\text{O}}}_{{\text{3}}}} + {\text{CO}}\;(--27.49\% ).$Образование Li2CO3 как основного твердого продукта разложения на этом этапе подтверждается рентгенофазовым анализом. Вторым твердым продуктом является черный аморфный высокоуглеродистый полимерный продукт, образующийся параллельно из расплава LiC4H3O · · 2H2O. Поскольку для полного разложения LiC4H3O4 · 2H2O расчетный остаток Li2CO3 должен составить 23.38 мас. %, а наблюдаемый твердый остаток составил 23.20 мас. %, можно оценить количество углеродистого продукта как 0.18 мас. % (∼0.6% всего углерода, содержавшегося в LiC4H3O4 · 2H2O).
Согласно данным электронной микроскопии, продуктом термолиза является композит, представляющий собой частицы Li2CO3 (рис. 3в, 3г), связанные небольшим количеством углерода. Размер частиц Li2CO3 составляет 1.5–3.0 мкм.
Термограмма разложения малеиновой кислоты представлена двумя этапами (рис. 6). В диапазоне 133–197°С происходит основной этап разложения с потерей массы 96.18 мас. % и выделением пяти газообразных продуктов: воды, ацетилена, углекислого газа, акриловой кислоты и малеинового ангидрида (m/z = 98). На этом этапе происходит также плавление при температуре 137.1°С. Это хорошо согласуется с литературными данными о плавлении малеиновой кислоты при 139–140°С [21]. Далее на втором этапе при 197–239°С масса уменьшается практически до нуля с выделением H2O, CO2, что может соответствовать разложению продуктов конденсации малеиновой кислоты. Можно отметить, что незначительные количества малеинового ангидрида выделяются на начальных этапах разложения малеатов Li, но не обнаруживаются в продуктах разложения Cd, Na.
Сравнение устойчивости безводного малеата к термолизу в зависимости от типа катиона можно выразить сравнением температур, соответствующих началу соответствующей ступени на кривой ТГ. При этом исследованные соединения можно упорядочить в ряд по возрастанию температур разложения: NaC4H3O4 · 3H2O (129°С), Cd(C4H3O4)2 · · 4H2O (131°С), C4H4O4 (137°С), LiC4H3O4 · 2H2O (190°С). Расположение в ряд по возрастанию температур разложения, определяемых по появлению в атмосфере первых молекул ацетилена, приводит к такой же последовательности: NaC4H3O4 · 3H2O (125°С), Cd(C4H3O4)2 · 4H2O (139°С), C4H4O4 (163°С), LiC4H3O4 · 2H2O (233°С). Таким образом, только в структуре малеата лития малеат-ион оказывается более устойчивым, чем в свободной малеиновой кислоте. Остальные катионы приводят к снижению его устойчивости.
Таким образом, результаты термического анализа позволили определить характерные особенности термолиза для всех исследованных в работе малеатов и малеиновой кислоты. Во-первых, разложение иона малеата или малеиновой кислоты всегда сопровождается формированием приблизительно равных количеств акриловой кислоты и ацетилена. Во-вторых, присутствие нескольких связей в молекулах исходных веществ и в молекулах газообразных продуктов термолиза приводит к их полимеризации и далее к формированию углеродного остатка, за исключением разложения малеиновой кислоты. Общее количество этого остатка является самым высоким в случае разложения малеата кадмия и самым низким в случае малеатов натрия и лития. В-третьих, термолиз малеатов Li и Na приводит к формированию соответствующих карбонатов в форме микрокристаллов, равномерно распределенных в этой матрице. Карбонат кадмия образуется в тех же условиях в виде намного более мелких кристаллов, размер которых не превышает 100 нм.
Работа выполнена при поддержке Российского научного фонда (грант № 18-42-06201), Правительства РФ (Постановление № 211 от 16.03.2013 г.), соглашение № 02.A03.21.0011 и Министерства образования и науки РФ в рамках ГЗ № 4.5749.2017/7.8. Рентгенофазовый и термический анализ, а также электронно-микроскопические исследования проведены в научно-образовательном центре “Нанотехнологии” ЮУрГУ.
Список литературы
Skoulika S., Dallas P., Siskos M.G. et al. // Chemistry of Materials. 2003. V. 15. № 24. P. 4576.
Dallas P., Bourlinos A.B., Komninou P. et al. // Nanoscale Research Letters. 2009. V. 4. № 11. P. 1358.
Stein I., Ruschewitz U. // Z. Anorg. Allgem. Chem. 2010. B. 636. № 2. S. 400.
Deacon G.B., Phillips R.J. // Coord. Chem. Rev. 1980. V. 33. № 3. P. 227.
Logvinenko V., Yudanova L., Yudanov N. et al. // J. Thermal Analysis and Calorimetry. 2003. V. 74. № 2. P. 395.
Allendorf M.D., Houk R.J.T., Andruszkiewicz L. et al. // J. Amer. Chem. Soc. 2008. V. 130. № 44. P. 14404.
Robl C., Hentschel S. // Z. Naturforschung. Section B-a Journal of Chemical Sciences. 1990. V. 45. № 11. P. 1499.
Хлесткин Р.Н., Хлесткина В.Л., Усанов Н.Г. и др. // Хим. пром-cть. 1982. № 7. С. 391.
Pomogailo A.D., Dzhardimalieva G.I., Rozenberg A.S. et al. // Russ. Chem. Bull. 2011. V. 60. № 7. P. 1476.
Юданова Л.И., Логвиненко В.А., Корольков И.В. и др. // Журн. физ. химии. 2018. Т. 92. № 11. С. 1753.
Юданова Л.И., Логвиненко В.А., Шелудякова Л.А. и др. // Журн. неорган. химии. 2014. Т. 59. № 10. С. 1420.
Юданова Л.И., Логвиненко В.А., Юданов Н.Ф. и др. // Коорд. химия. 2013. Т. 39. № 5. С. 309.
Помогайло А.Д., Розенберг А.С., Джардималиева Г.И. // Успехи химии. 2011. Т. 80. № 3. С. 272.
Yong L. // Acta Cryst. Section E. 2005. V. 61. P. 669.
Popelier P., Lenstra A.T.H., Geise H.J. // Acta Cryst. 1989. V. 45. P. 1024.
Zheng Y.-Q., Kong Z.-P., Lin J.-L. // Z. Kristallogr. NCS. 2001. V. 216. P. 355.
Ballirano P. // Eur. J. Mineralogy. 2016. V. 28. № 2. P. 285.
Essghaier B., Abdelhak J., Naouar A. et al. // J. Chem. Sci. 2015. V. 127. № 12. P. 2261.
Kissinger H.E., McMurdie H.F., Simpson B.S. // J. Amer. Ceram. Soc. 1956. V. 39. P. 168.
Girgis M.M., Elawaad A. // Thermochimica Acta. 1993. V. 214. № 2. P. 291.
Химическая энциклопедия / Под ред. И.Л. Кнунянца. М.: Сов. Энциклопедия, 1990. Т. 2. 671 с.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии




