Журнал физической химии, 2020, T. 94, № 7, стр. 963-974
Исследование расплавов системы CaO–TiO2 масс-спектрометрическим эффузионным методом Кнудсена
a Российская академия наук, Институт геохимии и аналитической химии им. В.И. Вернадского
Москва, Россия
* E-mail: sergey.shornikov@gmail.com
Поступила в редакцию 07.11.2019
После доработки 07.11.2019
Принята к публикации 12.11.2019
Аннотация
Масс-спектрометрическим эффузионным методом Кнудсена определены активности оксидов в расплавах системы CaO–TiO2 в области температур 2241–2441 K. На основании экспериментальных данных рассчитаны термодинамические свойства кальциево-титанатных расплавов – химические потенциалы оксидов и энергия смешения расплавов, а также парциальные и интегральные энтальпии и энтропии их образования. Полученные данные сопоставлены с имеющимися в литературе.
Физико-химические свойства расплавов системы CaO–TiO2 и ее соединений представляют значительный интерес для петрологии титаносодержащих пород и металлургии титана и его сплавов, а также для производства керамики и огнеупорных материалов. Особый интерес вызывают специфические свойства, которые начинают находить широкое применение в солнечной энергетике, что обусловлено высокой эффективностью и низкой ценой перовскитовых фотоэлементов [1].
Одна из первых диаграмм состояния кальциево-титанатной системы, построенная на основании визуальных наблюдений Умезу и Какиучи [2], содержала единственное соединение – перовскит CaTiO3 с температурой плавления 2013 ± 10 K. Позднее Парга Пондал и Бергт [3] при спекании оксидов наблюдали образование еще двух титанатов кальция – Ca2Ti3O8 и Ca3Ti2O7, существование последнего было подтверждено Ершовым [4] при наблюдении каплеобразования в пламени. Вартенберг и др. [5] обнаружили новые титанаты кальция Ca2TiO4 и Ca3TiO5 с температурами плавления 2073 ± 20 K и 2148 ± 20 K соответственно.
Однако Танака [6] не обнаружил никаких соединений в системе CaO–TiO2 кроме перовскита. Мамыкин и Лошкарев [7] и Куханор и др. [8] установили отсутствие твердых растворов в системе и подтвердили существование только CaTiO3 и Ca3Ti2O7. Бережной [9] модифицировал диаграмму состояния, предложенную Вартенберг и др. [5], предполагая конгруэнтное плавление Ca3Ti2O7 и разложение Ca2TiO4. ДеВриз и др. [10] провели систематические исследования методом закалки в сочетании с рентгеноструктурными исследованиями, результаты которых позволили в значительной степени прояснить запутанную ситуацию с обнаруженными титанатами кальция.
Вместе с тем, Рот [11] обнаружил еще одно новое соединение – Ca4Ti3O10, которое разлагается на перовскит и жидкость при температуре 2028 ± 10 K. Позднее Жонгежан и Вилкинс [12] на основании данных, полученных методом высокотемпературной микроскопии, сообщили о более высокой температуре разложения соединения Ca4Ti3O10 – 2143 ± 10 K. Однако Имлах и Глассер [13] в рентгенографических исследованиях не подтвердили существования соединения Ca4Ti3O10, что, возможно, связано с условиями отжига образцов.
Предположения Кимура и Муан [14] и Шульц [15] о наличии области твердых растворов Ca3Ti2O7–Ca4Ti3O10 было опровергнуто результатами рентгенофазовых исследований, выполненных Тулгар [16], обнаружившего еще одно новое соединение – Ca5Ti4O13, разлагающегося при температуре 2113 ± 20 K. Лимарь и Кисель [17, 18] и Пфаф [19] синтезировали и изучили метастабильные соединения CaTi4O9 и CaTi2O5, которые разлагаются при температурах 993 ± 20 K и 1123 ± 20 K соответственно на рутил и другие титанаты кальция. Савенко и Сахаров [20] в продуктах термолиза обнаружили соединение Ca2Ti5O12, устойчивое в области температур 1023–1273 K и разлагающееся на рутил и перовскит.
Возможные трудности синтеза и идентификации соединений в системе CaO–TiO2 могут быть связаны с наличием восстановительных условий, которые могут приводить, в частности, к образованию соединений Ca3Ti2O6 [21] или же CaTi2O4 [22–25]. При исследовании методом электронной микроскопии включений СaO в перовските Цех и Колар [26] обнаружили в разломах решетки CaTiO3 образование гомологичных оксидов Ca6Ti5O16, Ca8Ti7O22 и Ca9Ti8O25, срастающихся с CaTiO3.
Гребенщиков и Торопов [27] рассчитали из параметров кристаллических решеток энтальпии образования (ΔHT) титанатов кальция, рассматривая распад решетки соединения Ca3Ti2O7, характеризующий его инконгруэнтное плавление. Значения ΔHT для соединений Ca2TiO4 и CaTi2O5 были близки к рассчитанным Резницким и Филипповой [28], однако значительно отличались от оценок, сделанных в работах [29–32], из которых следовала их термодинамическая неустойчивость. Титанаты кальция Ca4TiO6, Ca8Ti3O14 и CaTi3O7, свойства которых рассчитаны в рамках различных квантово-химических моделей в работах [33–35], по-видимому, также неустойчивы, что не исключает их возможного существования [36].
Скомпилированная в настоящей работе на основании данных [10, 11], а также результатов недавних исследований Гонг и др. [37], выполненных методом рентгеновской дифракции, диаграмма состояния системы CaO–TiO2 в области высоких температур приведена на рис. 1. Сводка данных по соединениям в системе CaO–TiO2, включая индивидуальные оксиды [5, 9, 38–40], приведена в табл. 1.
Таблица 1.
Соединения в системе CaO–TiO2 (Тп – температура фазового перехода)
| Соединение | ${{x}_{{{\text{Ti}}{{{\text{O}}}_{{\text{2}}}}}}}$, мол. % | Тп, K | Фазы | Ссылка |
|---|---|---|---|---|
| CaO | 0.00 | 2853 ± 20 | жидкость | [5] |
| » | » | 2900 ± 150 | » | [39] |
| » | » | 3222 ± 25 | » | [40] |
| Ca4TiO6 | 20.00 | – | – | [33] |
| Ca3TiO5 | 25.00 | 2148 ± 20 | жидкость | [5] |
| Ca8Ti3O14 | 27.27 | – | – | [33, 34] |
| Ca2TiO4 | 33.33 | 2073 ± 20 | жидкость | [5] |
| » | » | 2043 ± 20 | Ca3Ti2O7 + жидкость | [9] |
| Ca3Ti2O7 | 40.00 | 2023 ± 10 | CaTiO3 + жидкость | [8] |
| » | » | 2073 ± 20 | жидкость | [9] |
| » | » | 2013 ± 10 | Ca4Ti3O10 + жидкость | [11] |
| » | » | 2023 ± 20 | Ca5Ti4O13 + жидкость | [16] |
| Ca4Ti3O10 | 42.86 | 2028 ± 10 | CaTiO3 + жидкость | [11] |
| » | » | 2143 ± 10 | » | [12] |
| Ca5Ti4O13 | 44.44 | 2113 ± 20 | CaTiO3 + жидкость | [16] |
| CaTiO3 | 50.00 | 2013 ± 10 | жидкость | [2] |
| » | » | 2253 ± 20 | » | [5] |
| » | » | 2188 ± 10 | » | [8, 11] |
| » | » | 2233 ± 20 | » | [16] |
| » | » | 2241 ± 10 | » | [42] |
| Ca2Ti3O8 | 60.00 | – | – | [3] |
| CaTi2O5 | 66.67 | 1123 ± 20 | CaTiO3 + Ca2Ti5O12 | [18, 19] |
| CaTi3O7 | 75.00 | – | – | [35] |
| Ca2Ti5O12 | 77.78 | 1273 ± 20 | CaTiO3 + TiO2 | [19, 20] |
| CaTi4O9 | 80.00 | 993 ± 20 | Ca2Ti5O12 + TiO2 | [17, 19] |
| TiO2 | 100.00 | 2128 ± 20 | жидкость | [5] |
| » | » | 2103 ± 20 | » | [9] |
| » | » | 2185 ± 10 | » | [39] |
| » | » | 2143 ± 15 | » | [38] |
Процессы испарения и термодинамические свойства наиболее изученного титаната кальция – перовскита в области высоких температур были рассмотрены в предыдущих публикациях [41, 42]. Заметим, что исследования термодинамических свойств других титанатов кальция – Ca3Ti2O7 и Ca4Ti3O10 – ограничиваются результатами нескольких работ [37, 43–45], выполненных при температурах, не превышающих 1250 K. Настоящая работа – продолжение исследования высокотемпературных физико-химических свойств системы CaO–TiO2 и ее соединений с акцентом внимания на термодинамических свойствах расплавов этой системы.
Термодинамическая информация о свойствах системы CaO–TiO2 в области температур, превышающих 1700 K, – довольно скудна и ограничивается результатами всего нескольких экспериментальных исследований (рис. 2). Кратко рассмотрим их.
Рис. 2.
Составы системы CaO–TiO2, исследованные: 1 – методом обменных равновесий в шлаках [46, 47]; 2 – при испарении перовскита (по Ленгмюру) [55]; 3–7 – масс-спектрометрическим эффузионным методом Кнудсена [42, 48, 51, 54] и в настоящей работе соответственно. Диаграмма состояния системы CaO–TiO2 изображена сплошной линией по данным [10, 11, 37] и пунктиром – по данным [16].

Суито и др. [46, 47] изучали равновесия в шлаках CaO–TiOx (или CaO–TiOx–A12O3) с жидким никелем по отношению к кислороду, азоту и сере в зависимости от содержания Ti (или A1) в металле с использованием тиглей из CaO или Al2O3 при температуре 1873 K. Значения активности TiO2 (${{a}_{{{\text{Ti}}{{{\text{O}}}_{{\text{2}}}}}}}$) оценивали либо по содержанию A1, Ti и O2, используя данные об энергии Гиббса образования оксида титана и соответствующих параметров взаимодействия, либо по найденным значениям нитридной и сульфидной емкости в шлаках (табл. 2).
Таблица 2.
Активности оксидов в системе CaO–TiO2
| ${{x}_{{{\text{Ti}}{{{\text{O}}}_{{\text{2}}}}}}}$, мол. % | T, K | ${{a}_{{{\text{CaO}}}}}$ | ${{a}_{{{\text{Ti}}{{{\text{O}}}_{{\text{2}}}}}}}$ × 10 | Ссылка, год |
|---|---|---|---|---|
| 30 | 2057 | (6.11 ± 3.06) × 10–1 | – | [54], 2004 |
| 40 | 2057 | (5.56 ± 2.78) × 10–1 | – | [54], 2004 |
| 50 | 1791 | (2.06 ± 0.08) × 10–2 | 1.09 ± 0.06 | [42], 2019 |
| 50 | 1873 | – | 1.05 ± 0.35 | [46], 1994 |
| 50 | 1873 | – | 1.80 ± 0.25 | [47], 1994 |
| 50 | 1873 | – | 1.50 ± 0.35 | [47], 1994 |
| 50 | 1873 | – | 1.50 ± 0.30 | [47], 1994 |
| 50 | 1875 | (2.19 ± 0.08) × 10–2 | 1.26 ± 0.06 | [42], 2019 |
| 50 | 2100 | (2.63 ± 0.22) × 10–2 | 2.46 ± 0.25 | [50], 2000 |
| 50 | 2100 | (2.54 ± 0.12) × 10–2 | 2.21 ± 0.10 | [51], 2003 |
| 50 | 2150 | (2.39 ± 0.36) × 10–2 | 2.10 ± 0.32 | [48], 1981 |
| 50 | 2182 | (2.59 ± 0.08) × 10–2 | 2.29 ± 0.07 | [42], 2019 |
| 50 | 2278 | (2.60 ± 0.08) × 10–2 | 2.39 ± 0.08 | данная работа |
| 50 | 2291 | (2.61 ± 0.25) × 10–2 | 2.43 ± 0.22 | [42], 2019 |
| 50 | 2315 | (2.62 ± 0.25) × 10–2 | 2.44 ± 0.22 | [42], 2019 |
Рассчитанные Суито и др. [46, 47] величины ${{a}_{{{\text{Ti}}{{{\text{O}}}_{{\text{2}}}}}}}$ коррелировали с полученными Банон и др. [48] масс-спектрометрическим эффузионным методом Кнудсена в интервале температур 1900–2200 K (табл. 2). Приведенные на рис. 3 данные были получены Банон и др. при исследовании испарения 24 составов системы CaTiO3–Ti2O3–TiO2 из молибденовых контейнеров. Синтезированные составы содержали до 90.2 мол. % Ti2O3 и до 42 мол. % TiO2, а также соединение CaTiO3. На основании экспериментально найденных значений парциальных давлений пара (Ca), (TiO) и (TiO2) над расплавами при температуре 2150 K (здесь и далее круглыми скобками обозначена газовая фаза, квадратными – конденсированная) авторы рассчитали величины активностей Ti, TiО, Ti2О3, TiО2 и CaTiО3, а также энергии смешения в расплавах. В случае системы CaTiO3–TiO2 значения активностей TiО2 и CaTiО3 рассчитывались путем экстраполяции из данных, относящихся к тройной системе CaTiO3–Ti2O3–TiO2, и, таким образом, имели, по мнению самих авторов, низкую точность, что, по-видимому, и обусловливало их несоответствие различным вариантам диаграммы состояния системы CaO–TiO2 [5, 10, 12, 16]. Тем не менее, Банон и др. [48], интерпретируя полученные высокие величины ${{a}_{{{\text{Ti}}{{{\text{O}}}_{{\text{2}}}}}}}$ в области концентраций, близких к диоксиду титана (рис. 3), предполагали наличие несмешиваемости расплава системы CaO–TiO2 в области, близкой к TiO2.
Шорников и др. [49–51] также масс-спектрометрическим эффузионным методом Кнудсена исследовали испарение 17 составов расплавов системы CaO–TiO2–SiO2 из молибденовых контейнеров в интервале температур 1582–2529 K. Синтезированные составы содержали от 25.60 до 50.00 мол. % CaO, до 60.67 мол. % SiO2, и от 5.05 до 50.00 мол. % TiO2, включая соединение CaTiO3. Установленный состав газовой фазы над изученными расплавами системы CaO–TiO2–SiO2 позволял предположить протекание реакций, типичных для индивидуальных оксидов [52]:
Как следует из табл. 2, рассчитанные в работах [50, 51] для случая псевдодвойных систем CaTiO3–CaSiO3 и CaTiO3–SiO2, соответственно, по методу Белтона–Фруехана [53] значения активностей оксидов в перовските при температуре 2100 K были близки к полученным Банон и др. [48].
Столярова и др. [54] исследовали свойства газовой фазы над 14 составами системы CaO–TiO2–SiO2, а также определяли величины активности оксидов и энергии смешения расплавов методом высокотемпературной масс-спектрометрии при испарении расплавов из вольфрамовых эффузионных контейнеров в интервале температур 1800–2200 K. Синтезированные составы содержали до 70 мол. % CaO, до 69 мол. % SiO2, и до 40 мол. % TiO2. Как следует из рис. 2, при 2057 K один из двух исследованных составов системы CaO–TiO2 находился в области “CaO + жидкость”, и, таким образом, его значение ${{a}_{{{\text{CaO}}}}}$ должно быть близко к единице. Второй состав находился в области “Ca4Ti3O10 + жидкость”, согласно информации, представленной в работах [10, 11], или же в области “Ca3Ti2O7 + жидкость”, как следует из данных, представленных Тулгар [16]. Однако рассчитанные значения ${{a}_{{{\text{CaO}}}}}$ довольно близки (табл. 2), что противоречит данным о диаграмме состояния системы CaO–TiO2 (рис. 2). Возможной причиной рассмотренных расхождений, по-видимому, является значительная погрешность в измерениях активностей CaO в расплаве, которая может составлять, по нашему мнению, более 50%.
В табл. 2 также приведены некоторые данные, полученные Шорниковым [42] при исследовании испарения перовскита масс-спектрометрическим эффузионным методом Кнудсена в области температур 1791–2398 K. Можно заметить согласованность термодинамической информации, полученной в работах [42, 46–51], однако только для одного состава, отвечающего перовскиту.
Недавно Жанг и др. [55] изучали изотопное фракционирование кальция и титана при испарении расплава перовскита, подвешенного на иридиевой проволоке в вакуумной печи, при 2278 K (по Ленгмюру). Изменение состава остаточного расплава перовскита в процессе испарения свидетельствовало о преимущественном испарении из расплава кальциевой составляющей расплава. Хотя оценка величины общего давления пара над расплавом перовскита и соответствовала нашим данным [41], однако остальная термодинамическая информация, полученная Жанг и др. [55], экспериментально не подтверждена.
Таким образом, имеющая информация о термодинамических свойствах расплавов системы CaO–TiO2 довольно незначительна. Информация о диаграмме состояния кальциево-титанатной системы противоречива (рис. 1 и 2) и нуждается в уточнениях о наличии/отсутствии титанатов кальция и положениях инвариантных точек, включая температуры плавления индивидуальных оксидов (табл. 1). Разрозненные определения величин активностей оксидов в системе CaO–TiO2 при различных температурах и составах (преимущественно в твердой фазе) не дают полного представления о физико-химических свойствах расплавов системы (табл. 2), что необходимо для их теоретического описания.
Цель настоящей работы заключалась в изучении термодинамических свойств расплавов системы CaO–TiO2 на основании данных, полученных масс-спектрометрическим эффузионным методом Кнудсена в области температур 2241–2441 K.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Эксперименты были выполнены с помощью серийного масс-спектрометра МИ–1201, оснащенного модифицированным ионным источником для проведения высокотемпературных исследований (до температуры 3000 K). Молибденовый эффузионный контейнер нагревался переменным электрическим током, протекающим через его корпус, температура нагрева определялась оптическим пирометром ЭОП-66 с погрешностью, не превышающей 10 K при 2400 K. Общее давление остаточных газов в масс-спектрометре в области эффузионного контейнера не превышало 10–10 атм во всем температурном интервале. Высокая чувствительность аппаратуры была достигнута близостью положения эффузионного контейнера к области ионизации источника при соосности молекулярного и ионного пучков. Конструкция разработанного ионного источника и методические особенности проведения масс-спектрометрического эксперимента детально описаны ранее [56].
Синтез исходных составов системы CaO–TiO2–SiO2, был выполнен по керамической технологии с последующим рентгенофазовым и химическим анализом образцов. Для приготовления требуемого состава в качестве исходных материалов были использованы CaCO3 (марка “ос. ч.”), TiO2 (марка “ос. ч.”) и порошок горного хрусталя с содержанием 99.90 мас. % SiO2, которые смешивались в шаровой яшмовой мельнице в ацетоне в течение 24 ч. После просушки полученные смеси кальцинировались в силитовых печах на воздухе при температуре до 1300 K в течение 24 ч. После вторичного перетирания производился высокотемпературный обжиг образцов при 1530 K в течение 24 ч.
Исследуемые составы представляли собой остаточные расплавы системы CaO–TiO2–SiO2, содержащие до 1 мол. % SiO2, потерянного в процессе высокотемпературного испарения. Таким образом было получено более 200 композиций системы CaO–TiO2, содержащих от 38 до 95 мол. % TiO2 в области температур 2241–2441 K, некоторые из них изображены на рис. 2.
Как показано ранее [49], первая стадия процесса испарения кальциево-титано-силикатных расплавов характеризовалась преобладающим испарением содержащегося в расплаве диоксида кремния при постоянной концентрации кальциево-титанатной составляющей расплава. На второй стадии испарения расплавов системы CaO–TiO2–SiO2, обедненных диоксидом кремния до концентраций, близких к полю оксида кальция (от ∼70 до 80 мол. % СаО), происходило испарение кальциево-силикатной составляющей расплава вплоть до практически полного испарения SiO2. Дальнейшее испарение остаточного расплава системы CaO–TiO2 протекало с преимущественным испарением оксида кальция из расплава до области концентраций, близких к полю рутила TiO2.
Наблюдаемое изменение количества i-го оксида (${{m}_{t}}$) в расплаве системы CaO–TiO2–SiO2 за время t рассчитывалось согласно подходу, предложенному в [57], исходя из соотношения интегральных выражений для временных зависимостей i-х полных ионных токов (${{I}_{{ij}}}$), образованных от j-х молекулярных форм газовой фазы над расплавом:
(6)
${{\left( {\frac{{{{m}_{t}}}}{{{{m}_{0}}}}} \right)}_{i}} = \frac{{\int\limits_0^t {{{I}_{{ij}}}dt} }}{{\int\limits_0^{{{t}_{0}}} {{{I}_{{ij}}}dt} }},$В масс-спектрах пара над полученными таким образом расплавами системы CaO–TiO2 при энергии ионизирующих электронов, равной 25 эВ, преобладали молекулярные ионы TiO$_{2}^{ + }$, Ca+, TiO+ и O+ [49, 51]. Содержание остальных молекулярных ионов, характерных как для масс-спектров пара над индивидуальными оксидами (CaO+, Ti+, ${\text{O}}_{2}^{ + }$), так и для молекулярного иона CaTiO$_{3}^{ + }$, обнаруженного ранее над перовскитом [41], было незначительным. В этой связи значения интенсивностей полных ионных токов в соотношении (6) были рассчитаны в пренебрежении последних.
Энергии появления ионов в масс-спектрах пара над расплавами системы CaO–TiO2 были определены методом Уоррена [58] и соответствовали принятым в [59] значениям энергиям ионизации атомов и молекул, типичных для простых оксидов. Энергия появления иона CaTiO$_{3}^{ + }$ в масс-спектрах пара над расплавами соответствовала определенной нами ранее для перовскита [41]. Соотношение интенсивностей ионных токов в масс-спектрах пара над расплавом системы CaO–TiO2, содержащим 57.81 ± 0.15 мол. % TiO2, при температуре 2278 ± 10 K было следующим: ${{I}_{{{\text{Ca}}}}}$ : ${{I}_{{{\text{CaO}}}}}$ : ${{I}_{{{\text{Ti}}}}}$ : ${{I}_{{{\text{TiO}}}}}$ : ${{I}_{{{\text{Ti}}{{{\text{O}}}_{{\text{2}}}}}}}$ : ${{I}_{{{\text{CaTi}}{{{\text{O}}}_{{\text{3}}}}}}}$ : ${{I}_{{\text{O}}}}$ : ${{I}_{{{{{\text{O}}}_{{\text{2}}}}}}}$ = 25 : 0.02 : 0.1 : 56 : 100 : 0.13 : 0.44 : 0.012, что несколько отличается от полученного для перовскита [41]. При определении интенсивности ионного тока молекулярного иона CaTiO$_{3}^{ + }$, как и ранее [41], учитывалась его фрагментация на ионы CaTi+, CaTiO+ и CaTiO$_{2}^{ + }$.
В масс-спектрах пара над кальциево-титанатным расплавом наблюдали также ионы MoO$_{i}^{ + }$ (i = = 0–3), количество которых было невелико: ${{I}_{{{\text{Ti}}{{{\text{O}}}_{2}}}}}$ : ${{I}_{{{\text{Mo}}}}}$ : ${{I}_{{{\text{MoO}}}}}$ : ${{I}_{{{\text{Mo}}{{{\text{O}}}_{{\text{2}}}}}}}$ : ${{I}_{{{\text{Mo}}{{{\text{O}}}_{{\text{3}}}}}}}$ = 100 : 0.35 : 1.6 : 1.8 : 5.4. Их происхождение вызвано собственным испарением молибденового контейнера при высокой температуре:
и взаимодействием расплава с материалом контейнера с образованием газообразных оксидов молибдена, находящихся в следующих равновесиях:На основании установленного состава газовой фазы над расплавом системы CaO–TiO2 были рассчитаны парциальные давления молекулярных форм пара по уравнению Герца–Кнудсена, записанному в следующем виде [60]:
(11)
${{p}_{i}} = {{K}_{{\alpha }}}\frac{{{{m}_{i}}}}{{{{s}_{{or}}}{{C}_{{or}}}t}}\sqrt {\frac{{2{\pi }RT}}{{{{M}_{i}}}}} ,$Рассчитанные парциальные давления компонентов газовой фазы над расплавом системы CaO–TiO2 для случая температуры 2278 ± 10 K с погрешностью, не превышающей 10%, приведены в табл. 3. Парциальные давления атомарного кислорода (табл. 4), определенные по соотношению (11), удовлетворительно соответствовали рассчитанным из термохимических данных [39] о константах равновесия Kr(T) возможных реакций (1), (2), (3), (5) и (10), протекающих в газовой фазе над расплавом по следующим соотношениям:
(13)
${{p}_{{\text{O}}}} = \frac{{{{p}_{{{\text{Ti}}{{{\text{O}}}_{2}}}}}}}{{{{p}_{{{\text{TiO}}}}}}}{{K}_{2}}(T),$(16)
${{p}_{{\text{O}}}} = \frac{{{{p}_{{{\text{Mo}}{{{\text{O}}}_{3}}}}}}}{{{{p}_{{{\text{Mo}}{{{\text{O}}}_{2}}}}}}}{{K}_{{10}}}(T),$Таблица 3.
Парциальные давления (атм)компонентов газовой фазы над расплавами системы CaO–TiO2 при температуре 2278 K
| ${{x}_{{{\text{Ti}}{{{\text{O}}}_{{\text{2}}}}}}}$, мол. % | ${{p}_{{{\text{Ca}}}}}$ | ${{p}_{{{\text{CaO}}}}}$ | ${{p}_{{{\text{Ti}}}}}$ | ${{p}_{{{\text{TiO}}}}}$ | ${{p}_{{{\text{Ti}}{{{\text{O}}}_{2}}}}}$ | ${{p}_{{\text{O}}}}$ × × 107 | ${{p}_{{{{{\text{O}}}_{2}}}}}$ × × 109 | ${{p}_{{{\text{CaTi}}{{{\text{O}}}_{3}}}}}$ × × 109 | ${{p}_{{{\text{Mo}}{{{\text{O}}}_{2}}}}}$ × × 107 | ${{p}_{{{\text{Mo}}{{{\text{O}}}_{3}}}}}$ × × 108 |
|---|---|---|---|---|---|---|---|---|---|---|
| 37.91 | 2.33 × 10–5 | 3.07 × 10–8 | 3.19 × 10–10 | 2.88 × 10–7 | 6.62 × 10–7 | 4.62 | 12.40 | 8.42 | 11.1 | 16.50 |
| 40.02 | 1.66 × 10–5 | 1.80 × 10–8 | 8.23 × 10–10 | 6.23 × 10–7 | 1.23 × 10–6 | 3.92 | 8.25 | 9.46 | 7.85 | 9.80 |
| 43.15 | 1.03 × 10–5 | 9.68 × 10–9 | 2.18 × 10–9 | 1.30 × 10–6 | 2.41 × 10–6 | 3.29 | 5.88 | 9.63 | 5.64 | 5.72 |
| 46.66 | 6.37 × 10–6 | 5.41 × 10–9 | 4.86 × 10–9 | 2.46 × 10–6 | 3.95 × 10–6 | 2.89 | 4.34 | 8.56 | 4.23 | 3.91 |
| 50.00 | 4.19 × 10–6 | 3.02 × 10–9 | 7.51 × 10–9 | 3.86 × 10–6 | 5.41 × 10–6 | 2.72 | 3.99 | 7.27 | 3.84 | 3.17 |
| 53.75 | 2.75 × 10–6 | 2.03 × 10–9 | 9.98 × 10–9 | 4.72 × 10–6 | 6.91 × 10–6 | 2.66 | 3.94 | 5.98 | 3.88 | 3.08 |
| 57.81 | 1.83 × 10–6 | 1.32 × 10–9 | 1.17 × 10–8 | 5.45 × 10–6 | 8.43 × 10–6 | 2.72 | 3.88 | 4.96 | 3.88 | 3.28 |
| 62.38 | 1.26 × 10–6 | 9.50 × 10–10 | 1.34 × 10–8 | 6.62 × 10–6 | 1.01 × 10–5 | 2.77 | 4.18 | 4.14 | 3.99 | 3.57 |
| 65.18 | 1.01 × 10–6 | 8.20 × 10–10 | 1.42 × 10–8 | 7.56 × 10–6 | 1.11 × 10–5 | 2.83 | 4.37 | 3.74 | 4.26 | 3.68 |
| 69.28 | 7.39 × 10–7 | 6.02 × 10–10 | 1.53 × 10–8 | 8.40 × 10–6 | 1.26 × 10–5 | 2.91 | 4.79 | 3.21 | 4.41 | 4.06 |
| 75.18 | 4.48 × 10–7 | 3.78 × 10–10 | 1.64 × 10–8 | 9.89 × 10–6 | 1.50 × 10–5 | 3.06 | 5.13 | 2.43 | 4.73 | 4.67 |
| 79.64 | 2.84 × 10–7 | 2.55 × 10–10 | 1.73 × 10–8 | 1.06 × 10–5 | 1.68 × 10–5 | 3.16 | 5.52 | 1.78 | 5.17 | 5.12 |
| 83.14 | 1.84 × 10–7 | 1.65 × 10–10 | 1.77 × 10–8 | 1.10 × 10–5 | 1.79 × 10–5 | 3.22 | 5.57 | 1.25 | 5.38 | 5.43 |
| 87.16 | 1.00 × 10–7 | 9.62 × 10–11 | 1.91 × 10–8 | 1.11 × 10–5 | 1.90 × 10–5 | 3.28 | 5.56 | 0.74 | 5.60 | 5.61 |
| 93.15 | 3.04 × 10–8 | 2.78 × 10–11 | 2.07 × 10–8 | 1.24 × 10–5 | 2.09 × 10–5 | 3.38 | 5.82 | 0.25 | 5.74× | 6.30 |
Таблица 4.
Парциальные давления пара атомарного кислорода (рО × 107 ) над расплавами системы CaO–TiO2 при температуре 2278 K, рассчитанные по соотношениям (11) –(16)
| ${{x}_{{{\text{Ti}}{{{\text{O}}}_{{\text{2}}}}}}}$, мол. % | (11) | (12) | (13) | (14) | (15) | (16) |
|---|---|---|---|---|---|---|
| 37.91 | 4.62 | 4.70 | 4.42 | 4.83 | 4.82 | 4.76 |
| 40.02 | 3.92 | 3.88 | 3.80 | 4.05 | 3.93 | 3.99 |
| 43.15 | 3.29 | 3.37 | 3.55 | 3.20 | 3.32 | 3.24 |
| 46.66 | 2.89 | 3.047 | 3.07 | 2.71 | 2.85 | 2.95 |
| 50.00 | 2.72 | 2.58 | 2.69 | 2.75 | 2.73 | 2.64 |
| 53.75 | 2.66 | 2.63 | 2.81 | 2.53 | 2.72 | 2.54 |
| 57.81 | 2.72 | 2.57 | 2.96 | 2.49 | 2.69 | 2.70 |
| 62.38 | 2.77 | 2.70× | 2.91 | 2.64 | 2.80 | 2.85 |
| 65.18 | 2.83 | 2.90× | 2.81 | 2.85 | 2.86 | 2.76 |
| 69.28 | 2.91 | 2.91 | 2.88 | 2.94 | 3.00 | 2.94 |
| 75.18 | 3.06 | 3.01 | 2.92 | 3.22 | 3.10 | 3.16 |
| 79.64 | 3.16 | 3.21 | 3.05 | 3.27 | 3.21 | 3.16 |
| 83.14 | 3.22 | 3.21 | 3.13 | 3.31 | 3.23 | 3.22 |
| 87.16 | 3.28 | 3.43 | 3.28 | 3.11 | 3.23 | 3.20 |
| 93.15 | 3.38 | 3.27 | 3.24 | 3.19 | 3.30 | 3.50 |
Значения активностей оксидов в расплавах системы CaO–TiO2 были рассчитаны на основании соотношений Льюиса [62]:
(17)
${{a}_{{{\text{CaO}}}}} = \frac{{{{p}_{{{\text{CaO}}}}}}}{{p_{{{\text{CaO}}}}^{ \circ }}} = \frac{{{{p}_{{{\text{Ca}}}}}{{p}_{{\text{O}}}}}}{{p_{{{\text{Ca}}}}^{ \circ }p_{{\text{O}}}^{ \circ }}},$(18)
${{a}_{{{\text{Ti}}{{{\text{O}}}_{{\text{2}}}}}}} = \frac{{{{p}_{{{\text{Ti}}{{{\text{O}}}_{{\text{2}}}}}}}}}{{p_{{{\text{Ti}}{{{\text{O}}}_{{\text{2}}}}}}^{ \circ }}} = \frac{{{{p}_{{{\text{TiO}}}}}{{p}_{{\text{O}}}}}}{{p_{{{\text{TiO}}}}^{ \circ }p_{{\text{O}}}^{ \circ }}},$(20)
$\ln {{a}_{{{\text{Ti}}{{{\text{O}}}_{2}}}}} = - \int {{{x}_{{{\text{CaO}}}}}d\ln \frac{{{{p}_{{{\text{CaO}}}}}}}{{{{p}_{{{\text{Ti}}{{{\text{O}}}_{2}}}}}}}} .$На основании протекания газофазных реакций (1) и (2) соотношение (20) можно было преобразовать к следующему виду:
(21)
$\ln {{a}_{{{\text{Ti}}{{{\text{O}}}_{2}}}}} = - \int {{{x}_{{{\text{CaO}}}}}d\ln \frac{{{{p}_{{{\text{Ca}}}}}{{p}_{{\text{O}}}}}}{{{{p}_{{{\text{TiO}}}}}{{p}_{{\text{O}}}}}}} = - \int {{{x}_{{{\text{CaO}}}}}d\ln \frac{{{{p}_{{{\text{Ca}}}}}}}{{{{p}_{{{\text{TiO}}}}}}}} ,$(22)
$\ln {{a}_{{{\text{Ti}}{{{\text{O}}}_{2}}}}} = - \int {{{x}_{{{\text{CaO}}}}}d\ln \frac{{{{I}_{{{\text{Ca}}}}}}}{{{{I}_{{{\text{TiO}}}}}}}} $(23)
$\ln {{a}_{{{\text{CaO}}}}} = - \int {\frac{{{{x}_{{{\text{Ti}}{{{\text{O}}}_{{\text{2}}}}}}}}}{{{{x}_{{{\text{CaO}}}}}}}d\ln {{a}_{{{\text{Ti}}{{{\text{O}}}_{{\text{2}}}}}}}} .$Определенные по соотношениям (22) и (23) значения активностей оксидов в расплавах системы CaO–TiO2 для случая температуры 2278 K сопоставлены в табл. 5, из которой можно заметить их удовлетворительное совпадение с найденными независимым способом по соотношениям (17) и (18).
Таблица 5.
Активности оксидов в расплавах системы CaO–TiO2 при температуре 2278 K, рассчитанные по соотношениям (17), (18), (22) и (23)
| ${{x}_{{{\text{Ti}}{{{\text{O}}}_{{\text{2}}}}}}}$, мол. % | ${{a}_{{{\text{CaO}}}}}$, (17) | ${{a}_{{{\text{CaO}}}}}$, (23) | ${{a}_{{{\text{Ti}}{{{\text{O}}}_{{\text{2}}}}}}}$, (18) | ${{a}_{{{\text{Ti}}{{{\text{O}}}_{{\text{2}}}}}}}$, (22) |
|---|---|---|---|---|
| 37.91 | 2.46 × 10–1 | 2.27 × 10–1 | 2.92 × 10–2 | 3.34 × 10–2 |
| 40.02 | 1.49 × 10–1 | 1.51 × 10–1 | 5.45 × 10–2 | 5.34 × 10–2 |
| 43.15 | 7.73 × 10–1 | 7.87 × 10–2 | 1.07 × 10–1 | 1.04 × 10–1 |
| 46.66 | 4.20 × 10–2 | 4.15 × 10–2 | 1.74 × 10–1 | 1.77 × 10–1 |
| 50.00 | 2.60 × 10–2 | 2.60 × 10–2* | 2.39 × 10–1 | 2.38 × 10–1 |
| 53.75 | 1.69 × 10–2 | 1.68 × 10–2 | 3.04 × 10–1 | 3.05 × 10–1 |
| 57.81 | 1.14 × 10–2 | 1.12 × 10–2 | 3.72 × 10–1 | 3.77 × 10–1 |
| 62.38 | 7.96 × 10–3 | 7.66 × 10–3 | 4.45 × 10–1 | 4.55 × 10–1 |
| 65.18 | 6.53 × 10–3 | 6.24 × 10–3 | 4.90 × 10–1 | 5.02 × 10–1 |
| 69.28 | 4.92 × 10–3 | 4.71 × 10–3 | 5.58 × 10–1 | 5.69 × 10–1 |
| 75.18 | 3.13 × 10–3 | 3.14 × 10–3 | 6.65 × 10–1 | 6.62 × 10–1 |
| 79.64 | 2.05 × 10–3 | 2.19 × 10–3 | 7.42 × 10–1 | 7.29 × 10–1 |
| 83.14 | 1.45 × 10–4 | 1.55 × 10–3 | 7.91 × 10–1 | 7.80 × 10–1 |
| 87.16 | 8.92 × 10–4 | 9.27 × 10–4 | 8.41 × 10–1 | 8.37 × 10–1 |
| 93.15 | 2.55 × 10–4 | 2.75 × 10–4 | 9.22 × 10–1 | 9.17 × 10–1 |
| 100.00 | – | – | – | 1.00* |
Значения химических потенциалов (Δμi), парциальных энтальпий (ΔHi) и энтропий (ΔSi) оксидов в расплавах системы CaO–TiO2 были рассчитаны по известным соотношениям [64]:
(26)
$\Delta {{H}_{i}} = \frac{{d\left( {\frac{{\Delta {{\mu }_{i}}}}{T}} \right)}}{{d\left( {\frac{1}{T}} \right)}} = R\frac{{d\ln {{a}_{i}}}}{{d\left( {\frac{1}{T}} \right)}},$Рис. 4.
Химические потенциалы оксидов и энергия смешения (а), парциальные энтальпии оксидов и энтальпия образования (б) и парциальные энтропии оксидов и энтропия образования (в) расплавов в системе CaO–TiO2 при 2278 K; 1 – CaO, 2 – TiO2, 3 – интегральная термодинамическая характеристика (энергия смешения, энтальпия и энтропия образования расплавов). Вертикальной пунктирной линией обозначена граница области “CaO + жидкость” и расплава.

ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Определенные значения активностей CaO, TiO2 и CaTiO3 в расплавах системы CaO–TiO2 при температуре 2250 K сопоставлены на рис. 3 с полученными Столяровой и др. [54] и Банон и др. [48] для гетерогенных областей системы CaO–TiO2 при близких температурах – 2057 и 2150 K соответственно. Результаты [48] коррелируют с данными настоящей работы. Некоторое различие в величинах ${{a}_{{{\text{Ti}}{{{\text{O}}}_{{\text{2}}}}}}}$, как уже упоминалось выше, вероятно, обусловлено процедурами экстраполяции информации [48] для составов тройной системы CaTiO3–Ti2O3–TiO2, что могло снизить их точность. Наблюдаемое в [48] поведение активности TiO2 в расплавах в области концентраций, близкой к рутилу, возможно, и свидетельствует о некоторой несмешиваемости расплава, что следует из наблюдаемого перегиба концентрационной зависимости ${{a}_{{{\text{Ti}}{{{\text{O}}}_{{\text{2}}}}}}}$ (рис. 3, линия 3) и близости к постоянным величинам концентрационных зависимостей ${{p}_{{{\text{Ti}}}}}$, ${{p}_{{{\text{TiO}}}}}$, ${{p}_{{{\text{Ti}}{{{\text{O}}}_{2}}}}}$, ${{p}_{{\text{O}}}}$ и ${{p}_{{{{{\text{O}}}_{2}}}}}$ (табл. 3), полученных в настоящей работе. Однако, на наш взгляд, поведение активностей TiO2 и CaTiO3 (рис. 3, линии 4 и 6) более близко к идеальному. Максимальное значение ${{a}_{{{\text{CaTi}}{{{\text{O}}}_{{\text{3}}}}}}}$ соответствует области составов, близких к перовскиту (рис. 3, линии 5 и 6). Различия со значениями ${{a}_{{{\text{CaO}}}}}$ из [54] (рис. 3, точки 1) вызваны, по-видимому, их низкой точностью.
Представленные на рис. 4 парциальные и интегральные термодинамические зависимости, характеризующие расплавы системы CaO–TiO2, показывают их симбатность. Энтальпии и энтропии образования расплавов положительны. Экстремальные величины интегральных термодинамических свойств расплавов находятся в концентрационной области, близкой к составу перовскита, что подтверждает его устойчивость в расплаве. Некоторое смещение экстремума интегральных термодинамических функций в расплавах системы CaO–TiO2, подобное таковому для расплавов системы CaO–SiO2 [65], может быть вызвано наличием в расплаве оксидных соединений с большим количеством CaO по сравнению с перовскитом CaTiO3.
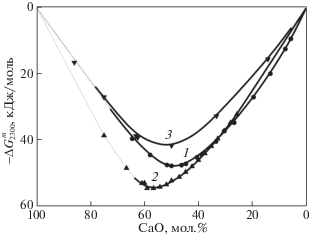
Сопоставление энергии смешения в расплавах системы CaO–TiO2 при температуре 2300 K с таковыми для систем CaO–SiO2 [65] и CaO–Al2O3 [66], представленное на рис. 5, свидетельствует о более сильном химическом взаимодействии в расплаве системы CaO–TiO2 по сравнению с расплавом системы CaO–Al2O3, однако меньшую, чем в расплаве системы CaO–SiO2, что проявляется в более положительных величинах энергии смешения расплава.
Таким образом, в настоящей работе высокотемпературным масс-спектрометрическим эффузионным методом Кнудсена двумя независимыми подходами определены активности оксидов в расплавах системы CaO–TiO2 в области температур 2241–2441 K. На основании полученных данных рассчитаны термодинамические свойства кальциево-титанатных расплавов – химические потенциалы оксидов и энергии смешения в расплавах, а также парциальные и интегральные энтальпии и энтропии образования расплавов из индивидуальных оксидов. Полученная экспериментальная информация свидетельствует о симбатности поведения найденных термодинамических функций, характеризующих расплавы системы, а также о возможной несмешиваемости расплавов системы CaO–TiO2 в области, близкой к TiO2, что уже было отмечено ранее. Экстремальные величины интегральных термодинамических свойств расплавов находятся в концентрационной области, близкой к составу перовскита, что подтверждает его устойчивость в расплаве. Смещение экстремума интегральных термодинамических функций в расплавах системы CaO–TiO2 может быть вызвано наличием в расплаве оксидных соединений с большим количеством CaO по сравнению с перовскитом CaTiO3.
Автор искренне благодарен О.И. Яковлеву (Институт геохимии и аналитической химии им. В.И. Вернадского РАН) за постоянное внимание и полезное обсуждение при написании настоящей публикации и М.А. Назарову (Институт геохимии и аналитической химии им. В.И. Вернадского РАН) за поддержку, оказанную автору при выполнении настоящей работы.
Работа выполнена при финансовой поддержке Программы № 7 Президиума РАН “Экспериментальные и теоретические исследования объектов Солнечной системы и планетных систем звезд. Переходные процессы в астрофизике” и Российского фонда фундаментальных исследований (код проекта № 19-05-00801A).
Список литературы
Coontz R. // Sci. 2013. V. 342. № 6165. P. 1438.
Umezu S., Kakiuchi F. // Nippon Kogyo Kwaisi. 1930. V. 46. № 546. P. 866.
Parga Pondal I., Bergt K. // Anal. Soc. Espan. Fis. Quim. 1933. V. 31. P. 623.
Ершов Л.Д. Изучение состава и свойств титанатов кальция и получение титанистого цемента // Тр. Гипроцемента. 1940. № 1. С. 5–31.
Wartenberg H.V., Reusch H.J., Saran E. // Z. Anorg. Allg. Chem. 1937. V. 230. № 3. P. 257.
Tanaka Y. // J. Chem. Soc. Japan. 1940. V. 61. № 4. P. 345.
Мамыкин П.С., Лошкарев Б.А. // Огнеупоры. 1950. Т. 15. № 5. С. 215–221.
Coughanour L.W., Roth R.S., DeProsse V.A. // J. Res. NBS. 1954. V. 52. № 1. P. 37.
Бережной А.С. // Огнеупоры. 1950. Т. 15. № 8. С. 350.
DeVries R.C., Roy R., Osborn E.F. // J. Phys. Chem. 1954. V. 58. № 12. P. 1069.
Roth R.S. // J. Res. NBS. 1958. V. 61. № 5. P. 437.
Jongejan A., Wilkins A.L. // J. Less-Comm. Met. 1970. V. 20. № 4. P. 273.
Imlach J.A., Glasser F.P. // Trans. Brit. Ceram. Soc. 1968. V. 67. № 3. P. 581.
Kimura S., Muan A. // Amer. Miner. 1971. V. 56. № 7–8. P. 1332.
Shultz R.L. // J. Amer. Ceram. Soc. 1973. V. 56. № 1. P. 33.
Tulgar H.E. // Istanbul Tek. Univ. Bull. 1976. V. 29. № 1. P. 111.
Лимарь Т.Ф., Кисель Н.Г., Чередниченко И.Ф., Савоськина А.И. // Журн. неорган. химии. 1972. Т. 17. № 2. С. 559.
Кисель Н.Г., Лимарь Т.Ф., Чередниченко И.Ф. // Там же. 1972. Т. 8. № 10. С. 1782.
Pfaff G. // J. Eur. Ceram. Soc. 1992. V. 9. № 4. P. 293.
Савенко В.Г., Сахаров В.В. // Журн. неорган. химии. 1979. Т. 24. № 5. С. 138.
Борисенко А.И., Широкова П.В. // Там же. 1956. Т. 1. № 4. С. 615.
Bright N.F.H., Rowland J.F., Wurm J.G. // Can. J. Chem. 1958. V. 36. № 3. P. 492.
Dring K. Electrochemical Reduction of Titanium Dioxide in Molten Calcium Chloride / Thesis. L.: University of London, 2005. 190 p.
Jacob K.T., Gupta S. // Bull. Mater. Sci. 2009. V. 32. № 6. P. 611.
Suzuki R.O., Noguchi H., Hada H., Natsui S., Kikuchi T. // Mater. Trans. 2017. V. 58. № 3. P. 341.
Ceh M., Kolar D. // J. Mater. Sci. 1994. V. 29. № 23. P. 6295.
Гребенщиков Р.Г., Торопов Н.А. // Докл. АН СССР. 1964. Т. 158. № 3. С. 710.
Reznitskii L.A., Filippova S.E. // Russ. J. Phys. Chem. 2002. V. 76. № 9. P. 1389.
Yokokawa H., Kawada T., Dokiya M. // J. Amer. Ceram. Soc. 1989. V. 72. № 1. P. 152.
Udayakumar K.R., Cormack A.N. // J. Phys. Chem. Solids. 1989. V. 50. № 1. P. 55.
Ramadan A.H.H., Hesselmann L., De Souza R.A. // J. Phys. Chem. Solids. 2015. V. 86. P. 90.
Glasser L. // Inorg. Chem. 2017. V. 56. № 15. P. 8920.
Lazaro S.R. Estudo teorico-experimental do titanato de calcio – CaTiO3 / Thesis. Sao Carlos: Universidade Estadual Paulista, Intituto de Quimica, 2002. 57 p.
Pontes F.M., Pinheiro C.D., Longo E. et al. // Mater. Chem. & Phys. 2003. V. 78. № 1. P. 227.
Seko A., Hayashi H., Kashima H., Tanaka I. // Phys. Rev. Mater. 2018. V. 2. № 1. P. 13805-1.
Oganov A.R., Ma Y., Lyakhov A.O. et al. // Rev. Miner. Geochem. 2010. V. 71. P. 271.
Gong W., Wu L., Navrotsky A. // J. Amer. Ceram. Soc. 2018. V. 101. № 3. P. 1361.
Brauer G., Littke W. // J. Inorg. Nucl. Chem. 1960. V. 16. № 1. P. 67.
Глушко В.П., Гурвич Л.В., Бергман Г.А. и др. Термодинамические свойства индивидуальных веществ. Справочник / Под ред. В.П. Глушко. М.: Наука, 1978–1982.
Manara D., Bohler R., Capriotti L. et al. // J. Eur. Ceram. Soc. 2014. V. 34. № 6. P. 1623.
Shornikov S.I. // Russ. J. Phys. Chem. A. 2019. V. 93. № 6. P. 866.
Shornikov S.I. //Ibid. 2019. V. 93. № 8. P. 1428.
King E.G. // J. Amer. Chem. Soc. 1955. V. 77. № 4. P. 2150.
Todd S.S., Kelley K.K. // U. S. Bur. Min. Repts. 1956. № 5193. 13 p.
Jacob K.T., Abraham K.P. // J. Chem. Thermodyn. 2009. V. 41. № 6. P. 816.
Cho S.-W., Suito H. // Met. Mater. Trans. A. 1994. V. 25. № 2. P. 5.
Kishi M., Suito H. // Steel Res. 1994. V. 65. № 7. P. 261.
Banon S., Chatillon C., Allibert M. // Can. Met. Q. 1981. V. 20. № 1. P. 79.
Archakov I.Yu., Shornikov S.I., Tchemekova T.Yu., Shultz M.M. // Proc. 9th World Conf. on Titanium. Ed. by I.V. Gorynin and S.S. Ushkov. Saint-Petersburg: CRISM “Prometey”, 2000. V. 3. P. 1464.
Shornikov S.I., Archakov I.Yu., Shultz M.M. // Ibid. 2000. V. 3. P. 1469.
Shornikov S.I., Archakov I.Yu. // Proc. II Intern. Symp. on High Temperature Mass Spectrometry. Ed. by L. Kudin, M. Butman, A. Smirnov. Ivanovo: ISUCST, 2003. P. 112–116.
Казенас Е.К., Цветков Ю.В. Испарение оксидов. М.: Наука, 1997. 543 с.
Belton G.R., Fruehan R.J. // Met. Trans. B. 1971. V. 2. № 1. P. 291.
Stolyarova V.L., Zhegalin D.O., Stolyar S.V. // Russ. Glass Phys. Chem. 2004. V. 30. № 2. P. 142.
Zhang J., Huang S., Davis A.M. et al. // Geochim. Cosmochim. Acta. 2014. V. 140. P. 365.
Shornikov S.I., Archakov I.Yu., Chemekova T.Yu. // Russ. J. Phys. Chem. 2000. V. 74. № 5. P. 677.
Сидоров Л.Н., Коробов М.В., Журавлева Л.В. Масс-спектральные термодинамические исследования. М.: Изд-во МГУ, 1985. 208 с.
Warren J.W. // Nature. 1950. V. 165. № 4203. P. 810.
Гурвич Л.В., Карачевцев Г.В., Кондратьев В.Н. и др. Энергии разрыва химических связей. Потенциалы ионизации и сродство к электрону. M.: Наука, 1974. 351 с.
Shornikov S.I. // Geochem. Int. 2002. V. 40. Suppl. 1. P. S46.
Shornikov S.I. // Geochem. Int. 2015. V. 53. № 12. P. 1080.
Lewis G.N., Randall M. Thermodynamics and The Free Energy of chemical Substances. N. Y. and L.: McGrow-Hill book comp., 1923. 676 p.
Семенов Г.А., Николаев Е.Н., Францева К.Е. Применение масс-спектрометрии в неорганической химии . Л.: Химия, 1976. 152 с.
Prigogine I., Defay R. Chemical Thermodynamics. L.: Longman, 1954. 543 p.
Shornikov S.I., Archakov I.Yu. // Glastech. Ber. Glass. Sci. Technol. 2000. V. 73C2. P. 51.
Shornikov S.I., Stolyarova V.L., Shultz M.M. // Russ. J. Phys. Chem. 1997. V. 71. № 1. P. 19.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии