Журнал физической химии, 2021, T. 95, № 2, стр. 213-219
Самодиффузия производных фуллерена С60 в водных растворах и суспензиях эритроцитов по данным ямр с импульсным градиентом магнитного поля
И. А. Авилова a, Ю. В. Солдатова a, О. А. Краевая a, b, А. В. Жиленков a, Е. А. Долгих c, Р. А. Котельникова a, П. А. Трошин a, b, В. И. Волков a, d, *
a Российская академия наук, Институт проблем химической физики
Черноголовка, Россия
b Сколковский институт науки и технологий
Москва, Россия
c Московский государственный университет имени М.В. Ломоносова
Москва, Россия
d Российская академия наук, Научный центр в Черноголовке
Черноголовка, Россия
* E-mail: vitwolf@mail.ru
Поступила в редакцию 06.03.2020
После доработки 11.03.2020
Принята к публикации 16.03.2020
Аннотация
Один из принципиальных вопросов метаболизма – выявление механизма проницаемости веществ в биологические клетки. Интерес к водорастворимым производным фуллерена С60 связан с их высокой биологической активностью (адресная доставка лекарств, противовирусная и антибактериальная активность и т.д.). В качестве модели целевых мишеней выбраны клетки эритроцитов. Получены параметры, характеризующие молекулярную диффузию следующих водорастворимых производных фуллерена С60 в водных растворах и суспензии эритроцитов: пентазамещенное производное с присоединенными остатками меркаптопропионовой кислоты и пентазамещенное производное с присоединенными остатками пролина. Показано, что в суспензии эритроцитов производные фуллерена С60 находятся в виде изолированных и ассоциированных молекул в водной фазе или связаны с клеточной мембраной. Определены относительные доли и времена жизни молекул водорастворимых производных фуллеренов в клетках эритроцитов.
Молекулярный и ионный обмен в клеточных мембранах играет важную роль в процессах метаболизма в живых системах. Одной из основных характеристик биологических мембран является их избирательная проницаемость, природа которой может быть понята на основании исследования механизмов функционирования биомембран. Особый интерес представляет изучение проницаемости клеточных мембран для молекул биологически активных веществ, которая, как правило, определяется их взаимодействием с компонентами мембраны [1–7].
В ряду биологически активных веществ особое внимание привлекают водорастворимые производные фуллеренов (ВПФ) [8]. Эти соединения проявляют эффективную противовирусную активность [9–12], антибактериальные [13–15], нейропротекторные [16, 17] и противоопухолевые [14, 18, 19] свойства. Кроме этого, производные фуллеренов могут применяться в качестве носителей для целевой доставки лекарств в пораженные клетки [8, 20].
Основной особенностью молекулярной структуры водорастворимых производных фуллеренов является наличие в их составе гидрофильных компонент [21–23], что обусловливает их хорошую растворимость в воде и способность включаться в биологические мембраны или транспортироваться через них в клетки [24–28].
Таким образом, водорастворимые производные фуллеренов служат перспективными материалами для биомедицинских исследований и дальнейших фармакологических приложений. Поэтому изучение закономерностей взаимодействия молекул ВПФ с клеточными мембранами имеет особое значение для понимания механизмов их функционирования в биосистемах in vivo.
Удобной системой для исследования мембранотропных свойств водорастворимых производных фуллеренов служат эритроциты, поскольку они являются основным компонентом крови. Помимо этого, эритроцитарной мембране присущи общие принципы молекулярной организации биомембран.
ЯМР с импульсным градиентом магнитного поля (ЯМР ИГМП) – уникальный метод исследования механизмов молекулярного обмена в живых системах [29]. Этот метод позволяет непосредственно количественно охарактеризовать молекулярную диффузию в биологических клетках [29–34]. В частности, в нашей предыдущей работе была изучена самодиффузия молекул пентазамещенного производного фуллерена С60 с присоединенными остатками 3-меркаптопропансульфоновой кислоты C60[S(CH2)3SO3Na]5H в эритроцитах, тенях эритроцитов и липосомах [35]. Было показано, что молекулы C60[S(CH2)3SO3Na]5H фиксируются на поверхности мембран эритроцитов, определена их доля и время жизни в мембране.
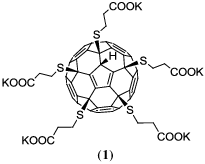
Данная работа представляет собой продолжение этих исследований. Будут рассмотрены следующие водорастворимые производные фуллерена С60: пентазамещенное производное с присоединенными остатками меркаптопропионовой кислоты
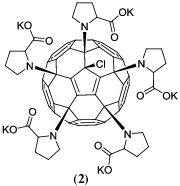
и пентазамещенное производное с присоединенными остатками пролинаРанее было показано, что аналог соединения 1 способствует пролиферации нейральных стволовых клеток in vitro и приводит к восстановлению нарушенных в результате повреждения центральной нервной системы двигательных функций in vivo (на модели рыб Данио) [17]. Cоединение 2 обладает противоопухолевым действием и способно снижать выживаемость клеток немелкоклеточной карциномы легкого (A549) [36].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Исследуемые водорастворимые производные фуллеренов (соединения 1 и 2) были синтезированы согласно предложенным ранее методикам [15, 36]. Концентрация этих соединений составила 8 × 10–3 М и 10–2 М в водных растворах и в суспензии эритроцитов соответственно.
Получение эритроцитов осуществляли по стандартной методике [37]. Для проведения ЯМР-исследований эритроцитарную суспензию дополнительно отстаивали в течение 4 ч, затем отбирали осевшие эритроциты [34, 35].
Самодиффузия молекул производных фуллерена С60 исследовалась методом ЯМР с импульсным градиентом магнитного поля. Измерения проводились на импульсном спектрометре ЯМР с фурье-преобразованием Bruker Avance-III-400 WB, оснащенном датчиком импульсного градиента магнитного поля, на ядрах 1Н на частоте 400.22 МГц. Для измерения коэффициентов самодиффузии (КСД) использовали импульсную последовательность “стимулированное эхо”, представленную на рис. 1 [33–35]. В ходе экспериментов регистрировался спад сигнала спинового эха с увеличением амплитуды импульсного градиента g при постоянных временах задержки между РЧ-импульсами и длительности градиентного импульса (диффузионное затухание). Для анализа диффузионных затуханий использовались интегральные интенсивности линий ЯМР исследуемых молекул в фурье-спектрах эха.
Рис. 1.
Трехимпульсная последовательность “стимулированное эхо” с импульсным градиентом магнитного поля: δ – длительность импульсного градиента магнитного поля, g – амплитуда импульсного градиента магнитного поля, τ и τ1 – интервалы между радиочастотными импульсами, Δ – интервал между импульсами градиента магнитного поля.
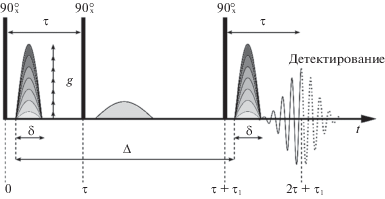
Параметры экспериментов в водных растворах: δ = 1 мс, максимальная амплитуда g = 5 Тл/м, Δ варьировался от 20 до 1000 мс, число точек в диффузионном затухании составляло 32 или 64.
Параметры экспериментов в суспензии эритроцитов: δ = 1 мс, максимальная амплитуда g = = 11 Тл/м, Δ варьировался от 10 до 300 мс, число точек в диффузионном затухании = 64.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
На рис. 2 представлены спектры водного раствора соединения 1 (а), суспензии эритроцитов (б) и суспензии эритроцитов с водным раствором соединения 1 (в). Спектры водного раствора соединения 2, суспензии эритроцитов и эритроцитов с соединением 2 показаны на рис. 3.
Рис. 2.
Спектры 1Н: а – водный раствор соединения 1 (2.51 м.д. – 10Н, м., –СН2-СООK; 2.75–3.60 м.д. – 10Н, м., –СН2–S); б – суспензия эритроцитов (0–1.70 м.д. – (СН2)n- и СН3-группы липидов, 6–9 м.д. – белковая компонента (протоны ароматических колец, NH- и ОН-групп); в – суспензия эритроцитов с введенным соединением 1.
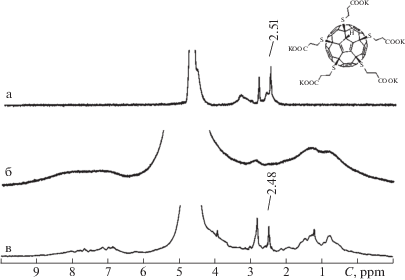
Рис. 3.
Спектры 1Н: а – водный раствор соединения 2 (4.08–4.14 ppm – 5H, м., –CH–; 3.28–3.52 – 10H, м., –CH2–N-; 2.29–2.48 и 1.95–2.12 – 10H, м., –CH2–СН-; 1.96–2.26 – 10Н, м., –CH2–CH2–CH2-); б – суспензия эритроцитов (0–1.70 ppm – (СН2)n и СН3-группы липидов, 6–9 ppm – белковая компонента (ароматические группы, NH- и ОН-группы)); в – суспензия эритроцитов с введенным соединением 2.
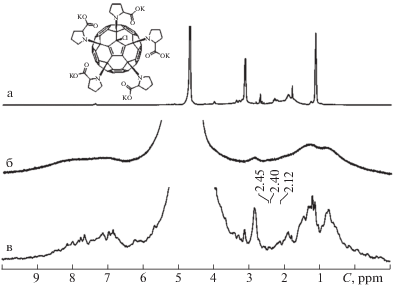
При введении производных фуллерена С60 в эритроциты наблюдается изменение их 1Н химических сдвигов, что предположительно объясняется межмолекулярным взаимодействием данных соединений с компонентами клеток эритроцитов. Анализ сигналов спинового эхо исследуемых систем, полученных при различных значениях амплитуды градиентного импульса g, показал, что компоненты соединений 1 и 2 могут быть однозначно выделены из спектров.
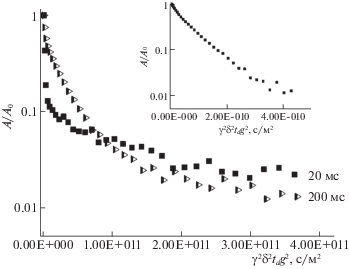
Для получения информации о трансляционной подвижности молекул производных фуллерена С60 в водных растворах и суспензии эритроцитов были зарегистрированы и проанализированы диффузионные затухания (ДЗ) сигнала спинового эхо на ядрах 1Н при различных временах диффузии td = Δ – δ/3. На рис. 4 представлены диффузионные затухания для соединения 1 в суспензии эритроцитов при временах диффузии td 10 и 300 мс. На рис. 5 – диффузионные затухания для соединения 2 в суспензии эритроцитов при временах диффузии td 20 и 200 мс. Диффузионные затухания молекул производных фуллерена С60 в водных растворах (td = 20 мс) показаны во вставках.
Рис. 4.
Диффузионные затухания спинового эхо на ядрах 1Н при различных временах диффузии td = Δ – δ/3 (указаны на рисунке) молекул соединения 1 в суспензии эритроцитов. На вставке показаны ДЗ молекул соединения 1 в водном растворе.
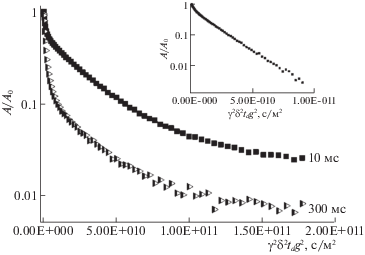
Рис. 5.
Диффузионные затухания спинового эхо на ядрах 1Н при различных временах диффузии td = Δ – δ/3 (указаны на рисунке) молекул соединения 2 в суспензии эритроцитов. На вставке показаны ДЗ соединения 2 в водном растворе.
Полученные диффузионные затухания носят сложный характер и описываются уравнением для многофазной системы, представляющим собой сумму экспоненциальных компонент [33–35, 38]:
(1)
$A(g) = \frac{{A(2\tau ,{{\tau }_{1}},g)}}{{A(2\tau ,{{\tau }_{1}},0)}} = \sum\limits_{i = 1}^m {p_{i}^{'}\exp ( - {{\gamma }^{2}}{{g}^{2}}{{\delta }^{2}}{{t}_{d}}{{D}_{{si}}})} ,$В водных растворах ДЗ производных фуллерена С601 и 2 носят двухэкспоненциальный характер с коэффициентами самодиффузии $D_{{s1}}^{{\text{в}}}$ и $D_{{s2}}^{{\text{в}}}$. В то время как, в суспензии эритроцитов появляется дополнительная третья компонента с коэффициентами самодиффузии $D_{{s3}}^{{\text{c}}}$ = (5 ± 1) × 10–12 м2/с и (6 ± 1) × 10–12 м2/с для соединений 1 и 2, соответственно. Таким образом, подвижность молекул производных фуллерена С60 в водных растворах характеризуется двумя коэффициентами самодиффузии $D_{{s1}}^{{\text{в}}}$ и $D_{{s2}}^{{\text{в}}}$, а в суспензии – тремя $D_{{s1}}^{{\text{c}}}$, $D_{{s2}}^{{\text{c}}}$ и $D_{{s3}}^{{\text{c}}}$ (табл. 1).
Таблица 1.
Коэффициенты самодиффузии производных фуллерена С60 в водных растворах и суспензии эритроцитов
| Соединение | Водный раствор | Суспензия эритроцитов | |||
|---|---|---|---|---|---|
| $D_{{s1}}^{{\text{в}}}$ × 1010, м2/с | $D_{{s2}}^{{\text{в}}}$ × 1011, м2/с | $D_{{s1}}^{{\text{c}}}$ × 1010, м2/с | $D_{{s2}}^{{\text{c}}}$ × 1011, м2/с | $D_{{s3}}^{{\text{c}}}$ × 1012, м2/с | |
| 1 | 4.3 ± 0.8 | 7.5 ± 1.5 | 7.1 ± 1.4 | 4.4 ± 0.9 | 5 ± 1 |
| 2 | 1.2 ± 0.1 | 4.9 ± 0.5 | 8 ± 1 | 3.8 ± 0.6 | 6 ± 1 |
Как видно из табл. 1, коэффициенты самодиффузии $D_{{s1}}^{{\text{в}}}$, $D_{{s2}}^{{\text{в}}}$ и $D_{{s1}}^{{\text{c}}}$, $D_{{s2}}^{{\text{c}}}$ в водных растворах и суспензии эритроцитов близки. Большее значение коэффициентов $D_{{s1}}^{{\text{c}}}$ в суспензии, по сравнению с водными растворами, по-видимому, связано с частичным перекрыванием сигналов протонов молекул воды и регистрируемого сигнала, что, в свою очередь, приводит к возрастанию компонента $D_{{s1}}^{{\text{c}}}$.
Наличие биэкспоненциальности диффузионного затухания в водных растворах производных фуллерена С60 связывают с образованием ассоциатов [39, 40]. В этом случае, наибольший коэффициент самодиффузии $D_{{s1}}^{{\text{в}}}$ соответствует изолированным молекулам, а $D_{{s2}}^{{\text{в}}}$ ассоциированным молекулам ВПФ.
Исходя из соотношения Стокса–Эйнштейна были рассчитаны гидродинамические радиусы изолированных молекул и ассоциатов:
где k – постоянная Больцмана 1.3806 × 10–23 Дж/K, Т – температура в Кельвинах, η – вязкость растворителя при температуре Т, rН – гидродинамический радиус частицы.Гидродинамические радиусы производных фуллерена С60 в водных растворах, составили dH1 = 1.0 ± 0.2 нм и dH2 = 5.0 ± 1.0 нм для соединения 1; dH1 = 1.1 ± 0.1 нм и dH2 = 7.4 ± 0.4 нм для соединения 2. Таким образом, в водных растворах исследуемые производные фуллерена С60 находятся в виде изолированных молекул с диаметром dH1 и ассоциированных молекул, характеризуемых диаметром dH2.
Как отмечалось ранее (табл. 1), в отличие от водных растворов, в суспензии эритроцитов подвижность молекул соединений 1 и 2 характеризуется тремя коэффициентами самодиффузии. Наименьший КСД $D_{{s3}}^{{\text{c}}}$ практически совпадает с коэффициентом латеральной диффузии липидов в мембране эритроцитов (≈7 × 10–12 м2/с). Два других коэффициента самодиффузии близки к КСД молекул соединений 1 и 2 в чистых водных растворах. Это позволяет сделать вывод, что в суспензии эритроцитов молекулы производных фуллерена С60 находятся в изолированном и ассоциированном виде в водной фазе, а также связаны с эритроцитарной мембраной.
Благодаря наличию проницаемости мембран эритроцитов, между молекулами производных фуллерена С60, связанных с мембраной и находящихся в водной фазе, существует обмен. Количественную информацию об обменных процессах можно получить из анализа зависимости населенности р3 (относительной доли производной фуллерена в эритроцитах) от времени диффузии td. Как показано на рис. 6, эта зависимость хорошо аппроксимируется соотношением (3) [38, 39, 41]:
где τ – время жизни молекулы производной фуллерена C60 в клетке эритроцита.Рис. 6.
Зависимости относительных долей р3 молекул соединений 1 и 2 в суспензии эритроцитов от времени диффузии td.
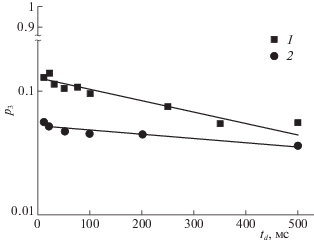
Величины τ составили 470 ± 70 мс и 1200 ± 300 мс для соединений 1 и 2, соответственно. Коэффициенты самодиффузии $D_{{s3}}^{{\text{c}}}$, относительные доли р3 и времена жизни τ молекул производных фуллерена С60 в эритроцитах представлены в табл. 2. Для сопоставления в этой таблице приведены аналогичные данные для производного фуллерена С60 с присоединенными остатками 3-меркаптопропансульфоновой кислоты C60[S(CH2)3SO3Na]5H (соединение 3), полученные нами ранее [35].
Таблица 2.
Коэффициенты самодиффузии $D_{{s3}}^{{\text{c}}}$, относительные доли р3 и времена жизни τ молекул производных фуллерена С60 в эритроцитах
| Соединение | $D_{{s3}}^{{\text{c}}}$ × 1012, м2/c | р3(0) | τ, мс |
|---|---|---|---|
| 1 | 5 ± 1 | 0.13 | 470 ± 70 |
| 2 | 6 ± 1 | 0.06 | 1200 ± 300 |
| 3 | 5 ± 1 | 0.33 | 440 ± 70 |
Таким образом, методом ЯМР ИГМП, выявлена способность молекул производных фуллерена С60, проникать в биологические мембраны. Определены парциальные коэффициенты самодиффузии молекул ВПФ в эритроцитах. Установлено, что в суспензии эритроцитов молекулы ВПФ находятся в виде изолированных и ассоциированных молекул в водной фазе или связаны с клеточной мембраной. Оценено время обмена молекул ВПФ между мембраной эритроцитов и водным раствором.
Результаты исследования пентазамещенного производного фуллерена С60 с присоединенными остатками пролина выполнены при финансовой поддержке РФФИ в рамках научного проекта № 18-32-00815. ЯМР измерения выполнены с использованием оборудования АЦКП ИПХФ РАН при поддержке государственного задания ИПХФ РАН (№ гос. регистрации 0089-2019-0010/№ AAAA-A19-119071190044-3).
Список литературы
Baker G.F., Rogers H.J. // Biochem. Pharmacol. 1972. V. 21. P. 1871.
Sun D., Lennernas H., Welage L.S. et al. // Pharm. Res. 2002. V. 19. № 10. P. 1400.
van Breemen R.B., Li Y. // Expert Opin. Drug Metab. Toxicol. 2005. V. 1. P. 175.
Jung S.J., Choia S.O., Um S.Y. et al. // J. Pharm. Biomed. Anal. 2006. V. 41. № 2. P. 469.
Tsuchiya H., Ueno T., Mizogami M., Takakura K. // Chem. Biol. Interact. 2010. V. 183. P. 19.
Liu L., Lei T., Bankir L. et al. // J. Comp. Physiol. B. 2011. V. 181. P. 65.
Benga G. // Eur. Biophys. J. 2013. V. 42. P. 33.
Ros T.D., Prato M. // Chem. Commun. 1999. P. 663.
Bosi S., Ros T.D., Spalluto G. et al. // Bioorg. Med. Chem. Lett. 2003. V. 13. P. 4437.
Mashino T., Shimotohno K., Ikegami N. et al. // Bioorg. Med. Chem. Lett. 2005. V. 15. P. 1107.
Kornev A.B., Peregudov A.S., Martynenko V.M. et al. // Chem. Commun. 2011. V. 47. № 29. P. 8298.
Khakina E.A., Kraevaya O.A., Popova M.L. et al. // Org. Biomol. Chem. 2017. V. 15. P. 773.
Bosi S., Da Ros T., Castellano S. et al. // Bioorg. Med. Chem. Lett. 2000. V. 10. P. 1043.
Mashino T., Nishikawa D., Takanashi K. et al. // Bioorg. Med. Chem. Lett. 2003. V. 13. P. 4395.
Deryabin D.G., Efremova L.V., Vasilchenko L.S. et al. // J. Nanobiotechnology. 2015. V. 13. P. 1.
Lin A., Fang S., Lin S. et al. // NeuroScience Research. 2002. V. 43. P. 317.
Hsieh F.-Y., Zhilenkov A.V., Voronov I.I., Khakina E.A., Mischenko D.V., Troshin P.A., Hsu S.-H. // ACS Appl. Mater. Interfaces. 2017. V. 9. P. 11482–11492.
Nakajima N., Nishi C., Li F.-M., Ikada Y. // Fuller. Sci. Technol. 1996. V. 4. P. 1–19.
Tabata Y., Ishii T., Aoyama T., Oki R., Hirano Y., Ogawa O., Ikada Y. // Kluver Academ. Publ., 2001.
Gareth A. // Nanomedicine: NBM. 2005. V. 1. P. 22–30.
Yurkova A.A., Khakina E.A., Troyanov S.I., Chernyak A.V., Shmygleva L.V., Peregudov A.A., Martynenko V.M., Dobrovolskiy Y.A., Troshin P.A. // Chem. Commun. 2012. V. 48. P. 8916–8918.
Fedorova N.E., Klimova R.R., Tulenev Yu.A., Chichev E.V., Kornev A.B., Troshin P.A., Kushch A.A. // Mendeleev Commun. 2012. V. 22. P. 254–256.
Kobzar O.L., Trush V.V., Tanchuk V.Yu., Voronov I.I., Peregudov A.S., Troshin P.A., Vovk A.I. // Mendeleev Commun. 2015. V. 25. P. 199–201.
Wong-Ekkabut J., Baoukina S., Triampo W., I.-Ming Tang, Tieleman D.P., Monticelli L. // Nature Nanotechnology. 2008. V. 3. P. 363–368.
Kotelnikova R.A., Kotelnikov A.I., Bogdanov G.N., Romanova V.S., Kuleshova E.F., Parnes Z.N. // FEBS Lett. 1996. V. 389. P. 111–114.
Kotelnikova R.A., Bogdanov G.N., Frog E.C. et al. // J. Nanopart. Res. 2003. V. 5. P. 561–566.
Foley S., Crowley C., Smaihi M., Bonfils C., Erlanger B.F., Seta P., Larroque C. // Res. Commun. 2002. V. 294. P. 116–119.
Dellinger A., Zhou Z., Norton S.K., Lenk R., Conrad D., Kepley C.L. // Nanomedicine: NBM. 2010. V. 6. P. 575–582.
Waldeck A.R., Kuchel P.W., Lennon A.J., Chapman B.E. // Progr. Nucl. Magn. Reson. Spectr. 1997. V. 30. P. 39–68.
Cho C.-H., Hong Y.-S., Kang K., Volkov V.I., Skirda V., Lee C.-Y.J., Lee C.-Ho. // MRI. 2003. V. 21. P. 1009–1017.
Suh Ki-J., Hong Y.-S., Skirda V.D., Volkov V.I., Lee C.-Y., Lee C.-Ho. // Biophys. Chem. 2003. V. 104. P. 121–130.
Anselmi C., Bernardi F., Centini M., Gaggelli E., Gaggelli N., Valensin D., Valensin G. // Chem. Phys. Lipids. 2005. V. 134. P. 109–117.
Avilova I.A., Vasil’ev S.G., Rimareva L.V., Serba E.M., Volkova L.D., Volkov V.I. // Russ. J. Phys. Chem. A. 2015. V. 89. № 14. P. 710–714.
Avilova I.A., Smolina A.V., Kotelnikov A.I., Kotelnikova R.A., Loskutov V.V., Volkov V.I. // Appl. Magn. Reson. 2016. V. 47. № 3. P. 335–347.
Avilova I.A., Khakina E.A., Kraevaya O.A., Kotelnikov A.I., Kotelnikova R.A., Troshin P.A., Volkov V.I. // BBA – Biomembranes. 2018. V. 1860. P. 1537–1543.
Wong C.-W., Zhilenkov A.V., Kraevaya O.A., Mischenko D.V., Troshin P.A., Hsu S.-H. // J. Med. Chem. 2019. V. 62. V. 15. P. 7111–7125.
Шейко Л.М., Бокуть С.Б. Практикум по медицинской и биологической физике. Раздел “Биологическая физика”: Методы биофизических исследований. Минск: МГЭУ им. А.Д. Сахарова, 2011. 64 с.
Маклаков А.И., Скирда В.Д., Фаткуллин Н.Ф. Самодиффузия в растворах и расплавах полимеров. Казань: Издательство Казанского Университета, 1987. 225 с.
Avilova I.A., Chernyak A.V., Zhilenkov A.V., Troshin P.A., Volkov V.I. // Mendeleev Communications. 2016. V. 26. P. 146–148.
Chernyak A.V., Avilova I.A., Khakina E.A., Mumyatov A.V., Zabrodin V.A., Troshin P.A., Volkov V.I. // Appl. Magn. Reson. 2016. V. 47. № 8. P. 859–868.
Karger J., Pheifer H., Heink W. // Adv. Magn. Reson. 1988. V. 12. № 1. P. 1–89.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии