Журнал физической химии, 2021, T. 95, № 2, стр. 220-225
Влияние состава водно-органических растворителей на устойчивость комплексов ионов меди(II) с анионами янтарной и малеиновой кислот
Н. В. Тукумова a, *, Н. В. Белова a, Т. Р. Усачева a, Чан Тхи Зъеу Тхуан b, **
a Ивановский государственный химико-технологический университет
153000 Иваново, Россия
b Индустриальный университет города ХоШиМина
Го Вап, Вьетнам
* E-mail: oxt@isuct.ru
** E-mail: tranthidieuthuan@iuh.edu.vn
Поступила в редакцию 12.02.2020
После доработки 10.07.2020
Принята к публикации 13.07.2020
Аннотация
Методом UV-Vis-спектрофотометрии исследованo влияние водно-этанольных растворителей на устойчивость координационных соединений ионов Cu(II) с анионами янтарной (Y2–) и малеиновой (L2–) кислот. Величины логарифмов констант устойчивости сукцинатных и малеатных комплексов сопоставлены с полученными нами методом потенциометрического титрования. Для объяснения различий в устойчивости сукцинатных и малеатных комплексов выполнено квантово-химическое исследование структуры малеиновой и янтарной кислот, а также их комплексов с ионом меди(II).
Наличие информации об устойчивости комплексов микроэлементов с биолигандами в различных средах имеет важное значение для понимания механизма действия биологически активных веществ на процессы в живых системах. К биолигандам, обладающим высокой биологической активностью, принимающим участие во многих процессах жизнедеятельности, относятся янтарная и малеиновая кислоты. Поэтому в настоящее время не снижается интерес к разработке инновационных фармкомпозиций с участием этих биомолекул [1, 2]. Ранее [3] методом потенциометрического титрования нами было изучено влияние состава водно-этанольного растворителя на устойчивость координационных соединений ионов меди(II) с анионами малеиновой и янтарной кислот (табл. 1). Данное исследование является продолжением работ [3–6] и представляет результаты, полученные методами UV-vis-спектроскопии и квантовой химии.
Таблица 1.
Значения логарифмов констант устойчивости комплексов ионов Cu(II) с анионами малеиновой (H2L) и янтарной (H2Y) кислот в водных и водно-этанольных растворителях
| $\lg \beta $ | Содержание этанола в водном растворе XEtOН, мол. доли | Источник | |||||
|---|---|---|---|---|---|---|---|
| 0 | 0.1 | 0.3 | 0.4 | 0.5 | 0.7 | ||
| CuL | 4.10 ± 0.20 | 4.66 ± 0.20 | 5.82 ± 0.20 | – | – | – | – |
| 3.86 ± 0.06 | 4.36 ± 0.06 | 5.47 ± 0.06 | 5.65 ± 0.06 | 6.50 ± 0.04 | 6.62 ± 0.04 | [3] | |
| CuY | 3.10 ± 0.15 | 3.89 ± 0.10 | – | – | – | – | |
| 2.98 ± 0.08 | 3.78 ± 0.08 | 5.20 ± 0.04 | 6.01 ± 0.06 | – | – | [3] | |
Спектроскопические эксперименты проведены на спектрофотометре Hitachi-U2001 в интервале длин волн 360–900 нм (видимая область, так как растворы окрашены). Спектры поглощения растворов Cu2+ получены в присутствии янтарной и малеиновой кислот в водных и водно-этанольных растворах. Для снятия спектров использованы кюветы из кварцевого стекла с толщиной поглощающего слоя 1 см. Содержание этанола в растворе изменялось от 0 до 0.3 мол. доли. При большем содержании неводного компонента при данных концентрационных условиях не удалось провести математическую обработку экспериментальных данных и получить надежные значения констант устойчивости. В качестве раствора сравнения использованы дистиллированная вода и водно-этанольный растворитель, аналогичный по содержанию этанола исследуемому. Для создания ионной силы использован раствор перхлората натрия, а для создания рН – раствор гидроксида натрия.
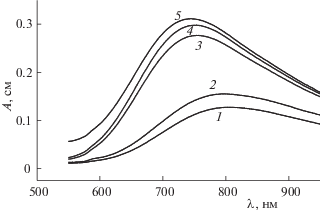
Получены спектры поглощения растворов ионов Cu2+ в присутствии анионов янтарной и малеиновой кислот в зависимости от величин рН в водно-этанольных растворах с различным содержанием неводного компонента. Для примера на рис. 1 приведены зависимости изменения оптической плотности растворов ионов меди(II) в присутствии янтарной кислоты при содержании этанола 0.1 мол. доли. Из рис. 1 видно, что при увеличении рН раствора от 3.0 до 5.0 в спектрах поглощения наблюдаются смещение максимума поглощения от 800 до 740 нм и увеличение оптической плотности растворов. Аналогичная зависимость наблюдается и в случае малеиновой кислоты.
Рис. 1.
Спектры поглощения растворов ионов Сu2+ в присутствии янтарной кислоты в водно-этанольных растворах с содержанием этанола 0.1 мол. доли, ${{С}_{{{{{\text{Y}}}^{{2 - }}}}}}$ = = ${{С}_{{{\text{С}}{{{\text{u}}}^{{2 + }}}}}}$ = 0.01 моль/л; рН 3.0 (1), 3.5 (2), 4.0 (3), 4.5 (4) и 5.0 (5).
В дальнейшем снимали спектры поглощения для серии растворов с постоянной концентрацией лиганда С° = 1 × 10–2 моль/л и переменной концентрацией ионов меди $С_{{{\text{Cu}}}}^{^\circ }$ = 6 × 10–3–1.2 × × 10–2 моль/л при фиксированном значении рН 4.0, при котором выход монолигандной частицы был не менее 20% (данные потенциометрического исследования [3]) и ионной силе 0.1 М (NaClO4).
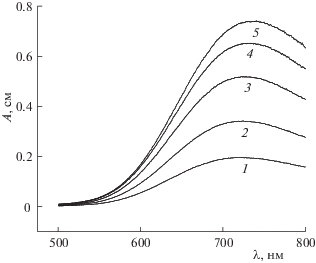
На рис. 2 приведены спектры поглощения водно-этанольных растворов ионов меди(II) в присутствии аниона малеиновой кислоты с содержанием этанола 0.1 мол. доли. Как видно из рис. 2, увеличение концентрации ионов меди(II) приводит к росту оптической плотности растворов.
Рис. 2.
Спектры поглощения растворов ионов Сu2+ в присутствии анионов малеиновой кислоты в водно-этанольных растворах с содержанием этанола 0.1 мол. доли, ${{С}_{{{{{\text{L}}}^{{2 - }}}}}}$ = 0.01 моль/л; $С_{{{\text{С}}{{{\text{u}}}^{{2 + }}}}}^{0}$ = 0.006 (1), 0.007 (2), 0.0095 (3), 0.01 (4) и 0.012 моль/л (5).
Математическую обработку полученных методом спектрофотометрии результатов проводили с помощью программы “FTMT” [7]. Для расчета величин констант устойчивости комплексов ионов меди(II) с анионом янтарной (малеиновой) кислоты использовали значения оптической плотности при λ = 794 (741) нм, соответственно. Это область, в которой наблюдается смещение максимума поглощения, что соответствует образованию монолигадных частиц. Выбор рН 4.0 обусловлен резким увеличением оптической плотности при этом значении рН (рис. 1) и данными потенциометрического титрования, в соответствии с которыми при рН 4.0 выход монолигандной частицы приближен к максимальному.
Для системы, содержащей ионы Cu2+, анион малеиновой (L2–) или янтарной кислот (Y2–), фоновый электролит (NaClO4) предполагали протекание следующих процессов:
(1)
${{{\text{H}}}_{{\text{2}}}}{\text{L}}({{{\text{H}}}_{{\text{2}}}}{\text{Y}}) \Leftrightarrow {{{\text{H}}}^{ + }} + {\text{H}}{{{\text{L}}}^{--}}({\text{H}}{{{\text{Y}}}^{--}}),$(2)
${\text{H}}{{{\text{L}}}^{--}}({\text{H}}{{{\text{Y}}}^{--}}) \Leftrightarrow {{{\text{H}}}^{ + }} + {{{\text{L}}}^{{2--}}}({{{\text{Y}}}^{{2--}}}),$(3)
${\text{C}}{{{\text{u}}}^{{2 + }}} + {\text{H}}{{{\text{L}}}^{--}}({\text{H}}{{{\text{Y}}}^{--}}) \Leftrightarrow {\text{CuH}}{{{\text{L}}}^{ + }}({\text{CuH}}{{{\text{Y}}}^{ + }}),$(4)
${\text{C}}{{{\text{u}}}^{{2 + }}} + {{{\text{L}}}^{{2--}}}({{{\text{Y}}}^{{2--}}}) \Leftrightarrow {\text{CuL}}({\text{CuY}}),$(5)
${\text{C}}{{{\text{u}}}^{{2 + }}} + 2{{{\text{L}}}^{{2--}}}({\text{2}}{{{\text{Y}}}^{{2--}}}) \Leftrightarrow {\text{CuL}}_{2}^{{2 - }}{\text{(CuY}}_{2}^{{2 - }}),$(6)
${\text{C}}{{{\text{u}}}^{{2 + }}} + {\text{О}}{{{\text{Н}}}^{--}} \Leftrightarrow {\text{CuО}}{{{\text{Н}}}^{ + }},$(7)
${\text{N}}{{{\text{a}}}^{ + }} + {{{\text{L}}}^{{2--}}} \Leftrightarrow {\text{Na}}{{{\text{L}}}^{--}},$Значения рK констант ступенчатой диссоциации (процессы (1) и (2)) для янтарной и малеиновой кислот были определены нами методом потенциометрического титрования при температуре 298.15 K и ионной силе 0.1, создаваемой перхлоратом натрия при исследуемых содержаниях этанола в водном растворе [3].
Математическая обработка экспериментальных данных показала, что выход протонированных и билигандных частиц (уравнения (3), (5)) составляет менее 5%, что не позволяет при данных условиях надежно рассчитать их константы устойчивости.
Величины логарифмов констант устойчивости образующихся комплексов в водных и в водно-этанольных растворах, полученные методами потенциометрического титрования [3] и спектрофотометрии приведены в табл. 1. Оценку погрешности определения величин $\lg \beta $ проводили на основе статистической обработки результатов не менее 5 параллельных опытов с помощью критерия Стьюдента при доверительной вероятности 95%.
Из табл. 1 видно, что как значения $\lg {{\beta }_{{{\text{CuL}}}}}$, так и $\lg {{\beta }_{{{\text{CuY}}}}}$, полученные двумя независимыми методами, удовлетворительно согласуются между собой.
Анализ полученных результатов показал, что водно-этанольный растворитель оказывает одинаковое влияние на изученные процессы комплексообразования: устойчивость обоих комплексов увеличивается с ростом содержания неводного компонента растворителя, что обусловлено дестабилизацией лигандов [3]. Однако устойчивость координационных соединений ионов меди(II) с анионом янтарной кислоты меньше, чем с анионом малеиновой кислоты при всех содержаниях неводного компонента в растворах (табл. 1).
Для объяснения данной закономерности нами было проведено квантово-химическое исследование структур малеиновой и янтарной кислот, а также их комплексов с ионом меди(II). Квантово-химические расчеты выполнялись с использованием пакета программ GAUSSIAN 03 [8] в приближении теории функционала электронной плотности с функционалом B3LYP [9–13]. Для комплексов ионов меди(II) использовался вариант ROB3LYP. Во всех расчетах для атомов O, C и H использовались корреляционно-согласованные валентно-трехэкспонентные базисы cc-pVTZ [14, 15]. Для описания внутренних (1s22s22p6) оболочек атома Cu использован релятивистский эффективный псевдопотенциал ECP10MWB [16]. Внешние оболочки атома меди описаны базисом (8s7p6d2f1g/6s5p3d2f1g) [16, 17]. Для каждой рассмотренной конфигурации проведена оптимизация геометрических параметров с последующим вычислением матрицы вторых производных полной энергии по декартовым координатам ядер. Изучение распределения электронной плотности в молекулах проводилось с помощью анализа натуральных орбиталей в рамках программы NBO 3.1 [18], входящей в состав программного комплекса GAUSSIAN 03.
На рис. 3, 4 представлены конфигурации малеиновой и янтарной кислот, соответствующие минимумам на поверхности потенциальной энергии, а также их относительные энергии. В случае малеиновой кислоты наблюдаются четыре устойчивых изомера. Наличие двойной связи С2=С3 обеспечивает плоскостность углерод-кислородного каркаса, в результате все изомеры H2L обладают симметрией CS. Наиболее низкой относительной энергией обладает транс-изомер (t1). Относительное содержание изомеров малеиновой кислоты, рассчитанное на основании теоретических значений относительных энергий Гиббса, $\Delta G_{{278}}^{0}$, составляет 72.8, 22, 5 и 0.2% для конфигураций t1, t2, c2 и c1 соответственно. Несмотря на то, что относительное содержание транс-форм существенно превалирует, образование комплексов, по всей видимости, происходит из цис-форм малеиновой кислоты. В случае янтарной кислоты все наблюдающиеся четыре устойчивых изомера обладают симметрией С1. Изомер (1) соответствует глобальному минимуму на ППЭ. Относительное содержание изомеров янтарной кислоты, рассчитанное на основании теоретических значений относительных энергий Гиббса, $\Delta G_{{278}}^{0}$, составляет 72.9, 20, 7 и 0.1% для конфигураций (1), (2), (4) и (3) соответственно.
Рис. 3.
Стабильные цис- (c) и транс- (t) конфигурации малеиновой кислоты, соответствующие минимумам на ППЭ, и относительные энергии (ΔE, ккал/моль) по данным квантово-химических расчетов.
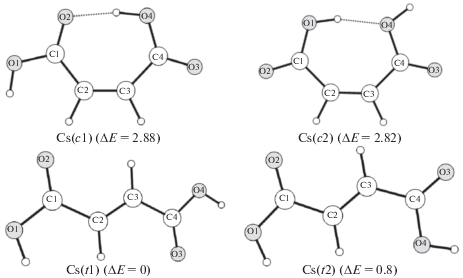
Рис. 4.
Стабильные конфигурации янтарной кислоты, соответствующие минимумам на ППЭ, и относительные энергии (ΔE, ккал/моль) по данным квантово-химических расчетов.
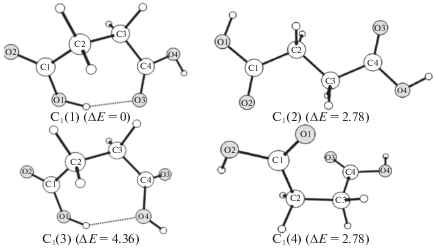
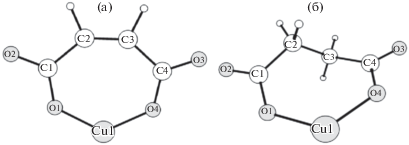
На рис. 5 представлены равновесные конфигурации комплексов ионов меди (II) с анионами малеиновой и янтарной кислот. Согласно результатам квантово-химических расчетов, малеатный комплекс CuL обладает симметрией ${{C}_{{2{v}}}}$, в то время как симметрия сукцинатного комплекса CuY–C2.
В табл. 2 приведены геометрические параметры наиболее устойчивых изомеров малеиновой и янтарной кислот и их медных комплексов. Результаты анализа распределения электронной плотности в молекулах представлены в табл. 3 и 4. Можно отметить, что образование малеатного комплекса CuL из изомера малеиновой кислоты (с2) требует меньших энергетических затрат на перестроение углерод-кислородного каркаса, чем при образовании CuY из изомера (1) янтарной кислоты. Несколько меньшую устойчивость сукцинатного комплекса меди CuY по сравнению с малеатным CuL можно было бы связать с несколько большим значением длины связи r(Cu–O) в случае CuY и большими стерическими напряжениями в углерод-кислородном каркасе. Однако, значения индексов Вайберга (табл. 4) для связей Cu-O, характеризующих порядки связей, практически одинаковы для двух комплексов. Величины Q(Cu–O) ∼ 0.35 свидетельствуют о преимущественно ионном характере связи Cu–O. Приведенные в табл. 4 значения натуральных зарядов для двух комплексов ионов меди(II) достаточно близки между собой, что указывает на сходство физико-химических свойств CuL и CuY. Анализ распределения электронной плотности показывает во всех изученных молекулах наличие донорно-акцепторных взаимодействий между неподеленной электронной парой кислорода с разрыхляющей орбиталью соседней связи π*(С–О), приводящее к дополнительному сопряжению во фрагментах (О–C=O). Кроме того, в случае малеиновой кислоты и комплекса CuL наблюдается гиперсопряжение между связывающей орбиталью π(С2–С3) и разрыхляющими орбиталями π*(С1–О2) и π*(С4–О3), что приводит к понижению энергии и дополнительной стабилизации молекулярной системы. Наличие гиперсопряжений в углерод-кислородном каркасе приводит к изменению соответствующих межъядерных расстояний (табл. 3), а также индексов Вайберга (табл. 5 ) по сравнению с величинами, характерными для одинарных или двойных связей.
Таблица 2.
Геометрические параметры изомеров малеиновой (H2L) и янтарной (H2Y) кислот, а также малеатного (CuL) и сукцинатного (CuY) комплексов ионов меди(II)
| H2L | CuL | H2Y | CuY | ||
|---|---|---|---|---|---|
| CS(t1) | CS(c2) | C1(1) | |||
| Межъядерные расстояния, Å | |||||
| C1–C2 | 1.492 | 1.505 | 1.504 | 1.528 | 1.528 |
| C2–C3 | 1.329 | 1.339 | 1.340 | 1.535 | 1.550 |
| C3–C4 | 1.483 | 1.478 | 1.504 | 1.507 | 1.528 |
| C1–O1 | 1.356 | 1.334 | 1.328 | 1.344 | 1.340 |
| C1–O2 | 1.199 | 1.205 | 1.209 | 1.201 | 1.203 |
| C4–O3 | 1.206 | 1.202 | 1.209 | 1.213 | 1.203 |
| C4–O4 | 1.350 | 1.365 | 1.328 | 1.341 | 1.340 |
| C2–H | 1.084 | 1.083 | 1.084 | 1.087 1.092 |
1.087 1.093 |
| C3–H | 1.081 | 1.082 | 1.084 | 1.091 1.094 |
1.087 1.093 |
| O1–H | 0.964 | 0.973 | – | 0.978 | – |
| O4–H | 0.969 | 0.969 | – | 0.970 | – |
| Cu–O1 | – | – | 1.768 | – | 1.779 |
| Cu–O4 | – | – | 1.768 | – | 1.779 |
| Валентные углы, град. | |||||
| O1–C1–O2 | 120.5 | 121.1 | 120.3 | 121.3 | 120.4 |
| O2–C1–C2 | 124.3 | 117.8 | 118.1 | 122.5 | 122.6 |
| C1–C2–C3 | 121.1 | 136.1 | 138.6 | 115.5 | 117.6 |
| С2–С3–С4 | 120.7 | 133.6 | 138.6 | 115.0 | 117.6 |
| C3–C4–O4 | 111.1 | 115.9 | 121.6 | 112.2 | 117.0 |
| O3–C4–O4 | 123.3 | 121.2 | 120.3 | 122.0 | 120.4 |
| O1–Cu–O4 | – | – | 125.8 | – | 126.7 |
| Двугранные углы, град. | |||||
| O2–C1–C2–C3 | 0.0 | 180.0 | 180.0 | –115.2 | –126.7 |
| O1–C1–C2–C3 | 180.0 | 0.0 | 0.0 | 65.4 | 54.3 |
| C1–C2–C3–C4 | 180.0 | 0.0 | 0.0 | –77.0 | –101.4 |
| C2–C3–C4–O4 | 180.0 | 0.0 | 0.0 | –166.6 | 54.3 |
| C2–C3–C4–O3 | 0.0 | 180.0 | 180.0 | 13.4 | –126.7 |
| C2–C1–O1–H | 0.0 | 0.0 | – | –3.2 | – |
| C3–C4–O4–H | 180.0 | 180.0 | – | –178.4 | – |
| C1–O1–Cu–O4 | – | – | 0.0 | – | –14.3 |
| O1–Cu–O4–C4 | – | – | 0.0 | – | –14.3 |
Таблица 3.
Натуральные заряды на атомах (q, ē) в конформерах малеиновой (H2L) и янтарной (H2Y) кислот, а также в комплексах меди (II) по данным NPA-анализа
| H2L | CuL | H2Y | CuY | ||
|---|---|---|---|---|---|
| CS(t1) | CS(c2) | C1(1) | |||
| С1 | 0.750 | 0.734 | 0.733 | 0.791 | 0.789 |
| С2 | –0.253 | –0.205 | –0.255 | –0.499 | –0.503 |
| С3 | –0.226 | –0.284 | –0.255 | –0.492 | –0.503 |
| С4 | 0.749 | 0.749 | 0.733 | 0.823 | 0.789 |
| O1 | –0.654 | –0.660 | –0.773 | –0.681 | –0.790 |
| O2 | –0.541 | –0.537 | –0.533 | –0.567 | –0.548 |
| O3 | –0.578 | –0.540 | –0.533 | –0.627 | –0.548 |
| O4 | –0.657 | –0.712 | –0.773 | –0.661 | –0.790 |
| H(O1) | 0.475 | 0.496 | – | 0.496 | – |
| H(O4) | 0.487 | 0.507 | – | 0.493 | – |
| H(C2) | 0.212 | 0.225 | 0.227 | 0.218 0.231 |
0.222 0.237 |
| H(C3) | 0.236 | 0.228 | 0.227 | 0.235 0.239 |
0.222 0.237 |
| Cu | – | – | 1.202 | – | 1.187 |
Таблица 4.
Индексы Вайберга (Q) для связей в конформерах малеиновой (H2L) и янтарной (H2Y) кислот, а также в их комплексах с ионами меди(II)
| Связь | H2L | CuL | H2Y | CuY | |
|---|---|---|---|---|---|
| CS(t1) | CS(c2) | C1(1) | |||
| C1–C2 | 1.008 | 1.000 | 1.002 | 0.964 | 0.968 |
| C2–C3 | 1.860 | 1.857 | 1.875 | 1.011 | 1.003 |
| C3–C4 | 1.012 | 1.036 | 1.002 | 0.993 | 0.968 |
Таким образом, результаты квантово-химических расчетов позволяют заключить, что большая устойчивость малеатного комплекса ионов меди(II) по сравнению с сукцинатным обусловлена, по всей видимости, меньшими стерическими напряжениями в хелатном кольце, а также наличием π-сопряжения в углерод-кислородном каркасе, что приводит к дополнительной стабилизации комплекса.
Исследование проведено в рамках государственного задания Министерства науки и высшего образования Российской Федерации (проект FZZW-2020-0009).
Список литературы
Larrañeta E., Barturen L., Ervine M., Donnelly R.F. // Int. J. Pharm. 2018. V. 538. № 1–2. P. 147.
Varshosaz J., Minaiyan M., Dayyani L. // Eur. J. Pharm. Sci. 2018. V. 112. P. 195.
Тукумова Н.В., Усачева Т.Р., Чан Тхи Зъеу Тхуан, Шарнин В.А // Журн. физ. химии. 2014. Т. 88. № 10. С. 1510.
Tukumova N.V., Usacheva T.R., Thuan Tran Thi Dieu et al. // Izv. Vyssh. Uchebn. Zaved. Khim. Khim. Tekhnol. 2018. V. 61. № 9–10. P. 16.
Тукумова Н.В., Чан Тхи Зъеу Тхуан, Усачева Т.Р., Шарнин В.А. // Журн. физ. химии. 2018. Т. 92. № 12. С. 1.
Тукумова Н.В., Чан Тхи Зьеу Тхуан, Усачева Т.Р. и др. // Там же. 2017. Т. 91. № 4. С. 639.
Бородин В.А., Козловский Е.В., Васильев В.П. // Журн. неорган. химии. 1986. Т. 31. № 1. С. 10.
Frisch M.J., Trucks G.W., Schlegel H.B., Scuseria G.E., Robb M.A., Cheeseman J.R., Montgomery J.A., Jr., Vreven J.T., Kudin K.N., Burant J.C., Millam J.M., Iyengar S.S., Tomasi J., Barone V., Mennucci B., Cossi M., Scalmani G., Rega N., Petersson G.A., Nakatsuji H., Hada M., Ehara M., Toyota K., Fukuda R., Hasegawa J., Ishida M., Nakajima T., Honda Y., Kitao O., Nakai H., Klene M., Li X., Knox J.E., Hratchian H.P., Cross J.B., Adamo C., Jaramillo J., Gomperts R., Stratmann R.E., Yazyev O., Austin A.J., Cammi R., Pomelli C., Ochterski J.W., Ayala P.Y., Morokuma K., Voth G.A., Salvador P., Dannenberg J.J., Zakrzewski V.G., Dapprich S., Daniels A.D., Strain M.C., Farkas O., Malick D.K., Rabuck A.D., Raghavachari K., Foresman J.B., Ortiz J.V., Cui Q., Baboul A.G., Clifford S., Cioslowski J., Stefanov B.B., Liu G., Liashenko A., Piskorz P., Komaromi I., Martin R.L., Fox D.J., Keith T., Al-Laham M.A., Peng C.Y., Nanayakkara A., Challacombe M., Gill P.M.W., Johnson B., Chen W., Wong M.W., Gonzalez C., Pople J.A. Gaussian 03, Revision B.03, Gaussian, Inc. 2003, Pittsburgh PA.
Bauschlicher C.W., Partridge H. // Chem. Phys. Lett. 1994. V. 231. P. 277.
Becke A.D. // J. Chem. Phys. 1993. V. 98. P. 5648.
Becke A.D. // Phys. Rev. A. 1998. V. 38. P. 3098.
Lee C., Yang W., Parr R.G. // Phys. Rev. B. 1998. V. 37. P. 785.
Vosko S.H., Wilk L., Nusair M. // Can. J. Phys. 1980. V. 58. P. 1200.
Dunning T.H. J. // J. Chem. Phys. 1989. V. 90. P. 1007.
Kendall R.A., Dunning T.H.J., Harrison R.J. // Ibid. 1992. V. 96. P. 6796.
Dolg M., Wedig U., Stoll H., Preuss H. // Ibid. 1987. V. 86. P. 866.
Martin J.M.L., Sundermann A. // Ibid. 2001. V. 114. P. 3408.
Glendening E.D., Reed A.E., Carpenter J.E., Weinhold F. // QCPE Bull. 1990. V. 10. P. 58.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии