Журнал физической химии, 2021, T. 95, № 2, стр. 201-206
Твердофазный каталитический изотопный обмен водорода на дейтерий в мексидоле
А. К. Дадаян a, *, Ю. А. Борисов b, Ю. А. Золотарев a, Э. В. Бочаров c, И. Ю. Нагаев a, Н. Ф. Мясоедов a
a Российская академия наук, Институт молекулярной генетики
Москва, Россия
b Российская академия наук, Институт элементоорганических соединений им. А.Н. Несмеянова
Москва, Россия
c Российская академия наук, Институт биоорганической химии им. М.М. Шемякина и Ю.А. Овчинникова
Москва, Россия
* E-mail: dak.img.ras@gmail.ru
Поступила в редакцию 11.04.2020
После доработки 03.05.2020
Принята к публикации 15.05.2020
Аннотация
Реакция спилловер-водорода (СВ) с мексидолом при высокотемпературном твердофазном каталитическом изотопном обмене (ВТКИО) изучена экспериментально и с помощью расчетов DFT B3LYP и MP2. В образцах меченного дейтерием мексидола, полученных реакцией ВТКИО при температуре 50–120°С, с помощью ЯМР-спектроскопии и масс-спектроскопии определены распределение изотопа и энергия активации реакции. Установлено, что рассчитанная с помощью DFT энергия активации реакции переноса водорода на заряженном кластере оксида алюминия HH+(–Al–O–)3(OH)6 хорошо согласуется с экспериментальными данными. Предложен механизм реакции ВТКИО, основанный на одноцентровом синхронном обмене водорода между адсорбированным соединением и заряженными кислотными центрами бренстедовского типа, образовавшимися на поверхности носителя под действием спилловера водорода.
В гетерогенном катализе спилловером называют транспорт активных частиц, сорбированных или образованных на одной фазе, на другую фазу, которая в данных условиях не сорбирует или не образует этих частиц. Активированный водород, транспортированный с платиновых металлов на неорганический носитель, получил название спилловер водорода (СВ) [1]. В данной работе исследован механизм реакции между СВ и мексидолом (2-этил-6-метил-3-гидроксипиридина сукцинат) – мультитаргетным фармакологическим препаратом с антигипоксантной, антиоксидантной, анксиолитической и ноотропной активностью.
Несмотря на то, что процессы, протекающие с участием СВ, известны в течение многих лет, до настоящего времени нет общепринятого мнения о природе СВ. Согласно различным гипотезам, водород мигрирует либо в форме сольватированного протона, либо в виде протон-электронной пары, либо в виде атомарного водорода. Показано, что миграция СВ на полупроводниковый неорганический носитель сопровождается протонированием TiO2 и переносом электрона в зону проводимости [2–4]. С использованием DFT-расчетов спилловера водорода по поверхности невосстанавливаемого оксида металла было показано, что атомарный водород не может мигрировать в кристаллическую решетку, а также для атомов водорода невозможно объяснить наблюдаемую способность СВ гидрировать адсорбированные на носителе молекулы [5]. Известно, что под действием СВ селективность каталитической реакции изомеризации углеводородов увеличивается до 95–99% [6]. Такое изменение селективности связано с тем, что эта реакция происходит с участием новых кислотных центров бренстедовского типа (КБЦ), образовавшихся под действием СВ [7, 8].
В пользу того, что СВ переносится на неорганический носитель в виде положительно заряженной частицы, свидетельствует образование отрицательного заряда на металле платиновой группы [9, 10]. Предполагается, что перемещение протона по поверхности, содержащей связанную воду и гидроксильные группы, может происходить по эстафетному механизму [11]. На образующиеся при этом КБЦ могут происходить реакции гидроизомеризации, гидрокрекинга и изотопного обмена. Экспериментально было показано, что реакция высокотемпературного твердофазного каталитического изотопного обмена (ВТКИО) происходит на каталитических центрах неорганического носителя, образовавшихся под действием СВ [12]. Установлено, что в отличие от жидкофазных реакций, реакция ВТКИО характеризуется чрезвычайно низкими кинетическими изотопными эффектами [13]. Реакция ВТКИО водорода органических соединений на дейтерий и тритий происходит без рацемизации асимметрических углеродных атомов, что позволяет ее использовать для синтеза высокомеченных тритием физиологически активных соединений [14].
Уже давно каталитические процессы с участием СВ прочно вошли в промышленное использование, однако механизм реакций, происходящих на образующихся при этом сильных кислотных центрах, все еще недостаточно изучен. Цель данной рабты – экспериментальное и квантово-химическое исследование реакции каталитического изотопного обмена водорода, происходящей между СВ и нанесенным на окид алюминия мексидолом.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез меченного дейтерием мексидола проводили реакцией ВТКИО с дейтерием в твердой смеси, образованной нанесенным на оксид алюминия мексидолом и высокодисперсным катализатором 5% Pd на BaSO4 (Fluka). Твердую реакционную смесь готовили согласно описанию, приведенному для синтеза меченного изотопами водорода Gly [14]. Для этого раствор 1.0 мг мексидола в 0.5 мл воды смешивали с 20 мг оксида алюминия, замораживали и удаляли воду лиофильной сушкой. Оксид алюминия с нанесенным мексидолом смешивали с катализатором 10 мг 5% Pd/BaSO4 (Fluka). В ампулу объемом 10 мл помещали твердую реакционную смесь, вакуумировали, охлаждали до 0°С и заполняли дейтерием до давления 30 кПа и проводили реакцию изотопного обмена в условиях, приведенных в табл. 1 при температуре 50–120°С. Ампулу охлаждали, вакуумировали и продували водородом. Мексидол десорбировали 50%-м водным этанолом. Меченый мексидол еще дважды растворяли в 50%-м водном этаноле и упаривали досуха для удаления лабильного дейтерия. Очистку образцов меченного дейтерием мексидола проводили с помощью ВЭЖХ на колонке Кромасил 8 × 150 в градиенте концентрации водного раствора метанола 15–40%, в присутствии 0.1% гептафтормасляной кислоты (HFBA), с использованием двухлучевой УФ-детекции на 220 и 254 нм. Хроматографические параметры удерживания и отношение экстинкции для меченного дейтерием и исходного немеченого мексидола полностью совпадали. Очищенные с помощью ВЭЖХ образцы меченного дейтерием мексидола упаривали под уменьшенным давлением, растворяли в дистиллированной воде и лиофильно высушивали при –50°С.
Таблица 1.
Высокотемпературный твердофазный каталитический изотопный обмен водорода на дейтерий в мексидоле
| Т, °С | τ, мин | H(7) | H(8) | H(12), H(13), H(14) | H(16), H(17) | H(19), H(20), Н(21) |
|---|---|---|---|---|---|---|
| Включение дейтерия на одну C–H-связь | ||||||
| 50 | 5 | 0.41 | 0.14 | 0.30 | 0.12 | 0.00 |
| 65 | 5 | 0.56 | 0.17 | 0.48 | 0.20 | 0.00 |
| 65 | 10 | 0.80 | 0.27 | 0.79 | 0.35 | 0.00 |
| 80 | 5 | 0.81 | 0.30 | 0.80 | 0.47 | 0.00 |
| 90 | 5 | 0.80 | 0.37 | 0.80 | 0.64 | 0.00 |
| 105 | 5 | 0.81 | 0.49 | 0.81 | 0.81 | 0.00 |
| 120 | 4 | 0.80 | 0.50 | 0.81 | 0.81 | 0.05 |
| Каталитический центр (расчет) | Энергия активации, ккал/моль | |||||
| Эксперимент | 9.1 | 13.0 | ||||
| 1. HAl(OH)4 (DFT B3LYP/6-311G*) | 22.58 | 24.29 | 31.04 | 31.16 | 32.72 | |
| 2. HAl(OH)4 (MP2 B3LYP/6-311+G*) | 29.02 | 28.07 | 33.07 | 31.94 | 38.26 | |
| 3. HH+Al(OH)4 (MP2 B3LYP/6-311+G*) | 11.00 | 12.81 | 18.90 | 19.84 | 30.29 | |
| 4. HH+[–Al–O–]3[OH]6 (DFT B3LYP/6-311+G*) | – | 10.78 | – | 11.53 | – | |
| 5. H[–Al–O–]3[OH]6 (DFT B3LYP/6-311+G*) | 21.97 | |||||
Масс-спектрометрия. Анализ меченного дейтерием [2H]мексидола провели с помощью масс-спектрометра LCQ Advantage MAX (Thermo Electron). Расчетная величина MW для легкого моно изотопного мексидола равна 137. Анализируемый образец меченного дейтерием [2H]мексидола разбавлялся раствором, состоящим из смеси метанол–уксусная кислота (100 : 0.1) до концентрации 10 мкг/мл. Измерение спектров пептидов производили в режиме положительных ионов в диапазоне m/z от 50 до 200.
Спектроскопия ЯМР. Положение изотопной метки и степень замещения водорода С–Н связей на дейтерий в меченном дейтерием [2H]мексидоле определяли на основе 1Н-ЯМР-спектров, накопленных при 20°С с помощью сравнения интенсивности пиков в одно- и двумерных 1H-ЯМР-спектрах (1H/1H-TOCSY с временем задержки 60 мс). 1H-ЯМР-спектры получали с использованием ЯМР-спектрометра AVANCE 700 MГц.
Квантово-химические расчеты изученных систем проводили методом функционала энергии от электронной плотности DFT B3LYP/6-31G* с полной оптимизацией энергии и расчетом частот нормальных колебаний. Рассчитаны геометрические параметры соединений, электронные характеристики, распределение электронной плотности, полные энергии, энергии превращений, энтропии превращений, частоты нормальных колебаний. Оптимизацию геометрического строения молекул и расчет частот нормальных колебаний проводили при использовании атомных базисов 6-31G*. Все расчеты с полной оптимизацией геометрии молекул и расчеты частот нормальных колебаний проводили по программе GAUSSIAN-09 [15] под операционной системой LINUX. DFT B3LYP представляет собой сочетание метода Хартри–Фока и теории функционала плотности с применением градиентно-скорректированного функционального ряда Бекке с тремя параметрами (В3) [16, 17] и корреляционного функционального ряда Ли–Янга (LYP) [18]. Для каждой молекулы было оптимизировано геометрическое расположение атомов с использованием аналитических методов расчета. Путем расчета частот нормальных колебаний с использованием вторых производных было подтверждено, что точки стационарности, определенные при оптимизации геометрии, являются минимумами энергии. Выполнены расчеты фрагментов потенциальной поверхности реакций. Переходные состояния реакций рассчитывались методами синхронного транзита QST2 и QST3 [19, 20]. Для установления соответствия полученных переходных состояний предполагаемой реакции использован метод IRC [21].
РЕЗУЛЬТАТЫ
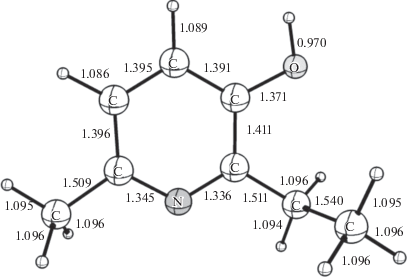
С помощью расчетов теории функционала энергии от электронной плотности (DFT) получены данные о строении мексидола (рис. 1). На рисунке показаны длины связей и положение водородных атомов, для которых рассмотрено участие в реакции твердофазного изотопного обмена со СВ и для которых были выполнены квантово-химические расчеты строения переходных состояний реакции обмена водорода и рассчитаны энергии активации.
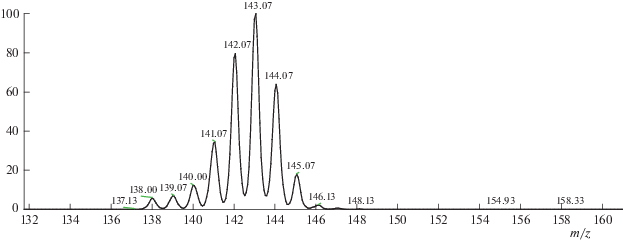
Реакцию ВТКИО с мексидолом исследовали в интервале температур 50–120°С. На рис. 2 приведен масс-спектр меченного дейтерием [D]мексидола, полученного реакцией ВТКИО при 80°C в течение 5 мин. Для моноизотопного иона мексидола отношение m/z = 138. Среднее содержание дейтерия в [D]мексидоле по данным масс-спектроскопии составляет 4.50 атомов дейтерия на молекулу [D]мексидола. В этом образце доля молекул содержащих от 3 до 6 атомов дейтерия составляет 88%. Содержание немеченых молекул в этом [D]мексидоле составляет менее 2%.
Рис. 2.
Масс-спектр [D]мексидола, полученного реакцией ВТКИО при 80°C, 5 мин; (моноизотопный ион m/z = 138).
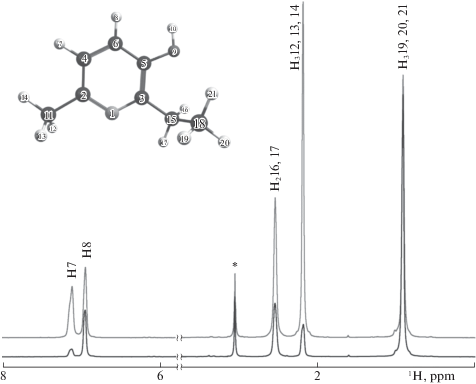
Анализ региоселективности реакции ВТКИО между мексидолом и СВ был выполнен с помощью ЯМР-спектроскопии (рис. 3). На этом рисунке показаны 1H-ЯМР-спектры исходного, легкого [H]мексидола и тяжелого [D]мексидола, который был получен реакцией ВТКИО при 80°C в течение 5 мин. Среднее содержание дейтерия в этом образце [D]мексидола составляет по данным ЯМР 4.45 атомов дейтерия на молекулу. Приводятся данные о распределении дейтерия по С–Н-положениям молекулы (табл. 1).
Рис. 3.
1H-ЯМР-спектры [D]мексидола: сверху – исходный, легкий [H]мексидол; снизу – тяжелый [D]мексидол, (80°C, 5 мин). Над пиками приведено отнесение 1H-резонансов мексидола.
Из температурной зависимости скорости замещения водорода на дейтерий в ароматической и алифатической части молекулы мексидола была рассчитана энергия активации реакции ВТКИО. Экспериментальные значения Eact реакции ВТКИО составляют 9.1 для ароматического H(8) и 13.0 ккал/моль для алифатических H(16, 17) атомов соответственно (табл. 1). На основе DFT-расчетов рассмотрен механизм реакции изотопного обмена между мексидолом и модельными кислотными центрами, HAl(OH)4, HH+Al(OH)4, H(–Al–O–)3(OH)6 и HH+(–Al–O–)3(OH)6. Найдены структуры переходных состояний и рассчитаны значения энергии активации для реакции обмена водорода между модельными кислотными центрами и водородными атомами в молекуле мексидола (табл. 1).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Найденные величины энергии активации реакции ВТКИО для алифатических H(16, 17) в мексидоле близки к экспериментальным значениям Eact для реакции изотопного обмена в глицине и амино-изомасляной кислоте, которые составляют 15.3 и 13.6 ккал/моль соответственно [13]. Для глицинового фрагмента циклопролилглицина было найдено, что Eact реакции обмена водорода на дейтерий в реакции ВТКИО составляет 14.5 ккал/моль [22].
Ранее при рассмотрении реакции ВТКИО в качестве модели кислотного каталитического центра, образующегося под действием СВ, были рассмотрены кислотные каталитические центры H3O+ и HAlCl4 [13, 22]. Квантово-химические расчеты Eact реакции изотопного обмена водорода на этих кислотных центрах соответствуют экспериментальным данным, полученным для реакции ВТКИО. Результаты DFT-расчетов на кислотном каталитическом центре HAlCl4, полученные для реакции обмена водорода в циклопролилглицине, хорошо согласуются с экспериментальными данными по стереоселективности и региоселективности реакции ВТКИО водорода на дейтерий в нанесенном на оксид алюминия циклопролилглицине [22]. С целью дальнейшего уточнения механизма реакции ВТКИО со СВ, в этом сообщении исследуется реакция обмена водорода на модельных каталитических центрах, представленных кластерами оксида алюминия строения H(–Al–O–)3(OH)6 и HH+(–Al–O–)3(OH)6 [23]. Для этого были проведены экспериментальные исследования реакции ВТКИО в нанесенном на оксид алюминия мексидоле и для реакции обмена водорода выполнены расчеты MP2 и расчеты с использованием метода функционала энергии от электронной плотности DFT B3LYP/6-31G* с полной оптимизацией энергии и расчетом частот нормальных колебаний.
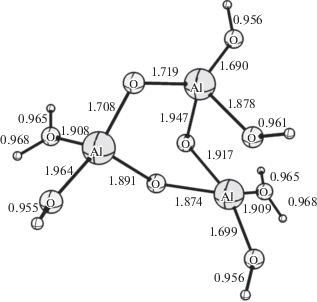
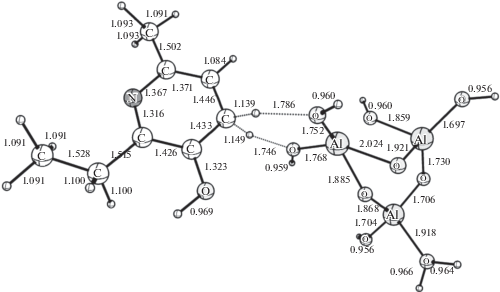
В результате DFT-расчетов реакции обмена водорода между мексидолом и модельными кислотными каталитическими центрами HAl(OH)4, HH+Al(OH)4, H(–Al–O–)3(OH)6 и HH+(–Al–O–)3 (OH)6 были найдены структуры переходных состояний и рассчитаны значения энергии реакции (табл. 1). Из приведенных в табл. 1 данных следует, что для незаряженных модельных каталитических центров расчетная величина Eact значительно превосходит экспериментально найденную, а наличие положительного заряда на модельном каталитическом центре приводит к резкому снижению величины Eact до уровня величин, найденных экспериментально. Результаты DFT B3LYP/6-31G*-расчетов Eact реакции обмена водорода между кислотными центрами и водородными атомами молекулы мексидола приведены в табл. 1. На рис. 4 показано строение модельного положительно заряженного каталитического центра HH+(–Al–O–)3(OH)6, который образовался после присоединения протона к каталитическому центру H(–Al–O–)3(OH)6.
Для каталитического центра HH+(–Al–O–)3 (OH)6 были выполнены квантово-химические расчеты реакции обмена водорода между органическим соединением и каталитическим центром. На рис. 5 показано строение переходного состояния реакции обмена водорода между заряженным каталитическим центром HH+(–Al–O–)3(OH)6 и мексидолом. Согласно выполненным DFT-расчетам, энергия активации переноса водорода между ароматическим атомом Н(8) и заряженным каталитическим центром составляет 10.78 ккал/моль. Аналогичный расчет энергии активации был выполнен для алифатических водородных атомов в положении H(16). Энергия активации переноса водорода, с помощью DFT-расчета составляет 11.53 ккал/моль. Полученная с помощью DFT-расчета энергия активации для реакции между водородом в Н(8) и Н(16) положениях молекулы мексидола и модельным заряженным каталитическим центром HH+(–Al–O–)3(OH)6, хорошо согласуется с найденной в эксперименте Eact реакции ВТКИО водорода на дейтерий (табл. 1). На основе экспериментальных данных реакции твердофазного изотопного обмена водорода в мексидоле на дейтерий и полученных с помощью DFT-расчета для реакции обмена водорода на каталитических центрах оксида алюминия, был сделан вывод о механизме реакции ВТКИО. Таким образом, механизм реакции ВТКИО может быть представлен как одноцентровый синхронный обмен водорода между адсорбированным соединением и заряженными кислотными каталитическими центрами бренстедовского типа, образовавшимися на поверхности носителя под действием СВ.
Рис. 5.
Переходное состояние реакции обмена водорода между Н(8) мексидола и кластером окиси алюминия HH+[‒Al–O–]3[OH]6, несущим положительный заряд.
Работа поддержана Программой фундаментальных исследований президиума РАН, “Молекулярная и клеточная биология и постгеномные технологии”.
Список литературы
Conner W.C., Falconer J.L. // Chem. Rev. 1995. V. 95. P. 759.
Panayotov D.A., Burrows S.P., Yates J.T., Morris J.R. // J. Phys. Chem. C. 2011. V. 115. P. 22400.
Parambhath V.B., Nagar R., Sethupathi K., Ramaprabhu S. // Ibid. 2011. V. 115. P. 15679.
Conradie J., Gracia J., Niemantsverdriet J.W. // Ibid. 012. V. 116. P. 25362.
Prins R., Palfi V.K., Reiher M. // Ibid. 2012. V. 116. P. 14274.
Yang M., Nakamura I., Fujuimoto K. // J. Applied Catal., General. 1996. V. 144. P. 221.
Stumbo A.M., Grande P., Delmon B. // Studies in Surface Science and Catalysis. 1997. V. 112. P. 211.
Roessner F., Roland U., Braunschweig T. // J. Chem. Soc. Faraday Trans. 1995. V. 91. P. 1536.
Gutsze A., Roland U., Karger H.G. // Stud. Surf. Sci. Catal. 1997. V. 112. P. 417.
Holmberg M., Lundström I. // J. Appl. Surf. Sci. 1996. V. 93. P. 67.
Ярославцев А.Б. // Успехи химии. 1994. Т. 63. С. 449.
Zolotarev Yu.A., Dorokhova E.M., Nezavibatko V.N. et al. // Amino Acids. 1995. V. 8. P. 353.
Zolotarev Yu.A., Dadayan A.K., Borisov Yu.A. et al. // J. Phys. Chem. C. 2013. V. 117. № 33. P. 16878.
Zolotarev Yu.A., Dadayan A.K., Borisov Yu.A., Kozik V.S. // Chem. Rev. 2010. V. 110. P. 5425.
Gaussian 09W, Version 7.0, Copyright 1995-09 Gaussian, Inc.
Parr R.G., Yang Y. Density-Functional Theory of Atoms and Molecules. Oxford: Oxford Univ. Press, 1989.
Becke A.D. // Phys. Rev. A. 1988. V. 38. P. 3098.
Lee C., Yang W., Parr R.G. // Phys. Rev. B. 1988. V. 37. P. 785.
Gonzalez C., Schlegel H.B. // J. Phys. Chem. 1990. V. 94. № 14. P. 5523.
Schlegel H.B., Robb M.A. // Chem. Phys. Lett. 1982. V. 93. № 1. P. 43.
Schlegel H.B. Geometry Optimization on Potential Energy Surfaces, in Modern Electronic Structure Theory / Ed. by D.R. Yarkony. Singapore: World scientific Publishing, 1995.
Дадаян А.К., Борисов Ю.А., Бочаров Э.В. и др. // Докл. АН. 2019. Т. 484. № 3. С. 307.
Чукин Г.Д. Строение оксида алюминия и катализаторов гидрообессеривания. Механизмы реакций. М.: Типография Паладин, ООО “Принта”, 2010. 288 с.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии