Журнал физической химии, 2021, T. 95, № 2, стр. 192-196
Термохимические свойства бис-фенилпропиолата трифенилсурьмы Ph3Sb(OC(O)С≡СPh)2
Д. В. Лякаев a, А. В. Маркин a, *, П. Е. Горюнова a, Н. Н. Смирнова a, А. В. Князев a, В. В. Шарутин b, О. К. Шарутина b
a Национальный исследовательский Нижегородский государственный университет им. Н.И. Лобачевского
Нижний Новгород, Россия
b Национальный исследовательский Южно-уральский государственный университет
Челябинск, Россия
* E-mail: markin@calorimetry-center.ru
Поступила в редакцию 10.05.2020
После доработки 10.05.2020
Принята к публикации 24.05.2020
Аннотация
В калориметре сгорания со статической бомбой определена энергия сгорания кристаллического бис-фенилпропиолата трифенилсурьмы при Т = 298.15 K. По полученным экспериментальным данным рассчитаны стандартная энтальпия сгорания указанного вещества в кристаллическом состоянии при T = 298.15 K и проведен расчет стандартных функций образования изученного соединения ∆fH°, ∆fG° в кристаллическом состоянии при T = 298.15 K.
Металлорганические соединения широко исследуются в связи с возможностью их потенциального применения в различных областях науки, техники и биомедицины [1, 2]. В частности, сурьмаорганические производные используются в качестве катализаторов и реагентов в органическом синтезе [3–8], фотокатализаторов при разложении полимерных материалов [9], поглотителей углекислого газа [10] элементов солнечных батарей [11]. Кроме того, органические комплексы сурьмы проявляют высокую противоокислительную, противоопухолевую, противомалярийную и антибактериальную активность [12–18] и находят применение против лейшманиоза и гепатита С [19, 20]. Также производные сурьмы широко используются для синтеза металлсодержащих полимеров, обладающих фунгицидными и биоцидными свойствами [21–23], термостойкостью и радиорезистентностью [24, 25].
Термодинамические характеристики соединений сурьмы необходимы для расчета и оптимизации технологических процессов с их участием.
В работах [26–30] методами прецизионной калориметрии были определены термодинамические свойства производных пятивалентной сурьмы Ph3SbX2, где X – органические заместители. Термохимические характеристики (ΔcU°, ∆cH°, ∆fH°) Ph3Sb(OС(O)C≡CPh)2 в литературе отсутствуют.
Настоящая работа посвящена калориметрическому определению энтальпии сгорания ΔсН°, расчету стандартной энтальпии образования ∆fH°, стандартной функции Гиббса образования ∆fG° в кристаллическом состоянии при T = 298.15 K бис-фенилпропиолата трифенилсурьмы.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Характеристика изученного образца
Исследованное соединение было синтезировано и идентифицировано по методике, описанной в работе [31].
Образец бис-фенилпропиолата трифенилсурьмы был получен по реакции, протекающей в эфире (10 мл) с участием трифенилсурьмы и фенилпропиоловой кислоты (0.333 г, 1.700 ммоль) в присутствии 70%-го раствора трет-бутилгидропероксида. Смесь выдерживалась на водяной бане в течение 12 часов. В результате были получены бесцветные кристаллы; целевой выход реакции достигал 99%:
(1)
$\begin{gathered} {\text{P}}{{{\text{h}}}_{{\text{3}}}}{\text{Sb}} + {\text{2НOС}}({\text{O}}){\text{C}}{\kern 1pt} \equiv {\kern 1pt} {\text{CPh}} + tert{\text{ - BuOOH}} \to \\ \to {\text{P}}{{{\text{h}}}_{{\text{3}}}}{\text{Sb}}{{({\text{OС(O)C}}{\kern 1pt} \equiv {\kern 1pt} {\text{CPh}})}_{2}} + tert{\text{ - BuOH}} + {{{\text{H}}}_{{\text{2}}}}{\text{O}}. \\ \end{gathered} $Полученное соединение было идентифицированно методом элементного анализа: найдено (%) Sb 18.89, С 67.18, Н 3.88, для формулы C36H25O4Sb рассчитано (%): Sb 18.92, С 67.21, Н 3.92. Элементный анализ был проведен на анализаторах “Carlo Erba CHNS-O EA 1108” для углерода и водорода и на “Shimadzu EDX-720” для сурьмы.
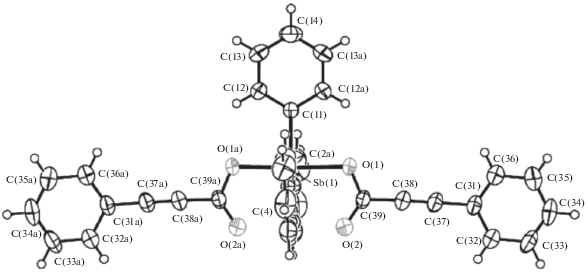
Структура соединения бис-фенилпропиолата трифенилсурьмы была охарактеризована методами ИК-спектроскопии и рентгеноструктурного анализа (рис. 1). ИК-спектр (ν, см–1) был записан на спектрометре Bruker Tensor 27 в области 4000–400 см–1: 3057, 2201, 1621, 1574, 1544, 1488, 1479, 1433, 1313, 1239, 1224, 1190, 1188, 1158, 1066, 1020, 996, 926, 773, 765, 746, 734, 690, 609, 469, 454, 447.
Рентгеноструктурный анализ был проведен на четырехкружном диффрактометре Bruker D8 QUEST (графитовый монохроматор, MoKα-излучение, θ/2θ-сканирование). Исследование показало, что кристаллы моноклинные a = = 13.6536(11), b = 20.7096(17), c = 12.2683(15) Å, β = 122.820(2)°, V = 2915.3(5) Å3, пр. гр. Р21/n, Z = 4, ρ (рассчит.) = 1.466 г/см3. Атом сурьмы в Ph3Sb(OС(O)C≡CPh)2 имеет искаженную тригонально-бипирамидальную координацию с фенилпропиолатными лигандами в аксиальных положениях.
Содержание основного вещества в образце Ph3Sb(OС(O)C≡CPh)2 составляло 99.0 мол. %. Примеси не были идентифицированы, но, учитывая их количество, можно заключить, что они не влияли на значения термодинамических величин в пределах погрешностей их определения.
Аппаратура и методика измерений. Энтальпию сгорания исследуемого соединения определяли в усовершенствованном калориметре В-08МА со статической калориметрической бомбой [32]. Отметим, что калибровку калориметрической системы проводили по эталонной бензойной кислоте марки К-2 (ΔсU= −(26454.4 ± 2.2) Дж/г) при взвешивании на воздухе). Энергетический эквивалент системы W = 14805 ± 3 Дж/K с удвоенным квадратичным отклонением от среднего результата 0.02%.
Образец сжигали при давлении кислорода 3 × × 106 Па в расплавленном парафине, наличие которого, с одной стороны, обеспечивало стандартный подъем температуры в опытах, с другой – создавало условия для полного окисления исходной навески. Газообразные продукты сгорания анализировали на содержание СО2, по количеству которого рассчитывали массу взятого для опыта вещества. Методика проведения анализа газообразных продуктов сгорания приведена в работе [33]. Точность определения СО2, установленная по результатам анализа сгорания эталонной бензойной кислоты, 5 × 10–4 г. Полноту сгорания определяли по отсутствию в продуктах сгорания монооксида углерода путем пропускания исследуемого газа через специальные индикаторные трубки. В пределах погрешности анализа (6 × 10–6 г) CO не был обнаружен. Визуальный осмотр поверхности бомбы не обнаружил никаких следов неполного сгорания вещества. После опыта был проведен рентгенофазовый анализ твердых продуктов сгорания.
Для приведения измеренной величины ∆cU к стандартным условиям (∆cU°) использовали приближенную формулу Уошберна [34, 35]:
(2)
$\pi = \frac{{0.30P}}{{ - {{\Delta }_{{\text{c}}}}U{\text{/}}a}}\left[ { - 1 + 1.1\left( {\frac{{b - 2c}}{{4a}}} \right) - \frac{2}{p}} \right],$С учетом поправки Уошберна (π) и поправки, обусловленной изменением числа молей газов (Δn), рассчитывали стандартные величины ΔсU° и ΔсН° для реакции сгорания исследуемого вещества. По полученным значениям ΔсН° рассчитывали энтальпию образования ΔfH° соединению в кристаллическом состоянии при Т = 298.15 K.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Энергию сгорания бис-фенилпропиолата трифенилсурьмы Ph3Sb(OС(O)C≡CPh)2 определяли в семи опытах. Масса навески составляла ∼0.2 г. Данные экспериментов представлены в табл. 1.
Таблица 1.
Результаты опытов по определению энергии сгорания бис-фенилпропиолата трифенилсурьмы Ph3Sb(OC(O)С≡СPh)2 (M = 643.35 г/моль)
| Значения | Опыт № 1 | Опыт № 2 | Опыт № 3 | Опыт № 4 | Опыт № 5 | Опыт № 6 | Опыт № 7 |
|---|---|---|---|---|---|---|---|
| m, г | 0.14736 | 0.17185 | 0.18390 | 0.17382 | 0.18404 | 0.21308 | 0.16118 |
| m(пар), г | 0.71959 | 0.72130 | 0.72326 | 0.72565 | 0.73092 | 0.73158 | 0.73140 |
| m(х.н.), г | 0.00234 | 0.0022 | 0.00200 | 0.00195 | 0.00203 | 0.00173 | 0.00172 |
| W, Дж/г | 14 805 | 14 805 | 14 805 | 14 805 | 14 805 | 14 805 | 14 805 |
| ΔT, K | 2.55773 | 2.60983 | 2.63888 | 2.62794 | 2.66422 | 2.72144 | 2.62152 |
| q, Дж | 37 867.2 | 38 638.5 | 39 068.6 | 38 906.7 | 39 443.8 | 40 290.9 | 38 811.6 |
| q(пар), Дж | 33 636.3 | 33 716.2 | 33 807.8 | 33 919.5 | 34 165.9 | 34 196.7 | 34 188.3 |
| q(х.н.), Дж | 39.2 | 36.8 | 33.5 | 32.6 | 34.0 | 29.0 | 28.8 |
| q(сажа), Дж | 5.48 | 6.39 | 6.84 | 6.46 | 6.84 | 7.92 | 5.99 |
| q(HNO3), Дж | 4.10 | 4.69 | 4.69 | 6.44 | 5.27 | 5.86 | 4.69 |
| q(Sb2O3), Дж | 3.61 | 4.20 | 4.50 | 4.25 | 4.50 | 5.21 | 3.94 |
| −Δcu°, Дж/г | 28 465.5 | 28 449.8 | 28 447.4 | 28 514.9 | 28 512.5 | 28 485.0 | 28 524.3 |
| −ΔсU°, Дж/моль | 18 313.3 | 18 303.2 | 18 301.6 | 18 345.0 | 18 343.5 | 18 325.8 | 18 351.1 |
Обозначения: m – масса сжигаемого вещества, ∆Т – подъем температуры в опыте с поправкой на теплообмен; q(пар), q(х.н.), q(сажа), q(HNO3), q(Sb2O3) – поправки на энергию сгорания парафина, хлопчатобумажной нити, неполноту сгорания углерода, энергии образования водного раствора HNO3 и кристаллического Sb2O3 соответственно; Δcu° – удельная энергия сгорания исследуемого вещества, приведенная к стандартным условиям; ΔсU° – мольная энергия сгорания исследуемого вещества, приведенная к стандартным условиям. ∆сU° = –(18326.2 ± 7.8) кДж/моль – среднее значение.
После опыта проводили анализ продуктов сгорания. По данным рентгенофазового анализа, твердые продукты сгорания дибензоата трифенилсурьмы содержали тетраоксид сурьмы Sb2O4 (85 мас. %), триоксид сурьмы Sb2O3 (15 мас. %). В продуктах сгорания сурьмы в свободном виде не обнаружено.
Погрешность рентгенофазового анализа не превышает 3%, что существенно не искажает экспериментального значения энтальпий сгорания. Поскольку продукты сгорания наряду с тетраоксидом сурьмы содержали триоксид сурьмы, то нами вводились соответствующие поправки на неполное окисление металла.
(3)
${\text{S}}{{{\text{b}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}{\text{(кр}}{\text{.)}} + 0.5{{{\text{O}}}_{{\text{2}}}}{\text{(г)}} \to {\text{S}}{{{\text{b}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{4}}}}{\text{(кр}}{\text{.)}}.$Принимая во внимание мольное содержание оксидов и значение энтальпии реакции (3), рассчитанной по энтальпиям образования ∆fH°(Sb2O3(кр.)) = = −715.46 ± 3.422 кДж/моль [36], ∆fH°(Sb2O4(кр.)) = = −907.509 ± 4.602 кДж/моль [36], установлено, что величина поправки на неполное окисление металла (3–6 Дж) не существенно влияет на конечное значение ∆cU(≈30 000 Дж).
Кроме того, при вычислении ΔUc вносили обычные термохимические поправки: на сгорание хлопчатобумажной нити используемой для поджигания навески вещества (CH1.686O0.843 [37], ∆cU(х.н) = –(16736.0 ± 11.1) Дж/г), сгорание применявшегося парафина (н-гексадекан, массовая доля > 99.9%, ΔсU(пар) = –(46744 ± 8) Дж/г) и образование раствора HNO3 (∆rH° = –59.7 кДж/моль для 0.1 моль/л HNO3(р) из простых веществ N2(г), O2(г) иH2O(ж) [38]).
Процесс, протекающий в бомбе, может быть описан уравнением:
(4)
$\begin{gathered} {\text{P}}{{{\text{h}}}_{{\text{3}}}}{\text{Sb(OC(O)C}}{\kern 1pt} \equiv {\kern 1pt} {\text{CPh}}{{{\text{)}}}_{{\text{2}}}}{\text{(кр)}} + 41.25{{{\text{О}}}_{2}}{\text{(г)}} \to \\ \to 36{\text{С}}{{{\text{О}}}_{2}}{\text{(г)}} + 12.5{{{\text{Н}}}_{{\text{2}}}}{\text{О}}({\text{ж}}) + 0.5{\text{S}}{{{\text{b}}}_{{\text{2}}}}{{{\text{O}}}_{4}}({\text{к}}). \\ \end{gathered} $При вычислении стандартной энтальпии сгорания кристаллического бис-фенилпропиолата трифенилсурьмы вводили также поправку Уошберна (π = –0.04782%) и поправку на изменение числа молей газообразных реагентов реакции сгорания (Δn = –5.25 моль) в соответствии с [34, 35]. В результате стандартная энтальпия сгорания кристаллического Ph3Sb(OC(O)C≡CPh)2 при Т = = 298.15 K:
По величине стандартной энтальпии сгорания вещества и стандартной энтальпии образования продуктов сгорания ∆fH°(CO2(г)) = –393.513 ± ± 0.046 кДж/моль [36], ∆fH°(H2O(ж)) = –285.829 ± ± 0.040 кДж/моль [36], ∆fH°(Sb2O4(кр.)) = –907.509 ± ± 4.602 кДж/моль [36], рассчитали стандартную энтальпию образования исследуемого соединения в кристаллическом состоянии при T = 298.15 K:
По рассчитанному значению ∆fH° исследованного соединения и значению стандартной энтропии образования ΔfS°(298.15, Ph3Sb(OC(O)C≡ CPh)2 кр.) = –(1536 ± 5) Дж/(K моль) [27], была определена стандартная функция Гиббса образования (∆fG°, кДж/моль):
(5)
$\begin{gathered} {\text{Sb(кр}}{\text{.)}} + 36{\text{С(гр}}{\text{.)}} + 12.5{{{\text{H}}}_{{\text{2}}}}{\text{(г)}} + 2{{{\text{O}}}_{{\text{2}}}}{\text{(г)}} \to \\ \to {\text{P}}{{{\text{h}}}_{{\text{3}}}}{\text{Sb(OC(O)C}}{\kern 1pt} \equiv {\kern 1pt} {\text{CPh}}{{{\text{)}}}_{{\text{2}}}}{\text{(кр}}{\text{.)}}, \\ \end{gathered} $Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований (код проекта № 19-33-90070) и Министерства науки и высшего образования Российской Федерации (Госзадание Проект № 0729-2020-0039).
Список литературы
Tiekink E.R.T. // Critical Reviews in Oncology, Hematology. 2002. V. 42. P. 225.
Sharma P., Perez D., Cabrera A. et al. // Acta Pharmacol. Sin. 2008. V. 29. P. 881.
Kakusawa N., Tobiyasu Y., Yasuike S. et al. // J. Organomet. Chem. 2006. V. 691. P. 2953.
Nianyuan Tan, Tong Nie, Chak-Tong Au et al. // Tetrahedron Letters. 2017. V. 58. P. 2592.
Додонов В.А., Гущин А.В., Горькаев Д.А. // Изв. РАН. Сер. хим. 2002. № 6. С. 965.
Moiseev D.V., Gushchin A.V., Shavirin A.S. et al. // J. Organomet. Chem. 2003. V. 667. P. 176.
Гущин А.В., Моисеев А.В., Додонов В.А. // Изв. РАН. Сер. хим. 2001. № 50. С. 1291.
Гущин А.В., Короткова М.В., Малышева Ю.В. и др. // Там же. 2006. № 55. С. 679.
Xiao-Yin Zhang, Lian-sheng Cui, Xia Zhang et al. // J. Mol. Struct. 2017. V. 1134. P. 742.
Dostal L., Jambor R., Ruzicka A. et al. // Organometallics. 2009. V. 28. P. 2633.
Karunakara M.B., Priyadharsini K., Anupriya S. et al. // J. Mater. Chem. A. 2017. V. 5. P. 20843.
Keppler B.K. // Metal complexes in cancer chemotherapy, VCH, Weinheim. 1993.
Kopf-Maier P. // European J. Clinical Pharm. 1994. V. 47. P. 1.
Alama A., Tasso B., Novelli F. et al. // Drug Discov. Today. 2009. V. 14. P. 500.
Hadjikakou S.K., Ozturk I.I., Banti C.N. et al. // J. Inorg. Biochem. 2015. V. 153. P. 293.
Urgut O.S., Ozturk I.I., Banti C.N. et al. // Mater. Sc. Eng. C. 2016.V. 58. P. 396.
Rodrigues B.L., Marzano I.M., Perreira-Maia E.C. et al. // European J. Medic. Chem. 2016.V. 109. P. 254.
Wang G.-C., Xiao J., Yu L. et al. // J. Organomet. Chem. 2004. V. 689. P. 1631.
Berman J. // Curr. Opin. Infect. Dis. 2003. V. 16. P. 397.
Gielen M., Tiekink E.R.T. // John Wiley & Sons, Chichester 2005. P. 441.
Naka K., Nakahashi A., Chujo Y. // Macromolecules. 2006. V. 398. P. 257.
Naka K. // Polymer J. 2008. V. 40. P. 1031.
Chujo Y. // Conjugated Polymer Synthesis, Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim. 2010.
Carraher C.E., Sheats J.E., Jr., Pittman C.U., Jr. et al. // Organometallic Polymers, Jr., Eds., New York: Academic, 1978. P. 107.
Carraher C.E., Roner M.R., Thibodeau R. et al. // Inorg. Chimica Acta. 2014. V. 423. P. 123.
Smirnova N.N., Letyanina I.A., Larina V.N. et al. // J. Chem. Thermodyn. 2009. V. 41. P. 46.
Lyakaev D.V., Markin A.V., Smirnova N.N. et al. // Thermochimica Acta. 2020. in press.
Лякаев Д.В., Маркин А.В., Смирнова Н.Н. и др. // Журн. физ. химии. 2020. Т. 94. № 9. С. 1.
Lyakaev D.V., Markin A.V., Smirnova N.N. et al. // J. Therm. Anal. Calorim. 2018. V. 133. P. 1143.
Маркин А.В., Лякаев Д.В., Смирнова Н.Н. и др. // Журн. физ. химии. 2020. Т. 94. № 1. С. 6.
Шарутин В.В., Шарутина О.К., Котляров А.Р. // Журн. неорган. химии. 2015. Т. 60. P. 525.
Кирьянов К.В., Тельной В.И. Тр. по химии и хим. технологии: Межвуз. сб. Горький: Горьк. гос. ун-т, 1975. С. 109.
Лебедев Ю.А., Мирошниченко Е.А. Термохимия парообразования органических веществ. М.: Наука, 1981. 214 с.
Скуратов С.М., Колесов В.П., Воробьев А.Ф. // Термохимия. В 2 т. Т. 2. М.: изд-во МГУ, 1966. 436 с.
Washburh E.W. Standard states for bomb calorimeter // J. Res. Natl. Bur. Standards. 1933. V. 10. P. 525.
Термические константы веществ: Справочник / Под ред. Глушко В.П. М.: ВИНИТИ. 1965–1981. Вып. I–X.
Rossini F.D. Experimental Thermochemistry, Interscience, New York, 1956 (Chapter 3; Chapter 4, Chapter 5).
The NBS Tables of Chemical Thermodynamic Properties // J. Phys. Chem. Ref. Data 11 (Suppl. no. 2) 1982.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии