Журнал физической химии, 2021, T. 95, № 2, стр. 183-191
Термодинамические свойства раствора 2-этоксиэтанола в авиационном керосине
М. Н. Мамонтов a, *, А. П. Ощенко b
a Московский государственный университет им. М.В. Ломоносова, Химический факультет
Москва, Россия
b ФАУ “25 ГосНИИ химмотологии Минобороны России”
Москва, Россия
* E-mail: mamontovmn@gmail.com
Поступила в редакцию 25.04.2020
После доработки 30.05.2020
Принята к публикации 10.06.2020
Аннотация
На основании ранее опубликованных экспериментальных данных по составу пара, находящегося в равновесии с топливом для реактивных двигателей с добавкой 2-этоксиэтанола (этилцеллозольва) в концентрации от 0.1 до 0.5 мас. %, удалось дать описание парожидкостных равновесий термодинамическими моделями Вильсона и Ван-Лаара. Построенные модели позволили рассчитать ряд термодинамических свойств, таких как коэффициент активности, давление насыщенного пара, активность в интересующем диапазоне концентраций при температуре кипения раствора. Проведена экстраполяция рассчитанных высокотемпературных свойств к комнатной температуре.
В топливо для реактивных двигателей перед заправкой в летательный аппарат при необходимости полетов на большой высоте и в условиях длительного полета допускается вводить противоводокристаллизационную жидкость (ПВКЖ). В настоящее время в качестве ПВКЖ допущен к применению 2-этоксиэтанол (коммерческое название – этилцеллозольв технический по ГОСТ 8313). Этилцеллозольв (ЭЦ) представляет собой этиловый эфир этиленгликоля, 99.5% чистоты. Он является одновременно алифатическим спиртом и простым эфиром. Его химические свойства заметно отличаются от свойств углеводородов, входящих в состав топлива. А именно, ЭЦ может растворяться в полимерных материалах или растворять их, вызывая изменение физических и эксплуатационных свойств. Заранее предсказать ресурс полимерного материала, находящегося в контакте с ЭЦ и его растворами в топливе невозможно. По этой причине обязательным условием для допуска к применению материалов, находящихся в контакте с топливом в топливной системе летательного аппарата является проведение испытаний. Только при положительных результатах таких испытаний материал может быть допущен к применению.
Проблема заключается в разработке адекватной методики испытаний, то есть в выборе температуры, контактной среды и времени контакта. В литературе имеются примеры с описанием испытаний материалов в климатической камере, моделирующей условия эксплуатации материала – “теплое топливо–холодная стенка”. В такой климатической камере пластины с нанесенным на них материалом выдерживаются на стенках, охлаждаемых до температур минус 30°С и ниже, а температуру топлива поддерживают 20–25°С [1]. В результате конденсации паров топлива с присадкой на поверхности испытуемого материала формируется симуляционная среда, которая по мнению авторов методики соответствует составу конденсата, попадающего на стенки топливного бака летательного аппарата.
Технический ЭЦ кипит в диапазоне температур 134–138°С, а топливо для реактивных двигателей марок Jet-A1, ТС-1 и РТ в диапазоне 135–280°С. Авторы собрали статистическую выборку по средней температуре кипения топлива (под средней температурой кипения здесь понимается среднее значение температур выкипания фракций с объемными долями 10, 50 и 90%) для 25 образцов топлив для реактивных двигателей, произведенных отечественной промышленностью в период 2017–2019 гг. По нашим данным значение средней температуры кипения для топлив марок ТС-1 и РТ находится в диапазоне 175.7–193.0°С, причем для топлива марки ТС-1 этот диапазон составляет 181.3–193°С, а для топлива РТ соответственно 175.7–186.7°С.
Сравнение данных по средним температурам кипения топлива и ЭЦ показывает, что пар, находящийся в равновесии с топливом, должен обогащаться более летучим ЭЦ, а при охлаждении пара на холодных стенках состав образующегося конденсата будет соответствовать составу равновесного пара, соответствующего температуре топлива. Таким образом, содержание более летучего ЭЦ в конденсате может заметно превышать его концентрацию в топливе. По этой причине проведение испытаний материалов с топливом, содержащим штатное количество ЭЦ (не более 0.5%) не позволяет получить объективные данные о коррозионной стойкости материала к топливу. Такие испытания следует проводить в симуляционных средах, состав которых отражает состав конденсата, появляющегося на холодных стенках камеры в условиях полета при отрицательных температурах окружающего воздуха.
Углеводородный состав топлива для реактивных двигателей зависит от технологии получения и может изменяться в широких пределах. В удовлетворительном приближении можно рассматривать топливо как раствор индивидуальных химических веществ, давление паров которых подчиняется закону Рауля, так как концентрация каждого индивидуального вещества в смеси относительно невелика – не более единиц мольных процентов для нескольких веществ (из класса н-алканов) и долей мольного процента для химических веществ групп изо-алканов, алкил-ароматики и циклоалканов.
Подчинение закону Рауля парциального давления пара индивидуального химического вещества в растворе означает, что эта величина равна произведению давления пара чистого индивидуального вещества при данной температуре и мольной доли этого вещества в жидком растворе. Сделав такое предположение, можно экспериментально определить содержание ЭЦ в парах, находящихся в равновесии с топливом, содержащим различные концентрации ЭЦ, и по полученным значениям определить температуру образования капель конденсата ЭЦ, появляющегося на холодных стенках топливных баков.
Давление пара этилцеллозольва (ЭЦ) и индивидуальных углеводородов из топлива
Данные по давлению насыщенного пара индивидуальных химических веществ, входящих в состав топлива установлены надежными экспериментальными методами. В экспериментальной работе [2] получены коэффициенты уравнения Антуана для 60 углеводородов, входящих в состав легкой керосиновой фракции нефти, а в справочнике [3] опубликовано выражение:
(1)
$\begin{gathered} \lg P_{{1s}}^{0}\;[{\text{ммHg]}} = 115.8686 - \frac{{6012.8}}{T} - \\ - \;40.900\lg (T) + 0.020888T + 1.6481 \times {{10}^{{ - 15}}}{{T}^{2}} \\ \end{gathered} $Сравнение температурных зависимостей давления насыщенного пара над жидким чистым ЭЦ и аналогичных температурных зависимостей для чистых жидких углеводородов, представляющих три основных группы (нормальные алканы, изоалканы, алкил-ароматические углеводороды) входящих в состав легкой керосиновой фракции, выкипающей в пределах 130–150°С, проведено в [4].
Анализ информации, выполненный в [4], позволяет предположить, что в широком температурном интервале состав пара над жидкой смесью углеводородов и ЭЦ не изменяется, за исключением изо-алканов, которые обнаруживают в области температур 50–150°С несколько большую летучесть по сравнению с ЭЦ. Это означает, что, установив состав пара при температуре начала кипения жидкой смеси топлива с ЭЦ можно с высокой достоверностью распространить эти результаты на область более низких температур и отнести их к составу пара, находящегося в равновесии с жидкой фазой при температуре 25°С и ниже.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Давление пара этилцеллозольва (ЭЦ) в растворе с топливом определялось экспериментально в настоящей работе. Для экспериментальных исследований были взяты три коммерческих образца топлива для реактивных двигателей с разным фракционным составом, при этом разница температур конца и начала кипения (∆tкип) составляла 36.9, 57.5 и 83.0°С. Температурные свойства керосина различных марок приведены в табл. 1.
Таблица 1.
Информация о марках керосина, полученная в настоящей работе
| № | Марка керосина | tкип, °C (нач.) | tкип, °C (средн.) | Δtкип, °C |
|---|---|---|---|---|
| 1 | ‘JetA-1’ | 150 | 168.4 | 36.9 |
| 2 | ‘ТС-1’ | 145 | 173.5 | 57.5 |
| 3 | ‘РТ’ | 145 | 186.7 | 83.0 |
Приведенная в табл. 1 величина ∆tкип определялась в топливе в соответствии с требованиями ГОСТ Р ЕН ИСО 3405-2007 или ГОСТ 2177-99 в условиях воздушной перегонки в колбе Энглера, имитирующей перегонку с одной теоретической тарелкой.
Подробности применявшейся методики определения состава пара от состава раствора ЭЦ в топливе описаны в [4]. Экспериментальные результаты представлены в табл. 2.
Таблица 2.
Экспериментальные данные по составу раствора ЭЦ – керосин и его насыщенного пара при температуре кипения, полученные в настоящей работе
| № | x1 | wx | y1 | wy |
|---|---|---|---|---|
| 1 | 0.0014 | 0.100 | 0.0569 | 4.009 |
| 1 | 0.0018 | 0.126 | 0.0641 | 4.528 |
| 1 | 0.0030 | 0.208 | 0.0939 | 6.693 |
| 2 | 0.0015 | 0.100 | 0.0459 | 3.226 |
| 2 | 0.0022 | 0.149 | 0.0544 | 3.827 |
| 2 | 0.0029 | 0.200 | 0.0636 | 4.492 |
| 2 | 0.0045 | 0.314 | 0.0793 | 5.629 |
| 2 | 0.0081 | 0.564 | 0.1168 | 8.389 |
| 3 | 0.0013 | 0.092 | 0.0338 | 2.366 |
| 3 | 0.0032 | 0.221 | 0.0329 | 2.303 |
| 3 | 0.0053 | 0.364 | 0.0303 | 2.118 |
| 3 | 0.0099 | 0.684 | 0.0203 | 1.412 |
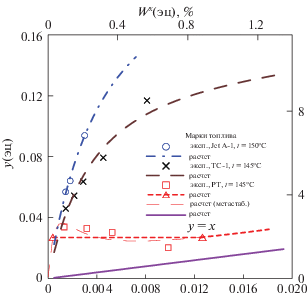
Экспериментальные данные по массовой доле ЭЦ в парах в зависимости от его содержания в жидком топливе, находящемся в равновесии с паром, нанесены в виде отдельных символов на рис. 1. Результаты представлены для трех марок топлива, различающихся по фракционному составу, а именно по разности температур начала и конца кипения (∆tкип).
Рис. 1.
Зависимости состав пара (y1 – мольная доля ЭЦ в паре) от состава раствора ЭЦ – керосин (x1 – мольная доля ЭЦ в растворе) при температуре кипения раствора и атмосферном общем давлении. Прямая, соединяющая треугольники отвечает области расслаивания жидкости для образца РТ; эксп – экспериментальные данные, расчет – расчет по модели с параметрами из табл. 3, wy, wx – массовая доля ‘ЭЦ’ в паре, растворе соответственно (%).
ТЕРМОДИНАМИЧЕСКИЙ РАСЧЕТ
Описание модели
Применение термодинамических моделей для описания экспериментальной информации позволяет, в частности, найти термодинамические свойства системы во всем рассматриваемом диапазоне составов фаз, проанализировать фазовый состав исследуемой смеси веществ и определить оптимальные (т.е. оптимизировать), с точки зрения соответствия всем экспериментальным данным, зависимости свойств от внешних переменных, таких как давление, температура, валовой состав. Правильная экстраполяция формул модели за пределы экспериментального диапазона составов позволяет сделать прогноз поведения системы в более широких по сравнению с изученными областях изменения переменных.
По данным [5] керосин марки JetA-1 представляет собой сложную смесь алканов (50–65 об. %), моно- и полиароматических (10–20 об. %) соединений, циклоалканов или нафтенов (моно- и полициклических (20–30 об. %)). Наибольшими концентрациями обладают нормальные алканы.
В состав керосина марок ТС-1 и РТ входят нормальные алканы (30–45 об. %), изоалканы (15–25 об. %), циклоалканы (20–30 об. %), ароматические углеводороды (10–25 об. %), полиароматические углеводороды (менее 1.5 об. %), гетероатомные соединения (с серой, кислородом и азотом) (менее 1.0 об. %).
С термодинамической точки зрения, рассматриваемые образцы представляют собой многокомпонентные смеси. В литературе есть примеры термодинамического описания парожидкостных равновесий, при которых целая группа органических веществ, входящих в систему, рассматривалась как один компонент. Например, авторы [6] изучили систему растительное масло–этанол–гексан. Использовались такие разновидности растительного масла как хлопковое, кукурузное, каноловое, соевое. Как следует из [7], растительные масла состоят в основном из триацилглицеридов, то есть сложных эфиров, в которых одна молекула глицерина связана с тремя молекулами жирных кислот, а также из небольшого количества других веществ, таких как свободные жирные кислоты, частично гидролизованных ацилглицеролов (моно- и ди-ацилглицеролы), фосфолипидов, стеролов, токоферолов, токотриенолов, витаминов, каротинов, хлорофиллов и других красящих веществ. Каждое из масел рассматривалось в [6] как псевдокомпонент в квазитройных системах. Корреляция для термодинамических свойств описывалась при помощи модели NRTL (Non-Random Two Liquid). Полученные зависимости позволили успешно описать расслаивание в жидкой фазе, наблюдаемое в этих системах. Стандартное отклонение рассчитанных от экспериментальных концентраций бинодали составило 0.7%.
В работах [7–9] для описания парожидкостных равновесий в системах растительное масло–спирт (или н-гексан) применялись термодинамические модели UNIQUAC, UNIFAC. Исследовались подсолнечное, рапсовое, соевое сорта продукта. Растительное масло также как и в [6] рассматривалось как один компонент. То есть авторы предполагали, что различные триацилглицериды, содержащиеся в масле, ведут себя в термодинамическом аспекте одинаковым образом, и поэтому могут быть представлены в модели одним псевдокомпонентом, обладающим некоторыми средними физико-химическими свойствами. В оптимизацию наряду с данными по фазовым равновесиям были включены измеренные энтальпии, коэффициенты активности компонентов. Ошибка в описании экспериментальных данных не превысила 7%.
Приведенные примеры побудили нас опробовать подобный подход в отношении раствора ЭЦ в керосине, представляющем собой, как и растительные масла, смесь большого количества углеводородов. То есть в настоящей работе изучаемая система рассматривалась как разбавленный раствор компонента ЭЦ в керосине, считавшегося псевдокомпонентом.
Данные по составу пара над раствором этилцеллозольва (ЭЦ) в керосине в зависимости от его мольной доли в растворе x1 аппроксимировались моделями типичными для описания парожидкостного равновесия. Были опробованы четыре модели: Ван-Лаара, Вильсона, UNIQUAC, Маргулеса [10]. Расчет проводился в предположении идеальности газовой фазы
(2)
$\ln ({{\gamma }_{1}}) = {{A}_{{12}}}{{\left( {\frac{{{{A}_{{21}}}{{x}_{2}}}}{{{{A}_{{12}}}{{x}_{1}} + {{A}_{{21}}}{{x}_{2}}}}} \right)}^{2}}{\kern 1pt} ,\quad \ln (\gamma _{1}^{\infty }) = {{A}_{{12}}},$(3)
$\begin{gathered} \ln ({{\gamma }_{1}}) = - \ln \left( {\sum\limits_{j = 1}^m {{{x}_{j}}} {{\Lambda }_{{1j}}}} \right) + 1 - \sum\limits_{k = 1}^m {\frac{{{{x}_{k}}{{\Lambda }_{{k1}}}}}{{\sum\limits_{j = 1}^m {{{x}_{j}}{{\Lambda }_{{kj}}}} }}} , \\ {{\Lambda }_{{ij}}} = \frac{{V_{j}^{L}}}{{V_{i}^{L}}}\exp \left( { - \frac{{{{\lambda }_{{ij}}} - {{\lambda }_{{ii}}}}}{{RT}}} \right), \\ \end{gathered} $(3a)
$\begin{gathered} \ln ({{\gamma }_{1}}) = - \ln ({{x}_{1}} + {{\Lambda }_{{12}}}{{x}_{2}}) + \\ + \;{{x}_{2}}\left( {\frac{{{{\Lambda }_{{12}}}}}{{{{x}_{1}} + {{\Lambda }_{{12}}}{{x}_{2}}}} - \frac{{{{\Lambda }_{{21}}}}}{{{{x}_{2}} + {{\Lambda }_{{21}}}{{x}_{1}}}}} \right), \\ \ln (\gamma _{1}^{\infty }) = 1 - \ln ({{\Lambda }_{{12}}}) - {{\Lambda }_{{21}}}, \\ {{\lambda }_{{12 - 11}}} = {{\lambda }_{{12}}} - {{\lambda }_{{11}}},\quad {{\lambda }_{{21 - 22}}} = {{\lambda }_{{21}}} - {{\lambda }_{{22}}}. \\ \end{gathered} $ЭЦ считался первым компонентом с мольной долей (x1, y1) в растворе и газовой фазе соответственно, керосин – вторым. Рассчитанные характеристики моделей приведены в табл. 3.
Таблица 3.
Параметры моделей термодинамических свойств растворов ‘ЭЦ’ – керосин при температуре начала кипения
| № | Параметры ${{\lambda }_{{12 - 11}}}$, A12 |
s0 | Параметры ${{\lambda }_{{21 - 22}}}$, A21 |
s0 | s0(γ1), % | Модель | N |
|---|---|---|---|---|---|---|---|
| 1 | 18 479.33 | 1.6 × 104 | –5087.42 | 5.7 × 103 | 2.9 | Вильсон | 3 |
| 2 | 18 748.5 | 1.7 × 103 | –5412.5 | 463 | 8 | Вильсон | 5 |
| 3 | 4.4575 | 0.8 | 0.02696 | 0.01 | 7 | Ван-Лаар | 4 |
Так как по характерной волнообразной форме зависимости экспериментальных значений состава пара от состава образца РТ можно предположить наличие расслаивания в жидкости, то модель Вильсона не может быть применена в данном случае потому, что она не предназначена для описания равновесия между двумя жидкостями. Как известно, модель Ван-Лаара позволяет установить корреляции для системы с разделением жидкой фазы.
Параметры в табл. 3 отвечают наилучшему согласию между рассчитываемыми по формулам моделей значениями коэффициентов активности ЭЦ и вычисленными непосредственно из экспериментальных данных по формуле
в которой Ptot обозначает общее давление пара над раствором, в наших условиях равное атмосферному, $P_{{1s}}^{0}$ – давление насыщенного пара над чистым ЭЦ, для вычисления которого использовалось выражение (1). Вычисленные таким образом значения γ1 можно назвать экспериментальными.Процедура оптимизации для каждой марки топлива заключалась в подборе параметров модели, отвечающих минимуму целевой функции
Концентрационные зависимости парциального давления насыщенного пара ${{P}_{{1s}}}$, активности (a1) и состава пара (y1) над раствором рассчитывались по следующим формулам
(5)
$P_{{1s}}^{{}} = {{\gamma }_{1}}{{x}_{1}}P_{{1s}}^{0},\quad {{a}_{1}} = {{\gamma }_{1}}{{x}_{1}},\quad {{y}_{1}} = \frac{{{{\gamma }_{1}}{{x}_{1}}P_{{1s}}^{0}}}{{{{P}_{{{\text{tot}}}}}}}.$Корреляции
Результаты расчетов показаны на рис. 1–4.
Рис. 2.
Зависимости коэффициента активности γ компонента ЭЦ от состава раствора ЭЦ–керосин при температуре кипения раствора и атмосферном общем давлении; эксп – расчет в экспериментальных точках по (4), расчет – расчет по модели с параметрами из табл. 3.
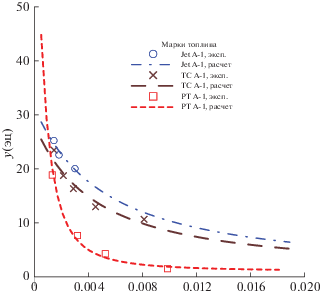
Рис. 3.
Зависимости парциального давления пара P компонента ЭЦ (${{P}_{{1s}}}$) над раствором ЭЦ–керосин от состава раствора при температуре кипения раствора и атмосферном общем давлении; эксп – расчет в экспериментальных точках по (5), расчет – расчет по модели с параметрами из табл. 3.
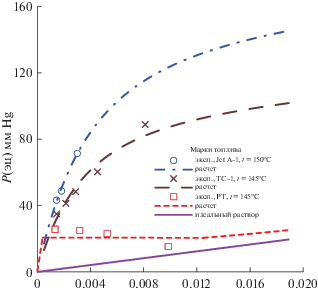
Рис. 4.
Зависимости активности a компонента ЭЦ в растворе ЭЦ–керосин от состава раствора; эксп – расчет в экспериментальных точках по (5), расчет – расчет по модели с параметрами из табл. 3.
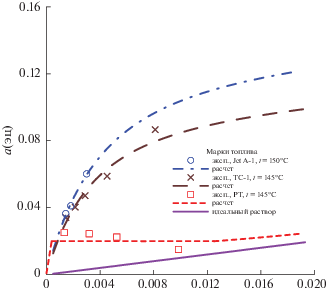
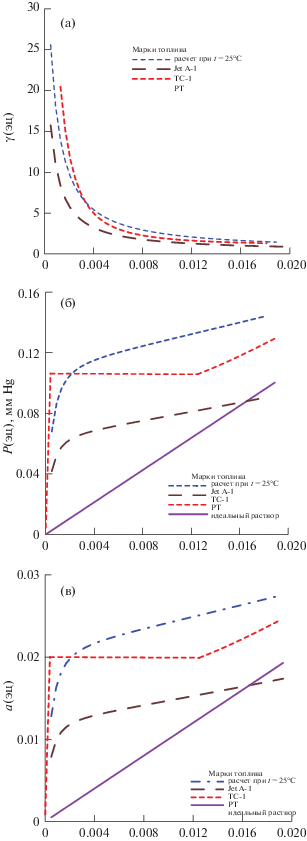
На всех рисунках показаны зависимости от x1‑мольной доли ЭЦ в растворе при температуре кипения раствора, которая для марки JetA-1, как это видно из табл. 1, отличается от двух остальных. Пунктиром показаны зависимости, рассчитанные по моделям с параметрами из табл. 3. Символы точек отражают величины, рассчитанные по (4), (5) из экспериментальных значений x1. Прямая (фиолетовая) отвечает зависимости y1 = = x1 на рис. 1 и идеальному раствору на рис. 2–4. Для идеального раствора справедливы выражения (5), в которых γ1 принят за 1. Цвет синий, коричневый, красный относится к маркам образцов соответственно № 1, 2, 3.
Анализ рассчитанных, как и экспериментальных данных позволяет предположить, что насыщенный пар многократно обогащается ЭЦ. В соответствии с расчетом для топлив с “узким” фракционным составом (с малым значением разности температур начала и конца кипения) содержание ЭЦ в паре может достигать значения примерно 8 мас. % при применении дозировки ЭЦ в топливе в концентрации 0.3 мас. %, т.е. массовая концентрация ЭЦ в парах возрастает примерно в 30 раз при температуре кипения. Как следует из описанного ниже расчета равновесия, этот показатель становится меньше при понижении температуры. Например, при 25°С должно происходить пятикратное увеличение содержания ЭЦ в парах по сравнению с раствором.
Как следует из графиков на рис. 1–4 все три образца характеризуются положительными отклонениями термодинамических свойств от идеальности. Наиболее сильно такая тенденция проявляется для образца РТ, так как из экспериментальных данных следует, что он должен даже испытывать расслаивание на две жидкости.
Протяженность области расслаивания показана горизонтальной пунктирной линией. Ширина области должна меняться незначительно с понижением температуры до комнатных значений. Рассчитанные составы сосуществующих фаз и активность ЭЦ в них приведены в табл. 4.
Таблица 4.
Свойства (границы и активность ЭЦ) рассчитанной области расслаивания в образце РТ
| x1 (лев) | x1 (прав) | y1 | a(ЭЦ) | t °C |
|---|---|---|---|---|
| 0.000393 | 0.01266 | 0.0270 | 0.020 | 145 |
| 0.000393 | 0.01266 | 0.0099 | 0.020 | 25 |
Все экспериментальные данные относятся к температурам кипения образцов, представленным в табл. 1. Поэтому рассчитанные параметры моделей относятся к этой температуре. Для анализа фазовых равновесий в рассматриваемых системах при комнатной температуре были рассчитаны концентрации, коэффициенты активности, парциальные давления, термодинамические активности при температуре 25°С, представленные на рис. 5, 6.
Рис. 5.
Зависимости состав пара от состава раствора ЭЦ–керосин при температуре 25°С. Расчет по модели с параметрами из табл. 3; wy , wx – массовая доля ЭЦ в паре, растворе соответственно (%).
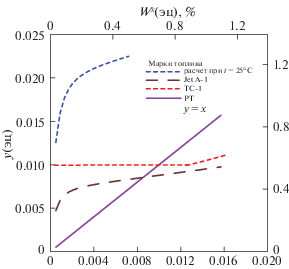
Рис. 6.
Зависимости коэффициента активности γ (а), парциального давления пара P (б), активности a (в) компонента ЭЦ от состава раствора ЭЦ–керосин при температуре раствора 25°C, расчет – расчет по модели с параметрами из табл. 3.
При пересчете термодинамических функций от температуры кипения к комнатной температуре подразумевалось, что параметры A12, A21 в модели Ван-Лаара, а значит и коэффициент активности γ1 в системе с топливом марки РТ не зависят от температуры. Для марок JetA-1 и ТС-1 предполагалась неизменность, полученных в ходе оптимизации, параметров ${{\lambda }_{{12 - 11}}}$, ${{\lambda }_{{21 - 22}}}$ в модели Вильсона с понижением температуры. При этом, в силу особенностей модели, коэффициенты активности, меняются с температурой, так как они выражаются через температурозависимые коэффициенты Λ12, Λ21.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Применимость модели Вильсона для псевдобинарной системы
Можно проанализировать при каких ограничениях, налагаемых на свойства многокомпонентной системы, общее выражение (3) для коэффициента активности в модели Вильсона, приобретает вид (3a) свойственный двухкомпонентной системе.
Если предположить, что энергия взаимодействия между молекулами углеводородов керосина одинакова для любой пары веществ и их молярные объемы одинаковы, то параметры
для j > 1, т.е. для любого углеводорода.Кроме того, если принять, что молекулы ЭЦ одинаково взаимодействуют со всеми углеводородами керосина, то для любого j > 1
При выполнении последних четырех равенств выражение (3) для коэффициента активности первого компонента, т.е. ЭЦ в керосине примет вид (3a), типичный для двухкомпонентного случая. Модель будет иметь два параметра ${{\Lambda }_{{12}}}$, ${{\Lambda }_{{21}}}$, подлежащих определению в процессе обработки экспериментальных данных. Поэтому, строго говоря, раствор ЭЦ в керосине можно рассматривать как двухкомпонентную систему, только при справедливости двух упомянутых предположений. Если они не выполняются, то модель может и не описать экспериментальные данные с удовлетворительной точностью. Как видно из табл. 3 модель Вильсона для двухкомпонентной системы (3а) позволила нам описать экспериментальные величины коэффициента активности ЭЦ со стандартным отклонением не превышающим 8%.Характер взаимодействия молекул этилцеллозольва (“ЭЦ”) с углеводородами керосина
Один из выводов, которые могут быть сделаны в настоящей работе, основан на рассмотрении свойств предельно разбавленных растворов ЭЦ–керосин. В табл. 5 представлены данные относящиеся к коэффициентам активности ЭЦ в растворах при бесконечном разбавлении ($\gamma _{1}^{\infty }$). Для сравнения приведены литературные данные для раствора ЭЦ в воде.
Таблица 5.
Коэффициент активности ЭЦ ($\gamma _{1}^{\infty }$) в предельно разбавленных растворах
| Растворитель | $\gamma _{1}^{\infty }$ | s0($\gamma _{1}^{\infty }$) a) | Модель | t°C | Лит. источник |
|---|---|---|---|---|---|
| JetA-1 | 31.3 | 92 | Вильсон | 150 | [наст. раб.] |
| ТС-1 | 28.2 | 17 | Вильсон | 145 | |
| РТ | 86.3 | 76 | Ван-Лаар | 145 | |
| H2O | 5.41 | – | – | 20 | [3] |
Как видно из табл. 5, все три образца, изученные в настоящей работе, демонстрируют значительные положительные отклонения от свойств идеального раствора. Из трех растворов наибольшим $\gamma _{1}^{\infty }$ для ЭЦ отличается третий образец (РТ). Большое положительное отклонение его свойств от идеальности подтверждается наличием, по данным расчета, расслаивания в этом растворе.
Следует обратить внимание, что у всех марок керосинов доверительный интервал (2s0) для $\gamma _{1}^{\infty }$ превышает его величину. Поэтому прослеживание корреляция между фракционным составом керосина и $\gamma _{1}^{\infty }$ для растворенного в нем ЭЦ будет ненадежным.
Опираясь на данные настоящей работы, можно также сравнить силу взаимодействия молекул ЭЦ с молекулами воды и углеводородами, содержащимися в керосине. Величина $\gamma _{1}^{\infty }$ для раствора ЭЦ в воде, рассчитанная по данным [3] для константы Генри при 20°С, составляет 5.41. Если предположить слабую температурную зависимость $\gamma _{1}^{\infty }$ и сравнить это значение с приведенными в табл. 5 для температуры кипения, то очевидно, что предельно разбавленный раствор ЭЦ для каждого керосина демонстрирует значительно большее положительное отклонение от идеального поведения, чем водный раствор. Это означает более сильное притяжение молекул ЭЦ молекулами воды, чем молекулами углеводородов в керосине.
Точка росы этилцеллозольва (ЭЦ)
Принимая во внимания полученную в исследованиях термодинамическую информацию о свойствах образцов, интересным представляется охарактеризовать поведение насыщенного пара ЭЦ над керосином с присадкой ЭЦ при его контакте с некоторым холодным предметом, на котором должна начаться конденсация из пара.
Например, случай, когда топливо и содержащий его контейнер, находятся при комнатной температуре, а стенки контейнера, контактирующие с насыщенным паром, начинают постепенно охлаждать. Если допустить, что масса топлива, как и объем, занимаемый паром достаточно велики, чтобы их состав практически не изменялся при конденсации, тогда расчет температуры образования капель ЭЦ на стенках, то есть точки росы ЭЦ, приводит к следующим результатам.
Согласно расчетам при 25°C пар над образцом марки JetA-1, в котором ЭЦ содержится в количестве, например, 0.5 мас. %, на 1.57 мас. % состоит из ЭЦ. Для него точка росы по ЭЦ имеет температуру –36°C. При этом предполагается, что температура и давление пара чистого ЭЦ связаны уравнением (2).
Расчет температуры точки росы для пара, содержащегося при других температурах, приводит к зависимости, показанной на рис. 7.
Рис. 7.
Расчетные значения точки росы (tт.р) ЭЦ в зависимости от температуры t (‘JetA-1’) насыщенного пара над раствором ЭЦ–JetA-1, содержащим 0.5 мас. % ЭЦ.
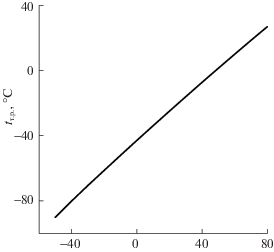
Вид функции на рис. 7 свидетельствует о близкой к линейной связи между температурой топлива и температурой конденсации ЭЦ на охлаждаемой стенке контейнера.
Список литературы
Zabarnick S., Adams R., West W. // Energy Fuels. 2010. V. 24. P. 2614–2627.
Alphonse F., William R. // Research Paper. 1949. RP2049. V. 43. 45 p.
Yaws C. Chemical Properties Handbook: Physical, Thermodynamics, Environmental Transport, Safety & Health Related Properties for Organic & Inorganic Chemical; McGraw-Hill: New York, 1999
Ощенко А.П., Шарин Е.А., Черных А.В. и др. // Тез. докл. VII-й Междунар. науч.-практич. конф. “Академические Жуковские чтения”, ноябрь 2019. Воронеж, 2019.
Dagaut P., ElBakali A., Ristori A. // Fuel. 2006. V. 85. P. 944.
Lanza M., Neto W.B., Batista E. et al. // J. Chem. Eng. Data 2008. V. 53. P. 5.
Belting P.C., Bolts R., Rarey J. et al. // Fluid Phase Equilibria. 2014. V. 375. P. 124.
Belting P.C., Rarey J., Gmehling J. et al. // Fluid Phase Equilibria. 2014. V. 361. P. 215.
Belting P.C., Gmehling J., Bolts R. et al. // Fluid Phase Equilibria. 2015. V. 395. P. 15.
Gmehling J., Onken U. Vapor-liquid equilibrium Data Collection, Aqueous-Organic Systems. V. 1. Part 1. 1977.
Дубовкин Н.Ф., Маланичева В.Г., Массур Ю.П., Федоров Е.П. Физико-хим. и эксплуатационные св-ва реактивных топлив. Справочник. М.: Химия, 1985. 240 с.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии


