Журнал физической химии, 2021, T. 95, № 2, стр. 226-230
Влияние структуры имидазолиевых ионных жидкостей на электропроводность и процессы ионной ассоциации в растворах ацетонитрила
a Тверской государственный университет
170002 Тверь, Россия
* E-mail: pifchem@mail.ru
Поступила в редакцию 16.03.2020
После доработки 16.03.2020
Принята к публикации 14.04.2020
Аннотация
Исследована электропроводность ряда ионных жидкостей на основе четвертичных солей 1-алкил-3-метилимидазолия с неорганическими анионами в ацетонитриле. Методом Ли–Уитона рассчитаны константы ионной ассоциации Ka, предельная молярная электрическая проводимость (λ0) и энергия Гиббса ассоциации (ΔG) в растворах. Показано, что определяющее влияние на ассоциацию исследованных ионных жидкостей оказывает природа и размер аниона. Установлено, что предельная молярная электропроводность бромидов оказывается ниже, чем у гексафторфосфатов и тетрафторборатов.
Количество исследований ионных жидкостей (ИЖ) постоянно растет. Идет поиск новых областей применения ионных жидкостей, расширяются и совершенствуются уже известные прикладные аспекты их использования с учетом новых фундаментальных знаний о взаимосвязи структуры ИЖ с их свойствами. Уже сейчас ионные жидкости применяются в таких областях науки как электрохимия, процессы разделения, синтеза и катализа, фармацевтической промышленности и др. [1–5]. Такой интерес к данному классу соединений вызван тем, что ИЖ обладают целым комплексом таких свойств как: низкое давление насыщенного пара, высокая электропроводность, негорючесть, хорошая сольватирующая способность для целого ряда полярных и неполярных соединений [6–8]. В последнее время ИЖ все чащи стали использоваться в области электрохимических исследований и прикладных аспектах для применения их в качестве электролитов нового поколения в аккумуляторных батареях, солнечных панелях и др. [9–12]. С использованием кондуктометрического анализа возможно получение ценной информации о ионной ассоциации и ионной сольватации электролитов [13]. Данные о молярной проводимости и ионной ассоциации ионных жидкостей необходимы при их обширных кондуктометрических исследованиях, в основном в смесях с молекулярными растворителями в широком диапазоне концентраций. Результаты показывают, что структура катиона и аниона в составе ионных жидкостей сильно влияет на ионную ассоциацию и молярную электропроводность при бесконечном разведении [13–17]. Таким образом, знание зависимостей электропроводности от концентрации для растворов ионных жидкостей в молекулярных растворителях, а также поведения ионов в растворах является на сегодняшней день актуальной задачей.
Цель данной работы – изучение электропроводности имидазолиевых ионных жидкостей с неорганическими анионами, а также процессов их ассоциации в растворах ацетонитрила.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Все соединения синтезировали и очищали по ранее описанной методике [18]. Структура соединений подтверждена данными ИК-спектроскопии, состав – данными элементного анализа. ИК-спектры записывали на спектрометре ALPHA в тонкой пленке между стеклами KBr для жидкостей и в таблетках KBr для твердых соединений. Элементный анализ выполняли на анализаторе PerkinElmerCHNS/O РЕ 2400-II. Электропроводность (ЭП) растворов ИЖ измеряли на кондуктометре Seven Go Pro MettlerToledeo при термостатировании 25 ± 0.1°С в ацетонитриле. Ацетонитрил марки “ч.д.а.” предварительно осушали путем кипячения и последующей перегонки над P4O10. Для каждой ионной жидкости готовили серию растворов в концентрационном интервале 10–4–10–2 моль/л. Измерение ЭП каждого раствора проводили 5 раз и находили среднее значение. Удельную ЭП пересчитывали в эквивалентную по известной формуле.
Методом Ли–Уитона рассчитывали константы ионной ассоциации, предельную молярную электрическую проводимость (λ0) и энергию Гиббса ассоциации (ΔG). Зависимость молярной электропроводности от концентрации природы электролита и растворителя в общем случае можно выразить в виде [19]:
Для определения константы ионной ассоциации (Kа), предельной молярной электрической проводимости (λ0) по экспериментальным кондуктометрическим данным использовали уравнение Ли–Уитона [20–22] в модификации Петибриджа [23] и второе приближение теории Дебая–Хюккеля:
(2)
$\begin{gathered} {\lambda } = {\text{\;}}\alpha \left\{ {\mathop {{{{\lambda }}_{0}}}\limits_{} \text{[}1 + {\text{\;}}{{С}_{1}}{\beta }k + {\text{\;}}{{C}_{2}}{{{({\beta }k)}}^{2}} + {\text{\;}}{{C}_{3}}{{{({\beta }k)}}^{3}}] - } \right. \\ \left. { - \;{\text{\;}}\frac{{{\rho }k}}{{1 + t}}{\text{\;\;}}\left[ {1 + {\text{\;}}{{C}_{4}}{\beta }k + {\text{\;}}{{C}_{5}}{{{\left( {{\beta }k} \right)}}^{2}} + {\text{\;}}\frac{t}{{12}}} \right]} \right\} \\ \end{gathered} $В выражении (2): λ – молярная электропроводность (ЭП) электролита, См см2/моль; λ0 – предельная молярная ЭП, α – степень диссоциации электролита;
q – критическое расстояние Бьеррума, м. Значение параметра Дебая для I–I-электролита определяется выражением [23]: где c – молярная концентрация раствора электролита, моль/л; ε – относительная диэлектрическая проницаемость среды; Т – абсолютная температура, K; F – число Фарадея, Кл/моль; е – заряд электрона, Кл; η – вязкость растворителя, Па с; Сn = f(k, R) – коэффициенты, выраженные нелинейными зависимостями [23]. При выводе уравнения (2) с использованием параметра наибольшего сближения ионов R учитывалась возможность образования вокруг ионов сольватных оболочек (косфер Гарнея) [21].Обработка экспериментальных данных сводится к минимизации функции F и нахождению неизвестных параметров Kа и λ0 [20]:
(6)
$F = \mathop \sum \limits_{i = 1}^n {{({\lambda }_{i}^{{{\text{теор}}}} - {{{\lambda }}^{{{\text{эксп}}}}})}^{2}}.$Задача поиска неизвестных параметров (Kа и λ0) заключается в решении системы нелинейных уравнений: концентрационной зависимости молярной электрической проводимости, закона действующих масс, материального баланса и средних ионных коэффициентов активности.
Для максимальной средней ионной концентрации электролита предложенной в работе [22] можно записать $C_{{{\text{max}}}}^{i}$ = 9.1 × 10–15(εT)3. Исходя из этого, при проведении расчетов использовали кондуктометрические данные в области концентраций 10–4–10–2 моль/л. Обработку экспериментальных данных проводили по методике, описанной в работе [20]. Результаты расчетов представлены в табл. 1. Энергию Гиббса ассоциации рассчитывали по формуле: ∆G = –RTln Ka.
Таблица 1.
Значения предельных молярных электропроводностей λ0, констант ассоциации Ka, и энергий Гиббса ассоциации ΔG исследованных соединений
| № | R | X– | λ0, См см2 моль–1 | Ka, л/моль | –ΔG, кДж/моль |
|---|---|---|---|---|---|
| 1 | C4H9 | Br– | 190 ± 2 | 59 ± 6 | 10.1 |
| 2 | BF$_{4}^{ - }$ | 209 ± 1 | 48 ± 4 | 9.6 | |
| 3 | PF$_{6}^{ - }$ | 201 ± 1 | 51 ± 4 | 9.8 | |
| 4 | C6H13 | I– | 188 ± 1 | 66 ± 3 | 10.4 |
| 5 | BF$_{4}^{ - }$ | 186 ± 1 | 50 ± 3 | 9.7 | |
| 6 | PF$_{6}^{ - }$ | 191 ± 1 | 44 ± 3 | 9.4 | |
| 7 | C8H17 | Br– | 149 ± 1 | 50 ± 3 | 9.7 |
| 8 | BF$_{4}^{ - }$ | 170 ± 2 | 57 ± 3 | 10.0 | |
| 9 | PF$_{6}^{ - }$ | 164 ± 1 | 46 ± 4 | 9.5 | |
| 10 | C10H21 | Br– | 152 ± 1 | 75 ± 5 | 10.7 |
| 11 | BF$_{4}^{ - }$ | 160 ± 1 | 46 ± 3 | 9.5 | |
| 12 | PF$_{6}^{ - }$ | 164 ± 1 | 40 ± 3 | 9.0 | |
| 13 | C12H25 | Br– | 154 ± 1 | 73 ± 4 | 10.6 |
| 14 | BF$_{4}^{ - }$ | 174 ± 1 | 54 ± 4 | 9.9 | |
| 15 | PF$_{6}^{ - }$ | 167 ± 1 | 43 ± 3 | 9.3 |
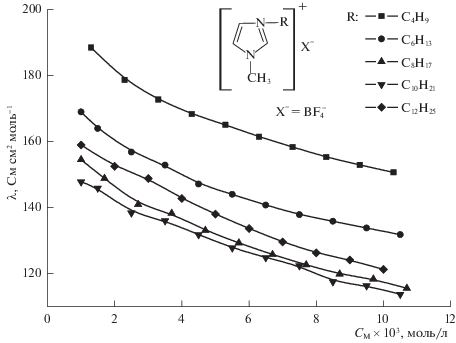
Рис. 1.
Зависимости эквивалентной ЭП растворов тетрафторборатов 1-алкил-3-метилмидазолия в ацетонитриле от концентрации при 25°С. Наибольшей электропроводностью из изученных тетрафторборатов (рис. 1) в данном диапазоне концентраций обладает тетрафторборат 1-бутил-3-метилимидазолия, а наименьшей – тетрафторборат 1-децил-3-метилимидазолия. Значения эквивалентной ЭП составляют 115–190 См см2 моль–1. Эквивалентная электропроводность разбавленных растворов тетрафторборатов в ацетонитриле при увеличении концентрации снижается. Ионы противоположного знака в растворе ионной жидкости, по-видимому, образуют относительно стабильные агрегаты (нейтральные подсистемы), которые не могут быть проводниками заряда. Аналогичная зависимость наблюдается для водных растворов электролитов.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Для изучения поведения ионных жидкостей в растворах нами проведено кондуктометрическое исследование растворов имидазолиевых ионных жидкостей в ацетонитриле. На основе кондуктометрических измерений были построены зависимости эквивалентной электропроводности (ЭП) от концентрации.
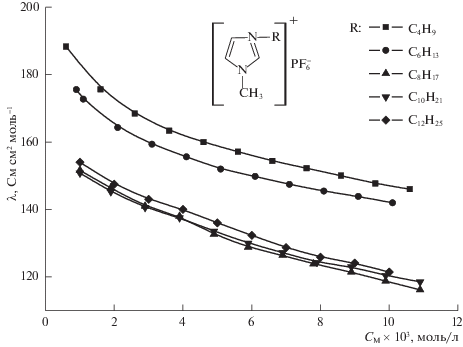
Похожее поведение в растворе характерно и для изученных нами гексафторфосфатов 1-алкил-3-метилимидазолия (рис. 2). Необходимо отметить, что электропроводность гексафторфосфатов оказалась немного ниже, чем тетрафторборатов с одноименными катионами.
Рис. 2.
Зависимости эквивалентной ЭП растворов гексафторфосфатов 1-алкил-3-метилмидазолия в ацетонитриле от концентрации при 25°С.
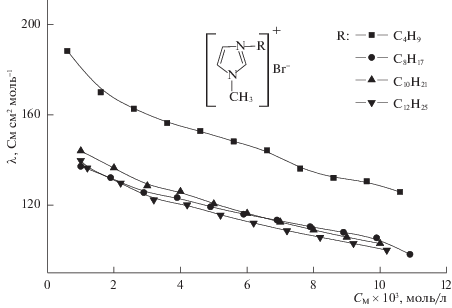
Для сравнения нами изучена электропроводность растворов бромидов 1-алкил–3-метилимидазолия (рис. 3), которые были прекурсорами для получения ионных жидкостей. Эквивалентная ЭП их растворов в ацетонитриле монотонно снижается с увеличением концентрации. Следует отметить, что все исследованные соединения, в состав которых входит 1-бутил-3-метилимидазолий катион, обладают наибольшей эквивалентной ЭП в данном концентрационном диапазоне. Такой эффект, по-видимому, связан с меньшим размером и более высокой симметрией 1-бутил-3-метилимидазолий катиона по сравнению с остальными изученными, что приводит к увеличению его подвижности в растворе и как следствие – к повышению электропроводности.
Рис. 3.
Зависимости эквивалентной ЭП растворов бромидов 1-алкил-3-метилмидазолия в ацетонитриле от концентрации при 25°С.
При сопоставлении значений констант ассоциации (табл. 1) для ИЖ с одноименным катионом прослеживается снижение констант при переходе от бромид- к гексафторфосфат-аниону. Тетрафторбораты и гексафторфосфаты 1-алкил-3-метилимидазолия имеют близкие значения констант ассоциации и для большинства исследованных соединений совпадают в пределах погрешности. Этот факт согласуется с уже известным в литературе [24, 25] влиянием размера аниона на прочность образования водородных связей с катионом: при увеличении размера аниона энергия водородных связей уменьшается. Простой бромид-анион более прочно удерживается катионом, поэтому соединения, содержащие бромид-анион, будут в меньшей степени диссоциировать в растворе. Напротив, более объемные анионы BF$_{4}^{ - }$ и PF$_{6}^{ - }$ труднее удерживаются катионом, в результате содержащие их ИЖ будут подвергаться диссоциации в большей степени. Авторы работы [26] с помощью методов ИК-спектроскопии и квантово-химических расчетов установили, что для простых анионов, таких как галогены и OH–, преобладают сильные электростатические взаимодействия, а для более сложных (в частности, PF$_{6}^{ - }$ и BF$_{4}^{ - }$) – водородное связывание. Этот факт хорошо объясняет меньшую предельную ЭП бромидов 1-алкил-3-метилимидазолия по сравнению с гексафторфосфатами и терафторборатами. В пользу этого свидетельствует и тот факт, что полученные нами значения предельной молярной ЭП для бромидов 1-алкил-3-метилмидазолия оказываются ниже, чем для гексафтофросфатов и тетрафторборатов.
Сопоставляя значения констант ассоциации ИЖ с одноименным PF$_{6}^{ - }$ анионом, можно заключить, что значения для всех изученных соединений совпадают в пределах погрешности. Таким образом, определяющее влияние на процесс ионной ассоциации оказывает природа и структура аниона. К аналогичному выводу пришли авторы работы [27], изучавшие ассоциацию ряда имидазолиевых и пиридиниевых ИЖ в ацетонитриле.
Для всех исследованных соединений интервал величин энергии Гиббса ассоциации составляет от –9.0 до –10.7 кДж/моль. Сравнивая константы ассоциации и энергии Гиббса ассоциации, можно сделать вывод, что самой ассоциированной ионной жидкостью из изученных является бромид 1-децил-3-метилимидазолия.
Список литературы
Hallett J.P., Welton T. // Chem. Rev. 2011. V. 111. № 5. P. 3508. https://doi.org/10.1021/cr1003248
Zhao H., Malhotra S.V. // Aldrichim. Acta. 2002. V. 35. P. 75. https://doi.org/10.1155/2014/729842
Olivier-Bourbigou H., Magna L., Morvan D. // Appl. Catal., A: General. 2010. V. 373. P. 1. https://doi.org/10.1016/j.apcata.2009.10.008
Priambodo R., Chen T.C., Lu M.C. et al. // Energy Procedia. 2015. V. 75. P. 84. https://doi.org/10.1016/j.egypro.2015.07.143
Kim H.J., Shim Y. // ACS Nano. 2009. V. 3. № 7. P. 1693. https://doi.org/10.1021/nn900195b
Watanabe M., Tokuda H., Tsuzuki S. et al. // J. Phys. Chem. B. 2006. V. 110. № 39. P. 19593. https://doi.org/10.1021/jp064159v
Chaban V.V., Voroshylova I.V., Kalugin O.N. // Phys. Chem. Chem. Phys. 2011. V. 13. P. 7910. https://doi.org/10.1039/c0cp02778b
Duan E.H., Guo B., Zhang M.M. et al. // J. Chem. Eng. Data. 2010. V. 55. № 10. P. 4340. https://doi.org/10.1021/je100361s
Abbott A.P., McKenzie K.J. // Phys. Chem. Chem. Phys. 2006. V. 8. P. 4265. https://doi.org/10.1039/B607329H
Kawano R., Matsui H., Matsuyama C. et al. // J. Photochem. Photobiol A:Chemistry. 2004. V. 164. P. 87. https://doi.org/10.1016/j.jphotochem.2003.12.019
Grande L., Paillard E., Kim G.T. et al. // Int. J. Mol. Sci. 2014. V. 15. № 5. P. 8122 https://doi.org/10.3390/ijms15058122
Sakaebe H., Matsumoto H., Tatsumi K. // Electrochim. Acta. 2007. V. 53. P. 1048. https://doi.org/10.1016/j.electacta.2007.02.054
Foreiter M.B., Gunaratne H.Q.N., Nockemann P. et al. // Phys. Chem. Chem. Phys. 2014 V. 16. № 3. P. 1208. https://doi.org/10.1039/c3cp53472c
Duan E., Guan Y., Guo B. et al. // J. Mol. Liq. 2013. V. 178. P. 1. https://doi.org/10.1016/j.molliq.2012.10.026
Liu Q.-S., Li P.-P., Welz-Biermann U. et al. // J. Chem. Thermodyn. 2013. V. 66. P. 88. https://doi.org/10.1016/j.jct.2013.06.008
Vila J., Fernández-Castro B., Rilo E.C. et al. // Fluid Phase Equilib. 2012. V. 320. P. 1. https://doi.org/10.1016/j.fluid.2012.02.006
Leys J., Tripathi C.S.P., Glorieux C. et al. // Phys. Chem. Chem. Phys. 2014. V. 16. P. 10548. https://doi.org/10.1039/C4CP00259H
Журавлев О.Е., Ворончихина Л.И., Герасимова К.П. // Журн. общ. химии. 2016. Т. 86. № 12. С. 1969.
Чумак В.Л., Максимюк М.Р., Нешта Т.В. и др. // Восточно-Европейский журн. передовых технологий. 2013. Т. 62. № 2/5. С. 59.
Lee W.H., Wheaton R.J. // J. Chem. Soc. Faraday Trans. 1978. Part 2. V. 74. № 4. P. 743. https://doi.org/10.1039/F29787400743
Lee W.H., Wheaton R.J. // Ibid. 1978. Part 2. V. 74. № 8. P. 1456. https://doi.org/10.1039/F29787401456
Lee W.H., Wheaton R.J. // Ibid. 1979. Part 2. V. 75. № 8. P. 1128. https://doi.org/10.1039/f29797501128
Pethybridge A.D., Taba S.S. // Ibid. 1980. V. 76. № 9. P. 368. https://doi.org/10.1039/F19807600368
Leys J., Wübbenhorst M., Menon C.P. et al. // J. Chem. Phys. 2008. V. 128. № 6. P. 64509. https://doi.org/10.1063/1.2827462
Leys J., Rajesh R.N., Menon P.C. et al. // Ibid. 2010. V. 133. № 3. P. 34503. https://doi.org/10.1063/1.3455892
Gao Y., Zhang L., Wang Y. et al. // J. Phys. Chem. B 2010. V. 114. P. 2828. https://doi.org/10.1021/jp910528m
Voroshylova Iu.V., Dakhova E.A., Chaban V.V. et al. // Kharkov University Bulletin. 2010. V. 895. № 18. P. 159.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии


