Журнал физической химии, 2021, T. 95, № 3, стр. 342-347
Структурные и динамические характеристики смеси вода–этанол–2-метокси-4-(2-гидроксипропил)фенол в субкритических условиях
Т. В. Богдан a, b, *, В. Е. Петренко c, М. Л. Антипова c, А. А. Филиппова d, В. И. Богдан a, b
a Московский государственный университет имени М.В. Ломоносова,
Химический факультет
119991 Москва, Россия
b Российская академия наук, Институт органической химии им. Н.Д. Зелинского
119991 Москва, Россия
c Российская академия наук, Институт химии растворов им. Г.А. Крестова
153045 г. Иваново, Россия
d Первый Московский государственный медицинский университет имени И.М. Сеченова Министерства здравоохранения РФ (Сеченовский университет)
119991 Москва, Россия
* E-mail: chemist2014@yandex.ru
Поступила в редакцию 02.09.2020
После доработки 02.09.2020
Принята к публикации 14.09.2020
Аннотация
Молекула 2-метокси-4-(2-гидроксипропил)фенола (ГПФ) представляет собой структурную единицу хвойного лигнина. Представлены результаты молекулярно-динамического моделирования структурных и динамических параметров трехкомпонентной смеси вода–этанол–ГПФ при температуре 573 K и плотности 0.737 г/см3, что отвечает субкритическим условиям состояния флюида. Рассчитаны функции радиального распределения между центрами масс молекул ГПФ и молекул смешанного растворителя, количество молекул воды и этанола в сольватных оболочках, средние числа и средние времена жизни водородных связей, коэффициенты самодиффузии молекул растворителя. Показано, что молекулы ГПФ образуют между собой, а также с водой и этанолом водородные связи. При этом водородные связи между молекулами ГПФ оказываются наиболее стабильными и долгоживущими.
Лигнин – нерегулярный природный полимер с сильно разветвленной структурой и с высокой молекулярной массой. Основным мономером лигнина является гваяцил-пропильная единица. В настоящее время лигнин в наиболее больших объемах получается в результате переработки целлюлозы (целлюлозно-бумажная промышленность, гидролизные производства). Благодаря своей доступности и обилию активных функциональных групп лигнин рассматривается как идеальное исходное сырье для производства разнообразных ценных материалов (фенольные смолы, эпоксидные смолы, клеи, полиолефины, связующие вещества и др.), в том числе, возобновляемого биотоплива. Среди научных направлений, разрабатываемых под руководством академика В.В. Лунина, в последнее десятилетие выделилось исследование природных полимеров, в частности, лигнина и их трансформации в условиях воздействия повышенных температур и давления. Установлено, что использование сверхкритических флюидов состава: суб- и сверхкритическая вода/водно-органический раствор, – является очень перспективным направлением деполимеризации лигнина и расщепления его на малые молекулы. При этом увеличения растворимости ароматического каркаса лигнина при делигнификации достигают использованием водно-органических смесей, в частности: вода–фенол, вода–этанол, вода–метанол. Одним из наиболее экологически чистых органических сорастворителей воды является этанол [1].
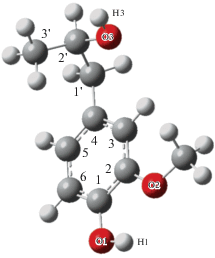
К настоящему времени получено не так много сведений по закономерностям химической трансформации лигнина, поскольку сильная зависимость молекулярной структуры лигнина от параметров состояния, природы и концентрации растворителей затрудняет их выявление. Кроме этого, проведение эксперимента в суб- и сверхкритических условиях препятствует использованию структурно-чувствительной техники. Все это приводит к возрастанию роли компьютерного эксперимента в поиске закономерностей превращения лигнина. В настоящей работе исследовано поведение молекулы мономерного звена лигнина в водно-этанольном растворе в субкритических условиях с использованием классического молекулярно-динамического моделирования. В качестве модели была взята молекула 2-метокси-4-(2-гидроксипропил)фенола (ГПФ) (рис. 1), способная образовывать β-O-4 связь с другой молекулой. Молекула ГПФ является одной из основных структурных единиц хвойного лигнина. Растворение лигнина в суб- и сверхкритических водно-этанольных смесях сопровождается разрушением его полимерной структуры, в результате чего составлявшие ее мономерные соединения переходят в раствор. Таким образом, исследуемые в данной работе флюидные системы представляют собой модели растворов, образующихся в результате деполимеризации хвойного лигнина в суб- и сверхкритических водно-этанольных смесях.
Рис. 1.
Молекула 2-метокси-4-(2-гидроксипропил)фенола после оптимизации геометрии. Показана нумерация атомов.
Ранее, в работе [2], было проведено исследование сольватации молекулы ГПФ в водно-этанольных растворах разной концентрации (0.020, 0.115, 0.285 мольных долей (м.д.) этанола) при температуре 573 K и плотностях, соответствующих экспериментальному давлению 23 MPa. Было показано, что ГПФ образует водородные связи (ВС) как с водой, так и с этанолом, которые характеризуются более высокой продолжительностью жизни, чем ВС вода–вода, этанол–этанол, вода–этанол. При этом в окружении ГПФ преимущественно находятся молекулы воды, а не этанола. Включение молекул этанола в сольватные оболочки происходит только вокруг гидроксильных групп О1Н1 и О3Н3. С ростом концентрации этанола уменьшается общее количество ВС во флюиде, но при этом увеличивается продолжительность их жизни. Сольватные комплексы, образуемые ГПФ с водой и этанолом, ведут себя в среде субкритического флюида как относительно стабильные структуры, существующие более длительное время по сравнению с ассоциатами из молекул воды и спирта. При повышении концентрации этанола во флюиде наблюдается увеличение времени жизни ВС, т.е. происходит стабилизация сольватных комплексов и структурирование сольватных оболочек. Повышение концентрации этанола во флюиде не влияет на общее число водородных связей, образованных растворенным веществом, но приводит к увеличению продолжительности жизни всех водородных связей во флюиде, в том числе и водородных связей растворенное вещество – вода и растворенное вещество – этанол. В настоящей работе исследовано, в какой степени в субкритических условиях молекулы ГПФ в водно-этанольной среде способны проявлять тенденцию к самоассоциации. Также рассмотрено изменение состава сольватных оболочек и структурно-динамических характеристик ВС при переходе от модельной системы, содержащей одну молекулу растворенного вещества, к системе, содержащей 8 молекул.
ПОСТРОЕНИЕ МОДЕЛЬНОЙ СИСТЕМЫ
Модельная молекула растворенного вещества ГПФ построена на основе структуры 2-метокси-4-пропилфенола [3]. Оптимизация молекулярной структуры ГПФ проводилась в рамках приближения теории функционала плотности с использованием функционала B3LYP [4, 5] и базисного набора 6-31G++(d,p). Все расчеты проводились с использованием программного комплекса Gaussian 09 [6]. Отсутствие мнимых частот колебаний подтвердило стационарный характер полученной структуры. Заряды на атомах получены из анализа натуральных связевый орбиталей (NBO). Геометрия молекул ГПФ и этанола и параметры взаимодействия взяты из силового поля OPLS-AA [7]. Моделирование проводили с использованием пакета Gromacs-5.0.7 [8]. Использовали модель частично нежесткой системы: для молекулы ГПФ геометрические параметры бензольного кольца и метоксигруппы (О2Ме) были зафиксированы, для гидроксильной группы (О1Н1) допускалось вращение относительно связи С–О, для гидроксипропиловой группы допускалось изменение валентных и торсионных углов. Для этанола использовали полностью жесткую модель молекулы с параметрами из силового поля OPLS-AA [7], для молекул воды – потенциал TIP4P.
МОЛЕКУЛЯРНО-ДИНАМИЧЕСКОЕ МОДЕЛИРОВАНИЕ
Молекулярно-динамическое моделирование проводили в NVT-ансамбле в полноатомном варианте с использованием программного пакета Gromacs-5.0.7 [8] с GPU-ускорителями, позволяющего выполнять высокопроизводительные параллельные вычисления. Для интегрирования уравнений Ньютона использовался алгоритм Верле [9], для поддержания постоянной температуры – термостат Нозе–Хувера [10, 11], для учета дальнодействующих электростатических взаимодействий – модифицированный метод суммирования Эвальда [12, 13], для ограничения по всем длинам связей – алгоритм LINCS [14].
Моделировались две системы: I – одна молекула ГПФ; II – восемь молекул ГПФ, – в водно-этанольном растворе (0.02 м.д. этанола) при T = = 573 K и ρ = 0.737 г/см3. Данная плотность соответствует плотности бинарной смеси вода–этанол (0.02 м.д. этанола). Значение плотности рассчитали путем интерполяции экспериментальных данных [15, 16].
Сначала была подготовлена ячейка с водно-этанольным раствором, которая содержала 5832 молекулы воды и 117 молекул этанола. Первоначально бинарную систему уравновешивали в кубической ячейке с ребром 6.29 нм в течение 500 пс; затем проводили подогрев системы и термостатирование в течение 1.5 нс. Далее для системы I была создана ячейка с ребром 6.3 нм, в которую сначала помещали одну молекулу ГПФ, а затем добавили водно-этанольный раствор. При заданных значениях температуры и плотности проводили термостатирование в течение 500 пс. Для системы II брали увеличенную в 8 раз исходную ячейку системы I, которую сжимали до куба с ребром 6.31 нм. Затем ячейку заполняли водно-этанольным раствором, после чего и проводили термостатирование системы в течение 500 нс. Заданный размер обеспечивал размещение в ячейке 5832 молекул воды, 117 молекул этанола и восемь молекул ГПФ с плотностью растворителя 0.737 г/см3. Были получены по 15 молекулярно-динамических траекторий для каждой системы. Время сбора данных для последующего анализа статических и динамических свойств составило: для системы I – 500 пс с шагом 1 фс; II – 1 нс с шагом 0.5 фс.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Рассчитаны функции радиального распределения (ФРР) для расстояний между центрами масс молекул ГПФ и воды (рис. 2) и между центрами масс молекул ГПФ и этанола (рис. 3), средние числа молекул воды и этанола в сольватных оболочках разного радиуса (табл. 1), средние числа и средние времена жизни водородных связей (ВС) между компонентами флюида, а также числа водородных связей, образуемых отдельными функциональными группами растворенного вещества (табл. 2, 3), и коэффициенты самодиффузии молекул растворителя (табл. 4).
Рис. 2.
Функции радиального распределения для центров масс молекул ГПФ и воды: а) система I; б) система II.
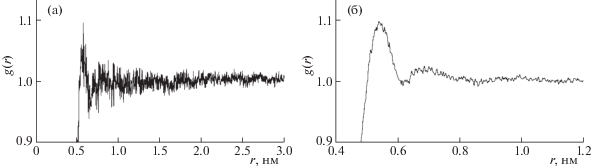
Рис. 3.
Функции радиального распределения для центров масс молекул ГПФ и этанола: а) система I; б) система II.
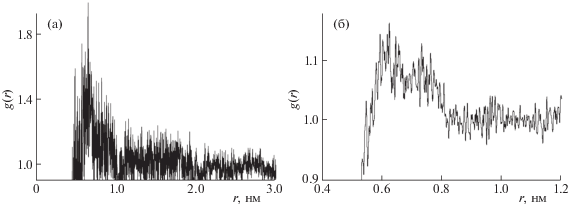
Таблица 1.
Среднее количество молекул N воды и этанола в сольватной сфере ГПФ
| N (этанол) | ||||
|---|---|---|---|---|
| Радиус сферы, нм | 1.0 | 0.979 | 0.75 | |
| система I | 2.0 | 1.94 | 0.8 | |
| система II | 1.8 | 1.7 | 0.7 | |
| N (вода) | ||||
| Радиус сферы, нм | 1.0 | 0.979 | 0.75 | 0.646 |
| система I | 91.2 | 85.5 | 34.5 | 19.8 |
| система II | 91.7 | 85.9 | 35.4 | 20.4 |
Таблица 2.
Средние числа ВС с водой и этанолом, образуемых молекулой ГПФ nHB и отдельными функциональными группами ГПФ, средние времена жизни ВС τI ГПФ–вода и ГПФ–этанол
| Параметр | ГПФ–вода | ГПФ–этанол | ||
|---|---|---|---|---|
| система I | система II | система I | система II | |
| nHB | 3.75 | 4.46 | 0.03 | 0.05 |
| nHB H1O1 | 1.09 | 1.53 | 0.01 | 0.03 |
| nHB O2 | 0.86 | 1.33 | 0.01 | 0.01 |
| nHB H3O3 | 1.80 | 1.60 | 0.01 | 0.02 |
| τI , пс | 1.06 | 1.34 | 0.81 | 1.82 |
Таблица 3.
Средние числа ВС nHB и среднее время жизни ВС τI между молекулами в системе II
| Тип ВС | nHB | τI, пс |
|---|---|---|
| ГПФ–ГПФ | 0.1 | 20.84 |
| Вода–этанол | 1.44 | 0.58 |
| Этанол–этанол | 0.1 | 0.67 |
Таблица 4.
Коэффициент самодиффузии молекул воды и этанола D × 105 см–2 с–1
| Система | Бинарная система этанол–вода | Cистема I | Cистема II |
|---|---|---|---|
| Этанол | 22.9 | 22.1 | 21.7 |
| Вода | 37.3 | 37.4 | 37.6 |
ФРР (рис. 2, 3) показывают наличие сольватных оболочек из молекул воды и спирта вокруг молекул ГПФ. Оболочки более выражены в случае системы I, где присутствует только одна молекула ГПФ. Для системы II сольватные оболочки из молекул растворителя менее выражены, по-видимому, из-за вхождения в координационную сферу других молекул ГПФ. В системе II следует отметить “расщепление” первого пика на ФРР для расстояний ГПФ – этанол. Это можно объяснить тем, что разные функциональные группы молекулы ГПФ по-разному сольватируются молекулами этанола. Более гладкий вид ФРР для системы II, по сравнению с системой I, связан с бóльшим количеством молекул ГПФ, участвующих в образовании водородных связей.
Интегрированием ФРР от 0 до заданного расстояния (1.000, 0.979, 0.750 и 0.646 нм) было получено количество молекул растворителя в сольватных сферах соответствующего радиуса (табл. 1). Для взаимодействий ГПФ–этанол значение 0.75 нм отвечает первому минимуму на ФРР. Для взаимодействий ГПФ–вода первому минимуму на ФРР отвечает значение 0.646 нм. Для системы II число молекул воды в сольватной оболочке фиксированного размера вокруг молекул ГПФ немного больше, по сравнению с системой I, а число молекул этанола – меньше. Этот эффект может быть объяснен вытеснением молекул этанола из координационной сферы из-за включения в нее других молекул ГПФ.
Были проанализированы средние числа nВС ВС, образованных между молекулами ГПФ и растворителя, и их времена жизни. Анализ ВС проводился для разных функциональных групп молекул ГПФ (табл. 2). Для идентификации ВС использовался геометрический критерий: максимальное межмолекулярное расстояние между атомами кислорода и водорода, образующими ВС, 0.245 нм, а между двумя атомами кислорода – 0.360 нм.
Для оценки стабильности ВС рассчитано среднее время их жизни $\tau _{{{\text{ВС}}}}^{{\text{I}}}$ из автокорреляционной функции (АКФ) CВС(t) [17]:
Для системы II рассчитаны числа ВС и средние времена жизни для компонентов флюида. Получено, что ввиду большего количества молекул воды и этанола, между ними образуется больше всего ВС, тогда как количество ВС этанол–этанол и ГПФ–ГПФ относительно невелико вследствие малой концентрации этих молекул. Однако времена жизни водородных связей между молекулами ГПФ оказываются существенно выше времен жизни ВС между другими компонентами (табл. 3). Водородные связи этанол–этанол также оказываются более долгоживущими по сравнению с аналогичными в системе вода–этанол.
В табл. 4 приведены рассчитанные коэффициенты диффузии для молекул растворителя. Получено, что в целом при переходе от бинарной смеси вода–этанол к трехкомпонентному флюиду наблюдается тенденция к увеличению подвижности молекул растворителя. Из работ Ю.Е. Горбатого [20, 21] известно, что в субкритической области, при приближении к критической изотерме, количество тетраэдрически координированных молекул воды уменьшается, свидетельствуя о разрушении непрерывной сетки ВС воды. В своей предыдущей работе [2] мы показали, что в субкритических условиях существуют водородные связи между молекулами воды, хотя их количество снижено, по сравнению с нормальными условиями. При добавлении молекул ГПФ происходит дальнейшее разрушение ВС между молекулами воды и водных оболочек вокруг молекул этанола, что приводит к увеличению подвижности молекул воды и этанола. Однако этот процесс сдерживается образованием более долгоживущих водородных связей между молекулами ГПФ и растворителем. Суммарно это отражается в незначительном увеличении коэффициента диффузии молекул растворителя при образовании трехкомпонентного раствора. Следует отметить, что образование долгоживущих ВС между молекулами ГПФ коррелирует с полученными ранее нами данными об образовании долгоживущих димеров гвайякола (другой модельной молекулы мономерного звена лигнина) в сверхкритических условиях [22] и экспериментальными данными об образовании продуктов конденсации фенолов в сверхкритической воде [23].
Таким образом, методом классической молекулярной динамики проведено исследование структурных и динамических параметров трехкомпонентных флюидов, содержащих молекулы ГПФ в водно-этанольном окружении при содержании этанола 0.02 м.д. при температуре 573 K и плотности, соответствующей экспериментальному давлению 23 MPa. Рассчитаны численные параметры, характеризующие распределение компонентов в сольватной оболочке растворенного вещества. Определены числа и времена жизни ВС между компонентами флюида. Показано, что молекулы ГПФ образуют между собой, а также с водой и этанолом ВС. При этом ВС между молекулами ГПФ оказываются наиболее стабильными. Полученные результаты связаны с динамикой молекул: более тяжелые компоненты (этанол и в большей степени, ГПФ) менее подвижны и вследствие этого образуют более долгоживущие ВС. Но при этом среднее число ВС, образуемых молекулой ГПФ с этанолом и другими молекулами ГПФ очень незначительно: в системе, содержащей 8 молекул ГПФ, это 0.05 и 0.10 соответственно, тогда как среднее число ВС с водой на молекулу ГПФ составляет 4.46. Таким образом, мы приходим к заключению, что молекулы ГПФ, как и исследованные ранее другие модельные молекулы структурных единиц лигнина (фенол, гвайякол) в среде водно-этанольного флюида способны образовывать между собой устойчивые водородносвязанные ассоциаты. Но при заданных концентрациях, выбранных таким образом, чтобы не был превышен порог растворимости вещества, образование таких ассоциатов носит случайный характер, и подавляющее большинство времени молекулы ГПФ равномерно распределены в объеме флюида.
Данное исследование выполнено при поддержке Российского фонда фундаментальных исследований (грант РФФИ № 18-29-06072). Расчеты выполнены с использованием суперкомпьютерных ресурсов МВС-100к Объединенного суперкомпьютерного центра Российской академии наук.
Список литературы
Толкачев Н.Н., Коклин А.Е., Лаптинская Т.В. и др. // Изв. АН. Серия химическая. 2019. № 8. С. 1613.
Antipova M.L., Petrenko V.E., Odintsova E.G., Bogdan T.V. // J. Supercrit. Fluids.2020.V. 155. 104649. https://doi.org/10.1016/j.supflu.2019.104649
https://ligandbook.org/package/146
Becke A.D. // Phys. Rev. A. 1988. V. 38. № 6. P. 3098.
Lee C., Yang W., Parr R.G. // Phys. Rev. B. 1988. V. 37. № 2. P. 785.
Frisch M.J. / Gaussian. Inc. Wallingford CT. 2009. Gaussian 09. Revision A.01.
Jorgensen W.L., Maxwell D.S.,Tirado-Rives J. // J. Am. Chem. Soc. 1996. V. 118. P. 11225.
Abraham M.J., van der Spoel D., Lindahl E., Hess B. / GROMACS development team, GROMACS User Manual version 5.0.7 (2015).
Allen M.P., Tildesley D.J. Computer simulation of liquids. Clarendon Press. Oxford. 1987. 400 p.
Nose S. // Mol. Phys. 1984. V. 52. № 2. P. 255.
Hoover W.G. // Phys. Rev. A 1985. V. 31. P. 1695.
Darden T., York D., Pedersen L. // J. Chem. Phys. 1993. V. 98. P. 10089.
Essmann U., Perera L., Berkowitz M.L. et al. // Ibid. 1995. V. 103. P. 8577.
Hess B., Bekker H., Berendsen H.J.C., Fraaije J.G.E.M. // J. Comput. Chem. 1997. V. 18. P. 1463.
Bazaev A.R. et al. //International J. Thermophysics. 2007. V. 28. P. 194.
Базаев А.Р., Базаев Э.А. // Сверхкритические флюиды: Теория и практика. 2010. Т. 5. С. 15.
Rapaport D.C. // Mol. Phys. 1983. V. 50. P. 1151.
Voloshin V.P., Naberukhin Y.I. // J. Struct. Chem. 2009. V. 50. P. 78.
Naberukhin Y. I., Voloshin V.P. // Z. Phys. Chem. 2009. B. 223. P. 1119.
Gorbaty Y.E., Bondarenko G.V. // J. Mol. Liq. 2017. V. 239. P. 5.
Gorbaty Y.E., Bondarenko G.V. // J. Supercrit. Fluids. 1998. V. 14. P. 1.
Алексеев Е.C., Богдан Т.В. // Сверхкритические флюиды: теория и практика. 2020. Т. 15 (1). С. 103.
Богдан В.И., Кондратюк А.В., Коклин А.Е., Лунин В.В. // Сверхкритические флюиды: теория и практика. 2016. № 4. С. 80.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии


