Журнал физической химии, 2021, T. 95, № 3, стр. 348-373
Метод лазерного электродиспергирования металлов для синтеза наноструктурированных катализаторов: достижения и перспективы
Т. Н. Ростовщикова a, *, Е. С. Локтева a, М. И. Шилина a, Е. В. Голубина a, К. И. Маслаков a, И. Н. Кротова a, А. А. Брыжин a, И. Г. Тарханова a, О. В. Удалова b, В. М. Кожевин c, Д. А. Явсин c, С. А. Гуревич c
a Московский государственный университет имени М.В. Ломоносова, Химический факультет
Москва, Россия
b Российская академия наук, Федеральный исследовательский центр химической физики имени Н.Н. Семенова
Москва, Россия
c Российская академия наук, Физико-технический институт имени А.Ф. Иоффе
Санкт-Петербург, Россия
* E-mail: rtn@kinet.chem.msu.ru
Поступила в редакцию 06.08.2020
После доработки 06.08.2020
Принята к публикации 10.08.2020
Аннотация
Лазерное электродиспергирование (ЛЭД), позволяющее равномерно диспергировать металл по внешней поверхности носителей в виде частиц строго фиксированного размера, состава и формы, использовано для синтеза модельных катализаторов и установления роли взаимодействий между частицами активного металла в катализе наноструктурированными материалами. При реализации Программы развития МГУ существенно расширены экспериментальные возможности физико-химического анализа систем с очень малым содержанием металлов, формируемых методом ЛЭД, что позволило получить новые данные о взаимосвязи строения и свойств моно- и биметаллических катализаторов. Найденные эффекты использованы при разработке “корочковых” катализаторов, которые при пониженном содержании активного металла/металлов обладают оптимальной поверхностной плотностью частиц и характеризуются чрезвычайно высокой активностью в ряде экологически важных процессов, на порядки выше по сравнению с аналогами, полученными методами “мокрой” химии. Работы по переработке токсичных хлорорганических соединений путем гидродехлорирования, выполненные под руководством академика РАН В.В. Лунина с участием проф. В.В. Смирнова, Е.С. Локтевой и др., отмечены Ломоносовской премией МГУ. Перспективы использования техники ЛЭД показаны на примерах синтеза катализаторов окисления монооксида углерода, метана и серосодержащих соединений.
В качестве альтернативы традиционным химическим методам синтеза гетерогенных катализаторов – пропитке, ионному обмену и осаждению из растворов – все чаще рассматриваются физические методы, основанные на лазерной абляции [1–3]. Они являются одностадийными, благоприятны с точки зрения экологии, так как не предполагают использования растворов химических реагентов и обеспечивают, как правило, достаточно равномерное распределение активных компонентов на поверхности катализатора. Недостатки методов “мокрой” химии особенно наглядно проявляются при приготовлении биметаллических катализаторов, интерес к которым в последнее время значительно возрос [4–6]. При химическом синтезе биметаллических композиций трудно обеспечить равномерное заполнение поверхности носителя активными компонентами при сохранении постоянства состава и размера их частиц. К тому же традиционные методы синтеза катализаторов многостадийны, трудно воспроизводимы, поскольку условия приготовления сильно влияют на структуру и свойства получаемых материалов [7, 8], и предполагают использование высоких содержаний металлов – до нескольких массовых процентов, что усиливает вредное воздействие на окружающую среду и экономически нецелесообразно. В литературе имеются отдельные примеры эффективного применения химически синтезированных катализаторов с пониженным содержанием благородных металлов [9–12]. Уменьшение концентрации металла кардинально меняет структуру активных центров за счет постепенного перехода от наночастиц к кластерам и отдельным атомам и ионам. При этом отмечается смена электронного состояния активного металла от металлического к ионному, что приводит к появлению новых каталитических свойств [13]. Использование катализаторов с низкими содержаниями металлов, составляющими доли процентов, затруднено отсутствием высокочувствительных и общедоступных методов диагностики таких материалов и требует применения специальных разработок [14].
Метод лазерного электродиспергирования (ЛЭД) металлов на подложки разработан в 2000 г. в ФТИ имени А.Ф. Иоффе РАН, г. Санкт-Петербург [15]. С этого времени на химическом факультете МГУ имени М.В. Ломоносова проводится изучение каталитических свойств формируемых материалов [16–21].
Одностадийный и универсальный метод ЛЭД позволяет без использования растворов химических реагентов и растворителей получать “корочковые” катализаторы, в которых активный компонент катализатора равномерно распределен по внешней поверхности носителя в виде частиц одинакового размера, состава и формы [22]. В результате высокая поверхностная плотность доступных для реагентов активных центров в ЛЭД-материалах достигается даже при низких и сверхнизких содержаниях металла: от 10–2 до 10–4 мас. %. Уникальность этой техники определяется двумя факторами: высокой поверхностной плотностью и монодисперсностью отдельных наночастиц активной фазы. Эти особенности трудно достижимы в других методах. Метод ЛЭД позволяет наносить на любые носители покрытия, включающие один или несколько металлов или их оксидов.
Основное отличие ЛЭД от стандартной техники лазерной абляции [1–3] заключается в том, что заряженные нанокапли металлов сферической формы и фиксированного размера предварительно формируются в плазме лазерного факела и лишь затем под действием электрического поля осаждаются на массивный или гранулированный носитель. Чрезвычайно быстрое снижение температуры в момент осаждения частиц металла обеспечивает сохранение их аморфной структуры и размера, определяемого работой выхода электрона конкретного металла. Особый режим формирования наночастиц металлов делением микрокапель на нанокапли, вместо “сборки” наночастиц из атомов и кластеров, задается выбором условий лазерного воздействия на материал мишени. Детально физические основы метода и примеры использования полученных ЛЭД материалов в катализе описаны в книгах [23–26].
Метод ЛЭД чрезвычайно плодотворен для приготовления модельных катализаторов с варьируемой степенью заполнения поверхности, позволяющих анализировать роль межчастичных взаимодействий в катализе наноструктурированными материалами. Первые указания на существование таких взаимодействий получены при анализе каталитических свойств металл-полимерных композитов с разным содержанием металла [27–29]. Оказалось, что при определенном составе пленок меди или палладия в поли-п-ксилилене их каталитическая активность в аллильной изомеризации дихлорбутенов резко возрастает, а при дальнейшем увеличении содержания металла уменьшается. Важно, что максимальная активность наблюдается при таких степенях наполнения композита металлом, когда пленки становятся проводящими, т.е. между отдельными металлическими частицами появляются контакты. Эту идею удалось подтвердить и развить на широком круге химических процессов для ряда металлов, осажденных методом ЛЭД на носители разной природы. Тот факт, что поведение системы наночастиц определяется не только их собственным размером (обычный размерный эффект), но и средним расстоянием между ними, подтвержден детальным анализом каталитического поведения монодисперсных наночастиц Cu, Ni и Pd, осажденных методом ЛЭД на кремниевые подложки [30]. Роль межкластерного переноса заряда в обеспечении аномально высокой каталитической активности ансамблей взаимодействующих частиц металлов на оксидных носителях показана на примерах реакций хлоруглеводородов и гидрирования ненасыщенных соединений. Во всех случаях поверхностная плотность наночастиц металла, при которой наблюдалась максимальная каталитическая эффективность системы, коррелировала с появлением проводимости, как и в металл-полимерных композитах. Теоретическое описание этого явления, связанного с возникновением на поверхности диэлектриков заряженных состояний наночастиц при сближении на пороговые расстояния, допускающие перенос электрона между ними, дано в работах [23–26, 30]. Обнаруженные в этих исследованиях процессы переноса заряда, способствующие формированию высокоактивных в катализе заряженных состояний в ансамблях близко расположенных частиц, могут быть реализованы различными путями. При этом вовсе нет необходимости использовать только монодисперсные системы. Даже напротив, присутствие частиц различных форм и размеров будет облегчать перенос заряда. Неслучайно сходные эффекты наблюдали для металл-полимерных композитов.
Развиваемые представления об оптимальной поверхностной плотности частиц активного компонента чрезвычайно полезны при разработке гетерогенных катализаторов на основе благородных металлов: их содержание можно снизить на порядки, не теряя эффективности каталитического действия. Полученные методом ЛЭД низкопроцентные катализаторы успешно применили для экологически важного процесса переработки токсичных хлорорганических соединений путем паро- и жидкофазного гидродехлорирования [31, 32]. Работы в этом направлении, выполненные под руководством академика РАН В.В. Лунина с участием проф. В.В. Смирнова, Е.С. Локтевой и др., отмечены в 2009 г. Ломоносовской премией МГУ.
Теоретическое и экспериментальное развитие этих исследований за последнее десятилетие частично отражено в разделах книг [24–26] и в статьях научной периодики, важнейшие из которых – работы [33–38]. Так, показано, что заряжение наночастиц обеспечивает усиление каталитической активности не только в случае оксидных носителей; существенное влияние может оказывать перенос заряда между наночастицами металла и проводящими носителями, в частности, углеродными. Измерение методом Кельвин-зонд-микроскопии контактной разности потенциалов между нанесенными наночастицами и проводящей подложкой и экспериментальные данные [25, 26] подтвердили, что в этом случае наибольших эффектов следует ожидать при уменьшении поверхностной плотности частиц металла, т.е. увеличении доли изолированных частиц активного компонента на поверхности носителя.
Исследование физико-химических свойств катализаторов с низким содержанием металлов вызывает значительные сложности, так как такие информативные методы, как РФА и температурно-программированное восстановление, не дают результатов. Однако совершенствование экспериментальной базы МГУ в ходе реализации Программы развития университета существенно расширило возможности физико-химического исследования низкопроцентных покрытий, формируемых методом ЛЭД. Особенно информативным при определении электронного состояния металлов на поверхности низкопроцентных катализаторов ЛЭД оказался метод РФЭС, поскольку весь нанесенный активный компонент (или компоненты) расположен во внешнем нанометровом слое на поверхности носителя и доступен для анализа. Проведенные за последнее десятилетие экспериментальные исследования существенно расширили представления о взаимосвязи структуры и свойств катализаторов ЛЭД; появилось большое количество новых примеров их уникального поведения в катализе. Показано, что ЛЭД сплавов или плотно спрессованных смесей порошков металлов позволяет получать биметаллические покрытия, эффективные в окислительно-восстановительных реакциях разных типов [39–41]. На многих примерах доказано, что по адсорбционным и каталитическим свойствам низкопроцентные катализаторы ЛЭД отличаются от аналогичных материалов, полученных традиционными методами, такими как пропитка, ионный обмен, металло-паровой синтез, осаждение из коллоидных дисперсий [35, 37]. Цель настоящей работы – обобщить накопленные в последнее время данные и показать возможности техники ЛЭД металлов в сравнении с химическим синтезом (ХС) для приготовления моно- и биметаллических катализаторов окислительно-восстановительных процессов. Для сравнения свойств катализаторов, полученных методами ЛЭД и ХС, выбраны имеющие фундаментальное и прикладное значение реакции газофазного окисления кислородом монооксида углерода и метана и жидкофазного окисления сероорганических соединений пероксидом водорода. Последний процесс служит альтернативой широко используемому способу гидроочистки нефтяного сырья от серосодержащих соединений.
МОНОМЕТАЛЛИЧЕСКИЕ КАТАЛИЗАТОРЫ НА ОСНОВЕ НАНОЧАСТИЦ Ni, Pd И Pt
Структурные исследования наночастиц, осажденных методом ЛЭД
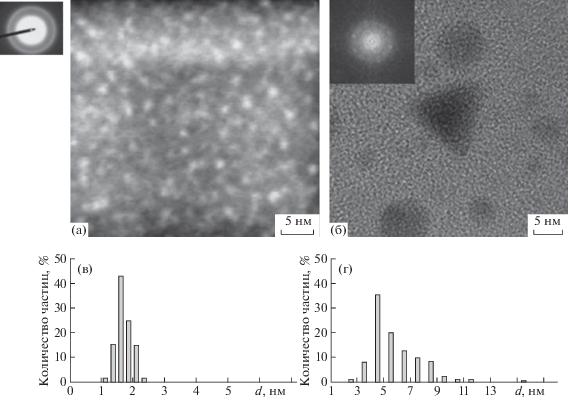
Микрофотографии наночастиц никеля, осажденных на покрытые аморфным углеродом медные сетки для просвечивающей электронной микроскопии (ПЭМ) методом ЛЭД или из химически синтезированных коллоидных дисперсий (КД) [35], показаны на рис. 1. Видно, что метод ЛЭД обеспечивает большую дисперсность и однородность никелевых частиц. Их средний размер не превышает 1.5–2.0 нм. Наночастицы, полученные химическим путем, характеризуются средним размером 3–4 нм, широким распределением по размерам и большей степенью кристалличности.
Рис. 1.
Изображения частиц Ni, нанесенных на покрытые аморфным углеродом медные сетки для ПЭМ методом ЛЭД (а) и осаждением из коллоидной дисперсии в н-гексане (б); гистограммы распределения частиц Ni по размерам в образце ЛЭД (в) и КД (г).
Получить изображения наночастиц Ni, нанесенных методом ЛЭД на поверхность гранул Al2O3, оказалось невозможным. Скорее всего, это обусловлено присутствием на поверхности носителя малоконтрастных по отношению к Al2O3 окисленных форм никеля, что подтверждается данными ИК-спектроскопии диффузного отражения (ИК ДО) и РФЭС. На основании полученных результатов можно заключить, что доля и природа окисленных состояний металла в составе наночастиц, осажденных на гранулы Al2O3 методом ЛЭД и синтезированных химически, различны [35–37]. В ИК ДО-спектрах СО, адсорбированного на поверхности образца 0.01 мас. % Ni/Al2O3 (ЛЭД) при давлении 0.1 кПа и комнатной температуре, имеется слабая полоса поглощения при 2206 см–1, отвечающая карбонильным комплексам катионов Ni2+ [36]. В аналогичных условиях в спектре СО, адсорбированного на 0.3 мас. % Ni/Al2O3, полученного методом пропитки (ХС), наблюдалась полоса при 2178 см–1, характерная для поглощения СО, адсорбированного на NiO [42].
Разный характер распределения никеля в катализаторах на Al2O3, полученных ЛЭД и химическими методами (осаждением из КД и пропиткой) виден из различий в рассчитанном из данных РФЭС атомном отношении Ni/Al на поверхности образцов. Результаты расчета для образцов ЛЭД, содержащих 0.05 и 0.005 мас. % Ni, и катализаторов сравнения – 0.17 мас. % Ni/Al2O3 (КД) и 0.3 мас. % Ni/Al2O3 (пропитка) приведены в табл. 1. Видно, что содержание Ni на поверхности катализаторов ЛЭД значительно превышает объемное, т.е. катализаторы имеют “корочковое” строение, причем соотношение Ni/Al хорошо коррелирует с содержанием никеля в образце. Высокая доля металла на внешней поверхности носителя является одной из причин необычных каталитических свойств образцов ЛЭД. Напротив, содержание Ni на поверхности химически синтезированных образцов понижено по сравнению с общим содержанием.
Таблица 1.
Параметры РФЭ-спектров образцов Ni/Al2O3, полученных разными методами
| Метод | Ni, мас. % | Ni/Al, ат. % | Условия обработки | Доля состояний, ат. % | ||
|---|---|---|---|---|---|---|
| Ni0 | NiO | Ni2+ | ||||
| Энергия связи, эВ | ||||||
| 852.6 | 854.1–854.4 | 855.3–856.5 | ||||
| ЛЭД | 0.05 | 3.4 | исходный | 35 | 17 | 48 |
| 0.005 | 0.35 | исходный | 1 | 68 | 31 | |
| Н2, 300°С | 21 | 50 | 29 | |||
| Н2, 450°С | 54 | 27 | 19 | |||
| КД | 0.17 | 0.03 | исходный | 5 | 46 | 49 |
| Пропитка | 0.3 | 0.01 | исходный | 15 | 7 | 78 |
РФЭ-спектр Ni2p-электронов катализатора 0.17 мас. % Ni/Al2O3 (КД) [35] включает в основном две компоненты от окисленных состояний никеля с энергиями связи 854.4 эВ (NiO) и 855.9 эВ (Ni(OH)2) [43]. Высокоэнергетическую компоненту также можно отнести к алюминату никеля [44], возникающему в результате взаимодействия оксидов никеля и алюминия на границе раздела фаз. В РФЭ-спектрах образцов ЛЭД со значительно меньшим содержанием никеля присутствуют компоненты, соответствующие уже трем электронных состояниям Ni0, NiO и Ni2+ с энергиями связи 852.6, 854.4 и 855.3–856.5 эВ [37]. Доля металлического состояния Ni0 достигает 37 ат. % в катализаторе 0.05 мас. % Ni/Al2O3 (ЛЭД) (рис. 2). Даже при столь малом содержании наночастицы никеля формируют многослойное покрытие на поверхности Al2O3, в котором только частицы первого слоя переходят в окисленное состояние за счет тесного контакта с кислородсодержащим носителем [41].
Рис. 2.
РФЭС Ni2p спектры образцов: а – 0.17 мас. % Ni/Al2O3 (КД); б – 0.05 мас. % Ni/Al2O3 (ЛЭД); в – 0.01 мас. % Ni/Al2O3 (ЛЭД), исходный и после in situ восстановления водородом при разных температурах.
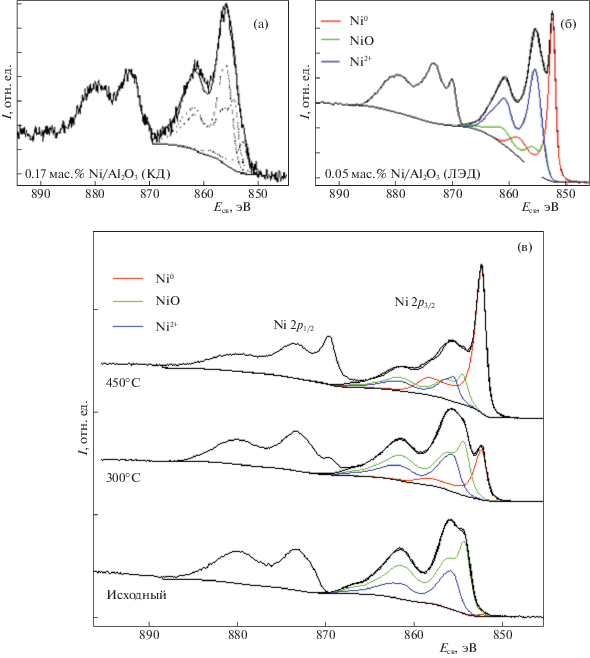
При содержаниях Ni ниже 0.01 мас. % в РФЭ-спектрах ЛЭД-образцов присутствуют только компоненты от окисленных состояний никеля, однако после обработки водородом уже при температуре 300°C вклад Ni0 заметно растет, а при 450°C восстанавливается уже более половины Ni (табл. 1). Причем, как видно из рис. 2в, в первую очередь уменьшается вклад компоненты с меньшим значением энергии связи (~854.4 эВ), близким к характерному для NiO. По-видимому, это значение соответствует более лабильной форме поверхностного оксида никеля, в меньшей степени взаимодействующей с носителем. Известно, что тонкие пленки поверхностного NiO восстанавливаются сравнительно легко [45]. Высокодисперсные частицы NiO, осажденные на Al2O3 классическими “мокрыми” методами, в силу сильного оксид-оксидного взаимодействия восстанавливаются водородом только при температурах выше 450°C [35, 46].
Различия в структуре и способности к восстановлению наночастиц никеля разной кристалличности, осажденных на пластины высокоориентированного пиролитического графита (ВОПГ) методом ЛЭД и из КД, подтверждены также данными сканирующей туннельной микроскопии и спектроскопии (СТМ/СТС) (рис. 3) [47].
Рис. 3.
Результаты СТС–СТМ-анализа наночастиц никеля на поверхности образца Ni/ВОПГ (ЛЭД, степень заполнения поверхности 0.1 слоя наночастиц): а – изображение поверхности; б и в – вольтамперные характеристики (ВАХ) разных участков поверхности образцов Ni/ВОПГ (ЛЭД) (б) и Ni/ВОПГ (КД) (в); г – изменение ширины запрещенной зоны в образцах Ni/ВОПГ (ЛЭД) и Ni/ВОПГ (КД) в ходе обработки водородом.
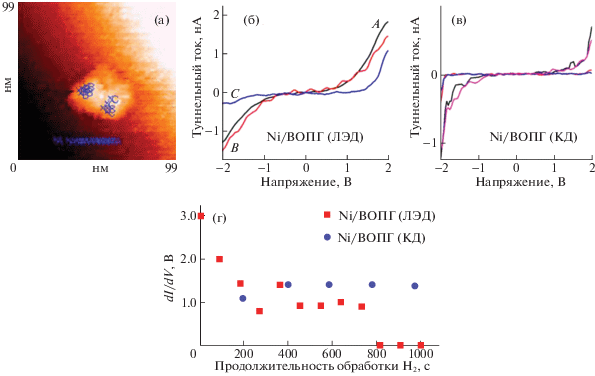
Светлая область на снимке образца Ni/ВОПГ (ЛЭД) (рис. 3а), скорее всего, относится к агрегату близко расположенных никелевых частиц. На основании разного характера вольтамперных характеристик (ВАХ) в разных точках на поверхности наночастиц, нанесенных на ВОПГ методом ЛЭД (рис. 3б), можно заключить, что присутствуют участки с металлической и нулевой проводимостью, соответствующей оксидам никеля, вероятно, нестехиометрического состава. В образцах, полученных нанесением никеля на ВОПГ из КД, присутствует только окисленная форма никеля (рис. 3в). Все измеренные ВАХ отвечают нулевой проводимости и не изменяются в присутствии водорода, что свидетельствует об устойчивости оксида никеля к восстановлению, по крайней мере, при комнатной температуре. Напротив, наночастицы никеля, нанесенные на поверхность ВОПГ методом ЛЭД, восстанавливаются водородом уже при комнатной температуре (рис. 3г), при этом на ВАХ исчезают участки с нулевой проводимостью. Различная способность к восстановлению – еще одна причина различий в каталитическом поведении аналогичных по составу образцов, полученных методами ЛЭД и КД.
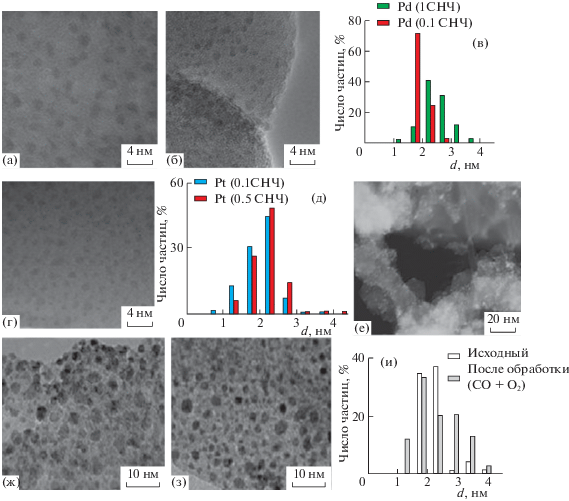
На рис. 4 приведены примеры микроизображений модельных образцов, полученных нанесением наночастиц Pd и Pt методом ЛЭД на сетки для ПЭМ, а также катализаторов, в которых использовали распространенные материалы подложек (цеолит ZSM-5, Al2O3, углеродный носитель Сибунит). Видно, что во всех случаях поверхность равномерно заполнена сферическими частицами металлов размером ~2 нм, причем размер частиц не зависит ни от природы носителя, ни от поверхностной плотности частиц металла. Эта величина, очень важная для характеристики ЛЭД-катализаторов, здесь и в дальнейшем приводится в виде количества слоев наночастиц металла (СНЧ) или доли монослоя, которую заполняют наночастицы металла на поверхности носителя. Однородность частиц по размеру и форме, их равномерное распределение по внешней поверхности носителя независимо от его природы обусловлены физическими принципами, лежащими в основе каскадного деления микрокапель металла в плазме лазерного факела, подробно изложенными в книге [26]. Эти особенности метода ЛЭД определяют его уникальные возможности не только при формировании модельных систем, предназначенных для анализа роли межчастичных взаимодействий, но и с точки зрения синтеза наноструктурированных катализаторов с улучшенными свойствами.
Рис. 4.
ПЭМ-изображения образцов ЛЭД: а – Pd/cетка ПЭМ, б – Pd/ZSM-5, в – распределение частиц Pd по размерам в образцах Pd/cетка ПЭМ с разной степенью заполнения поверхности; г – Pt/сетка ПЭМ; д - распределение частиц Pt по размерам в образцах с разной степенью заполнения поверхности; е – Pt/Сибунит; ж – Pt/Al2O3 исходный, з – Pt/Al2O3 после каталитических испытаний в окислении СО; и – распределение частиц Pt по размерам в образцах до и после каталитических испытаний.
Интенсивные сигналы нанесенных металлов регистрируются только в РФЭ-спектрах неизмельченных пластин или гранул низкопроцентных образцов, полученных методом ЛЭД. При измельчении сигналы в спектрах исчезают. Этот факт подтверждает, что наночастицы металла в методе ЛЭД осаждаются главным образом на внешнюю поверхность носителя, не проникая в его объем. На рис. 5 сопоставлены спектры Pd3d двух образцов, полученных нанесением наночастиц Pd на поверхность цеолитного носителя ZSM-5 ионным обменом (ХС) и методом ЛЭД.
Рис. 5.
РФЭ-спектры Pd/ZSM-5 катализаторов: а – ХС, 0.2 мас. % Pd до и после восстановления водородом при 350°С; б – ЛЭД, 0.01 мас. % Pd.
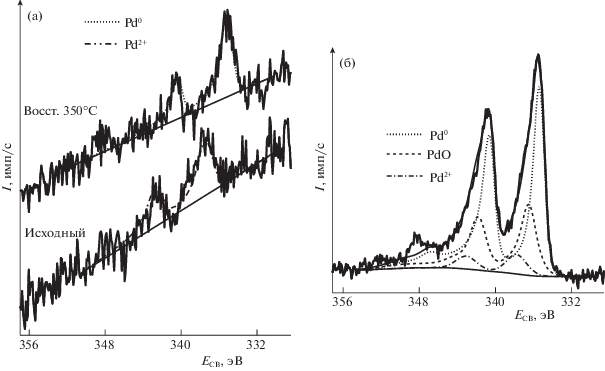
Видно, что интенсивность сигналов Pd3d в РФЭ-спектрах образца ЛЭД значительно выше, чем в химически синтезированном образце, хотя содержание Pd в первом в 20 раз меньше. Это свидетельствует о распределении палладия преимущественно на поверхности носителя в образце ЛЭД, а в образце, полученном ионным обменом, в основном в каналах цеолита. В результате различается атомное соотношение Pd/Al на поверхности этих образцов, а также электронное состояние палладия. Наночастицы, осажденные на поверхность цеолита методом ЛЭД, включают 62% Pd0 (Есв = 335.4 эВ) и два окисленных состояния PdO и Pd2+ (Есв = 336.5 и 337.8 эВ) с преобладанием низкоэнергетического состояния. Значения энергий связи согласуются с известными данными [48, 49]. Образец, полученный ионным обменом, включает только окисленный палладий, который полностью восстанавливается водородом за 3 ч при 350°С (рис. 5 и табл. 2).
Таблица 2.
Параметры РФЭ-спектров Pd-катализаторов, нанесенных на цеолит ZSM-5 и Al2O3 разными методами
| Образец | Доля состояний, ат. % | |||||
|---|---|---|---|---|---|---|
| Носитель | Метод, условия | Pd, мас. % | Pd/Al, ат. | Pd0 | PdO | Pd2+ |
| Есв, эВ | ||||||
| 335.1–335.9 | 336.5–336.7 | 337.3–338.0 | ||||
| ZSM-5 | ионный обмен | 0.2 | 0.008 | 0 | 0 | 100 |
| ионный обмен, Н2, 350°С | 0.008 | 100 | 0 | 0 | ||
| ЛЭД | 0.01 | 0.15 | 62 | 31 | 7 | |
| Al2O3 | ЛЭД | 0.02 | 1.9 | 79 | 12 | 9 |
| ЛЭД, Н2, 150°С | 1.05 | 81 | 10 | 9 | ||
| ЛЭД | 0.005 | 0.065 | 27 | 48 | 25 | |
| ЛЭД, Н2, 150°С | 0.075 | 86 | 10 | 4 | ||
В отличие от размера частиц, электронное состояние металлов в образцах ЛЭД зависит от степени заполнения поверхности или количества нанесенного металла, а также от природы носителя. На рис. 6 приведены РФЭ-спектры образцов Pd/Al2O3 с разным содержанием Pd.
Рис. 6.
Pd3d РФЭ-спектры Pd/Al2O3 катализаторов (ЛЭД): а – 0.02 мас. % Pd; б – 0.005 мас. % Pd до и после in situ восстановления H2 в ячейке высокого давления РФЭС-спектрометра.
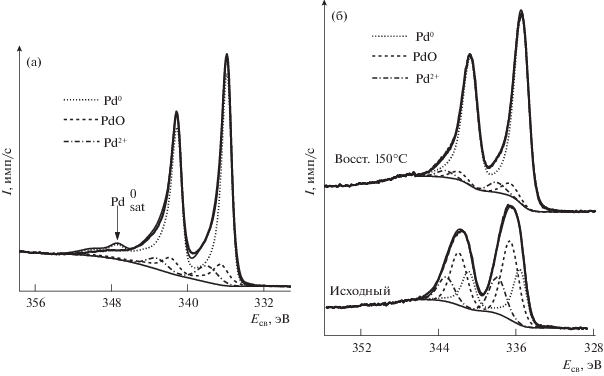
Видно, что образец 0.02 мас. % Pd/Al2O3 включает в основном Pd0, обработка водородом при 150°С практически не меняет соотношение Pd0/Pd2+. Сравнение геометрических размеров гранул Al2O3 (средний диаметр 0.7 мм) и наночастиц Pd (2 нм), позволяет утверждать, что на поверхности носителя формируется многослойное покрытие из 3–4 слоев таких наночастиц. Количество наночастиц палладия в образце 0.005 мас. % Pd/Al2O3 достаточно для образования монослойного покрытия, в котором палладий в значительной степени окислен (табл. 2) в результате взаимодействия с носителем. В этом случае обработка водородом при 150°С приводит к восстановлению образца и увеличению доли Pd0 до 86%. По-видимому, устойчивая к восстановлению форма Pd2+ (10–14%) сильно взаимодействует с Al2O3. После обработки водородом образца 0.02 мас. % Pd/Al2O3 с исходным преобладанием Pd0 соотношение Pd/Al на его поверхности уменьшается. Это соотношение меняется меньше для образцов со значительным вкладом окисленных форм палладия, что подтверждает сильное взаимодействие оксидов палладия и алюминия [50].
Сходные тенденции видны из данных анализа спектров Pt 4f катализаторов Pt/Al2O3, синтезированных методом ЛЭД (табл. 3).
Таблица 3.
Параметры РФЭ-спектров Pt-катализаторов (исходных, после предварительной обработки в He, после каталитических испытаний в окислении СО), нанесенных методом ЛЭД на гранулы Al2O3 разного размера и цеолита ZSM-5
| Образец | Условия | Доля состояний, ат. % | Pt/Al | |||||
|---|---|---|---|---|---|---|---|---|
| Носитель | Размер гранул носителя, мм | Pt, мас. % | Число СНЧ | Pt0 | PtO | Pt2+ | ||
| Eсв(Pt4f7/2), эВ | ||||||||
| 71.3 | 72.5 | 75.2 | ||||||
| Al2O3 | 0.7 | 0.02 | 3.5 | Исходный | 91 | 7 | 2 | 1.8 |
| 400°С, He | 95 | 3 | 2 | 0.9 | ||||
| 0.002 | 0.35 | Исходный | 10 | 79 | 11 | 0.14 | ||
| CO/O2 = 2 | 80 | 10 | 10 | 0.06 | ||||
| CO/O2 = 1 | 72 | 23 | 5 | 0.05 | ||||
| 400°С, He | 81 | 5 | 14 | 0.06 | ||||
| 0.08 | 0.02 | 0.4 | Исходный | 46 | 46 | 8 | 0.07 | |
| CO/O2 = 2 | 72 | 23 | 5 | 0.12 | ||||
| 0.005 | 0.1 | Исходный | 29 | 58 | 13 | 0.03 | ||
| ZSM-5 | 0.5 | 0.01 | – | Исходный | 2 | 95 | 3 | 1.5 |
В соответствии с данными [51–54], спектры Pt 4f разделены на три компоненты с энергиями связи 71.3, 72.5 и 75.2 эВ, соответствующими металлическому и двум окисленным состояниям платины. Окисленное состояние с большей энергией связи может относиться как к Pt4+, так и к соединениям Pt2+, в частности, смешанным оксидам или солям. Последнее предположение представляется более вероятным, поскольку указанная компонента спектра в наименьшей степени изменяется при обработке водородом. Это позволяет отнести ее к трудно восстанавливаемому продукту оксид-оксидного взаимодействия PtOx–Al2O3, существование которого доказано при исследовании радиальной функции распределения электронной плотности в катализаторах Pt/Al2O3, полученных методом пропитки из раствора нитрата платины [54].
Использование гранул Al2O3 разного диаметра позволяет при одинаковом содержании металла варьировать степень заполнения внешней поверхности носителя. Данные табл. 3 наглядно показывают, что степень заполнения поверхности наночастицами платины наряду с содержанием определяет соотношение ее окисленных и восстановленных форм в катализаторах. При равном массовым содержании на мелких гранулах Al2O3 с большей величиной внешней поверхности в расчете на грамм носителя доля поверхности, занятой металлом, существенно ниже, чем в образцах на крупных гранулах. Это находит подтверждение в разном соотношении Pt/Al. Чем оно ниже, т.е. чем реже расположены частицы металла, тем выше вероятность окисления металла за счет кислородного окружения на поверхности носителя. Возможность окисления Pt и Pd при взаимодействии с гидроксильными группами или водой на поверхности Al2O3 показана в работе [55]. Прогрев в атмосфере СО или He приводит к увеличению доли Pt0, при этом соотношение Pt/Al на поверхности, как и в случае Pd-содержащих катализаторов, уменьшается. Скорее всего, это связано с миграцией высокодисперсных металлических частиц вглубь носителя или c их декорированием носителем при повышенных температурах [50]. Для всех изученных металлов (Ni, Pd и Pt) увеличение доли металлического состояния в ходе восстановительных обработок происходит главным образом за счет восстановления окисленных форм с меньшими значениями энергии связи, доля высокоэнергетических окисленных состояний меняется меньше. Их повышенная устойчивость к восстановлению, скорее всего, обусловлена сильным взаимодействием с носителем.
Наночастицы Pt, нанесенные методом ЛЭД на цеолит ZSM-5, оказались практически полностью окисленными даже при относительно высоком содержании 0.01 мас. %, что связано, по-видимому, с более развитой поверхностью цеолита и более низкой степенью заполнения его поверхности частицами платины по сравнению с Al2O3.
Сильное взаимодействие с металлом в ЛЭД-образцах характерно не только для оксидных, но и для углеродных носителей. Влияние степени заполнения поверхности на электронное состояние металлов отчетливо видно из анализа РФЭ-спектров образцов, полученных осаждением разного количества наночастиц Ni, Pd и Pt на плоскую поверхность ВОПГ. Пример Pt4f- и С1s-спектров образов Pt/ВОПГ со степенью заполнения поверхности 0.1 и 0.5 СНЧ показан на рис. 7.
Рис. 7.
Pt4f и C1s РФЭ-спектры образцов Pt/ВОПГ с разной степенью покрытия носителя наночастицами Pt (0.1 и 0.5 слоев наночастиц, СНЧ). Спектры нормированы по интенсивности.
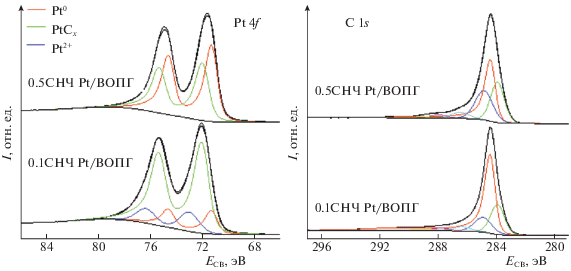
Атомное соотношение Pt/C на поверхности этих образцов составляет 0.027 и 0.125, что хорошо согласуется с заданным соотношением степеней заполнения поверхности. Параметры спектров собраны в табл. 4.
Таблица 4.
Зависимость электронного состояния металлов в катализаторах Ме/ВОПГ (ЛЭД) по данным РФЭС (δ – степень покрытия носителя, СНЧ)
| Параметр | Ni | Pd | Pt | |||
|---|---|---|---|---|---|---|
| δ | 0.1 | 0.5 | 0.1 | 0.5 | 0.1 | 0.5 |
| Ме0, ат. % | 9 | 7 | 5 | 17 | 15 | 55 |
| Есв, эВ | 852.6 | 335.3 | 71.3 | |||
| МеСх, ат. % | 25 | 48 | 39 | 81 | 70 | 45 |
| Есв, эВ | 853.1 | 335.9 | 72.1 | |||
| Ме2+, ат. % | 66 | 45 | 56 | 2 | 15 | 0 |
| Есв, эВ | 856.0 | 336.5–338.3 | 73.0 | |||
| СхМе, ат. % | 18 | 30 | 16 | 21 | 21 | 26 |
| Есв, эВ | 283.8 | 283.8 | 283.9 | |||
Форма и параметры компонент спектров свидетельствуют о сильном взаимодействии металлов с углеродом с образованием твердых растворов углерода или даже карбидоподобных структур МеСх. Во всех случаях, помимо компонент, соответствующих металлическому (Me0) и окисленному (Me2+) состояниям металлов, в спектрах наблюдаются дополнительные компоненты с энергиями связи 853.1, 335.9 и 72.1 эВ для Ni, Pd и Pt, которые соответствуют известным данным для карбидов металлов [56–61]. О наличии взаимодействия металл–углерод также свидетельствует появление в C1s РФЭ-спектре компонент с энергией связи 283.8–283.9 эВ, соответствующих карбидному состоянию, помимо узкой асимметричной линии при энергии связи 284.4 эВ, характерной для sp2-углерода. Во всех спектрах также присутствует слабый вклад от групп O=C–O (‒COO–) при энергии связи С1s, равной 288.5 эВ.
Как отмечено ранее для образцов на Al2O3, поверхностная плотность частиц металла влияет на соотношение окисленного и восстановленного состояний. Это связано с окислением металлов за счет кислородного окружения на поверхности Al2O3. На этом носителе Ni0 сохранялся только в составе многослойных покрытий, при этом ~30% Pt0 обнаружено в составе катализатора, содержащего всего 0.1 СНЧ (табл. 1 и 3). При такой же поверхностной плотности 0.1 СНЧ на поверхности ВОПГ присутствует больше Pt0 (~85%). При увеличении степени заполнения поверхности углеродного носителя до 0.5 СНЧ на поверхности ЛЭД-образцов преобладают восстановленные формы Pd, Pt и Ni (табл. 4). В спектре РФЭС-образца 0.5 СНЧ Pt/ВОПГ компонента, соответствующая состоянию Pt2+, отсутствует.
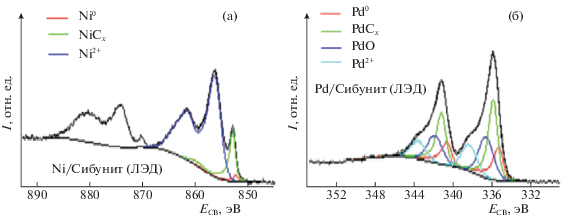
Взаимодействие металл–углерод обнаружено также в образцах, полученных осаждением наночастиц Ni и Pd на другой углеродный носитель – Сибунит (рис. 8). Правда, в этом случае вклад компонент, соответствующих MeCх, в спектры Ni2p, Pd3d и C1s ниже, чем в спектрах образцов, нанесенных на ВОПГ. Это, вероятно, обусловлено повышенным содержанием кислородсодержащих групп на поверхности Сибунита.
Рис. 8.
Спектры РФЭС-катализаторов ЛЭД на Сибуните: а – Ni 3p, 0.005 мас. % Ni; б – Pd 3d, 0.005 мас. % Pd.
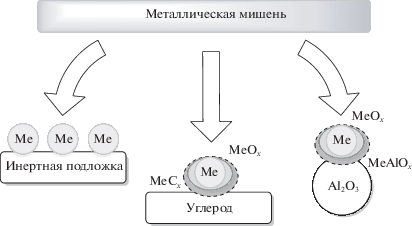
На основании проведенных исследований предположено, что наночастицы, нанесенные методом ЛЭД на оксидные или углеродные носители, имеют “луковичную” структуру, включающую металлическое ядро и оксидную оболочку. Оксидная оболочка наночастиц, осажденных на Аl2O3, включает два разных состояния – легко восстанавливающийся поверхностный оксид и устойчивый к восстановлению смешанный оксид MeOx–Al2O3, возникающий вследствие сильного взаимодействия высокодисперсных частиц металла с носителем. При использовании углеродных носителей (ВОПГ, Сибунит) на поверхности наночастиц металла формируется либо твердый раствор углерода, либо даже поверхностные карбидоподобные структуры МеСх (рис. 9).
Рис. 9.
Схема строения образцов, полученных ЛЭД-металлов на поверхность инертных подложек (сетка для ПЭМ), углерода (ВОПГ, Сибунит) и Al2O3.
Таким образом, электронное состояние металлов зависит, помимо природы металла и носителя, от поверхностной плотности частиц нанесенного металла. В плотных и многослойных покрытиях даже при содержаниях металла ~0.01 мас. % в составе наночастиц сохраняется металлическое ядро, что практически недостижимо при ХС наночастиц. Кроме того, оксидная фаза в составе наночастиц ЛЭД легче восстанавливается водородом по сравнению с химически синтезированными образцами. Это определяет особенности поведения наноструктурированных катализаторов, полученных методом ЛЭД, в окислительно-восстановительных процессах.
Особенности каталитических свойств наночастиц металлов, полученных методом ЛЭД
Наноструктурированные катализаторы, полученные лазерным электродиспергированием Ni, Pd и Pt на поверхность носителей, по своим адсорбционным и каталитическим свойствам резко отличаются от катализаторов близкого состава, синтезированных “классическими” химическими методами. Необычно высокая каталитическая активность, превышающая на порядки активность известных катализаторов, отмечена в реакциях углеводородов и хлоруглеводородов, протекающих в восстановительных условиях. Примеры таких процессов и причины аномального поведения катализаторов ЛЭД подробно рассмотрены в книгах [23–26]. В настоящей статье они дополнены новыми результатами. Также проанализированы возможности метода ЛЭД для синтеза катализаторов окисления. Сравнение их свойств с известными катализаторами проведено на примерах окисления кислородом монооксида углерода и метана.
Наночастицы никеля
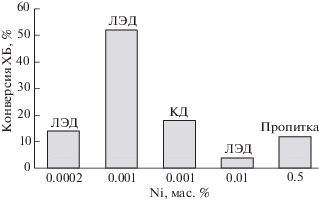
В случае никеля особенности каталитического поведения катализаторов ЛЭД проявляются наиболее ярко. Они зачастую обладают активностью там, где традиционные нанесенные катализаторы не работают вовсе или многократно уступают им по активности. Так, в парофазном гидродехлорировании (ГДХ) хлорбензола (ХБ) [34, 35] активность ЛЭД-катализаторов Ni/Al2O3 выше аналогов, полученных осаждением наночастиц никеля из коллоидных дисперсий.
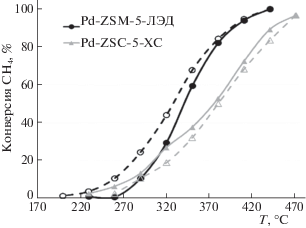
Как видно из рис. 1, наночастицы никеля, полученные методом ЛЭД, отличаются более низкой кристалличностью по сравнению с наночастицами из КД. Они легче восстанавливаются и обладают активностью в ГДХ уже при 100°С. При столь низкой температуре химически синтезированные катализаторы на основе никеля неактивны [62]. Сравнение конверсии хлорбензола (ХБ) в присутствии катализаторов ЛЭД с разным содержанием никеля, пропиточного и КД, показано на рис. 10. Видно, что конверсия ХБ на катализаторах ЛЭД выше, чем на химических аналогах, причем максимальная конверсия ХБ достигается на образце 0.001 мас. % Ni/Al2O3 с весьма низким содержанием никеля, со степенью заполнения поверхности ~0.3 СНЧ. Значительное повышение конверсии до 80% отмечено в результате восстановительной обработки образцов [33]. Столь высокая активность катализаторов ЛЭД связана с доступностью активной фазы – никеля, расположенного в виде монодисперсных наночастиц на внешней поверхности носителя, а также значительным содержанием Ni0 в их составе. Влияние восстановительной обработки, необычная экстремальная зависимость конверсии от степени заполнения поверхности Al2O3 частицами никеля и ее корреляция с появлением проводимости пленок позволяют связать отличное каталитическое действие с проявлением зарядовых взаимодействий в системе близко расположенных частиц [25, 26].
Рис. 10.
Содержание Ni и конверсия хлорбензола в реакции ГДХ при 350°С на катализаторах Ni/Al2O3, полученных разными методами.
Активность никелевых и палладиевых ЛЭД-катализаторов сопоставлена с традиционными пропиточными в табл. 5. Видно, что по активности, рассчитанной из начальной скорости ГДХ, приведенной к полному содержанию металла, никелевые ЛЭД-катализаторы лишь незначительно уступают палладиевым. Однако существенный недостаток никелевых катализаторов связан с их низкой стабильностью. Активность катализаторов ЛЭД так же, как и химически синтезированных образцов, быстро уменьшается в реакционной среде, что связано с декорированием частиц металла носителем, их вероятным укрупнением и хлорированием. Оказалось, что частично устранить эти недостатки можно, если предварительно методом ЛЭД нанести на поверхность Al2O3 тонкую пленку золота [33].
Таблица 5.
Конверсия и приведенная каталитическая активность в ГДХ Ni и Pd катализаторов при 200°С
| Параметр | Ni/Al2O3, ЛЭД | Ni/Al2O3 пропитка |
Pd/наноалмаз ионный обмен |
Pd/Al2O3, ЛЭД | Pd/Сибунит, ЛЭД | ||
|---|---|---|---|---|---|---|---|
| Ме, % | 0.001 | 0.003 | 4 | 0.5 | 0.01 | 0.001 | 0.003 |
| ХБ, % | 33 | 10 | 75 | 100 | 100 | 78 | 33 |
| А, ч–1 | 28 000 | 9500 | 23 | 570 | 22 000 | 66 000 | 21 000 |
ЛЭД-катализаторы Ni/Al2O3 с содержанием Ni < 0.01 мас. % активны в окислении СО при стехиометрическом соотношении реагентов (CO/O2 = 2), в то время как аналог, полученный методом пропитки и содержащий на порядок больше никеля, в тех же условиях практически неактивен [36, 37, 62]. Более того, как видно из рис. 11, конверсия СО на Ni/Al2O3 (ЛЭД) катализаторе значительно выше, чем на Au/Al2O3 (ЛЭД). Известно, что катализаторы на основе наночастиц золота относятся к числу самых активных в окислении СО и превосходят никелевые катализаторы примерно на три порядка [63]. Для катализаторов ЛЭД неожиданно получена обратная зависимость, которая может быть обусловлена широким распределением по размерам частиц Au, осажденных на подложку методом ЛЭД (от 1 до 8 нм, включая высокодисперсные кластеры или даже атомы золота) [33], что отличает их от ЛЭД-катализаторов на основе других металлов. Таким образом, число частиц с размерами, оптимальными для катализа окисления СО, в составе Au/Al2O3 (ЛЭД) может быть невелико.
Рис. 11.
Зависимость конверсии СО от температуры реакции для катализаторов Ni/Al2O3 (ЛЭД) (исходный и активированный в атмосфере СО при комнатной температуре) и Au/Al2O3 (ЛЭД) в импульсном режиме при CО/O2 = 2.
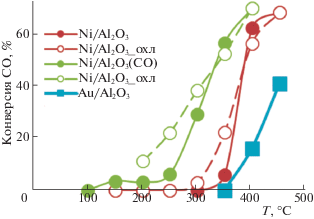
Восстановительная обработка СО при комнатной температуре приводит к повышению эффективности Ni/Al2O3 (ЛЭД), температура окисления СО снижается на 50–100°С (рис. 11). Высокая активность катализаторов ЛЭД так же, как в рассмотренной выше реакции ГДХ, связана с присутствием Ni0 или его появлением при восстановительной обработке в более мягких условиях (рис. 2) по сравнению с катализаторами, приготовленными методами ХС. Высокие температуры восстановления никельсодержащих катализаторов [46] ограничивают их применение в катализе. Приготовленные методом ЛЭД высокодисперсные никелевые системы легче поддаются восстановлению и позволяют обойти это ограничение.
Наночастицы платины и палладия
Массу металла, наносимого на подложку методом ЛЭД, обычно варьируют путем изменения времени нанесения. Однако, как указано выше, каталитические свойства зависят не только от массового содержания активного компонента, но и от степени заполнения поверхности носителя наночастицами. Изменения степени заполнения поверхности при одинаковом массовом содержании платины добивались путем использования гранул Al2O3 разного размера – с диаметром 0.7 и 0.08 мм. Это позволило варьировать степень заполнения поверхности от 3.5 до 0.04 СНЧ, переходя от многослойных покрытий к изолированным частицам Pt.
Как следует из приведенных выше примеров, предварительная обработка или использование катализаторов ЛЭД в восстановительных условиях (избыток H2 или СО) способствует улучшению каталитических свойств. В связи с этим тестирование катализаторов на основе наночастиц Pt и Pd в окислении СО кислородом проводили в реакционных смесях, не содержащих избытка кислорода (при стехиометрическом соотношении реагентов при СO/O2 = 2 в импульсном режиме или в эквимолярной смеси при СO/O2 = 1 в проточном реакторе), в обоих случаях в режимах последовательного нагрева и охлаждения. В импульсном режиме для построения кривых зависимости конверсии СО от температуры использовали стационарные значения конверсии СО, которые достигались, как правило, после подачи на катализатор от 10 до 20 импульсов реакционной смеси (СО/О2 = 2).
Из данных РФЭС (табл. 3) видно, что при использовании реакционных смесей указанного состава доля восстановленного металла (Pt0 в приведенном примере) в катализаторе в ходе процесса возрастает.
На рис. 12 приведены примеры температурной зависимости конверсии СО для двух выбранных катализаторов 0.002 мас. % Pt/Al2O3 и 0.01 мас. % Pt/Al2O3 (для них степень заполнения поверхности из-за разного размера гранул носителя составляла 0.35 и 0.2 СНЧ соответственно). Видно, что в проточной системе при соотношении СO/O2 = 1 на катализаторе со сверхнизким содержанием Pt (0.002 мас. %) окисление начинается при температуре ~200°С, характерной для катализаторов на основе металлов VIII группы [64–67]. В импульсном режиме при использовании реакционной смеси состава СO/O2 = 2 заметная конверсия СО достигается только при температуре выше 300°С даже на катализаторе с большим содержанием платины (0.01 мас. %), что отчасти обусловлено другим составом реакционной смеси, но также может быть связано с отличиями в электронном состоянии Pt при разной степени заполнения поверхности наночастицами. Известно, что сильная адсорбция СО на центрах Pt0 препятствует адсорбции кислорода и дальнейшему окислению [65]. При меньшей поверхностной плотности частиц на поверхности преобладает Pt2+. Однако на рис. 12 видна и общая закономерность – в двух режимах проведения процесса в условиях снижения температуры оба катализатора обеспечивают большую конверсию СО, чем при тех же температурах в ходе нагревания, т.е. обе зависимости смещаются в область низких температур. Этому же способствует предварительный прогрев катализатора в инертной атмосфере. По данным РФЭС, соотношение Pt0/Pt2+ на поверхности катализатора в условиях предобработки или реакции увеличивается и достигает значений от 3 до 4 (табл. 3). Вероятно, при этом формируется активное состояние катализатора, благоприятное для катализа. Современные теоретические и экспериментальные данные указывают на дополнительную активацию реагентов на границах контакта металл/оксид [68–70].
Рис. 12.
Зависимости конверсии СО от температуры реакции для катализаторов ЛЭД: а – 0.002 мас. % Pt/Al2O3 (диаметр гранул носителя 0.7 мм, поверхностная плотность частиц 0.35 СНЧ), CO/O2 = 1; б – 0.01 мас. % Pt/Al2O3 (диаметр гранул носителя 0.08 мм, поверхностная плотность частиц 0.2 СНЧ), исходный и активированный в He при 500°С, CO/O2 = 2 (сплошная линия – ступенчатый нагрев, пунктирная линия – ступенчатое охлаждение).
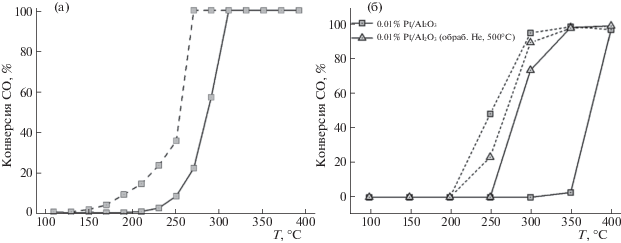
Анализ влияния степени заполнения поверхности на каталитическую активность Pt/Al2O3-катализаторов проведен с использованием стехиометрической смеси СO/O2 = 2 с учетом данных, полученных в режиме охлаждения, когда достигается стабильный режим работы катализатора. Оказалось, что как температура начала реакции, так и конверсия СО при заданной температуре экстремально зависят от степени заполнения поверхности гранул Al2O3 платиной.
Как видно из табл. 6, наименьшее значение температуры достижения 10%-ной конверсии СО (T10) и наибольшее значение конверсии при температуре 300°С обеспечивает катализатор 0.01 мас. % Pt/Al2O3 со степенью заполнения поверхности 0.2 СНЧ. Энергия активации, оцененная по низкотемпературному участку температурной зависимости конверсии в режиме снижения температуры, также для этого образца оказалась минимальной и составила ~75 кДж/моль. Для остальных образцов она достигает 91–94 кДж/моль. Таким образом, окисление СО кислородом на образцах, полученных осаждением монодисперсных наночастиц Pt на Al2O3, служит еще одним примером аномального поведения низкопроцентных катализаторов ЛЭД. Можно предположить, что наибольшая эффективность в катализе достигается за счет формирования оптимального электронного и зарядового состояния платины при неполном заполнении поверхности носителя ее частицами.
Таблица 6.
Влияние степени заполнения поверхности Al2O3 наночастицами Pt на температуру 10% конверсии (Т10) и конверсию СО при 300°С в режиме охлаждения, СO/O2 = 2
| Параметр | Число СНЧ Pt | ||||
|---|---|---|---|---|---|
| 0.04 | 0.1 | 0.2 | 0.4 | 3.5 | |
| Еа, кДж/моль | 91.5 | 93.9 | 74.8 | 85.6 | 91.5 |
| Т10, °С | 250 | 240 | 210 | 228 | 256 |
| Конверсия CO, % | 50 | 91 | 95 | 43 | 59 |
Сравнение эффективности катализаторов ЛЭД на основе наночастиц Pt и Pd между собой и с ХС аналогами на разных носителях в окислении СО при двух соотношениях CO/O2 = 1 и 2 приведено на рис. 13 и в табл. 7. При всех условиях платиновые катализаторы уступают палладиевым; Pt/Al2O3-катализаторы, приготовленные методами ЛЭД и ХС, обладают сравнимой эффективностью. Влияние природы носителя на каталитическую активность в окислении СО видно на примере наночастиц Pd.
Рис. 13.
Температурные зависимости конверсии СО; а–Pd/ZSM-5 0.01% ЛЭД и 0.1% ХС; б–Pd/Al2O3 ЛЭД (0.02%) и XC (0.1%); СO/O2 = 1, в режимах нагрева (сплошная линия) и охлаждения (пунктирная линия).
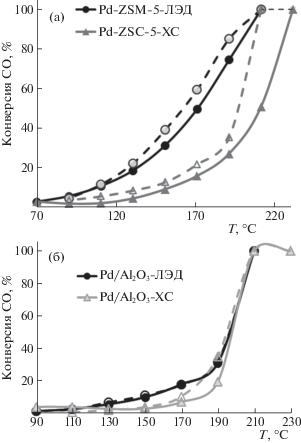
Таблица 7.
Сравнение эффективности Pd- и Pt-катализаторов на разных носителях, приготовленных ЛЭД и ХС (ионный обмен) в окислении СО в разных условиях
| Реакционная система | Катализатор | Ме, мас. % | Метод синтеза | Т10, °С, нагрев | Т10, °С, охл. |
|---|---|---|---|---|---|
| Проточная система, СO/O2 = 1 | Pd/ZSM-5 | 0.1 | ХС | 150 | 150 |
| Pd/ZSM-5 | 0.01 | ЛЭД | 110 | 110 | |
| Pd/Al2O3 | 0.02 | ЛЭД | 150 | 150 | |
| Pt/ZSM-5 | 0.01 | ЛЭД | 190 | 180 | |
| Pt/Al2O3 | 0.02 | ЛЭД | 250 | 190 | |
| Импульсная система, СO/O2 = 2 | Pd/Сибунит | 0.005 | ЛЭД | 300 | 250 |
| Pd/ZSM-5 | 0.01 | ЛЭД | 155 | 145 | |
| Pd/Al2O3 | 0.005 [71] | ЛЭД | 235 | 200 | |
| Pd/Al2O3 | 0.64 [8] | ХС | 175 | – | |
| Pt/Al2O3 | 0.01 | ЛЭД | 280 | 200 | |
| Pt/Al2O3 | 0.06 | ХС | 260 | 200 |
Катализатор 0.01 мас. % Pd/ZSM-5 (ЛЭД) обеспечивает меньшее значение T10 и более высокую конверсию CO уже при 190–200°С (рис. 13 и табл. 7). По этим параметрам он превосходит катализатор 0.1% Pd/ZSM-5 (ХС), полученный ионным обменом с последующим восстановлением, а также аналогичные Pd/Al2O3-катализаторы на оксиде алюминия. Полученный ионным обменом катализатор 0.64 мас. % Pd/Al2O3 более активен по сравнению с образцами ЛЭД, но необходимо учитывать, что содержание Pd в нем на два порядка выше, чем в образце ЛЭД [71].
Катализаторы ЛЭД, нанесенные на Al2O3 и тем более на Сибунит, уступают образцам на цеолите ZSM-5 (табл. 7). Поскольку размер частиц Pd на всех носителях одинаков, различия в каталитической способности связаны с разным электронным строением активных центров, обусловленным взаимодействием с носителем (рис. 9). На всех носителях Pd присутствует и в металлическом, и в окисленном состоянии, причем имеется дополнительная форма палладия, появление которой вызвано взаимодействием с носителем. Сильное взаимодействие Pd c углеродом, по-видимому, является причиной пониженной каталитической активности нанесенных на Сибунит образцов. Их активность резко повышается только после прогрева до 350°С. Вероятно, при этой температуре углерод окисляется и в виде оксидов покидает поверхность катализатора [41].
На поверхности Al2O3 и ZSM-5, помимо Pd0, присутствуют два окисленных состояния, с более низкой энергией электронов – Pd2+, и с более высокой – PdOx–Al2O3. Разное поведение в катализе образцов на цеолите и Al2O3 может быть связано с некоторыми различиями в их электронном состоянии (табл. 2), определяющими их адсорбционные свойства. Как отчетливо видно из рис. 13, температурные зависимости конверсии СО в присутствии палладиевых катализаторов, нанесенных на Al2O3 и ZSM-5, имеют разный характер. На катализаторе на Al2O3 процесс резко ускоряется при достижении температуры десорбции СО, что типично для катализаторов платиновой группы. Такой вид зависимости соответствует отрицательному порядку реакции по СО [72]. Более плавная зависимость, полученная на цеолите, скорее, соответствует первому порядку реакции по СО, в этом случае, скорее всего, адсорбция СО не препятствует дальнейшему окислению.
Как видно из температурных зависимостей конверсии СО (рис. 13), Pd-катализаторы ЛЭД сохраняют высокую активность при повторных каталитических испытаниях. Аналогичный эффект наблюдается и в окислении метана кислородом. Из рис. 14 видно, что катализатор 0.01 мас. % Pd/ZSM-5, полученный методом ЛЭД, оказался более эффективным в окислении метана, чем образец, полученный химическим путем с большим на порядок содержанием Pd. Поиск эффективных и стабильных катализаторов активации метана при относительно низких температурах остается актуальной задачей, при низких концентрациях полное окисление метана обычно осуществляется только при температурах выше 400°С [73]. Поэтому полученные результаты еще раз подтверждают преимущества использования метода ЛЭД для синтеза наноструктурированных катализаторов с улучшенными свойствами. Очевидно, что адсорбционные и каталитические свойства цеолитов, модифицированных введением небольших добавок благородных металлов методом ЛЭД, нуждаются в дальнейшем изучении. Но уже сейчас можно заключить, что в данном случае проявляется заметный синергический эффект совместного действия металла и цеолита.
БИМЕТАЛЛИЧЕСКИЕ КАТАЛИЗАТОРЫ ЛЭД
Совместное использование двух металлов зачастую приводит к улучшению активности, стабильности и селективности катализаторов, позволяет снизить содержание благородных металлов и, следовательно, стоимость катализаторов [4–6]. Однако химический синтез биметаллических катализаторов сложно контролировать, он отличается плохой воспроизводимостью. Поэтому важно оценить возможности метода ЛЭД для синтеза биметаллических катализаторов. Необычные свойства монометаллических никелевых ЛЭД-катализаторов стимулировали первоочередное исследование биметаллических систем, содержащих Ni в качестве одного из компонентов. Второй компонент выбирали в соответствии с характером целевых каталитических процессов: Au или Pd – для гидрирования и окисления СО кислородом, Mo и W – в случае окисления сероорганических соединений пероксидом водорода. При синтезе биметаллических катализаторов методом ЛЭД применяли следующие подходы:
1) последовательное нанесение металлов двух типов с использованием монометаллических мишеней (таким образом получены катализаторы для процессов ГДХ и окисления СО состава NiAu/Al2O3 [33, 36], а также СоPd/ZSM-5);
2) использование в качестве мишени сплава двух металлов (подход реализован в ходе синтеза NiPd/Al2O3 и NiPd/Сибунит катализаторов для использования в ГДХ и в окислении СО [39, 41]);
3) использование мишеней из предварительно плотно спрессованных смесей порошков Ni, Mo или W для синтеза катализаторов окисления сероуглеводородов пероксидом водорода [40, 41];
4) комбинированный подход, включающий химическое введение Со в структуру цеолита путем пропитки из раствора солей и нанесение Pd или Pt методом ЛЭД [74].
В данном разделе мы сопоставим возможности перечисленных выше подходов к использованию метода ЛЭД для получения биметаллических катализаторов в сравнении с традиционным химическим синтезом.
Последовательное нанесение наночастиц золота и никеля
Синтезированные методами ХС биметаллические катализаторы, включающие Ni и Au, служат ярким примером проявления синергических свойств двух металлов в ряде процессов, включая ГДХ хлорорганических соединений [74] и окисление СО [62].
Из табл. 8 следует, что активность и стабильность биметаллических образцов зависит от порядка нанесения металлов. Конверсия ХБ оказалась выше для образца Au/Ni/Al2O3, полученного нанесением золота поверх никеля, однако она заметно уменьшается со временем. На катализаторе Ni/Au/Al2O3 с обратным порядком нанесения конверсия ХБ оказалась ниже, но заметно увеличилась стабильность катализатора. В проточной системе с непрерывной подачей реагентов конверсия ХБ оставалась высокой в течение длительного времени.
Таблица 8.
Эффективность золото-никелевых катализаторов ЛЭД в ГДХ ХБ при длительных испытаниях
| Катализатор | Au/Ni/Al2O3 | Ni/Au/Al2O3 | |||
|---|---|---|---|---|---|
| Порядок нанесения | 1-Ni | 2-Au | 1-Au | 2-Ni | |
| Ме, мас. % | 0.001 | 0.01 | 0.01 | 0.001 | |
| Конверсия ХБ (%) при температуре (°С) | 200 | 72 | 22 | ||
| 300 | 100 | 85 | |||
| Длительность испытаний, ч | 1 | 82 (200°С) | 92 (300°С) | ||
| 9 | 55 | 95 | |||
| 23 | нет данных | 92 | |||
Эти особенности поведения связаны, скорее всего, с разной структурной организацией катализаторов. Как показано в [33], на изображениях ПЭМ биметаллических образцов присутствуют наночастицы Ni размером 1.5–2.0 нм и более крупные частицы Au от 1 до 8 нм, образующие цепочки частиц, а также высокодисперсные, фактически атомарные пленки золота, такие же, как в монометаллических аналогах. Хотя на основании данных ПЭМ–ЭДА можно заключить, что на всех исследованных участках поверхности присутствуют оба металла в соотношении Au : Ni ~10, которое задано временами их нанесения, однако взаимного влияния металлов на их электронную структуру не происходит. Об этом свидетельствует тот факт, что параметры РФЭ-спектров моно- и биметаллических катализаторов практически совпадают. На поверхности присутствует только Au0 и Ni2+. Однако присутствие тонкой пленки из отдельных кластеров и атомов золота на поверхности NiAu/Al2O3 может двояко влиять на каталитическое поведение никеля. Как показано ранее на рис. 10, именно образцы Ni/Al2O3 с содержанием никеля ~0.001 мас. % наиболее активны в ГДХ. Их высокая активность связана, по нашему мнению, с формированием ансамблей заряженных частиц за счет переноса электрона между близко расположенными частицами при оптимальной степени заполнения поверхности [25]. Появление на поверхности Al2O3 проводящих областей, образованных пленками золота, скорее всего, снижает действие этих эффектов и ухудшает активность. В то же время присутствие пленки золота уменьшает нежелательное взаимодействие оксида никеля с носителем, что является одной из причин потери его активности [35]. Как видно из рис. 15, синергический эффект совместного действия двух металлов заметен только при повышении температуры реакции ГДХ до 300–350°С, когда происходит частичное восстановление оксида никеля.
Рис. 15.
Зависимости конверсии ХБ от температуры в присутствии Ni/Al2O3, Au/Al2O3 и Ni/Au/Al2O3 катализаторов ЛЭД.

Адсорбционные и каталитические свойства биметаллических Ni/Au/Al2O3 ЛЭД-образцов сопоставлены со свойствами монометаллических аналогов и химически синтезированных катализаторов сравнения на примере окисления СО. Методом ИК ДО-спектроскопии адсорбированного СО [36] показано, что уже при комнатной температуре на биметаллических катализаторах происходит диссоциативная адсорбция СО, а при нагревании катализаторов в атмосфере СО в отсутствие кислорода осуществляется его окисление. Это подтверждается снижением интенсивности полос поглощения СО, адсорбированного на льюисовских кислотных центрах (ЛКЦ) Al2O3. Если на исходном Al2O3 полоса колебаний νCO при 2199 см–1 присутствует уже при давлении СО 0.2 кПа, то после нанесения биметаллического покрытия с низким суммарным содержанием металлов (0.01 мас. %) эта полоса появляется в спектрах только при давлениях на порядок выше (1.5–2.0 кПа). Одновременно с уменьшением интенсивности указанной полосы в спектрах возникают новые полосы поглощения в области 1800 см‒1, соответствующие карбонатным структурам или слабо связанным с поверхностью формам СО2. Интенсивность поглощения в этой области спектра увеличивается со временем. Подобные процессы осуществляются также на золотых катализаторах, приготовленных как методом ЛЭД, так и ионным обменом, и включающих частицы золота близкого размера 3–4 нм. Однако эффективность этих реакций многократно увеличивается при введении Ni в состав катализатора. В результате в РФЭ-спектрах золотосодержащих образцов после обработки в атмосфере СО регистрируется увеличение общей интенсивности спектра С1s и образование атомарного углерода. Полученные результаты свидетельствуют о том, что совместное действие Ni и Au в катализаторах ЛЭД приводит к диссоциативной адсорбции СО и его окислению в анаэробных условиях.
Однако при изучении окисления СО кислородом в стехиометрических условиях (СО/O2 = 2) заметный синергетический эффект не обнаружен [36]. Как видно из табл. 9, Ni/Au/Al2O3-катализатор по своему поведению в ходе первых тестовых испытаний в режиме нагрева не отличается от Ni-аналога. Разница становится заметной в условиях снижения температуры, когда температура 10%-ной конверсии СО (Т10) на биметаллическом образце смещается в область низких температур на 50°С и становится значительно ниже, чем для монометаллических аналогов.
Таблица 9.
Температура 10%-ной конверсии СО (Т10) для моно- и биметаллических золото-никелевых катализаторов, нанесенных на Al2O3 разными методами
| Металл | Ni | Ni–Au | Au | |
|---|---|---|---|---|
| Ме, мас. % | 0.01 | 0.01 | 0.01 | 0.1 [62] |
| Метод синтеза | ЛЭД | ионный обмен | ||
| Т10 – нагрев | 354 | 350 | 378 | 407 |
| Т10 – охлаждение | 327 | 300 | 352 | нет данных |
Причины активации катализатора в реакционной среде могут быть разными. В никелевых катализаторах – это, вероятно, частичное восстановление NiO и достижение благоприятного для катализа соотношения Ni0/Ni2+, как это обсуждалось ранее [37]. Разработка катализатора может быть также обусловлена удалением с его поверхности атомарного углерода в результате окисления. Нельзя также исключить, что при повышенных температурах усиливаются взаимодействия металл–металл, и совместное действие Ni и Au становится заметным. Отметим, что при изучении адсорбции СО методом ИК ДО-спектроскопии образцы предварительно прогревали в вакууме, в отличие от каталитических испытаний, которые проводили без предварительного прогрева катализатора. Химический синтез катализаторов обязательно включает стадии высокотемпературной обработки образцов [62]. Кроме того, в качестве предшественников используют растворы солей металлов в достаточно высоких концентрациях, что создает предпосылки для взаимодействия между металлическими компонентами [8, 75]. Похоже, что при независимом нанесении на поверхность носителя двух металлов методом ЛЭД взаимодействия наночастиц практически не происходит. Однако нельзя исключить его проявления при повышенных температурах. Весьма вероятно, что в этом и заключаются причины различного поведения NiAu/Al2O3-катализаторов ЛЭД в адсорбционных и каталитических тестах и их отличия от ХС-образцов.
Лазерное электродиспергирование сплава Ni77Pd23
Известно множество примеров улучшения свойств нанесенных Pd-катализаторов при введении Ni [76–78], одной из причин которого является формирование “сплавных” структур при синтезе материалов или в реакционных условиях [8, 9]. Поскольку, как показано выше, последовательное нанесение металлов методом ЛЭД не обеспечивает их тесного взаимодействия, мы использовали в качестве мишени для лазерного воздействия заранее изготовленный сплав Ni77Pd23 (указано атомное соотношение). Наночастицы осаждали методом ЛЭД на плоские модельные носители – сетки для ПЭМ, ВОПГ, а также на гранулированные носители Al2O3 и Сибунит. Использовали неполные степени заполнения модельных носителей (0.1 и 0.5 СНЧ) или низкое содержание (0.005 мас. %) металлов на гранулированных носителях. Как показали ПЭМ/ЭДА исследования, независимо от природы носителя, полученные системы включают однородные по размеру высокодисперсные частицы металлов, причем на всех изученных участках поверхности присутствуют оба металла в близком к исходному сплаву соотношении [39, 41]. Размер частиц в биметаллической системе (1 нм) оказался несколько меньше, чем в монометаллических (1.5–2.0 нм). По данным РФЭС, никель в биметаллическом катализаторе 0.005 мас. % NiPd/Al2O3 находится в состоянии Ni2+, как и в монометаллическом Ni/Al2O3 при таком же содержании (табл. 1). Палладий в биметаллических образцах присутствует в металлическом и окисленном состоянии, но доля Pd0 составила всего 14%, что в 2 раза меньше, чем для Pd/Al2O3 (табл. 2). Кроме того, оказалось, что восстановление металлов в биметаллических образцах затруднено. Обработка NiPd/Al2O3 в реакционной ячейке РФЭ-спектрометра водородом при 150°С увеличила содержание металлического палладия только до 32%, в то время как аналогичная обработка Pd/Al2O3 обеспечила содержание Pd0 86%. Такая степень восстановления в NiPd/Al2O3 достигается только при 450°С. Никель в составе NiPd/Al2O3 в таких условиях восстановить не удается [41].
В спектрах биметаллических NiPd образцов на ВОПГ и Сибуните так же, как в монометаллических аналогах, присутствуют компоненты, соответствующие карбидоподобным структурам. Образование твердых растворов углерода в металле или соединений типа СхМе подтверждает появление в спектре С1s дополнительной компоненты с энергией связи 283.8 эВ [41].
Однородность металлсодержащих частиц по размеру и составу на ПЭМ-изображениях биметаллических образцов и близкое к составу исходного сплава атомное соотношение Ni/Pd на поверхности (например, 5.3/1.5 для NiPd/Cибунит), а также повышенная устойчивость обоих металлов к восстановлению позволяют предположить, что нанесенные методом ЛЭД наночастицы включают как никель, так и палладий, вероятно, в составе смешанного оксида NiOxPd. Это предположение подтверждают данные СТМ/CТС-исследований таких частиц, осажденных методом ЛЭД на поверхность ВОПГ [79]. Выводы об электронном состоянии металлов сделаны на основании ширины запрещенной зоны на ВАХ на разных участках поверхности. Экспозиция образцов NiPd/ВОПГ в СО привела к сокращению ширины запрещенной зоны от 1.5–2.0 до 0.6–0.8 эВ практически на всех наночастицах. При последующей экспозиции в Н2 на ВАХ подавляющего большинства (более 85%) частиц запрещенная зона исчезла. Таким образом, воздействие СО и водорода в значительной степени освободило поверхность наночастиц от оксидов. Однако на ~15% кривых запрещенная зона шириной ~1 эВ сохранилась даже после длительного прогрева образца NiPd/ВОПГ в водороде при 250°С. В монометаллических образцах Ni/ВОПГ и Pd/ВОПГ, также полученных методом ЛЭД, в описанных условиях экспозиции в СО и водороде восстанавливается не только PdO, но даже NiO. Наблюдаемые различия в способности к восстановлению между моно- и биметаллическими системами могут быть обусловлены взаимодействием компонентов биметаллического покрытия как между собой, так и с носителем [41].
По каталитическим свойствам биметаллические NiPd-катализаторы как на Al2O3, так и на Сибуните отличаются от монометаллических аналогов. Это показали сравнительные исследования в ГДХ хлорбензола и в окислении СО. Так, конверсия ХБ в бензол при 200°С на 0.005 мас. % NiPd/Al2O3 после 3 ч работы составляла ~90%; в этих же условиях конверсия на Pd/Al2O3 составляла всего 70%, а в присутствии Ni/Al2O3 за 3 ч в проточной системе она уменьшилась от 45 до 10% [39]. Данные по окислению СО на моно- и биметаллических Ni-, Pd-катализаторах собраны в табл. 10. Видно, что катализаторы с аналогичным содержанием металлов, нанесенные на Сибунит, активны при более высоких температурах по сравнению с образцами на Al2O3. Для всех образцов характерен сдвиг Т10 в сторону низких температур в результате разработки катализатора под действием реакционной смеси. Биметаллический катализатор NiPd/Сибунит, в составе которого преобладает никель, не уступает по активности монометаллическим аналогам, а NiPd/Al2O3 их превосходит. Все эти образцы характеризуются пониженным содержанием металлов, а использование биметаллических “сплавных” катализаторов открывает дополнительную возможность для сокращения использования дорогостоящего Pd без потери активности катализатора.
Таблица 10.
Температуры 10%-ной конверсии СО (Т10) и величины TOF при окислении СО в стехиометрических условиях (СО/О2 = 2) в импульсной установке в присутствии моно- и биметаллических катализаторов на основе никеля и палладия
| Содержание металла, мас. % | Al2O3 | Сибунит | ||||
|---|---|---|---|---|---|---|
| Т10 – нагрев | Т10 – охлаждение | TOF, с–1 (250°С) | Т10 – нагрев | Т10 – охлаждение | ||
| 0.005Ni | 252 | 185 | 4 | 0 | 350 | – |
| 0.005Pd | 235 | 200 | 7 | 4 | 310 | 260 |
| 0.0039Ni 0.0011Pd |
245 | 140 | 26 | 16 | 325 | 250 |
Лазерное электродиспергирование смеси порошков Ni c Mo или W
Недавно продемонстрирована возможность использования в качестве мишеней для ЛЭД двухкомпонентных порошков, содержащих Ni в смеси с Mo или W [40, 41], а также их монометаллических аналогов. Cмеси Ni + Mo и Ni + W с соотношением компонентов 50/50 ат. % готовили холодным прессованием из порошков Ni, Mo и W с размером зерен 3–8 мкм. В качестве носителя использовали Al2O3. Методом РФЭС показано, что в полученных монометаллических системах никель, молибден и вольфрам находятся только в форме оксидов. Частицы оксидов высокодисперсны, и их трудно различить на ПЭМ-изображениях в связи с малой контрастностью по сравнению с Al2O3. Напротив, на снимках ПЭМ биметаллических образцов NiMo/Al2O3 и NiW/Al2O3 отчетливо видны изображения наночастиц со средним размером 3–7 нм, причем, как и в случае использования “сплавной” мишени, оба компонента каждой пары равномерно распределены по поверхности носителя, а их соотношение близко к 1. Причина более высокой контрастности металлсодержащих частиц обнаружена методом РФЭС и заключается в том, что в их составе даже при низком содержании металлов на поверхности носителя (0.005 мас. %) присутствуют Ni0, Mo0 и W0, а также металлы в низкой степени окисления – Mo4+ и W4+. Как отмечалось ранее, Ni0 в составе наночастиц ЛЭД на поверхности Al2O3 сохраняется только в многослойных покрытиях, содержащих более 0.03 мас. % Ni. Присутствие в составе биметаллических покрытий металлов в восстановленной форме указывает на то, что в ходе ЛЭД может происходить взаимодействие металлов. В литературе описано образование интерметаллидов никеля с молибденом и вольфрамом [80].
Сравнение каталитической активности NiMo/Al2O3 и NiW/Al2O3 с монометаллическими аналогами проведено на примерах окисления тиофена, дибензотиофена (ДБТ) и метилфенилсульфида (тиоанизола) пероксидом водорода. Продуктами окисления ДБТ и тиоанизола являются соответствующие сульфоны и сульфоксиды, в случае тиофена – серная кислота [41]. Катализаторы Ni/Al2O3 с содержанием никеля от 0.005 до 0.05 мас. % в указанных условиях неактивны, однако введение Ni в состав Mo- и W-катализаторов повышает их активность: по величинам TOF в реакции с тиофеном, рассчитанным на основании общего содержания активного металла (Mo или W) катализаторы ЛЭД многократно превышают лучшие известные катализаторы, полученные другими методами [81, 82]. Еще одним важным качеством биметаллических катализаторов является их стабильность (рис. 16), причем NiW/Al2O3 более стабилен по сравнению с NiMo/Al2O3.
Рис. 16.
Конверсия тиофена на моно- и биметаллических катализаторах в пяти последовательных циклах (продолжительность реакции 4 ч, 60°С, растворитель – изооктан, окислитель – 50% водный раствор Н2О2) .
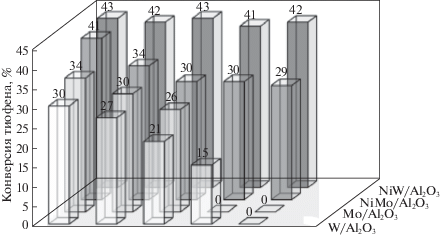
При длительном воздействии пероксида водорода и серной кислоты, образующейся в результате окисления тиофена [40], катализаторы, нанесенные на Al2O3, могут разрушаться. Плотное покрытие поверхности Al2O3 металлами в “корочковых” катализаторах ЛЭД, по-видимому, способствует их стабилизации.
Еще одной особенностью биметаллических катализаторов, содержащих никель, оказался необычный порядок активности в отношении различных окисляемых субстратов. Этот эффект наблюдали при исследовании катализатора NiW/Al2O3. Как видно из рис. 17, он наиболее активен в окислении ДБТ, скорость превращения тиофена несколько ниже, а реакция с тиоанизолом практически не идет. В то же время, согласно известному ряду электрофильности субстратов, которому соответствуют каталитические свойства традиционных катализаторов, содержащих молибден или вольфрам, порядок активности должен иметь вид: тиоанизол ≫ ДБТ ≫ тиофен [83].
Рис. 17.
Зависимости конверсии серосодержащих субстратов от времени на катализаторе NiW/Al2O3; 1– ДБТ, 2 – тиофен, 3 – тиоанизол (60°С, растворитель – изооктан, окислитель – 50% водный раствор Н2О2).
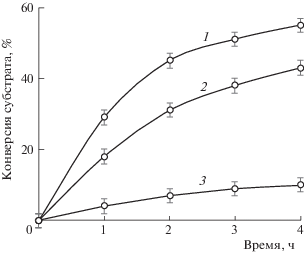
Указанный эффект можно объяснить прочностью адсорбции субстратов на поверхности, которая, по-видимому, становится ключевым фактором для катализаторов с ультранизким содержанием активной фазы. Действительно, эффективность Ni-содержащих адсорбентов определяется размером молекул сероорганического адсорбата, и соединения с объемными заместителями слабо взаимодействуют с частицами никеля вследствие возникающих стерических затруднений [84, 85]. В результате активность биметаллического катализатора становится функцией не только электрофильности субстратов, но и их способности к адсорбции, а необычный порядок активности субстратов на биметаллическом катализаторе NiW/Al2O3 может быть связан с разнонаправленным действием указанных эффектов.
Таким образом, необычные свойства катализаторов, полученных методом ЛЭД, по сравнению с известными системами, приготовленными традиционными методами, проявились также в жидкофазном процессе окисления серосодержащих соединений пероксидом водорода.
СоPd- и СоPt-катализаторы на цеолитных носителях
Известно, что совместное использование оксидов Со и благородных металлов позволяет создавать эффективные катализаторы окисления СО и метана [86, 87]. В настоящей работе мы использовали разные варианты синтеза СоPd- и CoPt-катализаторов, в которых подложкой служили два цеолита ZSM-5 с силикатными модулями Si/Al, составляющими 15 (Z) и 40 (Z*) (табл. 11). Применяли как последовательное нанесение двух металлов с помощью ЛЭД, так и комбинированный метод, включающий химический путь введения катионов кобальта в каналы цеолита и ЛЭД для нанесения благородных металлов. Тестирование катализаторов в реакциях окисления СО и метана кислородом проводили в проточной установке при последовательном повышении и снижении температуры с использованием реакционных смесей следующих составов 1.0% СО, 1.0% О2, 98% Не и 0.4% СН4, 24% О2 75.6% N2, соответственно.
Таблица 11.
Окисление СО на CoPd-катализаторах, приготовленных методом ЛЭД и комбинацией метода ЛЭД и химического синтеза на носителе ZSM-5 c силикатным модулем Si/Al = 15 (Z) и 40 (Z*). Результаты приведены для цикла охлаждения
| Метод синтеза | Катализатор | Т10,°C | Т50,°C | Конверсия СО,% | |
|---|---|---|---|---|---|
| 130°C | 190°C | ||||
| ЛЭД | 0.02 мас. %Со/Z* | 225 | 250 | <1 | 4 |
| 0.01 мас. %Pd/Z* | 188 | 198 | <1 | 60 | |
| 0.02 мас. %Сo/0.01%Pd/Z* | 178 | 205 | 3 | 30 | |
| ЛЭД + ХС | 4.5 мас. %Co/Z | 70 | 125 | 58 | 100 |
| 0.01 мас. % Pd/Z | 110 | 170 | 22 | 75 | |
| 0.01 мас. %Pd/4.5 мас. %Co/Z | 70 | 130 | 58 | 100 | |
| 4.5 мас. %Co/0.01 мас. %Pd/Z | 90 | 140 | 50 | 100 | |
Катализаторы сравнивали на основании значений температур 10%-ной и 50%-ной конверсии СО или метана (Т10 и Т50) и конверсии при заданных температурах. Результаты сравнительных испытаний катализаторов в окислении СО и СН4 приведены в табл. 11 и 12.
Таблица 12.
Окисление СО и метана на катализаторах на носителе ZSM-5 c силикатным модулем Si/Al = 15 (Z), в которых платину наносили методом ЛЭД, а кобальт – методом пропитки по влагоемкости
| Катализатор | Окисление СО | Окисление СH4 | ||||||
|---|---|---|---|---|---|---|---|---|
| Т10 | Т50 | Конверсия при Т, °С | Т10 | Т50 | Конверсия при 350°C | |||
| 130 | 190 | нагрев | охлаждение | |||||
| 0.01 мас. %Pt/Z | 190 | 220 | <1 | 15 | 440 | >500 | 3 | 2 |
| 0.01 мас. %Pt/4.5 мас. %Co/Z | 50 | 110 | 86 | 100 | 320 | 365 | 62 | 46 |
| 4.5 мас. %Co/0.01 мас. %Pt/Z | <50 | 90 | 88 | 100 | 260 | 350 | 68 | 50 |
Последовательное нанесение Со и Pd
Содержание металлов, нанесенных методом ЛЭД, составляло 0.02 мас. % Со и мас. 0.01% Pd. Из табл. 11 видно, что монометаллический катализатор Со/Z* (ЛЭД) по активности в окислении СО (T10 = 225°C) сравним с никелевым ЛЭД-катализатором Ni/Al2O3 (рис. 11) и значительно уступает Pd/Z*(ЛЭД)-образцу. Совместное действие Со- и Pd-наночастиц на поверхности Co/Pd/Z*-катализатора проявляется в катализе окисления СО только при относительно низких (<200°C) температурах: 10% конверсия СО на биметаллических системах достигается при температуре на 10°C ниже, чем на монометаллическом Pd/Z*, и значительно ниже, чем на монометаллическом Со/Z* ЛЭД-катализаторе (табл. 11).
Комбинированный синтез CoPd- и CoPt-катализаторов
Синтез катализаторов проводили двумя путями, один из которых (А) включал химическое введение катионов Со в структуру цеолита путем пропитки по влагоемкости водным раствором ацетата кобальта (ХС), как описано в [7], и нанесение Pd или Pt – методом ЛЭД на полученный материал, а другой путь (Б) подразумевал обратную последовательность нанесения благородных металлов и кобальта [73]. Содержание Сo во всех образцах составляло 4.5, а Pd и Pt – 0.01 мас. %.
Ранее показано [7, 88], что катализаторы Со/ZSM-5, полученные методом пропитки по влагоемкости при отношении Co/Al < 1, характеризуются высокими значениями активности в окислении СО кислородом при низких температурах. Кобальт в таких системах находится в основном в виде заряженных оксокатионных комплексов [CoxOy]n+ (n = 1, 2) в каналах цеолита. Содержание оксида кобальта Co3O4, быстро теряющего активность, на поверхности цеолита в этих условиях минимально.
Из табл. 11 видно, что химически синтезированный CoZ обеспечивает низкие значения Т10 и Т50 и высокую конверсию CO уже при 130°С, он значительно превосходит по этим параметрам образец CoZ*, полученный методом ЛЭД, а также монометаллические палладиевые катализаторы на различных носителях, полученные разными методами (рис. 13, 14). Биметаллические катализаторы Pd/Co/Z (А) и Со/Pd/Z (Б) обладали схожими каталитическими свойствами и не превосходили по активности Со/Z, синтезированный химически.
Заметное улучшение эффективности Со-содержащих катализаторов, полученных химической модификацией цеолитов ацетатом кобальта, при введении наночастиц платины методом ЛЭД обнаружено в двух тестовых реакциях окисления СО и СН4 (рис. 18 и табл. 12).
Рис. 18.
Зависимости конверсии СО от температуры для катализаторов на носителе ZSM-5 (Z): Со/Z – 4.5 мас. % Со (ХС); Pt/Z – 0.01 мас. % Pt (ЛЭД), Pt/Co/Z – 0.01 мас. % Pt (ЛЭД)/4.5 мас. % Со (ХС)/Z, Сo/Pt/Z – 4.5 мас. % Со (ХС)/0.01 мас. % Pt (ЛЭД)/Z, все кривые получены в режиме охлаждения.
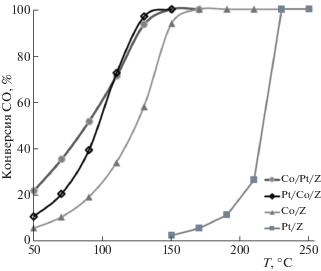
Монометаллические катализаторы на основе Pt, как отмечено выше, требуют значительно более высоких температур для окисления СО по сравнению с Pd/Z и, тем более, с Со/Z (XC). Так, при 130°C конверсия СО в присутствии обоих монометаллических катализаторов не превышала нескольких процентов. Однако при использовании биметаллических катализаторов Pt/Со/Z и Со/Pt/Z конверсия СО достигает 100% при 190°C.
Как видно из рис. 18 и табл. 12, активность биметаллических катализаторов в двух изученных реакциях практически не зависит от последовательности введения компонентов. Окисление метана кислородом на таких образцах начинается при необычно низких для этого процесса температурах (~200°С), а конверсия при 350°С превышает 60%.
Введение сверхмалых количеств Pt методом ЛЭД также повышает стабильность малоустойчивых катализаторов на основе Со/Z (XC) [73]. Биметаллические PtCo-катализаторы не теряют активности в нескольких последовательных циклах окисления (СО и метана) в проточной системе.
Факт заметного улучшения каталитических свойств биметаллических образцов, синтезированных комбинацией метода ЛЭД и химического синтеза, оказался довольно неожиданным. Имеются многочисленные свидетельства того, что наночастицы металлов осаждаются методом ЛЭД на внешнюю поверхность носителя, а ионы кобальта наиболее активны в катализе, если они расположены внутри каналов цеолита в виде оксо-комплексов [7]. Казалось бы, что взаимодействия между компонентами каталитической системы в этом случае ожидать трудно. Однако усиление каталитических свойств CoPt-систем заставляет предполагать возможность взаимного влияния металлов на их электронное строение и свойства, что подтверждают предварительные данные РФЭС. Этот вопрос, безусловно, заслуживает дальнейшего детального изучения, но уже сейчас можно считать, что сочетание метода ЛЭД с традиционными химическими способами модификации цеолитов открывает новые возможности создания высокоэффективных катализаторов.
ВЫВОДЫ
Основные достоинства метода ЛЭД заключаются в следующем:
− равномерное заполнение внешней поверхности носителя наночастицами металла или оксида строго определенного размера;
− возможность регулировать степень заполнения поверхности носителя металлом путем изменения времени нанесения и геометрических характеристик носителя;
− независимость размера металлсодержащих частиц от природы носителя, степени заполнения поверхности или содержания металла;
− размер получаемых частиц палладия, платины, никеля составляет от 1 до 2 нм, т.е. находится в области значений, наиболее подходящих для осуществления каталитических процессов;
− сохранение структуры отдельных наночастиц в плотных и даже многослойных покрытиях, т.е. повышенная устойчивость наночастиц к агрегации.
При сохранении размера частиц электронное состояние металлов зависит, помимо природы металла и носителя, от поверхностной плотности частиц. В катализаторах со степенью покрытия поверхности носителя частицами металла, близкой к монослою наночастиц, а также в многослойных покрытиях даже при содержаниях металла ~0.01 мас. % в наночастицах сохраняется металлическое ядро, что практически недостижимо при химическом синтезе наночастиц. Кроме того, окисленные формы металлов в составе наночастиц ЛЭД восстанавливаются в более мягких условиях по сравнению с химически синтезированными образцами близкого состава. Это определяет особенности поведения наноструктурированных металлсодержащих катализаторов, полученных методом ЛЭД, в окислительно-восстановительных процессах и делает данный метод весьма полезным при разработке новых низкопроцентных катализаторов. Снижение содержания активной фазы до <0.01 мас. % без потери эффективности катализаторов особенно важно для катализа благородными металлами. Преимущества новых катализаторов на основе наночастиц Pd, Pt, Au, Ni, W, Mo, Co продемонстрированы на примерах экологически важных окислительно-восстановительных процессов. В их числе утилизация хлорорганических отходов путем гидродехлорирования, окисление СО и метана, очистка нефтяного сырья путем окислительного обессеривания. Во всех случаях катализаторы ЛЭД не уступают, а в большинстве случаев превосходят по активности и/или стабильности известные катализаторы со значительно большим содержанием металлов, синтезированные химическими методами.
Работа выполнена при финансовой поддержке РФФИ в рамках научного проекта № 19-33-90024 с использованием оборудования, приобретенного по Программе развития Московского университета.
Список литературы
Yu J., Nan J., Zeng H. // Appl. Surf. Sci. 2017. V. 402. P. 330.
Hong S., Lee H., Yeo J. et al. // Nano Today. 2016. V. 11. № 5. P. 547.
Zhang J., Chaker M., Ma D. // J. Colloid Interface Sci. 2017. V. 489. P. 138.
Эллерт О.Г., Цодиков М.В., Николаев С.А. и др. // Успехи химии. 2014. Т. 83. № 8. С. 718. Ellert O.G., Tsodikov M.V., Nikolaev S.A. et al. // Russ. Chem. Rev. 2014. V. 83. № 8. P. 718.
Dal Santo V., Gallo A., Naldoni A. et al. // Catal. Today. 2012. V. 197. № 1. P. 190.
Cai F., Yang L., Shan S. et al. // Catalysts. 2016. V. 6. № 7. P 96.
Shilina M.I., Rostovshchikova T.N., Nikolaev S.A. et al. // Mater. Chem. Phys. 2019. V. 223. P. 287.
Nikolaev S.A., Golubina E.V., Shilina M.I. // Appl. Catal. B Environ. 2017. V. 208. P. 116.
Vedyagin A.A., Plyusnin P.E., Rybinskaya A.A. et al. // Mater. Res. Bull. 2018. V. 102. P. 196.
Vedyagin A.A., Volodin A.M., Stoyanovskii V.O. et al. // Top. Catal. 2017. V. 60. № 1–2. P. 152.
Qiao B., Wang A., Yang X. et al. // Nat. Chem. 2011. V. 3. № 8. P. 634.
Qiao B., Liang J.-X., Wang A. et al. // Nano Res. 2015. V. 8. № 9. P. 2913.
Liu L., Corma A. // Chem. Rev. 2018. V. 118. № 10. P. 4981.
Vedyagin A.A., Volodin A.M., Stoyanovskii V.O. et al. // Appl. Catal. B Environ. 2011. V. 103. № 3–4. P. 397.
Kozhevin V.M., Yavsin D.A., Kouznetsov V.M. et al. // J. Vac. Sci. Technol. B Microelectron. Nanom. Struct. 2000. V. 18. № 3. P. 1402.
Кожевин В.М., Ростовщикова Т.Н., Явсин Д.А. и др. // Докл. АН. 2002. Т. 387. № 6. С. 785.
Ростовщикова Т.Н., Явсин Д.А., Смирнов В.В. и др. // Кинетика и катализ, 2003. Т. 44. № 4. С. 607.
Rostovshchikova T.N., Smirnov V.V., Kozhevin V.M. et al. // Appl. Catal. A: General, 2005. № 296. P. 70.
Rostovshchikova T.N., Smirnov V.V., Gurevich S.A. et al. // Catalysis Today, 2005. № 105. P. 344.
Невская С.М., Николаев С.А., Носков Ю.Г. и др. // Кинетика и катализ. 2006. Т. 47. № 4. С. 657. Nevskaya S.M., Nikolaev S.A., Noskov Yu.G. et al. // Kinet. Catal. 2006. V. 47. № 4. P. 638.
Локтева Е.С., Ростовщикова Т.Н., Качевский С.А. и др. // Кинетика и катализ. 2008. Т. 49. № 5. С. 784. Lokteva E.S., Rostovshchikova T.N., Kachevskii S.A. et al. // Kinet. Catal. 2008. V. 49. № 5. P. 748.
Rostovshchikova T.N., Nikolaev S.A., Lokteva E.S. et al. In: Studies in Surface Science and Catalysis, ed. E.M. Gaigneaux, M. Devillers, S. Hermans Elsevier, 2010. P. 263.
Gurevich S.A., Kozhevin V.M., Yassievich I.N. et al. In: “Physico-chemical phenomena in thin films and at solid surfaces”, Volume: Thin films and nanostructures, ed. L.I. Trakhtenberg, S.H. Lin, O.J. Ilegbusi, Elsever Inc., 2007 Amsterdam: Elsevier, V. 34. P. 726–754.
Кожевин В.М., Явсин Д.А., Ильющенков Д.С. и др. В кн.:“Синтез, строение и свойства металл/полупроводник содержащих наноструктурированных композитов”. Ред. Л.И. Трахтенберг, М.Я. Мельников. М.: Техносфера, 2016. С. 447–486.
Rostovshchikova Tatiana N., Lokteva Ekaterina S., Golubina Elena V. et al. In: Advanced Nanomaterials for Catalysis and Energy: Synthesis, Characterization and Application / ed. Sadykov V. 2019. P. 61–97.
Rostovshchikova T.N., Lokteva E.S., Nikolaev S.A. et al. In: Catalysis: Principles, Types and Applications. Nova Science Publishers Inc NY, United States of America, 2011. P. 245–306.
Trakhtenberg L.I., Gerasimov G.N., Grigoriev E.I. et al. Studies in Surface Science and Catalysis, 2000. P. 941.
Трахтенберг Л.И., Герасимов Г.Н., Потапов В.К. и др. // Вестн. Моск. ун-та. Серия “Химия”. 2001. Т. 42. № 5. С. 325.
Воронцов П.С., Григорьев Е.И., Завьялов С.А. и др. // Хим. физика. 2002. Т. 21. № 2. С. 45.
Ростовщикова Т.Н., Смирнов В.В., Кожевин В.М. и др. // Российские нанотехнологии. 2007. Т. 2. № 1–2. С. 47.
Ростовщикова Т.Н., Локтева Е.С., Качевский C.А. и др. // Катализ в промышленности. 2009. Т. 3. С. 47. Rostovshchikova T.N., Lokteva E.S., Kachevskii S.A. et al. // Catal. Ind. 2009. V. 1. № 3. P. 214.
Lunin V., Smirnov V., Lokteva E. et al. The Role of Ecological Chemistry in Pollution Research and Sustainable Development. Ed. A.M. Bahadir and G. Duca. Springer, Netherlands. 2009. P. 221.
Lokteva E.S., Peristyy A.A., Kavalerskaya N.E. et al. // Pure Appl. Chem. 2012. V. 84. № 3. P. 495.
Ростовщикова Т.Н., Шилина М.И., Голубина Е.В. и др. // Изв. АН. Сер. хим. 2015. № 4. С. 812.
Кавалерская Н.Е., Локтева Е.С., Ростовщикова Т.Н. и др. // Кинетика и катализ. 2013. Т. 54. № 5. С. 631. Kavalerskaya N.E., Lokteva E.S., Rostovshchikova T.N. et al. // Kinet. Catal. 2013. V. 54. № 5. P. 597.
Ростовщикова Т.Н., Шилина М.И., Голубина Е.В. и др. // Изв. АН. Сер. хим. 2015. № 4. С. 812.
Голубина Е.В., Локтева Е.С., Маслаков К.И. и др. // Рос. нанотехнологии. 2017. Т. 12. № 1–2. С. 16.
Гуревич С.А., Ильющенков Д.С. // Электрохимия. 2017. № 53. С. 567.
Golubina E.V., Rostovshchikova T.N., Lokteva E.S. et al. // Pure Appl. Chem. 2018. V. 90. № 11. P. 1685.
Брыжин А.А., Тархановa И.Г., Маслаков К.И. и др. // Журн. физ. химии. 2019. Т. 93. № 10. С. 1575. Bryzhin A.A., Tarkhanova I.G., Maslakov K.I. et al. // Russ. J. Phys. Chem. A. 2019. V. 93. № 10. P. 1976.
Bryzhin A.A., Golubina E.V., Maslakov K.I. et al. // ChemCatChem. 2020. cctc.202000501. https://doi.org/10.1002/cctc.202000501
Tkachenko O.P., Kustov L.M., Nikolaev S.A. et al. // Top. Catal. 2009. V. 52. № 4. P. 344.
Biesinger M.C., Payne B.P., Grosvenor A.P. et al. // Appl. Surf. Sci. 2011. V. 257. № 7. P. 2717.
Biesinger M.C., Payne B.P., Lau L.W.M. et al. // Surf. Interface Anal. 2009. V. 41. № 4. P. 324.
D’Addato S., Grillo V., Altieri S. et al. // J. Phys. Condens. Matter. 2011. V. 23. № 17. P. 175003.
Li G., Hu L., Hill J.M. // Appl. Catal. A Gen. 2006. V. 301. № 1. P. 16.
Gatin A.K., Grishin M.V., Gurevich S.A. et al. // Nanotechnologies Russ. 2015. V. 10. № 11–12. P. 850–857. Гатин А.К., Гришин М.В., Гуревич С.А. и др. // Российские нанотехнологии. 2015. Т. 10. № 11–12. С. 1.
Pillo T., Zimmermann R., Steiner P. et al. // J. Phys. Condens. Matter. 1997. V. 9. № 19. P. 3987.
Mansour A.N. // Surf. Sci. Spectra. 1994. V. 3. № 3. P. 231.
Liu J.J. // ChemCatChem. 2011. V. 3. № 6. P. 934
Saveleva V.A., Papaefthimiou V., Daletou M.K. et al. // J. Phys. Chem. C. 2016. V. 120. № 29. P. 15930.
Kovtunov K.V., Barskiy D.A., Salnikov O.G. et al. // Chem. Commun. 2014. V. 50. № 7. P. 875.
Li Q., Wang K., Zhang S. et al. // J. Mol. Catal. A Chem. 2006. V. 258. № 1–2. P. 83.
Pakharukova V.P., Pakharukov I.Y., Bukhtiyarov V.I. et al. // Appl. Catal. A Gen. 2014. V. 486. P. 12.
Ammendola P., Barbato P.S., Lisi L. et al. // Surf. Sci. 2011. V. 605. № 19–20. P. 1812.
Kang M., Bae Y.-S., Lee C.-H. // Carbon N. Y. 2005. V. 43. № 7. P. 1512.
Weatherup R.S., Bayer B.C., Blume R. et al. // Nano Lett. 2011. V. 11. № 10. P. 4154.
Bayer B.C., Bosworth D.A., Michaelis F.B. et al. // J. Phys. Chem. C. 2016. V. 120. № 39. P. 22571.
Teschner D., Borsodi J., Wootsch A. et al. // Sci. 2008. V. 320. № 5872. P. 86.
Teschner D., Vass E., Havecker M. et al. // J. Catal. 2006. V. 242. № 1. P. 26.
Gabasch H., Hayek K., Klötzer B. et al. // J. Phys. Chem. C. 2007. V. 111. № 22. P. 7957.
Николаев С.А., Голубина Е.В., Кустов Л.М. и др. // Кинетика и катализ. 2014. Т. 55. № 3. С. 326. Nikolaev S.A., Golubina E.V., Kustov L.M. et al. // Kinet. Catal. 2014. V. 55. № 3. P. 311.
Royer S., Duprez D. // ChemCatChem. 2011. V. 3. № 1. P. 24.
Spronsen M.A., Frenken J.W.M., Groot I.M.N // Chem. Soc. Rev. 2017. V. 46. P. 4347.
McClure S.M., Goodman D.W. // Chem. Phys. Lett. 2009. V. 469. № 1–3. P. 1.
Allian A.D., Takanabe K., Fujdala K.L. et al. // J. Am. Chem. Soc. 2011. V. 133. № 12. P. 4498.
Ivanova A.S., Slavinskaya E.M., Gulyaev R.V. et al. // Appl. Catal. B Environ. 2010. V. 97. № 1–2. P. 57.
An K., Alayoglu S., Musselwhite N. et al. // J. Am. Chem. Soc. 2013. V. 135. № 44. P. 16689.
Zhao Z.-J., Li Z., Cui Y. et al. // J. Catal. 2017. V. 345. P. 157.
Deng J., Song W., Jing M. et al. // Catal. Today. 2020. V. 339. P. 210.
Гордон Е.Б., Карабулин А.В., Матюшенко В.И. и др. // Химия высоких энергий. 2016. Т. 50. № 4. С. 305. Gordon E.B., Karabulin A.V., Matyushenko V.I. et al. // High Energy Chem. 2016. V. 50. № 4. P. 292.
Duprat F. // Chem. Eng. Sci. 2002. V. 57. № 6. P. 901.
Losch P., Huang W., Vozniuk O. et al. // ACS Catal. 2019. V. 9. № 6. P. 4742.
Шилина М.И., Ростовщикова Т.Н., Кротова И.Н. и др. Сборник тезисов “Современная химическая физика”. 2019. C. 274.
Nikolaev S.A., Tsodikov M.V., Chistyakov A.V. et al. // Catal. Today. 2020. In press.https://doi.org/10.1016/j.cattod.2020.06.061
Shirakawa S., Osaki M., Nagai Y. et al. // Catal. Today. 2017. V. 281. P. 429.
Hou R., Yu W., Porosoff M.D. et al. // J. Catal. 2014. V. 316. P. 1.
Ahmed M.S., Jeon S. // ACS Catal. 2014. V. 4. № 6. P. 1830.
Гришин М.В., Гатин А.К., Сарвадий С.Ю. и др. // Хим. физика. 2020. Т. 23. № 7. C. 63.
Krstajic N., Jovic V., Gajickrstajic L. et al. // Int. J. Hydrogen Energy. 2008. V. 33. № 14. P. 3676.
Zhang B., Jiang Z., Li J. et al. // J. Catal. 2012. V. 287. P. 5.
Bryzhin A.A., Gantman M.G., Buryak A.K. et al. // Appl. Catal. B Environ. 2019. V. 257. P. 117938.
Craven M., Xiao D., Kunstmann-Olsen C. et al. // Appl. Catal. B Environ. 2018. V. 231. P. 82.
Park J.G., Ko C.H., Yi K.B. et al. // Appl. Catal. B Environ. 2008. V. 81. № 3–4. P. 244.
Ma X., Sprague M., Song C. // Ind. Eng. Chem. Res. 2005. V. 44. № 15. P. 5768.
Hassan H.M.A., Betiha M.A., Elshaarawy R.F.M. et al. // Appl. Surf. Sci. 2017. V. 402. P. 99.
Shen J., Hayes R.E., Semagina N. // Catal. Today. In press. https://doi.org/10.1016/j.cattod.2019.12.041
Shilina M., Udalova O., Krotova I. et al. // ChemCatChem. 2020. V. 12. № 9. P. 2556.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии