Журнал физической химии, 2021, T. 95, № 4, стр. 612-618
Влияние ацилирования антоцианов уксусной кислотой на удерживание гликозидов в условиях обращенно-фазовой хроматографии
В. И. Дейнека a, *, Я. Ю. Кульченко a, Л. А. Дейнека a, И. П. Блинова a
a Белгородский государственный национальный исследовательский университет
Белгород, Россия
* E-mail: deineka@bsu.edu.ru
Поступила в редакцию 19.05.2020
После доработки 04.07.2020
Принята к публикации 17.07.2020
Аннотация
Дана оценка влияния на удерживание антоцианов ацилирования их уксусной кислотой. Показано, что отсутствие корреляций в некоторых вариантах изменения структуры между экспериментальными данными по удерживанию веществ и CLOGP связано со спецификой “поплавочного” механизма удерживания антоцианов. При этом конформационный анализ антоцианов (в программе Chem3D) может объяснить ряд особенностей влияния ацилирования на удерживание по модели Хорвата–Меландера для гликозидных заместителей. Показано, что вклад ацетильной группы в суммарное удерживание антоцианов зависит от состава подвижной фазы, строения гликозидных заместителей и агликона при заданных стационарной фазе и температуре разделения. В целом ацетилирование приводит к значительному возрастанию удерживания антоцианов – к росту в ~10 раз для 3‑(6-ацетилглюкозидов) и этот рост примерно в 1.5 раза меньше при аналогичном ацетилировании 3,5-диглюкозидов.
Антоцианы относятся к числу важных соединений, вызывающих интерес исследователей – в поисковой системе Google Scholar на слово “anthocyanins” обнаруживается 181 000 ссылок за все время и 16 000 – начиная с 2019 года. Это объясняется высокой биологической активностью [1] и наличием окраски у некоторых форм антоцианов [2]. При этом в определении антоцианов в природных объектах важнейшую роль играет обращенно-фазовая хроматография (15 600 ссылок в Google Scholar на комбинацию слов “anthocyanins and hplc”).
Удерживание антоцианов в хроматографии, как и любых других соединений, является сложной функцией их строения, структуры стационарной и состава подвижной фаз, а также температуры разделения. Это серьезно осложняет поиск взаимосвязи между удерживанием веществ и их строением. Ранее популярное направление по определению влияния функциональных групп на удерживание сорбатов [3], постепенно завершилось. Одна из причин такого итога – отсутствие корректного системного подхода, который бы отвечал на ряд важнейших вопросов: а) должны ли вклады одинаковых функциональных групп зависеть от строения основы для одной и той же стационарной и подвижной фаз, б) должны ли они зависеть от состава подвижной фазы и в) как учесть их изменение при смене стационарной фазы. Не учёт ответов на эти вопросы сделал индексацию удерживания веществ в ВЭЖХ с использованием шкалы по удерживанию рядов некоторых гомологов менее значимой – индексы зависят от состава подвижной фазы даже для выбранной марки стационарной фазы. Предложенный ранее [4–6] метод относительного анализа удерживания позволяет ответить на поставленные вопросы и реанимировать эмпирический подход к оценке влияния строения веществ на их удерживание. С другой стороны широкое распространение получило еще одно эмпирическое направление – по количественной взаимосвязи между удерживанием веществ в обращенно-фазовой ВЭЖХ (как логарифма фактора удерживания, lgk(i)) и расчетным значением логарифма коэффициента распределения вещества в системе “октанол-1–вода”, CLOGP [7, 8]. Параметр липофильности в виде CLOGP удобен тем, что существует возможность расчета этой характеристики для веществ заданного строения множеством разработанных к настоящему времени программ. Значимость возможности предсказания изменения удерживания при заданном изменении структуры сорбата можно проиллюстрировать на следующем примере.
В работах [9, 10] при установлении строения антоцианов на основе масс-спектрометрических данных было предположено ацилирование гликозидов пара-кумаровой кислотой. Однако отношение m/z изменяется одинаково при добавлении как рамнозильного радикала, так и радикала пара-кумаровой кислоты, по этой причине метод масс-спектрометрии не способен дифференцировать эти варианты. Но если перейти к анализу изменения времен удерживания, то по нашим данным в первом случае рост должен быть незначительным (менее чем в 1.5 раза), тогда как для второго случая характерно практически 20-кратное увеличение удерживания (в изократическом режиме), что позволяет однозначно дифференцировать указанные варианты изменения структуры антоцианов по хроматографическим данным.
Цель настоящей работы – разработка подхода для количественной оценки влияния ацилирования некоторых антоцианов кислотами на примере уксусной кислоты и оценка применимости CLOGP для предсказания изменения удерживания сорбатов при изменении их строения. Строго говоря, при поиске таких корреляций считается более корректным использование параметра удерживания, экстраполированного до нулевого содержания органического модификатора, и в качестве органического модификатора предполагается использование метанола [7, 8]. При этом первое требование не имеет обоснования, и в этом отношении представляется более логичным способ, предложенный в работе [11]. Кроме того, по нашим данным, замена ацетонитрила метанолом мало сказывается на селективности разделения антоцианов. По этим причинам для качественной оценки взаимосвязи между $\lg k(i)$ и CLOGP в работе использовали удерживание антоцианов в нескольких составах подвижной фазы на основе ацетонитрила, муравьиной кислоты и воды.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Антоцианы лепестков цветков экстрагировали 0.1 М водным раствором HCl и очищали твердофазной экстракцией на патронах ДИАПАК С18 (БиоХимМак СТ, Москва).
Разделение осуществляли на оборудовании Agilent 1200 Infinity с диодно-матричным и масс-спектрометрическим детекторами. В работе использовали хроматографические колонки: 150 × × 4.6 мм Symmetry C18 (3.5 мкм) – для серийных исследований и 150 × 2.1 мм Kromasil 100-5C18 – при масс-спектрометрическом детектировании. Мертвое время определяли по щавелевой кислоте. Для элюирования использовали элюенты, содержащие 10 об. % НСООН и 6–20 об. % CH3CN в воде. Во всех случаях скорость подачи подвижной фазы была постоянной – 0.8 мл/мин. Хроматограммы регистрировали и обрабатывали программой Agilent ChemStation.
При расчетах факторов удерживания использовали “мертвое время”, определенное по удерживанию урацила.
Расчетные значения параметра липофильности CLOP выполняли в программном пакете ChemOffice 2016 (PerkinElmer, GB), ПП, в подпрограмме Chem3D. В этой же подпрограмме проводили оптимизацию геометрии методом MM2.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Ацилирование уксусной кислотой
Антоцианы цветков тюльпанов. Антоцианы цветков тюльпанов интересны тем, что в них синтезируются 3-рутинозиды (3Rut) трех неметилированных агликонов – пеларгонидина (Pg), цианидина (Cy) и дельфинидина (Dp). Дополнительно эти антоцианы могут быть ацилированы уксусной кислотой главным образом по гидроксильной группе в положении 2 рамнозильного радикала, 2'''AcRut; кроме того, в небольших количествах ацетилирование происходит по положению 3 этого же заместителя, 3'''AcRut, [12], рис. 1. Отметим, что хроматографическими методами положение ацильной группы в молекуле не может быть определено, поэтому в работе использовали литературные данные, полученные для антоцианов из соответствующих растительных источников набором специальных методов [13].
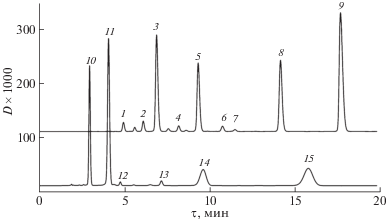
Рис. 1.
Разделение антоцианов лепестков цветка тюльпана. Условия записи хроматограммы: колонка 150 × 4.6 мм Symmetry C18, 3.5 мкм, подвижная фаза: 10 об. % ацетонитрила, 10 об. % метанола, 80 об. % воды, 0.8 мл/мин. Запись хроматограммы 515 нм. Антоцианы: 1 – Dp3Rut, 2 – Dp3(3'''AcRut), 3 – Cy3Rut, 4 – Cy3(3'''AcRut), 5 – Pg3Rut, 6 – Dp3(2'''AcRut), 7 – Pg3(3'''AcRut), 8 – Cy3(2'''AcRut), 9 – Pg3(2'''AcRut),10 – Сy3Glu5Glu, 11 – Pg3Glu5Glu, 12 – Сy3(xAcGlu)5Glu, 13 – Pg3(xAcGlu)5Glu, 14 – Сy3(6''AcGlu)5Glu, 15 – Pg3(6''AcGlu)5Glu.
В ряду цианидин → цианидин-3-глюкозид → → цианидин-3-рутинозид CLOGP последовательно уменьшается: 1.764 → 0.187 → ‒0.838. В соответствие с наличием корреляции между логарифмом фактора удерживания, $\lg k(i)$, и CLOGP(i) при глюкозилировании цианидина удерживание должно уменьшиться. И это (по нашему опыту) соответствует действительности, но предсказываемое снижение удерживания при добавлении рамнозильного радикала к глюкозидному противоречит экспериментальным данным. При ацетилировании гидроксильных групп в положениях 2, 3 и 4 рамнозильного радикала CLOGP в целом возрастает (табл. 1), но изменение удерживания при этом чувствительно к положению ацетилирования.
Таблица 1.
Параметры липофильности, CLOGP, и логарифмы факторов удерживания, $\lg k(i)$, продуктов ацетилирования цианидин-3-рутинозида
| Параметр | Cy3Rut | Cy3(2'''AcRut) | Cy3(3'''AcRut) | Cy3(4'''AcRut) |
|---|---|---|---|---|
| CLOGP | –0.838 | –0.644 | 0.009 | –0.641 |
| Подвижная фаза 10 об. % и 6 об. % НСООН | ||||
| $\lg k(i)$ | 0.625 | 1.454 | 0.835 | Нет |
| Подвижная фаза 10 об. % и 8 об. % НСООН | ||||
| $\lg k(i)$ | 0.209 | 1.007 | 0.443 | Нет |
| Подвижная фаза 10 об. % и 10 об. % НСООН | ||||
| $\lg k(i)$ | –0.140 | 0.630 | 0.110 | Нет |
Тем временем на хроматограмме на рис. 1 основные продукты ацетилирования (2'''AcRut) дельфинидина, цианидина и пеларгонидина имеют большее удерживание по сравнению с изомерами 3'''AcRut, табл. 1, что противоречит предсказаниям по CLOGP.
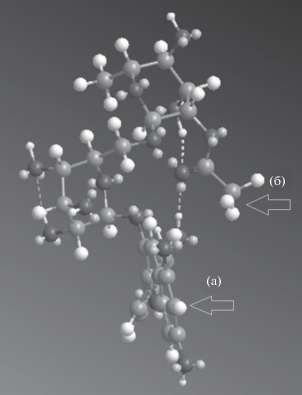
Расхождение между экспериментальными данными $\lg k(i)$ и расчетными параметрами CLOGP для антоцианов, вероятно, связано с тем, что второй параметр рассчитывается для распределения вещества между двумя фазами, а первый параметр определяется “поплавочным” механизмом сорбции антоцианов на обращенных фазах [14]. По этому механизму в стационарную фазу проникает только агликон, тогда как гликозидный радикал остается на поверхности. Минимизация энергии антоциана, выполненная методом ММ2 показывает, что для продукта ацетилирования в положении 2 возможна конформация, при которой метильная группа ацетильного радикала направлена в ту же сторону, что и антоцианидиновая составляющая (рис. 2), что благоприятствует сорбции этого изомера особенно с учетом образования водородной связи между карбонильным кислородом этой группы и гидроксильной группой в положении 3 кольца B агликона.
Рис. 2.
Одна из конформаций Cy3(2'''AcRut): а – антоцианидиновая часть, б – метильная группа ацетильного радикала в положении 2'''; пунктирные линии – водородные связи.
Рассмотрим карту разделения производных цианидина, рис. 3. Линии трендов для ацетилированных изомеров описываются уравнениями:
(1)
$\begin{gathered} \lg k\left[ {{\text{Cy3(2'''AcRut)}}} \right] = \\ = 1.078\lg k(\operatorname{Cy} 3Rut) + 0.781, \\ \end{gathered} $(2)
$\begin{gathered} \lg k\left[ {{\text{Cy3(3'''AcRut)}}} \right] = \\ = 0.951\lg k({\text{Cy3Rut}}) + 0.242. \\ \end{gathered} $Рис. 3.
Удерживание ацетилированных цианидин-3-рутинозидов и цианидин-3,5-диглюкозидов относительно цианидин-3-рутинозида. Соединения: 1 – Cy3Rut, 2 – Cy3(3'''AcRut), 3 – Cy3(2'''AcRut), 4 ‒ Cy3,5diGlu, 5 – Cy3(x''AcGlu)5Glu, 6 – Cy3(6''AcGlu)5Glu.
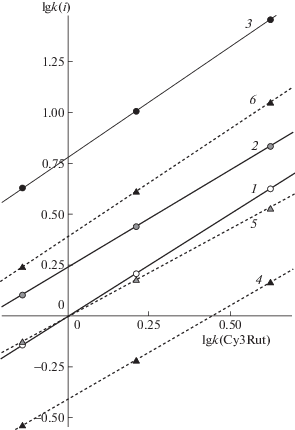
Если первый коэффициент в таком уравнении больше 1, то число атомарных контактов сорбата со стационарной фазой больше. Это эквивалентно высвобождению большего числа молекул органического модификатора при сорбции по уравнению Мураками [15], что подтверждает идею о специфике сорбции предложенного выше конформера Cy3(2'''AcRut). Более высокая гидрофобность части поплавка, ориентированной в сторону обращенной фазы, скажется на большей гидрофильности части “поплавка”, ориентированной в сторону подвижной фазы. Это должно способствовать выталкиванию сорбата из подвижной фазы на поверхность привитой фазы по механизму Хорвата–Меландера [16]. Для изомера Cy3(3'''AcRut) меньшее значение первого коэффициента в уравнении (2) эквивалентно меньшей гидрофобности части, обращенной в сторону стационарной фазы не только по сравнению с первым изомером, но и по сравнению с неацилированным Cy3Rut. В таком случае гидрофильность противоположной стороны должна оказаться более низкой, что скажется в меньшем выигрыше в энергии при гидрофобном выталкивании “поплавка” на поверхность обращенной фазы и в уменьшении времени удерживания.
Интересно второе следствие, вытекающее из предложенных положений. Назовем инкрементом разность между логарифмами факторов удерживания ацетилированных антоцианов и исходного цианидин-3-рутинозида:
(3)
$\begin{gathered} \Delta {{({\text{2'''Ac}})}_{{{\text{Cy}}}}} = \lg k\left[ {{\text{Cy3(2'''AcRut)}}} \right] - \\ - \;\lg k({\text{Cy3Rut}}), \\ \end{gathered} $(4)
$\begin{gathered} \Delta {{({\text{3'''Ac}})}_{{{\text{Cy}}}}} = \lg k\left[ {{\text{Cy3(3'''AcRut)}}} \right] - \\ - \;\lg k({\text{Cy3Rut}}). \\ \end{gathered} $Эти инкременты в значительной степени определяются вторыми коэффициентами в уравнениях (1) и (2). Величина этого коэффициента, равная 0.781 соответствует немногим более чем шестикратному росту исправленных времен удерживания при ацетилировании положения 2''', а 0.242 – росту удерживания лишь в 1.75 раза. При этом реальные кратности изменения удерживания зависят от состава подвижной фазы, уменьшаясь в первом случае и возрастая – во втором по мере роста элюирующей силы подвижной фазы. То есть вклады функциональных групп являются функцией не только строения вещества, но и состава подвижной фазы.
Отметим, что аналогичная тенденция найдена и для производных на основе пеларгонидина (Pg), что указывает на общность найденных закономерностей, хотя и инкременты для одного и того же состава подвижной фазы не эквивалентны для одинаковых структурных изменений в случае производных цианидина и пеларгонидина. Соответствующие расчеты можно выполнить по коэффициентам линий трендов:
(5)
$\begin{gathered} \lg k\left[ {{\text{Pg3(2'''AcRut)}}} \right] = \\ = 1.135\lg k({\text{Pg3Rut}}) + 0.683, \\ \end{gathered} $(6)
$\begin{gathered} \lg k\left[ {{\text{Pg3(3'''AcRut)}}} \right] = \\ = 0.975\lg k({\text{Pg3Rut}}) + 0.219. \\ \end{gathered} $Таким образом, получены ответы на поставленные первые два вопроса о взаимосвязи удерживания и строения веществ, приведенные выше.
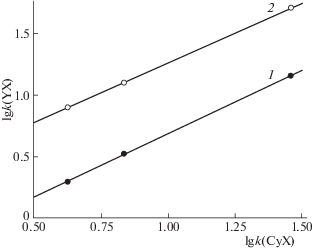
Для целей подтверждения правильности идентификации соединений интерес может представлять то, что для однотипных гликозидов перечисленного выше строения трех агликонов (дельфинидина и пеларгонидина относительно цианидина) соблюдается линейность в подходе, аналогичном анализу свойств сходственных видов М.Х. Карапетьянца [17], рис. 4.
Рис. 4.
Взаимосвязь логарифмов факторов удерживания производных цианидина с однотипными производными дельфинидина (1) и пеларгонидина (2).
Антоцианы цветков циннии (Zinnia elegans Jacq.). Антоцианы цветков цинии образованы двумя 3,5-диглюкозидами пеларгонидина и цианидина, часть которых ацилирована уксусной кислотой, что было установлено в единственной известной нам опубликованной работе, но без указания положения ацилирования [18]. Впрочем, в обзоре [19], ссылаясь на эту же работу, авторы приписали и направление ацилирования – положение 6'' глюкозидного радикала в положении 3 обоих агликонов. Ацетилирование этой группы является наиболее вероятным, – нам не удалось найти работы, в которых бы для ацилирования глюкозидного радикала уксусной кислотой были определены иные направления.
Для перехода от цианидин-3-глюкозида к цианидину-3,5-диглюкозиду CLOP предсказывает большее снижение параметра липофильности по сравнению с превращением в цианидин-3-рутинозид: CLOGP уменьшается от 0.187 до –1.219, что соответствует экспериментально найденному существенному уменьшению удерживания антоцианов в этом же направлении. При ацилировании цианидин-3,5-диглюкозида по гидроксильным группам глюкозидного заместителя в положении 3 получены позиционно-зависимые результаты, табл. 2. Таким образом, CLOGP предсказывает рост удерживания при ацетилировании для трех из четырех направлений, причем наибольший рост следовало бы ожидать для направления 3. При этом и ацетилирование положения 6 также должно привести к росту удерживания, что соответствует реальным изменениям удерживания антоцианов, рис. 1.
Таблица 2.
Параметры липофильности, CLOGP, и логарифмы факторов удерживания, $\lg k(i)$, продуктов ацетилирования цианидин-3,5-диглюкозида
| Параметр | Cy3,5diGlu | Cy3(2''AcGlu)5Glu | Cy3(3''AcGlu)5Glu | Cy3(4''AcGlu)5Glu | Cy3(6''AcGlu)5Glu |
|---|---|---|---|---|---|
| CLOGP | –1.219 | –1.025 | –0.372 | –1.678 | –0.973 |
| Подвижная фаза 10 об. % и 6 об. % НСООН | |||||
| $\lg k(i)$ | 0.165 | 0.530* | 1.050 | ||
| Подвижная фаза 10 об. % и 6 об. % НСООН | |||||
| $\lg k(i)$ | –0.216 | 0.180* | 0.613 | ||
| Подвижная фаза 10 об. % и 6 об. % НСООН | |||||
| $\lg k(i)$ | –0.530 | –0.120* | 0.247 | ||
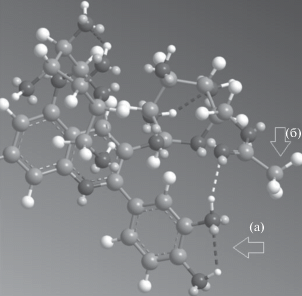
Рост исправленных времен удерживания 3,5-диглюкозидов цианидина и пеларгонидина при ацетилировании положения 6'' превышает 7 раз и несколько уменьшается с увеличением содержания ацетонитрила в подвижной фазе до ~6.5. В пользу ацетилирования именно положения 6 свидетельствует обнаружение конформации, рис. 5, в которой липофильность антоциана увеличивается за счет образования водородной связи между карбонильным кислородом ацетильной группы и гидроксильной группы в положении 3' и ориентацией ее же метильной группы по направлению к стационарной фазе при поплавочном механизме сорбции антоцианов.
Рис. 5.
Одна из конформаций Cy3(6''AcGlu)5Glu: а – антоцианидиновая часть, б – метильная группа ацетильного радикала в положении 6''; пунктирные линии – водородные связи.
На хроматограммах антоцианов цветков циний, рис. 1, кроме основных пиков ацилированных соединений обнаруживаются также и небольшие пики с тем же отношением m/z, поэтому мы их относим к изомерам неизвестной локализации ацетильных групп. Рост удерживания в этом случае составляет только 2.2–2.5 раза, причем, как и в случае минорных изомерных антоцианов цветков тюльпана, с ростом концентрации ацетонитрила кратность роста удерживания не уменьшается (как для основных изомеров), а увеличивается. Уравнения относительного удерживания для данных антоцианов имеют вид:
(7)
$\begin{gathered} \lg k\left[ {{\text{Cy3(6''AcGlu)5Glu}}} \right] = \\ = 1.149\lg k({\text{Cy3,5diGlu}}) + 0.861, \\ \end{gathered} $(8)
$\begin{gathered} \lg k\left[ {{\text{Cy3(x''AcGlu)5Glu}}} \right] = \\ = 0.933\lg k({\text{Cy3,5diGlu}}) + 0.378, \\ \end{gathered} $(9)
$\begin{gathered} \lg k\left[ {{\text{Pg3(6''AcGlu)5Glu}}} \right] = \\ = 1.128\lg k({\text{Pg3,5diGlu}}) + 0.800, \\ \end{gathered} $(10)
$\begin{gathered} \lg k\left[ {{\text{Pg3(x''AcGlu)5Glu}}} \right] = \\ = 0.888\lg k({\text{Pg3,5diGlu}}) + 0.392. \\ \end{gathered} $Уравнения (7)–(10) могут быть использованы для расчета вкладов функциональных групп и оценки их зависимости от состава подвижной фазы (с использованием данных табл. 2).
Антоцианы плодов винограда лесного (Vitis vinifera subsp. sylvestris). Виноград относится к числу растений, среди антоцианов которых основные компоненты – 3-глюкозиды пяти основных антоцианидинов (дельфинидина, цианидина, петунидина, пеонидина и мальвидина). В меньших (зависящих от сорта) количествах в экстракте находятся продукты их ацилирования в положение 6'' разными кислотами, в том числе и уксусной. Присутствие (6''AcGlu) в заметных количествах подтверждено для лесного винограда [20].
Основная хроматографическая проблема при исследовании антоцианов плодов винограда – широкий диапазон времен удерживания набора с большим диапазоном липофильности индивидуальных компонентов смеси, характерной для большинства объектов исследования. Так, в ряду от самого гидрофильного Dp3Glu до наименее гидрофильного из простых 3-глюкозидов, Mv3Glu, CLOGP возрастает немногим меньше, чем на единицу: от –0.479 до 0.415. Ацилирование же пара-кумаровой кислотой последнего приводит к росту CLOGP до 2.165. Вещества из такого диапазона липофильности нельзя уместить на хроматограмму при изократическом элюировании. Так, в быстрых элюентах удерживание 3-глюкозидов всех антоцианидинов за исключением Mv3Glu становится слишком маленьким для надежного определения их логарифмов факторов удерживания. Поэтому необходимо использование градиентного режима, при котором расчет вкладов функциональных групп практически невозможен. Но запись части хроматограммы, на которой проявляются некоторые из пиков ацетилированных антоцианов, возможна. В этом случае удается определить удерживание 3-глюкозидов цианидина, петунидина и пеонидина вместе с продуктами их ацетилирования по положению 6''. При этом оказывается, что различие в логарифмах факторов удерживания близки 1, т.е. исправленное время удерживания антоцианов возрастает примерно в 10 раз при ацетилировании, что заметно больше, чем при аналогичном ацетилировании 3,5-дигликозидов.
Список литературы
Smeriglio A., Barreca D., Bellocco E. et al. // Phytother. Res. 2016. V. 30. P. 1265.
Khoo H.E., Azlan A., Tang S.T. et al. // Food Nutr. Rees. 2017. V. 61. 1361779.
Smith R.M. / Ed. Smith R.M. Retention and selectivity in liquid chromatography. Prediction, standardization and phase comparisons. Elsevier Sci. B.V. 1995. P. 1.
Дейнека В.И. // Журн. физ. химии. 2006. Т. 80. № 3. С. 507.
Дейнека В.И. // Там же. 2006. Т. 80. № 3. С. 511.
Дейнека В.И. // Там же. 2006. Т. 80. № 4. С. 704.
Kaliszan R. // Chem. Rev. 2007. V. 107. P. 3212.
Rutkowska E., Pająk K., Jóźwiak K. // Acta Polon. Pharm. Drug Res. 2013. V. 70. P. 3.
Piovan A., Filippini R., Favretto D. // Rapid Commun. Mass Spectrom. 1998. V. 12. P. 361.
Dai Y., Rozema E., Verpoorte R. et al. // J. Chromat. A. 2016. V. 19. P. 50.
Дейнека В.И. // Журн. физ. химии. 2006. Т. 80. С. 1083.
Дейнека В.И., Кульченко Я.Ю., Дейнека Л.А. и др. // Сорбционные и хроматографические процессы. 2016. Т. 16. Вып. 4. С. 464.
Nakayama M., Okada M., Taya-Kizu M. et al. // JARQ. 2004. V. 38 (3). P. 185.
Дейнека В.И., Дейнека Л.А., Саенко И.И. и др. // Журн. физ. химии. 2015. Т. 89. С. 1172.
Murakami F. // J. Cromatogr. 1979. V. 178. P. 393.
Horvath C., Melander W. Molnar I. // J. Chomatogr. 1976. V. 125. P. 129.
Дейнека В.И., Кульченко Я.Ю., Чулков А.Н. и др. // Журн. физ. химии. 2019. Т. 93. С. 790.
Yamaguchi M.-A., Terahara N., Shizukuishi K.-I. // Phytochem. 1990. V. 29. P. 1269.
Gomaa A.A.-R., Samy M.N., Desoukey S.Y. et al. // J. Adv. Biomed. Pharm. Sci. 2019. V. 2. P. 29.
Budić-Leto I., Mucalo A., Ljubenkov I. et al. // Sci. Hortic. 2018. V. 238. P. 32.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии


