Журнал физической химии, 2021, T. 95, № 4, стр. 619-624
Газохроматографическое исследование композиционного сорбента на основе металлоорганического каркасного полимера MIL-53(Al)
М. Ю. Парийчук a, К. А. Копытин a, Л. А. Онучак a, *, Ю. В. Мартина a
a Самарский национальный исследовательский университет имени академика С.П. Королева
Самара, Россия
* E-mail: onuchakla@mail.ru
Поступила в редакцию 28.04.2020
После доработки 27.05.2020
Принята к публикации 10.06.2020
Аннотация
Исследованы закономерности удерживания и определены термодинамические характеристики сорбции летучих органических соединений из газовой фазы на колонках с композиционными сорбентами на основе металлоорганического каркаса MIL-53(Al) и полидифенилдиметилсилоксана (ПФМС). Показано, что при увеличении содержания MIL-53(Al) в бинарном сорбенте до 73 мас. % удерживание преимущественно связано с адсорбцией в микропористой структуре MIL-53(Al), а не растворением в пленке ПФМС. Показано, что взаимодействие адсорбат – адсорбент в ромбических каналах MIL-53(Al) в большей степени зависит от дисперсионных сил притяжения, чем диполь-дипольных и специфических взаимодействий.
Металлоорганические каркасные соединения (Metal Organic Frameworks, MOFs) или металлоорганические координационные полимеры (МОКП) представляют собой класс микро- и мезопористых материалов, получаемых за счет самосборки различных металл-содержащих структурных групп и органических линкеров. Большое разнообразие строительных единиц МОКП обеспечивает возможность широкого варьирования пористой структуры, а сравнительно высокая термостабильность и устойчивость в различных жидких средах делает МОКП перспективными материалами для технологии хранения газов [1], экстракции [2, 3], катализа [4, 5], хроматографии [6–10]. Описано применение как наполненных, так и капиллярных колонок с различными МОКП для разделения легких газов, алканов, аренов, полярных соединений в газовой хроматографии [11]. Необходимо отметить, что использование МОКП в качестве сорбентов для газовой хроматографии (ГХ) сопряжено с некоторыми трудностями, такими как неоднородность размеров частиц синтезированных кристаллов, их небольшая механическая прочность, что затрудняет получение высокоэффективных колонок с хорошими эксплуатационными свойствами. Поэтому более перспективным направлением в области практического применения МОКП в ГХ является получение композиционных сорбентов различного типа. Так, в работе [12] МОКП на основе меди (Cu-BTC) наносили на широкопористый кремнеземный носитель Хромосорб W, поверхность которого деактивировали с помощью 3% полиметилсилоксановой фазы SE-30. В работе [13] осуществляли направленный синтез (кристаллизацию) MOF-5 на микросферах из полидиметилсилоксана, получая частицы с морфологией “полимерное ядро – оболочка МОКП”. Возможность получения композиционного сорбента на основе углеродного материала (графена) и МОКП ZIF-8 продемонстрирована в работе [14]. Следует, однако, отметить, что большинство этих работ посвящено исследованию разделительных свойств колонок с сорбентами на основе МОКП. Отсутствуют работы, в которых анализируется влияние полимерной фазы и степени доступности внутренних пор МОКП в композите на его сорбционные свойства. В связи с этим, цель работы – изучение сорбции органических соединений из газовой фазы композиционным сорбентом на основе металлоорганического соединения MIL-53(Al) и полидифенилдиметилсилоксана при различных соотношениях МОКП и полимера для установления вклада адсорбции в пористой структуре МОКП в газохроматографическое удерживание и термодинамику сорбционного перераспределения.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Исходный MIL-53(Al) (Sigma-Aldrich) диспергировали с помощью ультразвука в ацетоне для получения фракции с размерами частиц ≤1 мкм. Композиционный сорбент получали нанесением микрочастиц MIL-53(Al) на широкопористый кремнеземный носитель Хроматон N AW (sуд = = 1 м2/г), предварительно модифицированный 5.5% полидифенилдиметилсилоксановой фазой SP-2250 (50% фенил). Были изготовлены две наполненные колонки с разным содержанием MIL-53(Al) в бинарном сорбенте “МОКП – полимер”. В колонке № 1 (1.2 м × 2.5 мм) композиционный сорбент содержал 6.7% MIL‑53(Al) и 5.5 мас. % полидифенилдиметилсилоксана (ПФМС) по отношению к массе Хроматона N AW, а в колонке № 2 (0.9 м × 2 мм) – 15% и 5.5 мас. % соответственно. Колонки кондиционировали в токе азота при температуре 280°С в течение 10 часов.
Эксперимент проводили на газовом хроматографе Кристалл-5000.2 с пламенно-ионизационным детектором. Избыточное давление на входе в колонку ΔP варьировали в интервале 80–120 кПа, что соответствовало скорости газового потока (азот) на выходе из колонки ${{F}_{{{{P}_{a}},{{T}_{c}}}}}$ = 20–30 мл/мин.
Фактор удерживания k рассчитывали по формуле:
где tR, tM – время удерживания сорбата и несорбирующегося вещества (метан) соответственно.Удельный объем удерживания сорбатов $V_{g}^{T}$ определяли в расчете на единицу массы бинарного сорбента по уравнению:
Для расчета ${{F}_{{\bar {P},{{T}_{c}}}}}$ применяли как традиционный метод с использованием мыльно-пленочного расходомера, так и предложенный в работе [15] метод “холодной” градуировки колонки. Оба метода показывали близкие значения объемной скорости газового потока внутри колонки ${{F}_{{\bar {P},{{T}_{c}}}}}$. Ввиду меньшей трудоемкости, особенно при работе в широком диапазоне температур, использовали преимущественно метод “холодной” градуировки колонки. Погрешность определения $V_{g}^{T}$ не превышала в среднем 5%, а фактора удерживания k – 8%.
Сорбционные характеристики (удельный объем удерживания $V_{g}^{T}$, фактор удерживания k) определяли для каждого из исследованных соединений в том интервале скоростей газового потока, в котором они сохраняются практически постоянными для малых проб сорбатов.
Изменение внутренней энергии $\Delta \bar {U}$ (теплоты) сорбции и величину, пропорциональную стандартному изменению энтропии $\Delta S{\kern 1pt} *$, определяли из экспериментальных данных по температурным зависимостям удельных объемов удерживания сорбатов по уравнению:
Общий массив экспериментальных данных по удерживанию 21 исследованного соединения был получен в интервале температур от 110 до 230°C. Однако, для каждого вещества зависимости $\ln V_{g}^{T}~ - 1{\text{/}}T$ были определены в более узком интервале ΔT, в котором хроматографические пики были не слишком размыты и имели симметричную форму.Исследованными сорбатами являлись н-алканы (С5–С7), изомеры октана, арены (бензол, о- и м-ксилолы), циклогексан, алканолы и изоалканолы (С3–С5), хлорпроизводные метана и нитрометан. С использованием программного комплекса Spartan для них были рассчитаны некоторые молекулярные параметры – длина l, объем Vm, поляризуемость α и дипольный момент молекулы μ.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
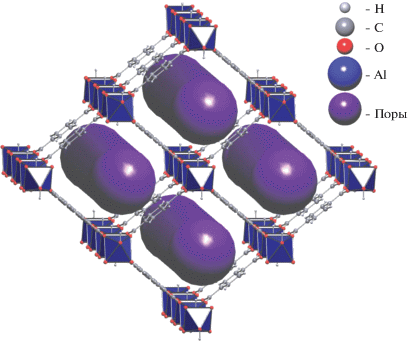
Металлоорганический каркасный полимер MIL-53(Al) (Al–OH-бензол-1,4-дикарбоксилат) имеет систему каналов ромбической формы. После синтеза получается каркас с сечением каналов 7.3 × 7.7 Å, в котором содержатся остатки линкера (молекулы терефталевой кислоты). Температурная активация приводит к освобождению каналов и увеличению размеров их сечения до 8.5 × × 8.5 Å [16] (рис. 1).
Для задач практической ГХ необходимо получить такой сорбент на основе МОКП, который бы обеспечивал быстрый массообмен между газовой фазой и его микропористой структурой, а также обладал хорошими эксплуатационными свойствами (механическая прочность, термостабильность). Использование широкопористого (диаметр пор ~10 мкм) кремнеземного носителя, а также послойное нанесение тонкой пленки (0.055 мкм) среднеполярного полимера ПФМС и слоя агрегированных микрокристаллитов MIL-53(Al) способствует не только облегчению переноса вещества в поры, но и лучшей адгезии и закреплению частиц на дезактивированной поверхности носителя.
Таким образом, на исследованных сорбентах одновременно происходят и адсорбция в порах, и растворение в пленке полимера (адсорбционно-абсорбционный вариант ГХ) [17]. В процессе кондиционирования колонки при достаточно высокой температуре (280°C) часть полимерной фазы из полимерного слоя может проникать в пространство между микрокристаллитами и тем самым экранировать их поверхность. Этот эффект должен уменьшаться при увеличении количества МОКП в сорбенте и приводить к существенному росту удерживания. Представленные на рис. 2 зависимости $\ln V_{g}^{T} - 1{\text{/}}T$, полученные на колонках с различным содержанием МОКП в композиционном сорбенте, подтверждают вышеизложенное предположение.
Рис. 2.
Зависимости $\ln V_{g}^{T} - 1{\text{/}}T$ изомеров ксилола, полученные на колонках с композиционным сорбентом “MIL-53(Al) – ПФМС”: 1, 2 – колонка № 1 (55% MIL-53(Al)); 3, 4 – колонка № 2 (73% MIL-53(Al)); 1, 3 – о-ксилол; 2, 4 – м-ксилол.
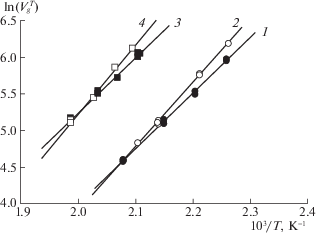
Из рис. 2 следует, что увеличение массовой доли МОКП в композиционном сорбенте от 0.55 (колонка № 1) до 0.73 (колонка № 2) приводит к росту удерживания ксилолов примерно в 6–7 раз. Такое многократное увеличение удельного объема удерживания $V_{g}^{T}$ наблюдается и для других исследованных углеводородов, и этот рост, как правило, сопровождается увеличением теплоты сорбции $\left| {\Delta \bar {U}} \right|$ на 3–10 кДж/моль. Для полярных соединений (спирты, дихлорметан) рост удерживания существенно меньше, причем величина $\left| {\Delta \bar {U}} \right|$ для них либо изменяется мало, либо даже уменьшается (пропанол-1, бутанол-1).
Найденные закономерности свидетельствуют о превалирующем вкладе адсорбции в удерживание на колонке № 2 с композиционным сорбентом, содержащем 73% MIL-53(Al) и 27% ПФМС, а также о том, что поверхность стенок пор этого МОКП имеет большую склонность к неспецифическим взаимодействиям с адсорбатами, чем к специфическим, что обнаружено в работах [18, 19]. Именно поэтому удерживание о-ксилола меньше, чем м-ксилола, так как длина молекулы последнего (6.5 Å) больше, чем у о-ксилола (5.9 Å), что приводит к увеличению дисперсионных сил притяжения м-ксилола гидрофобными стенками пор MIL-53(Al).
Увеличение количества МОКП в сорбенте влияет на последовательность элюирования из колонки хлорпроизводных метана. На сорбенте с меньшим содержанием MIL-53(Al) (колонка 1) удерживание возрастает с увеличением дипольного момента µ молекул в ряду тетрахлорметан (0 D) → трихлорметан (1.02 D) → дихлорметан (1.36 D). Такая последовательность удерживания, очевидно, связана с влиянием ПФМС. На колонке № 2 удерживание этих соединений возрастает с увеличением объема Vm и поляризуемости α молекул в ряду дихлорметан → трихлорметан → тетрахлорметан (табл. 1).
Таблица 1.
Молекулярные параметры и термодинамические характеристики сорбции исследованных соединений
| № п/п | Сорбаты | Vm, Å3 | α, Å3 | μ, D | $V_{g}^{T}$, 170°С, см3/г | k, 170°С | $ - \Delta \bar {U}$, кДж/моль | $ - \Delta S{\kern 1pt} *$, Дж/(моль K) |
|---|---|---|---|---|---|---|---|---|
| 1 | Пентан | 106.5 | 9.95 | 0 | 57.5 | 2.1 | 54.1 | 88.3 |
| 2 | Гексан | 124.8 | 11.78 | 0 | 160.5 | 6.1 | 57.6 | 87.7 |
| 3 | Гептан | 143.1 | 13.62 | 0 | 1254.9 | 37.5 | 66.2 | 90.0 |
| 4 | 2,2-Диметилгексан | 160.7 | 15.45 | 0 | 2063.1 | 71.7 | 73.4 | 102.3 |
| 5 | 2,3-Диметилгексан | 160.8 | 15.45 | 0 | 1796.2 | 61.7 | 67.3 | 89.5 |
| 6 | 2,3,4-Триметилпентан | 160.6 | 15.45 | 0 | 2284.9 | 60.3 | 72.7 | 99.8 |
| 7 | 2,2,4-Триметилпентан | 160.3 | 15.45 | 0 | 1897.9 | 60.9 | 73.2 | 102.3 |
| 8 | Циклогексан | 111.5 | 11.01 | 0 | 215.3 | 8.1 | 49.7 | 67.5 |
| 9 | Бензол | 99.2 | 10.43 | 0 | 463.2 | 13.2 | 52.1 | 66.5 |
| 10 | о-Ксилол | 135.3 | 14.10 | 0.46 | 1283.2 | 41.3 | 62.5 | 81.5 |
| 11 | м-Ксилол | 135.6 | 14.10 | 0.27 | 2052.2 | 60.9 | 78.4 | 113.6 |
| 12 | Пропанол-1 | 77.4 | 6.92 | 1.68 | 267.4 | 7.7 | 37.3 | 37.8 |
| 13 | Пропанол-2 | 77.4 | 6.92 | 1.63 | 56.2 | 1.3 | 49.6 | 78.3 |
| 14 | Бутанол-1 | 95.7 | 8.75 | 1.68 | 660.1 | 25.9 | 41.8 | 40.3 |
| 15 | 2-Метилпропанол-1 | 93.7 | 8.75 | 1.62 | 239.9 | 6.0 | 61.7 | 93.6 |
| 16 | 2-Метилпропанол-2 | 93.6 | 8.75 | 1.63 | 69.4 | 2.0 | 53.4 | 85.3 |
| 17 | 3-Метилбутанол-1 | 113.8 | 10.59 | 1.51 | 810.0 | 22.5 | 64.0 | 88.7 |
| 18 | Дихлорметан | 60.9 | 6.47 | 1.36 | 80.2 | 2.5 | 44.6 | 64.1 |
| 19 | Трихлорметан | 74.9 | 8.39 | 1.02 | 82.5 | 2.7 | 53.2 | 83.8 |
| 20 | Тетрахлорметан | 89.1 | 10.32 | 0 | 255.0 | 9.4 | 57.0 | 82.8 |
| 21 | Нитрометан | 55.4 | 4.45 | 3.98 | 84.7 | 2.6 | 42.2 | 58.3 |
Таким образом, влияние полимерного слоя на сорбцию в колонке № 2 очень мало и характеристики удерживания исследованных соединений на этой колонке, в основном, обусловлены адсорбцией в пористой структуре MIL‑53(Al), поэтому детальные исследования термодинамики сорбции были проведены с использованием этой колонки.
На рис. 3 представлены зависимости $\ln V_{g}^{T} - 1{\text{/}}T$, полученные на колонке № 2 для н-алканов С5–С7, 2,2,3-триметилментана, циклогексана и бензола. Из представленного рисунка видно, что диапазон температур элюирования существенно зависит от объема молекулы Vm. С увеличением Vm этот диапазон смещается в область более высоких температур.
Рис. 3.
Зависимости $\ln V_{g}^{T} - 1{\text{/}}T$ углеводородов на колонке с композиционным сорбентом “MIL-53(Al) – ПФМС” (73% MIL-53(Al)): 1 – н-пентан, 2 – н-гексан, 3 – циклогексан, 4 – бензол, 5 – н-гептан, 6 – 2,2,3-триметилпентан.
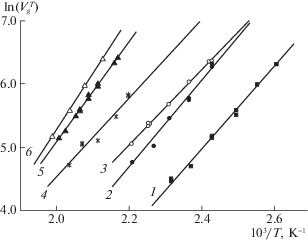
Адсорбция на MIL-53(Al) чувствительна к строению углеродного скелета молекулы. Так, в случае соединений, имеющих в своей структуре шесть атомов углерода, удерживание увеличивается в ряду н-гексан → циклогексан → бензол. Вместе с тем, на основе сопоставления теплот адсорбции $\left| {\Delta \bar {U}} \right|$ (таблица 1) можно утверждать, что линейные молекулы н-гексана сильнее взаимодействуют со стенками пор каркаса, чем циклические молекулы циклогексана и бензола. Следовательно, большее удерживание циклических углеводородов по сравнению с н-гексаном связано с меньшим падением энтропии при переходе их жестких (бензол) и полужестких (циклогексан) молекул из газовой фазы в пористую структуру каркаса. н-Октан элюировался из колонки только при t > 250°C, образуя сильно размытые и ассиметричные пики, что затрудняло определение характеристик удерживания. Линейные размеры изомерных октанов ($l$ = 6.8–8.1 Å) лучше соответствуют размерам ромбических каналов MIL-53(Al) и они элюировались из колонки в интервале температур 200–230°C.
Наличие метильных заместителей в основном скелете молекулы спирта приводит к усилению дисперсионных взаимодействий со стенками канала MIL-53(Al), и, как следствие, к увеличению теплоты адсорбции $\left| {\Delta \bar {U}} \right|$ изоалканолов по сравнению с их линейными аналогами. Это приводит к сильному увеличению наклона зависимости $\ln V_{g}^{T}--1{\text{/}}T$ изоалканолов по сравнению с соответствующими н-алканолами (рис. 4).
Рис. 4.
Зависимости $\ln V_{g}^{T} - 1{\text{/}}T$ спиртов на колонке с композиционным сорбентом “MIL-53(Al) – ПФМС” (73% MIL-53(Al)): 1 – бутанол-1, 2 – пропанол‑1, 3 – 2-метилпропанол-1, 4 – 2‑метилпропанол-2, 5 – пропанол-2.
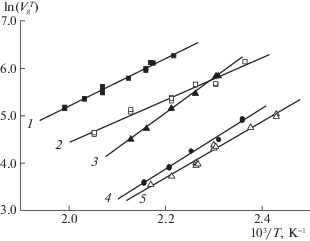
Однако, несмотря на более высокие значения $\left| {\Delta \bar {U}} \right|$ для изоалканолов, их удерживание существенно меньше. Из сопоставления величин падения энтропии при адсорбции (таблица 1) можно сделать вывод о том, что меньшее удерживание изомерных спиртов обусловлено меньшей подвижностью их молекул в пористой структуре каркаса по сравнению с поведением спиртов линейного строения.
Нами проанализировано влияние дипольного момента μ, линейного размера l и объема Vm молекул исследованных сорбатов на теплоту адсорбции $\left| {\Delta \bar {U}} \right|$. Так, наименьшие значения $\left| {\Delta \bar {U}} \right|$ найдены для нитрометана (µ = 3.98 D), пропанола-1 и бутанола-1 (µ = 1.68 D), полярные молекулы которых имеют линейное строение. Максимальные значения $\left| {\Delta \bar {U}} \right|$ получены для м-ксилола и изомеров октана (~70–78 кДж/моль).
Для исследованного набора соединений, линейные размеры которых изменяются от l = 2.84 Å (дихлорметан) до l = 9.33 Å (н-гептан) не установлено корреляции между l и $\left| {\Delta \bar {U}} \right|$. Так, для хлорпроизводных метана (l ≈ 2.85 Ǻ) величина $\left| {\Delta \bar {U}} \right|$ возрастает в ряду дихлорметан → трихлорметан → тетрахлорметан. При близких значениях l для н‑бутанола и 3-метилбутанола-1 (l = 6.55 Å) теплоты адсорбции составляют 41.8 и 64.0 кДж/моль, соответственно. В большей степени выражена тенденция роста $\left| {\Delta \bar {U}} \right|$ с увеличением объема ${{V}_{m}}$ (рис. 5) и поляризуемости молекул.
Рис. 5.
Изменение внутренней энергии при сорбции композиционным сорбентом “MIL-53(Al) – ПФМС” (73% MIL-53(Al)), представленное в координатах $\left| {\Delta \bar {U}} \right|$ – объем молекулы Vm (нумерация точек соответствует табл. 1).
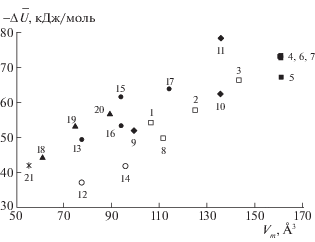
Следует отметить, что полученные значения $\left| {\Delta \bar {U}} \right|$ для исследованных соединений на колонке № 2 выше на (на 10–20 кДж/моль), чем при адсорбции на плоской поверхности графитированных саж [20] и сорбции на ПФМС. Так, для н-гексана и н-гептана величины $\left| {\Delta \bar {U}} \right|$ на “чистом” ПФМС составили, соответственно, 24.6 и 38.2 кДж/моль; для ароматических соединений они изменяются в пределах от 25.5 (бензол) до 42.8 (о-ксилол). Это подтверждает предположение о том, что удерживание на колонке № 2 в основном связано с адсорбцией в микропористой структуре MIL-53(Al), а не с растворением в пленке ПФМС.
Таким образом, при адсорбции в ромбических каналах MIL-53(Al) проявление диполь-дипольных взаимодействий, π–π-стекинга и специфических взаимодействий (водородная связь, донорно-акцепторные взаимодействия) затруднено. Взаимодействие адсорбат–адсорбент, характеризующееся величиной $\left| {\Delta \bar {U}} \right|$, в большей степени зависит от неспецифических дисперсионных сил притяжения, вклад которых при адсорбции в узких полостях МОКП повышается при увеличении объема молекулы, разветвлении углеводородной цепи и при повышении степени сферичности формы молекул (например, в ряду дихлорметан–трихлорметан–тетрахлорметан).
Авторы выражают благодарность в.н.с. лаборатории физико-химических основ хроматографии и хромато-масс-спектрометрии ИФХЭ РАН к.х.н. Сайфутдинову Б.Р. за предоставленные образцы МОКП MIL-53(Al) и директору МНИЦТМ д.х.н., проф. Блатову В.А. за консультации и техническую помощь.
Исследование выполнено при финансовой поддержке Российского фонда фундаментальных исследований в рамках научного проекта № 18-29-04010 мк.
Список литературы
Alkordi M.H., Belmabkhout Y., Cairns A. et al. // IUCrJ. 2017. V. 4. P. 131. https://doi.org/10.1107/S2052252516019060
Wang X., Ye N. // Electrophoresis. 2017. V. 38. P. 3059. https://doi.org/10.1002/elps.201700248
Rocio-Bautista P., Pacheco-Fernandez I., Pasan J. et al. // Anal Chim Acta. 2016. V. 939. P. 26. https://doi.org/10.1016/j.aca.2016.07.047
Zhang T., Lin W. // Chem. Soc. Rev. 2014. V. 43. P. 5982. https://doi.org/10.1039/C4CS00103F
Kornienko N., Zhao Y., Kley C.S. et al. // J. Am. Chem. Soc. 2015. V. 137. P. 14129. https://doi.org/10.1021/jacs.5b08212
Yusuf K., Aqel A., Al-Othman Z. // J. Chromatogr. A. 2014. V. 1348. P. 1. https://doi.org/10.1016/j.chroma.2014.04.095
Li J.-R., Kuppler R.J., Zhou H.-C. // Chem. Soc. Rev. 2009. V. 38. P. 1477. https://doi.org/10.1039/b802426j
Li J.-R., Sculley J., Zhou H.-C. // Chem. Rev. 2012. V. 112. P. 869. https://doi.org/10.1021/cr200190s
Yu Y., Ren Y., Shen W. et al. // Trend. Anal. Chem. 2013. V. 50. P. 33. https://doi.org/10.1016/j.trac.2013.04.014
Zhang J., Chen Z. // J. Chromatogr. A. 2017. V. 1530. P. 1. https://doi.org/10.1016/j.chroma.2017.10.065
Tang W.-Q., Xu J.-Y., Gu Z.-Y. // Chem. Asian J. 2019. V. 14. P. 3462. https://doi.org/10.1002/asia.201900738
Harvey S.D., Eckberg A.D., Thallapally P.K. // J. Sep. Sci. 2011. V. 34. P. 2418. https://doi.org/10.1002/jssc.201100317
Prasun M., Roy K., Ramanan A. et al. // RSC Adv. 2014. V. 4. P. 17429. https://doi.org/10.1039/C4RA00894D
Yang X., Li C., Qi M. et al. // J Chromatogr A. 2016. V. 1460. P. 173. https://doi.org/10.1016/j.chroma.2016.07.029
Кудряшов С.Ю., Арутюнов Ю.И., Онучак Л.А. // Журн. физ. химии. 2007. Т. 81. С. 107.
Loiseau T., Serre C., Huguenard C. et al. // Chem. Eur. J. 2004. V. 10. P. 1373. https://doi.org/10.1002/chem.200305413
Яшин Я.И., Яшин Е.Я., Яшин А.Я. Газовая хроматография. М.: Издательство “ТрансЛит”, 2009. 528 с.
Сайфутдинов Б.Р., Исаева В.И., Александров Е.В. и др. // Изв. АН. Сер. хим. 2015. № 5. С. 1039.
Сайфутдинов Б.Р., Коннова М.Е., Исаева В.И. и др. // Там же. 2017. № 1. С. 16.
Онучак Л.А., Лапшин С.В., Кудряшов С.Ю. и др. // Изв. вуз. Хим. хим. техн. 2003. Т. 46. № 4. С. 62.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии