Журнал физической химии, 2021, T. 95, № 4, стр. 581-587
Квантово-химическое моделирование необменной сорбции аминокислот анионообменником АВ-17
О. Н. Хохлова a, *, Е. Р. Каширцева a, В. Ю. Хохлов a, Е. С. Трунаева a
a Воронежский государственный университет
Воронеж, Россия
* E-mail: okxox@yandex.ru
Поступила в редакцию 01.05.2020
После доработки 04.07.2020
Принята к публикации 17.07.2020
Аннотация
С помощью квантово-химического моделирования проведена оценка энергии взаимодействия аминокислот различной природы – глицина, аланина и фенилаланина с высокоосновным анионообменником АВ-17 в хлоридной и нитратной ионных формах в условиях необменного поглощения. Установлена роль количества воды в стартовых фрагментах участников сорбции, противоиона анионообменника и радикала аминокислоты в выигрыш в энергии и соотношение различных типов межмолекулярных взаимодействий (кулоновские, гидрофобные, водородные связи) при образовании ионно-молекулярных структур в фазе ионообменника.
Выявление роли природы веществ, а именно состава и строения, в различных химических и физико-химических процессах является центральным вопросом химии вообще и химии сорбционных процессов в частности. Исследование влияния природы сорбата и сорбента возможно различными способами – с помощью сравнительного анализа ряда экспериментальных данных [1–4], анализа фазы сорбента и раствора до и после сорбции различными физико-химическими методами (ИКС, ЯМР и др.) [5–8], различными способами моделирования и прогнозирования [9–11]. На сегодняшний день метод квантово-химического моделирования является очень информативным и позволяет объяснить имеющиеся и прогнозировать интересующие закономерности взаимодействия сорбатов и сорбентов различной природы, получить оптимизированные структуры, образующиеся при поглощении веществ, выявить основные силы, действующие при этом, и оценить их вклад в суммарную энергию сорбции. Особый интерес представляют системы, имеющие в своем составе полярные и гидрофобные элементы, что определяет разнообразие возможных типов взаимодействий. К таким объектам рассмотрения относятся системы, содержащие ионообменники и аминокислоты.
Известны работы, посвященные моделированию гидратации ионообменников и их селективности к минеральным катионам [12–17]. Ряд работ, в которых обсуждается вопрос квантово-химического исследования взаимодействий сорбента с органическим сорбатом, в том числе, аминокислотами, значительно ýже [18–22]. Поэтому выявление роли растворителя, ионной формы анионообменника и природы аминокислот, оценка вклада основных действующих сил при закреплении сорбата в сорбенте в процессе необменного поглощения является актуальным.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Под необменной сорбцией понимают поглощение веществ ионообменниками без изменения ионной формы последних.
Для выявления роли противоиона сорбента при необменном закреплении аминокислот исследован анионообменник АВ-17 в хлоридной и нитратной ионной форме. Рассматриваемые противоионы однозарядны, характеризуются отрицательной гидратацией [23], имеют различный размер, геометрию и плотность заряда.
Исследуемые аминокислоты являются моноаминомонокарбоновыми и имеют различный радикал: простейшая – глицин, имеющая в качестве бокового радикала атом водорода, аланин с СН3-группой и фенилаланин с бензольным кольцом в боковом радикале. В исследуемых системах аминокислоты присутствуют в виде биполярных ионов (АК±).
Квантово-химическое моделирование проводилось с использованием программы Gaussian 09 методом гибридного функционала плотности B3LYP в базисе 6-31G++(d,p) [24]. Стартовые фрагменты в гидратированном состоянии (элементарное звено анионообменника АВ-17 и аминокислота) предварительно оптимизировали и располагали различным образом относительно друг друга. Суммарное количество воды в системе составляло от 8 до 14 молекул Н2О, однако основной сравнительный анализ характеристик систем проведен при 10 молекулах Н2О, что достаточно для формирования перекрывающихся гидратных оболочек противоиона сорбента и функционалной группы аминокислоты при их взаимодействии. На всех этапах оптимизированными считались структуры, характеризующиеся наименьшей энергией. Выигрыш в энергии в результате сорбции рассчитывался по разности между суммой энергий стартовых фрагментов и энергией итоговой оптимизированной структуры.
При проведении исследований были использованы вычислительные мощности Суперкомпьютера ВГУ.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
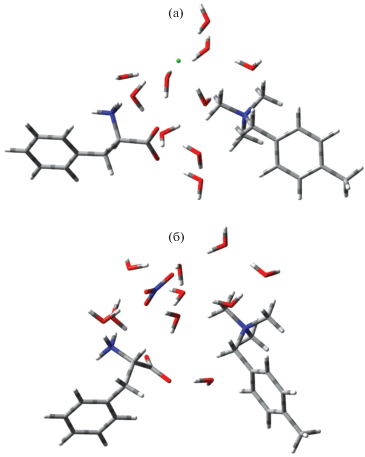
Получены оптимизированные структуры, которые формируются в фазе анионообменника АВ-17 в Cl– и NO3-форме при необменном закреплении аминокислот. На рис. 1 для примера приведены системы с участием фениаланина. Для обеих ионных форм сорбента характерно ориентирование аминокислот положительно заряженными аминогруппами к отрицательно заряженным противоионам и отрицательно заряженной карбоксильной группой к положительно заряженной функциональной группе анионообменника. Таким образом, формируется система кулоновских взаимодействий с чередованием разнозаряженных элементов с участием молекул воды, образующих новые водородные связи в системе, а для фенилаланина, кроме того, характерны взаимодействия бокового радикала различного характера с преобладанием гидрофобных.
При обсуждении необменной сорбции веществ на ионообменниках часто возникает вопрос о сохранении ионной формы и изменении состояния сорбента, а именно взаимодействий функциональная группа–противоион. Квантово-химическое моделирование структур АВ-17 + АК±(10Н2О) показало, что заряд функциональной группы и заряд противоиона (Сl–, ${\text{NO}}_{3}^{ - }$) анионообменника остаются практически неизменным при закреплении всех исследуемых аминокислот, а расстояния между ними уменьшается при нарастании гидрофобности аминокислоты (табл. 1). То есть структура функциональная группа–противоион не только не разрушается, а даже упрочняется при формировании сложного внутреннего раствора с гидрофобными участниками.
Таблица 1.
Некоторые характеристики взаимодействий в системе АB-17(7Н2О) + АК±(3Н2О)
| Характеристика | Gly | Ala | Phe |
|---|---|---|---|
| Cl– | |||
| ${{Z}_{{--{\text{N}}{{{({\text{C}}{{{\text{H}}}_{{\text{3}}}})}}_{{\text{3}}}}}}}$ | 0.3 | 0.2 | 0.2 |
| ${{Z}_{{{\text{C}}{{{\text{l}}}^{--}}}}}$ | –0.7 | –0.6 | –0.6 |
| ${{r}_{{--{\text{N}}{{{({\text{C}}{{{\text{H}}}_{{\text{3}}}})}}_{3}}--{\text{Cl}}}}}$, Å | 8.2 | 8.3 | 6.5 |
| EКулон, кДж/моль | –0.8 | –0.5 | –1.0 |
| ${\text{NO}}_{3}^{ - }$ | |||
| ${{Z}_{{--{\text{N}}{{{({\text{C}}{{{\text{H}}}_{{\text{3}}}})}}_{{\text{3}}}}}}}$ | 0.6 | 0.5 | 0.6 |
| ${{Z}_{{{\text{NO}}_{3}^{ - }}}}$ | –0.9 | –0.9 | –0.6 |
| ${{r}_{{--{\text{N}}{{{({\text{C}}{{{\text{H}}}_{{\text{3}}}})}}_{3}}--{\text{N}}{{{\text{O}}}_{{\text{3}}}}}}}$, Å | 6.0 | 5.7 | 5.4 |
| EКулон, кДж/моль | –4.4 | –4.4 | –4.3 |
Одной из задач исследования являлась оценка вклада различных взаимодействий в энергию закрепления аминокислоты в анионообменнике в сорбционных системах различного состава. Выигрыш в энергии (Е) при образовании ионно-молекулярных структур в сорбенте в результате сорбции аминокислот можно оценить как разность между суммой энергий структурных элементов Е(аn + 5Н2О) + Е(аk + 5Н2О), и энергией оптимизированной структуры Е(an + аk + 10Н2О), (здесь и далее аn – обозначение анионообменника, ak – обозначение аминокислоты).
Выделяя три типа взаимодействий – кулоновское притяжение (или отталкивание) между заряженными фрагментами в исследуемых системах (ЕКулон), водородные связи между гидратными оболочками аминогруппы аминокислоты и противоиона сорбента (${{Е}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}} \ldots {{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}$), а также взаимодействия различного характера между радикалами аминокислот и ионообменника (ЕR), суммарную энергию связывания в сорбционных системах Е можно представить как
(1)
$Е = {{Е}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}} \ldots {{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}} + {{Е}_{{{\text{Кулон}}}}} + {{Е}_{{\text{R}}}}.$(2)
$\begin{gathered} {{Е}_{{{\text{Кулон}}}}} = {{Е}_{{{\text{Кулон}}\;{\text{притяж}}}}}--{{Е}_{{{\text{Кулон}}\;{\text{отталк}}}}} = \\ = ({{Е}_{{{\text{C}}{{{\text{l}}}^{ - }} \ldots {}^{ + }{\text{N}}{{{\text{H}}}_{3}}{\text{ak}}}}} + {{Е}_{{{\text{CO}}{{{\text{O}}}^{ - }}{\text{ak}} \ldots + {\text{N(C}}{{{\text{H}}}_{3}}{{{\text{)}}}_{{\text{3}}}}{\text{an}}}}}) - \\ --\;({{E}_{{{}^{ + }{\text{N}}{{{\text{H}}}_{3}}{\text{ak}} \ldots {}^{ + }{\text{N(C}}{{{\text{H}}}_{3}}{{{\text{)}}}_{{\text{3}}}}{\text{an}}}}} + {{E}_{{{\text{C}}{{{\text{l}}}^{ - }} \ldots {\text{CO}}{{{\text{O}}}^{ - }}{\text{ak}}}}}). \\ \end{gathered} $Кулоновское взаимодействие между противоионом и функциональной группой сорбента +N(CH3)3an, а также между амино- и карбоксильной группами аминокислот является “несвязывающим”, поэтому не учитывается в суммарной энергии взаимодействия этого типа.
Энергия кулоновского взаимодействия рассчитывается согласно закону Кулона
где z+ и z– – заряды взаимодействующих частиц, r – расстояние между ними, рассчитанные квантово-химическим методом, е0 – заряд электрона, ε – диэлектрическая проницаемость.Диэлектрическая проницаемость согласно [25–27] является функцией расстояния между зарядами r и рассчитывается по уравнению
(4)
$\varepsilon (r) = 78 - 77{{\left( {\frac{r}{{2.5}}} \right)}^{2}}\frac{{{{e}^{{r/2.5}}}}}{{{{{({{e}^{{r/2.5}}} - 1)}}^{2}}}}.$Величина диэлектрической проницаемости в исследуемых системах изменяется от 25 до 53 в зависимости от расстояния между взаимодействующими группами атомов, что соответствует значениям, полученным ранее другими методами [28, 29]. Расчет энергии кулоновского взаимодействия между хлорид-ионом и функциональной группой анионообменника в отсутствие аминокислот сопоставим с данными, полученными в других работах [27], что может свидетельствовать о правильности использованного подхода.
Для простейшей аминокислоты глицина энергию водородной связи можно рассчитать из уравнения (1), приняв равной нулю взаимодействия бокового радикала. При этом получим энергию водородной связи, участвующую в связывании аминокислоты и сорбента без учета водородных связей гидратных оболочек участников, которые являются “несвязывающими”.
(5)
${{Е}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}} \ldots {{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}({\text{Gly}}) = Е({\text{Gly}})--{{Е}_{{{\text{Кулон}}}}}({\text{Gly}}).$(6)
${{Е}_{{\text{R}}}}({\text{АК}}) = Е({\text{АК}})--({{Е}_{{{\text{Кулон}}}}}({\text{АК}}) + {{Е}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}} \ldots {{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}).$Для обеих ионных форм сорбента и всех исследуемых аминокислот проведена оценка вкладов различных взаимодействий при закреплении сорбата в сорбенте. Как видно из рис. 2 и табл. 2, доминирующим является образование водородных связей, а вклад кулоновских и гидрофобных сил мал. Для фенилаланина характерно наиболее выраженное распределение энергии по составляющим в силу наличия ароматического радикала, и на долю водородных связей приходится порядка 75% суммарного выигрыша в энергии, а для глицина и аланина ~ 90%.
Рис. 2.
Вклад различных типов взаимодействия в энергию необменного закрепления аминокислот в системе АB-17(7Н2О) + АК±(3Н2О): Cl-форма (а), NO3-форма (б); 1 – кулоновские взаимодействия, 2 – водородные связи, 3 – взаимодействия радикала.
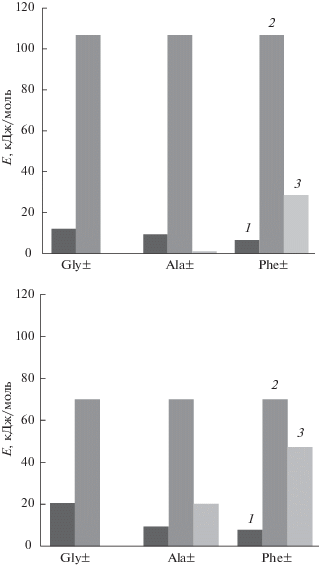
Таблица 2.
Некоторые характеристики взаимодействий различной природы в системах АB-17 (7Н2О) + АК±(3Н2О)
| Характеристика | АВ-17(NO3) + Gly± + + 10Н2О | АВ-17(NO3) + Ala± + + 10Н2О | АВ-17(NO3) + Phe± + + 10Н2О | |
|---|---|---|---|---|
| q | ${\text{NO}}_{3}^{ - }$ (nit) | –0.9 | –0.9 | –0.6 |
| –N+(CH3)3 (an) | 0.6 | 0.5 | 0.6 | |
| –N+H3 ak | 0.7 | 0.2 | 0.9 | |
| –COO– ak | –1.6 | –0.7 | –2.6 | |
| r, Å | N nit ··· N ak | 3.2 | 3.3 | 4.1 |
| N аn···N ak | 6.6 | 5.7 | 7.3 | |
| N аn···С –соо | 4.3 | 5.7 | 5.1 | |
| N nit···С –соо | 4.7 | 3.5 | 4.9 | |
| Н2О···Н2О | 1.7–2.5, 4.0–4.2 | |||
| Е, кДж/моль | Е | 90.5 | 99.6 | 124.9 |
| ЕКулон | 20.58 | 9.42 | 7.82 | |
| ${{Е}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}} \ldots {{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}$ | 69.92 | 69.92 | 69.92 | |
| ЕR | 20.3 | 47.16 | ||
| Характеристика | АВ-17(Сl) + Gly± + + 10Н2О | АВ-17(Сl) + Ala± + + 10Н2О | АВ-17(Сl) + Phe± + + 10Н2О | |
| q | Сl– | –0.7 | –0.6 | –0.6 |
| –N+(CH3)3 an | 0.3 | 0.2 | 0.2 | |
| –N+H3 ak | 0.5 | 0.6 | 0.4 | |
| –COO– ak | –0.8 | –0.9 | –1.1 | |
| r, Å | Cl···N ak, | 3.1 | 3.1 | 3.1 |
| N аn···N ak | 7.6 | 7.5 | 5.7 | |
| N аn···С –соо | 5.0 | 5.0 | 4.5 | |
| Сl···С –соо | 4.5 | 4.6 | 5.1 | |
| Н2О···Н2О | 1.9–2.3 | |||
| Е, кДж/моль | Е | 118.8 | 114.9 | 142.0 |
| ЕКулон | 12.0 | 9.4 | 6.6 | |
| ${{Е}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}} \ldots {{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}$ | 106.8 | 106.8 | 106.8 | |
| ЕR | –1.3 | 28.6 | ||
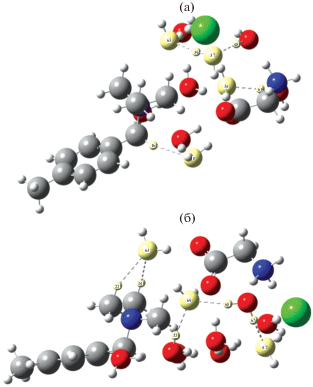
Центральным вопросом при изучении сорбционных систем является исследование роли растворителя. Особенно это важно при исследовании необменной сорбции, поскольку в этом процессе основным способом закрепления сорбата в сорбенте, как указывалось выше, является образование водородной связи. На примере системы АB-17Сl(nН2О) + АК±(mН2О), где аминокислотами АК± являлись глицин, фенилаланин и триптофан, исследовано влияние исходного количества воды в ионообменнике на энергетические характеристики сорбции. Моделировались системы с пятью и семью молекулами воды в составе исходного структурного элемента анионообменника, при этом количество воды в гидратной оболочке поглощаемой аминокислоты было 5 и 3 соответственно для получения систем с одинаковым общим количеством растворителя (10Н2О). Установлено, что независимо от природы аминокислоты, выигрыш в энергии выше для систем с бóльшим стартовым количеством воды в анионообменнике. Так, для систем, сорбция которых моделировалась на менее гидратированном сорбенте АB-17Сl(5Н2О) + АК±(5Н2О) энергия не превышает 90 кДж/моль, а для более гидратированного сорбента в системе АB-17Сl(7Н2О) + АК±(3Н2О) составляет 100–150 кДж/моль. Например, для глицина ${{Е}_{{{\text{АB - 17Cl}}({\text{5}}{{{\text{Н}}}_{{\text{2}}}}{\text{О}})\, + \,{\text{Gl}}{{{\text{y}}}^{ \pm }}({\text{5}}{{{\text{Н}}}_{{\text{2}}}}{\text{О}})}}}$ = 83.3 кДж/моль, а ${{Е}_{{{\text{АB - 17Cl}}({\text{7}}{{{\text{Н}}}_{{\text{2}}}}{\text{О}})\, + \,{\text{Gl}}{{{\text{y}}}^{ \pm }}({\text{3}}{{{\text{Н}}}_{{\text{2}}}}{\text{О}})}}}$ = 118.3 кДж/моль. Это вызвано, вероятно, бóльшим количеством точек образования водородной связи между гидратными оболочками противоиона сорбента и аминокислоты (рис. 3). Это соответствует экспериментальным данным – больше набухающие сорбенты лучше поглощают вещества по необменному механизму [33, 34].
Рис. 3.
Визуализация образующихся водородных связей при необменном закреплении глицина в фазе анионообменника АВ-17(Сl); а) АB-17(Сl)(5Н2О) + АК±(5Н2О), б) АB-17(Сl)(7Н2О) + АК±(3Н2О).
Исходя из того, что доминирующий вклад в энергию необменной сорбции вносит образование водородных связей, а ее энергия составляет около 20 кДж/моль [35, 36] можно оценить количество образующихся водородных связей при необменном закреплении аминокислоты в сорбенте. В системах (5 + 5) образуется четыре новые связи, а в системе (7 + 3) – порядка пяти более длинных связей (табл. 3). Формирование дробных 4.5 водородных связей можно трактовать как образование четырех новых связей и укрепление уже имеющихся, что и наблюдается при анализе оптимизированных структур. Кроме того, необходимо отметить, что образование новых водородных связей протекает двумя путями – между гидратными оболочками сорбата и сорбента и за счет обобществления молекулы воды одного из участников.
Таблица 3.
Некоторые характеристики водородных связей в системе АВ-17(Cl–) + Gly±
| ${{N}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}$ | АB-17Сl(nН2О) + + Gly ±(mН2О) | Е, кДж/моль | NН-связей | lН-связей, Å |
|---|---|---|---|---|
| 8 | 5 + 3 | 89.0 | 4 | 1.9–2.4 |
| 10 | 5 + 5 | 83.3 | 4 | 1.8–1.9 |
| 7 + 3 | 118.3 | 5 | 1.9–2.4 | |
| 12 | 5 + 7 | 87.1 | 4 | 1.9–2.3 |
| 7 + 5 | 93.3 | 4.5 | 2.1–3.0 | |
| 14 | 5 + 9 | 71.6 | 4 | 1.9–2.4 |
| 7 + 7 | 91.7 | 4 | 2.0–3.0 |
Для примера, на рис. 3 приведена визуализация водородных связей образующихся в ионообменнике при различном стартовом количестве воды у участников.
При увеличении общего количества воды в системе от 8 до 14 молекул растворителя с одинаковым стартовым составом анионообменника, выигрыш в энергии незначительно уменьшается (табл. 3). Это, вероятно, объясняется тем, что при внесении в анионообменник молекул воды, не участвующих в образовании связи для закрепления аминокислоты, часть энергии расходуется на структурирование растворителя. Это же приводит к удлинению водородных связей и достижению значений, характерных для недеформированной сетки водородных связей [33, 34].
Расположение молекул воды в системах с различным минеральным противоионом отличается – для нитратной формы сорбента характерно расположение растворителя на периферии структуры, а для хлоридной формы – вокруг и между всеми участниками взаимодействий (рис. 1). При этом аминокислоты располагаются таким образом, что расстояние от аминогруппы до противоиона одинаково для обеих форм сорбента, а карбоксильная группа ближе к функциональной группе сорбента на нитратной ионной форме анионообменника, что усиливает кулоновские взаимодействия. Кроме того, на Сl-форме сорбента новые водородные связи, способствующие закреплению аминокислоты, формируются преимущественно между гидратными оболочками компонентов системы, а на NO3-форме связь осуществляется в основном за счет обобществления молекул воды, изначально относящихся к структурным элементам ионообменника. При этом часть молекул растворителя, находящихся на периферии структуры, не образует общей системы водородной связи, так как находится на расстоянии более 4 Å. Это приводит к различию в соотношении действующих сил в фазе сорбента для исследуемых ионных форм анионообменника. Количественные характеристики взаимодействий представлены в табл. 2.
Сравнивая характеристики сорбции аминокислот на различных ионных формах анионообменника необходимо отметить, что для нитратной формы выигрыш в энергии ниже, чем для ионообменника в Сl-форме для каждой из исследуемых аминокислот. При этом вклад в энергию кулоновских и гидрофобных взаимодействий выше для системы с нитратом и характеризуется более близким расположением бензольных колец аминокислоты и анионообменника, а вклад образования водородных связей больше для системы с хлоридом (рис. 1, табл. 2).
Выигрыш в энергии соответствует экспериментальному ряду сорбции аминокислот Gly ≈ ≈ Ala < Phe. Введение в радикал аминокислоты СН3-группы незначительно отличает характеристики сорбции аланина по сравнению с глицином, поскольку мало влияет как на образование водородных связей, так и на гидрофобное взаимодействие с матрицей сорбента. Наличие ароматического радикала в молекуле фенилаланина приводит к росту суммарного выигрыша в энергии за счет значительного увеличения вклада гидрофобных взаимодействий бокового радикала (табл. 2). В целом в ряду Gly ≈ Ala < Phe при нарастании гидрофобности бокового радикала вклад кулоновских взаимодействий уменьшается, а взаимодействия радикала с матрицей растет.
Таким образом, основным способом закрепления аминокислот в фазе сорбента при необменной сорбции на анионообменнике является образование водородных связей при незначительном вкладе действия кулоновских сил и гидрофобного взаимодействия. Формирование 4–5 Н-связей в Сl-форме анионообменника происходит преимущественно между гидратными оболочками компонентов системы, а на NO3-форме связь осуществляется в основном за счет обобществления молекул воды, изначально относящихся к структурным элементам ионообменника. При этом бóльший выигрыш в энергии наблюдается для хлоридной формы сорбента по сравнению с нитратной при взаимодействии более гидратированного сорбента и менее гидратированной аминокислоты, что соответствует данным о сорбционных равновесиях. Роль радикала аминокислот мала, однако при нарастании гидрофобности бокового радикала вклад кулоновских взаимодействий уменьшается, а взаимодействия радикала с матрицей растет.
Список литературы
Крисилова Е.В., Елисеева Т.В., Селеменев В.Ф. и др. // Журн. физ. химии. 2009. Т. 83. № 10. С. 1948.
Хохлова О.Н. // Вестн. Вор. гос. ун-та. Сер.: Хим. Био. Фарм. 2015. № 2. С. 40.
Чиканова Е.С., Осенняя А.А., Голованова О.А. // Вестн. Омск. ун-та. 2014. № 4 С. 69.
Fleming D.E., Bronswijk W., Ryall R.L. // Clin. sci. 2001. V. 101. P. 159.
Углянская В.А., Чикин Г.А., Селеменев В.Ф. Инфракрасная спектроскопия ионообменных материалов. Воронеж: Изд-во ВГУ, 1989. 208 с.
Манк В.В., Куриленко О.Д. Исследование межмолекулярных взаимодействий в ионообменных смолах методом ЯМР. Киев: Наукова думка, 1976. 80 с.
Кузнецова Е.С. Хроматография, масс-спектрометрия и молекулярно-статистические расчеты адсорбции аминокислот и их производных на углеродных сорбентах: Автореф. дис. … канд. хим. наук. Москва, 2009. 26 с.
Кузнецова Е.С., Пыцкий И.С., Буряк А.К. // Сорбц. и хромат. процессы. 2017. Т. 17. № 2. С.191.
Мелихов И.В., Бердоносова Д.Г., Сигейкин Г.И. // Успехи химии. 2002. Т. 71. Вып. 2. С. 159.
Limousin G., Gaudet J.-P., Charlet L. et al. // App. Geochem. 2007. V. 22. № 2. P. 249.
Ayawei N., Ebelegi A.N., Wankasi D. // Hindawi J. of Chem. 2017. V. 2017. 11 p.
Soldatov V.S., Pristavko S., Zelenkovskii V., Kosandrovich E.G. // React. Funct. Polym. 2013. V. 73. № 5. P. 737.
Soldatov V.S., Zelenkovskii V., Kosandrovich E.G. // React. Funct. Polym. 2016. V. 102. P. 147.
Soldatov V.S., Kosandrovich E.G., Bezyazychnaya T.V. // React. Funct. Polym. 2018. V. 131. P. 219.
Нечаева Л.С., Бутырская E.B., Шапошник B.A., Селеменев В.Ф. Структурный анализ катионообменников. Воронеж: Научная книга, 2012. 164 с.
Бадесса Т.С., Родионов А.Н., Шапошник В.А. // Сорбц. и хромат. процессы. Воронеж. 2013. Т. 13. Вып. 4. С. 449.
Нифталиев С.И., Астапов А.В., Перегудов Ю.С., Бакаева Ю.В. // Конденс. среды и межфаз. границы. Т. 14. № 2. С. 221.
Трунаева Е.С., Хохлова О.Н., Хохлов В.Ю. // Сорбц. и хромат. процессы. 2018. Т. 18. Вып. 2. С. 142.
Хохлова О.Н., Хохлов В.Ю., Трунаева Е.С., Нечаева Л.С. // Журн. физ. химии. 2016. Т. 90. № 7. С. 1054.
Трунаева Е.С., Хохлова О.Н., Хохлов В.Ю. // Журн. структур. химии. 2017. Т. 58. № 1. С. 23.
Ghasemi A., Asgarpour Khansary M. et al. // Chemosphere. 2017. V. 178. P. 411.
Мироненко Н.В., Смусева С.О., Брежнева Т.А. и др. // Журн. общ. химии. 2016. Т. 86. Вып. 11. С. 1885.
Эрдеи-Груз Т. Явления переноса в водных растворах. М.: Мир, 1976. 595 с.
Frisch M.J., Trucks G.W., Schlegel H.B., Scuseria G.E., Robb M.A., Cheeseman J.R., Scalmani G., Barone V., Petersson G.A., Nakatsuji H., Li X., Caricato M., Marenich A., Bloino J., Janesko B.G., Gomperts R., Mennucci B., Hratchian H.P., Ortiz J.V., Izmaylov A.F., Sonnenberg J.L., Williams-Young D., Ding F., Lipparini F., Egidi F., Goings J., Peng B., Petrone A., Henderson T., Ranasinghe D., Zakrzewski V.G., Gao J., Rega N., Zheng G., Liang W., Hada M., Ehara M., Toyota K., Fukuda R., Hasegawa J., Ishida M., Nakajima T., Honda Y., Kitao O., Nakai H., Vreven T., Throssell K., Montgomery J.A., Jr., Peralta J.E., Ogliaro F., Bearpark M., Heyd J.J., Brothers E., Kudin K.N., Staroverov V.N., Keith T., Kobayashi R., Normand J., Raghavachari K., Rendell A., Burant J.C., Iyengar S S., Tomasi J., Cossi M., Millam J. M., Klene M., Adamo C., Cammi R., Ochterski J.W., Martin R.L., Morokuma K., Farkas O., Foresman J.B., Fox D.J. Gaussian 09, Revision A. 02. Gaussian, Inc., Wallingford CT, 2016.
Дебай П. Полярные молекулы. М.-Л.: ГНТИ, 1931. 247 с.
Шапошник В.А. // Сорбц. и хромат. процессы. 2020. Т. 20. № 1. С. 48.
Бадесса Т.С., Родионов А.Н., Шапошник В.А. // Сорбц. и хромат. процессы. Воронеж. 2013. Т. 13. Вып. 4. С. 449.
Хохлов В.Ю. Физико-химические процессы при неизотермической сорбции ароматических и гетероциклических аминокислот анионитами: Дис. … канд. хим. наук. Воронеж, 1997. 140 с.
Глотова Е.А., Тихонов Н.А., Хамизов Р.Х., Крачак А.Н // Вестн. Моск. ун-та. Сер. 3: Физ., астрономия. 2013. № 1. С. 64.
Шапошник В.А. // Сорбц. и хромат. процессы. 2020. Т. 20. № 1. С. 48.
Капуцкий Ф.Н., Юркштович Т.А., Борщевская Т.Н. // Журн. физ. химии. 1995. Т. 69. № 9. С. 1673.
Капуцкий Ф.Н., Юркштович Т.Л., Старобинец Г.Л. и др. // Там же. 2000. Т. 74. № 2. С. 277.
Гельферих Ф. Иониты. М.: ИЛ., 1962. 490 с.
Пыркова Т.С., Немцова Е.Е., Хохлов В.Ю., Хохлова О.Н. // Сорбц. и хромат. процессы. 2016. Т. 16. № 6. С. 831.
Gani T.Z.H., Ioannidis E.I., Kulik H.J. // Chem. of Mat. 2016. V. 28. № 17. P. 6207.
Xin-Zheng Li, Walker B., Michaelides A. // PNAS. 2011. V. 108. № 16. P. 6369.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии