Журнал физической химии, 2021, T. 95, № 4, стр. 588-593
Исследование процесса сорбции уранил-ионов из водных растворов структурированным сополимером 4-изопропенилфенола, фенола и формальдегида
Г. М. Мехтиева a, *, М. Р. Байрамов a, Дж. А. Нагиев b, М. А. Агаева a, Ш. Дж. Кулиева a
a Бакинский государственный университет
Баку, Азербайджан
b ЗАО Национальный ядерный исследовательский центр
Баку, Азербайджан
* E-mail: mehdiyeva_gm@mail.ru
Поступила в редакцию 20.05.2020
После доработки 20.05.2020
Принята к публикации 29.07.2020
Аннотация
Исследован процесс извлечения из водных систем урановых солей в статических условиях (при 25°С), сорбционным материалом на основе соолигомера 4-изопропенилфенола, фенола и малеинового ангидрида. Выявлено влияние различных факторов (pH среды, концентрации уранил-ионов, количества сополимера, продолжительности выдержки) на основные параметры процесса сорбции (степень извлечения уранил-ионов и сорбционная емкость). Установлено, что при рН 5–6 степень извлечения уранил ионов достигает максимума (~94%); сорбционная емкость составляет ~80 мг/г. При найденных оптимальных значениях рН (5–6) исследована зависимость статической сорбционной емкости от начальной концентрации (С0) уранил-ионов. Показано, что стационарная область наблюдается при концентрации >200 мг/л, при этом сорбционная емкость составляет 101 мг/г. Построены изотермы Фрейндлиха и Ленгмюра и сделаны предположения относительно возможных взаимодействий уранил-ионов с активными фрагментами сополимера. Исследована также возможность регенерации сорбента в присутствии кислот и щелочей. Выявлено, что максимальная десорбция происходит в присутствии минеральных кислот и достигает ~96.2%.
Одна из актуальных экологических проблем современной химической науки – разработка эффективных и безопасных способов очистки водных систем от тяжелых металлов, радионуклидов и др. вредных веществ [1–3]. Несмотря на то, что в этом направлении в последние годы проведены обширные исследования и предложены различные химические, электрохимические, сорбционные и др. способы очистки, многие задачи, связанные с изысканием доступного сырья, вспомогательных веществ и др. материалов, не решены в достаточной степени, что указывает на важность продолжения целенаправленных работ [4, 5].
Следует отметить, что в мировой практике предпочтение отдают применению сорбционных способов очистки с использованием как природных, так и гибридных и синтетических сорбционных материалов [1, 6]. Среди последних важное место занимают структурированные (сшитые) сополимеры, содержащие в структурах гидроксильные, аминные, амидные, нитрильные, карбоксильные и др. реакционноспособные фрагменты, за счет которых можно в “мягких” условиях проводить процессы улавливания тех или иных вредных веществ из водных систем, в том числе и промышленных и сточных вод [7–10]. Нами разработан синтетический сорбционный материал (4) на основе ранее полученного продукта (2) [11] – тройного соолигомера фенола, формальдегида и 4-изопропенилфенола (1), а также модифициирующего сомономера – малеинового ангидрида следующей структуры:
В настоящей работе приведены результаты исследований 4 в качестве сорбента для извлечения уранил-ионов из водной системы, содержащей NaCl.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Тройной соолигомер (2) 4-изопропенилфенола (1), фенола и формальдегида получали по известной методике [11] конденсацией 1 с фенолом и формальдегидом при их мольном соотношении 1 : 1 : 2 соответственно, температуре 90°С, продолжительности 3 ч в присутствии 0.5 мол. % ацетата цинка. По окончании реакции полученную смесь несколько раз промывали кипяченой водой, полученный остаток сушили под глубоким вакуумом. Выход 92%.
Методика получения сшитого сополимера (3). Сополимер 3 получали сополимеризацией полученного тройного соолигомера 2 с малеиновым ангидридом при температуре 80°С, продолжительности 5 ч в присутствии 0.5 мол. % (на общую смесь мономеров при расчете на кратную связь) инициатора ДИНИЗ. Реакцию проводили при эквимолярных соотношениях взятых реагентов в расчете на кратную связь. Полученный сополимер экстрагировали в ацетоне с целью удаления исходных реагентов из смеси и высушивали до постоянной массы. Выход 89%.
Гидролиз сшитого сополимера 3 проводили кипячением в воде в колбе, снабженной обратным холодильником, в течение 2 ч. По окончании реакции продукт 4 сушили под вакуумом до постоянной массы. Выход 94%. Структура соединения 4 подтверждена данными ИК-спектроскопии. Полосы поглощения при 748, 671, 818, 880 см–1 относятся к деформационным колебаниям ароматических СН-связей, характерных для ароматического кольца фенола и 1, полосы поглощения при 1102, 1162, 1209 см–1 относятся к деформационным и валентным колебаниям С–О-группы, полосы поглощения при 1361, 1454 см–1 – к деформационным колебаниям связей С–Н при СН2 и СН3, полосы при 1600, 1700 см–1 – к валентым колебаниям С=О-группы, полосы при 2921, 3188, 3283 см–1 – к валентным колебаниям ОН-группы
Используемые в реакции 4-изопропенилфенол (1) и фенол получали по известной методике [12] щелочным крекингом бис-фенола, полученного конденсацией фенола с ацетоном. Формальдегид в реакции брали в виде формалина (Carmalab) (36% водный раствор формальдегида). Малеиновый ангидрид (Carmalab) использовали в реактивном виде.
Подготовка сорбента 4 и приготовление растворов. Исследуемый сшитый сополимер 4 размельчали (до размера частиц <250 мкм) и сушили в термошкафу при 110°С. Для проведения лабораторных экспериментов использовали водный раствор урановой соли UO2(NO3)2 ⋅ 6H2O и 0.01М NaCl при различных рН. С целью регулирования pH среды использовали соляную кислоту (при pH 1–2), буферный раствор, состоящий из 0.1М CH3COOH и 0.1М NH4OH в различных соотношениях (при pH 3–11), а также NaOH (при pH 12–13).
Исследования проводили в статических условиях при 25°С и общей продолжительности 24 ч. Растворяли рассчитанное количество уранил-нитрата в 50 мл водного раствора NaCl, далее в раствор погружали 50 мг сополимера 4 и выдерживали заданное время. Содержание 80 мг/л ${\text{UO}}_{2}^{{2 - }}$ ионов в растворе эквивалентно 18 Бк/л активности изотопа 235U. Исследование процесса улавливания уранил-ионов по времени показало, что процесс интенсивно протекает в первые три часа, далее происходит некоторая стабилизация. Поэтому все дальнейшие исследования проводили при продолжительности 24 ч.
Степень сорбции уранил-ионов (R) и сорбционную емкость (qe) сорбента вычисляли по следующим формулам [13]:
где C0 – начальная концентрация уранил ионов, C – равновесная концентрация уранил ионов, Vsorb – объем сорбционной среды, msorb – масса сорбента.Аппаратура. ИК-спектры сополимеров регистрировали на ИК-фурье-спектрометре ALPHA (фирма BRUKER, Германия) в диапазоне волновых чисел 600–4000 см–1. С целью исследования сорбционных свойств сополимера 4 использовали γ-спектрометр HP Ge (с германиевым детектором, производства фирмы Canberra, США) для определения активностей изотопов урана (для определения содержания изотопов 235U и 238U в водных растворах).
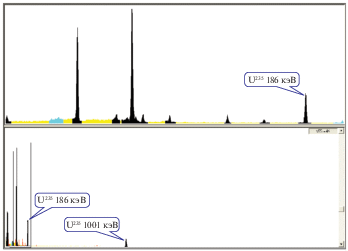
Методика определения сорбционных свойств. Содержание изотопа 235U определяли, исходя из его активности, равной 185.7 кэВ (энергетический выход пика 54%). Содержание изотопа 238U определяли по продукту его превращения в метастабильный изотоп 234Pa (активность 1001.03 кэВ, энергетический выход пика 0.59%). Следует отметить, что с помощью γ-спектрометра можно определить содержание изотопа 238U в исходном водном растворе. Однако вследствие различия химических свойств протактиния и урана и неодинаковых их сорбционных свойств, в фильтрате между 234Pa (m) и 235U наблюдается нарушение равновесия. Поэтому активность изотопа 238U определить исходя из активности изотопа 234Pa (m) невозможно (рис. 1). Поэтому для расчета концентрации 235U и 239U использовали формулы из [14]:
(3)
${{A}_{{{{{\text{U}}}_{{235}}}}}} = {{{{\lambda }}}_{{{{{\text{U}}}_{{235}}}}}}{{N}_{{{{{\text{U}}}_{{235}}}}}} = \frac{{\operatorname{In} 2}}{{T_{{1/2}}^{{{{{\text{U}}}_{{235}}}}}}}{{N}_{{\text{A}}}}\frac{{{{m}^{{{{{\text{U}}}_{{235}}}}}}}}{{{{M}_{{{{{\text{U}}}_{{235}}}}}}}},$(4)
${{A}_{{{{{\text{U}}}_{{238}}}}}} = {{{{\lambda }}}_{{{{{\text{U}}}_{{238}}}}}}{{N}_{{{{{\text{U}}}_{{238}}}}}} = \frac{{{\text{ln}}2}}{{T_{{1/2}}^{{{{{\text{U}}}_{{238}}}}}}}{{N}_{{\text{A}}}}\frac{{{{m}^{{{{{\text{U}}}_{{238}}}}}}}}{{{{M}_{{{{{\text{U}}}_{{238}}}}}}}},$ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Известно [15], что в зависимости от pH водного раствора урановые ионы могут находиться в различных формах: помимо уранил- и ураноил-ионов, также и в их гидратированных состояниях. Поэтому очень важно исследование влияния pH среды на процесс сорбции. Нами исследована зависимость степени сорбции и сорбционной емкости сорбента 4 от рН раствора в статических условиях при m = 50 мг, T = 300 K, C0 = 80 мг/л. Основная цель экспериментов – определение влияния рН среды на сорбционную способность урана сорбентом 4.
На рис. 2 приведена зависимость степени сорбции (R) и статической сорбционной емкости (q) сорбента 4 от pH раствора в указанных условиях. Как видно, кривые носят экстремальный характер. Максимальное значение степени сорбции наблюдается при pH 5–6.
Рис. 2.
Зависимости степени сорбции (R) и статической сорбционной емкости (q) сорбции урана от рН раствора сорбентом 4.
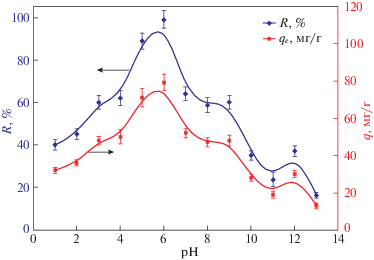
На рис. 3 приводится зависимость сорбционной емкости от начальной концентрации уранил-ионов в растворе. Из данных рис. 2 и 3 можно заключить, что при малых значениях pH (т.е. в кислых растворах) в водном растворе присутствуют уранил-ионы ${\text{UO}}_{2}^{{2 + }}$. С увеличением pH среды количество указанных ионов уменьшается, и в растворе превалирует ионы UO2OH+, (UO2)3(OH)$_{5}^{ + }$, т.е. происходит увеличение содержания гидрокси-катионов.
Рис. 3.
Зависимость статической сорбционной емкости (q) сорбента 4 от начальной концентрации уранил-ионов в растворе.
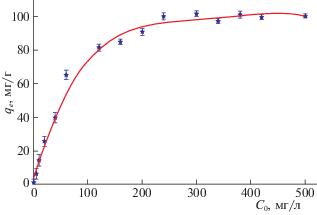
Приведенная на рис. 3 зависимость q = f(C0) показывает, что стационарная область наблюдается при С0 > 200 мг/л. Результаты проведенных исследований показали, что сорбционная емкость достигает максимального значения 101 мг/г по уранил-ионам. Очевидно, протоны двух –СООН-групп в структуре исследованного сополимера замещаются гидроксил-катионами. При рН 5–6 в среде в основном образуются катионы UO2OH+, которые взаимодействуют с поверхностными карбоксильными группами сополимера [15]. Ионы UO$_{2}^{{2 + }}$ и UO2OH+, видимо, реагируют и с ОН-группами, имеющимися в структуре фенольного звена. Эти взаимодействия могут быть достаточно сильными. Указанные ионные формы в основном реализуются при рН 5–6. Поэтому на зависимости R от рН (рис. 2) максимальная степень сорбции и получена при этих значениях рН.
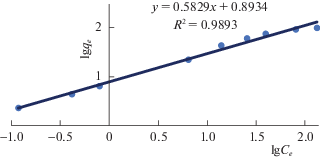
Обнаруженное равновесие между урановыми ионами и сорбентом хорошо иллюстрируется изотермой Фрейндлиха [16]:
где Ce – концентрация урана в растворе после сорбции, мг/л; qe – количество урана, сорбированного в единице массы сорбента 4, мг/г; KF – константа сорбционной емкости (рассчитана экспериментально), n – фактор неоднородности сорбента 4. Результаты расчетов приведены в табл. 1.Таблица 1.
Результаты расчетов параметров изотермы по Фрейндлиху
| A0, Бk/л | A, Бk/л | C0, мг/л | Ce, мг/л | $\lg {{C}_{{\text{e}}}}$ | qe, мг/г | $\lg {{q}_{{\text{e}}}}$ | Ce/qe |
|---|---|---|---|---|---|---|---|
| 1.2 | 0.06 | 2.4 | 0.12 | –0.92 | 2.28 | 0.36 | 0.053 |
| 2.4 | 0.21 | 4.8 | 0.42 | –0.38 | 4.38 | 0.64 | 0.096 |
| 3.6 | 0.4 | 7.2 | 0.8 | –0.10 | 6.4 | 0.81 | 0.125 |
| 14.4 | 3.2 | 28.8 | 6.4 | 0.81 | 22.4 | 1.35 | 0.286 |
| 28.8 | 6.9 | 57.6 | 13.8 | 1.14 | 43.8 | 1.64 | 0.315 |
| 43.2 | 12.6 | 86.4 | 25.2 | 1.40 | 61.2 | 1.79 | 0.412 |
| 57.6 | 19.5 | 115.2 | 39 | 1.59 | 76.2 | 1.88 | 0.512 |
| 86.4 | 39.4 | 172.8 | 78.8 | 1.90 | 94 | 1.97 | 0.838 |
| 115.2 | 64.7 | 230.4 | 129.4 | 2.11 | 101 | 2.00 | 1.281 |
При рН 7 на зависимостях R = f(pH) и qc = = f(pH) наблюдаются небольшие максимумы или стационарные области, что указывает на процесс сорбции на поверхности сополимера ионов и в виде (UO2)3(OH)$_{5}^{ + }$, (UO2)3(OH)$_{7}^{ + }$, т.е в виде гидрокси-катионов. В сильнощелочной среде (при рН ≥ 10), как показали эксперименты, на поверхности сорбента обнаруживаются электроноакцепторные центры, так как при этих значениях рН в растворе имеются гидрокси-анионы UO2(OH)$_{3}^{ - }$ и (UO2)3(OH)$_{7}^{ - }$. Изотерма Фрейндлиха приводится на рис. 4.
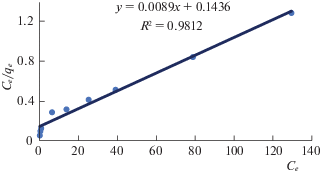
Была построена также изотерма Ленгмюра (рис. 5). Приведенную зависимость србционной емкости (qe) от Се можно объяснить исходя из изотермы Ленгмюра [17]:
(6)
$\frac{{{{C}_{{\text{e}}}}}}{{{{q}_{{\text{e}}}}}} = \frac{1}{{{{K}_{{\text{L}}}}}} + \frac{{{{a}_{{\text{L}}}}}}{{{{K}_{{\text{L}}}}}}{{C}_{{\text{e}}}},$(7)
${{q}_{{\text{e}}}} = \frac{{{{Q}_{{\max }}}{{a}_{{\text{L}}}}{{C}_{{\text{e}}}}}}{{1 + {{a}_{{\text{L}}}}{{C}_{{\text{e}}}}}},$С целью выявления выгодности процесса сорбции была вычислена постоянная рассеивания (RL) по формуле:
где b (aL) – постоянная Ленгмюра, C0 – начальная концентрация уранил ионов в растворе, мг/л [17].В табл. 2 приводятся константы изотерм Фрейндлиха и Ленгмюра.
Таблица 2.
Константы изотерм Фрейндлиха и Ленгмюра для сорбента 4
| Фрейндлих | Ленгмюр | |||||
|---|---|---|---|---|---|---|
| N | KF | R2 | KL, л/г | aL, л/мг | RL | Qmax, мг/г |
| 1.72 | 7.8 | 0.989 | 6.96 | 0.06 | 0.07 | 101 |
Как видно из табл. 2, значение RL находится в интервале 0–1, что указывает на возможность процесса сорбции. Также видно, что на основе изотермы Фрейндлиха вычислен коэффициент неоднородности поверхности сорбента (1/n = = 0.5829). Поскольку эта величина оценивается в диапазоне 0–1, было определено, что поверхность сорбента достаточно неоднородна.
С целью установления возможности максимального извлечения уранил-ионов были проведены эксперименты и при высокой концентрации урановой соли (300 мг/л) и различных количествах сорбента (0.2–10 г/л) (при рН 6, комнатной температуре, в общем объеме раствора 50 мл, в присутствии 10 мл буфера ацетата аммония). При увеличении концентрации сорбента в жидкой фазе от 0.2 до 10 г/л скорость сорбции уранил-ионов увеличивается. В диапазоне 5–10 г/л скорость сорбции начинает стабилизироваться.
С целью изучения возможности регенерации сорбента 4 исследована десорбция 100 мг/г уранил-иона из сорбента 4 растворами азотной, соляной кислот, гидроксида натрия и хлорида натрия [18]. По мере увеличения концентрации обеих кислот десорбция урана из сорбента увеличивается. Максимальная десорбция происходит при концентрации минеральных кислот, равной 0.5 М и составляет 95.3% в случае десорбции азотной кислотой и 96.2% – при десорбции соляной кислотой. Обе минеральные кислоты показывают почти одинаковую степень десорбции в растворах в одинаковой концентрации, следовательно, десорбция урана из сорбента происходит только за счет протона. Как было отмечено, десорбция уранила из сорбента осуществлялась также растворами NaOH и NaNO3. Выявлено, что степень десорбции уранил-ионов в присутствии 0.05 М раствора NaOH составляет всего 25%.
Таким образом, проведенные исследования позволяют сделать вывод о возможности использования структурированного сополимера 4 в качестве эффективного сорбента для очистки водных систем от урановых соединений.
Список литературы
Modi M.K., Pattanaik P., Nishad Dash et al. // Intern. J. Pharmac. Sci. Rev.and Res. 2015. V. 34. № 1. P. 122.
Akpomieab K.G., Dawodua F.A., Adebowale K.O. // Alexandria Engineering Journal. 2015. V. 54. № 3. P. 757. https://doi.org/10.1016/j.aej.2015.03.025
Бунина З.Ю., Брылева Е.Ю., Юрченко О.И., Беликов К.Н. // Хімія, фізика та технологія поверхні. 2018. Т. 9. № 1. С. 80.
Полякова И.В., Грошикова А.Р., Лещинская А.П. и др. // Сорбционные и хроматографические процессы. 2008. Т. 8. № 4. С. 694.
Шилина А.С., Милинчук В.К. // Там же. 2010. Т. 10. № 2. С. 237.
Jun Qian, Suya Cai, Sen Yang, Daoben Hua // J. Materials Chem. A. 2017. V. 5. P. 22380. https://doi.org/10.1039/C7TA08025E
James A.M., Harding S., Robshaw Th. et al. // ACS Applied Materials Interfaces. 2019. V. 11. № 25. P. 22464. https://doi.org/10.1021/acsami.9b06295
Ферапонтов Н.Б., Гагарин А.Н., Токмачёв М.Г. // Сорбционные и хроматографические процессы. 2016. Т. 16. № 3. С. 368.
Zemskova L., Egorin A., Tokar E., Ivanov V. // Biomimetics. 2018. V. 39. № 3. https://doi.org/10.3390/biomimetics3040039
Zakharchenko E., Mokhodoeva O., Malikov D. et al. // Procedia Chemistry. 2012. 7. P. 268. https://doi.org/10.1016/j.proche.2012.10.043
Магеррамов А.М., Байрамов М.Р. Химия алкенилфенолов. М.: Техносфера, 2018. 362 с.
Магеррамов А.М., Байрамов М.Р., Агаева М.А. и др. // Успехи химии. 2015. Т. 84. № 12. С. 1258.
Магеррамов А.М., Байрамов М.Р., Гарибов A.A. и др. // Журн. прикл. химии. 2011. Т. 84. № 1. С. 151.
3-rd ed, Ann Arboar, Michigan, 1999. P.806.
Annick Froideval. Chimie de l’uranium(VI) à l’interface solution/minéraux (quartz et hydroxyde d’aluminium): expériences et caractérisations spectroscopiques. Chimie. Université Louis Pasteur – Strasbourg I, 2004. Français.
Ho Y.S., Porter J.F., Kay Mc. // Water, Air, and Soil Pollution. 2002. V. 141. P. 1.
Ng J.C.Y., Cheung W.H., McKay G. // Chemosphere. 2003. V. 52. P. 1021. https://doi.org/10.1016/S0045-6535(03)00223-6
Nakajima A., Sakaguchi T. // Journal of Chemical Technology and Biotechnology. 1986. V. 36. № 1. P. 281. https://doi.org/10.1002/jctb.280400205
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии