Журнал физической химии, 2021, T. 95, № 4, стр. 534-541
Деградация структуры древесины Populus tremula при делигнификации озоном. Термический анализ
Н. А. Мамлеева a, *, А. В. Шумянцев a, А. Н. Харланов a
a Московский государственный университет имени М.В. Ломоносова, Химический факультет
119992 Москва, Россия
* E-mail: mamleevana@bk.ru
Поступила в редакцию 17.05.2020
После доработки 17.05.2020
Принята к публикации 10.07.2020
Аннотация
Превращения древесины осины под воздействием озона исследованы методом ИК-спектроскопии и синхронного термического (ТГ) анализа, совмещенного с масс-спектрометрическим (МС) анализом неконденсируемых продуктов пиролиза. Проанализированы ТГ/ДТГ-кривые лигноцеллюлозных материалов (ЛЦМ), полученных при различных значениях удельного поглощения озона. Проведено моделирование кривых ДТГ компонентами Гаусса. Показано, что под воздействием озона в древесине снижается содержание гемицеллюлоз (ГЦ) и лигнина (ЛГ), содержание целлюлозы возрастает. Данные ИК-спектроскопии подтверждают разрушение ароматических структур ЛГ и указывают на образование кислородсодержащих продуктов озонирования биомассы по мере увеличения удельного поглощения озона. На основании ТГ/МС-анализа ЛЦМ и результатов моделирования установлены область расходов озона, соответствующая преимущественному разрушению ЛГ и ГЦ, и область реакций озона с продуктами озонирования ЛЦМ. Отмечена деградация структуры целлюлозы при высоких расходах озона.
Древесина – материал биологического происхождения с высоким содержанием целлюлозы (ЦЛ), что и определяет ее ценность с точки зрения получения ЦЛ и продуктов на ее основе [1]. Стенки растительной клетки состоят из волокон целлюлозы, включенных в матрицу из гемицеллюлоз (ГЦ) и лигнина (ЛГ), ковалентно-связанных между собой. Эта особенность структуры растительной биомассы ограничивает доступность целлюлозного волокна для ферментов, что снижает выход моносахаридов при биоконверсии ЦЛ в сахара [1–3].
Одним из решений проблемы является проведение предварительной обработки биомассы, направленное на удаление ЛГ при минимальной деструкции ЦЛ волокна, что может быть достигнуто с использованием озона. Будучи электрофильным агентом, озон характеризуется высокой реакционной способностью по отношению к фенольным структурам ЛГ [1–5]. ЦЛ и ГЦ относительно устойчивы к воздействию озона [2–4]. Авторами обзора [4] показана перспективность использования озона для деструкции ЛГ на этапе предварительной обработки лигноцеллюлозного материала (ЛЦМ) в процессах получения моносахаридов и биоэтанола. Основное препятствие для практического использования озонной делигнификации – значительные затраты озона, что сдерживает его внедрение в производство. В этой связи исследование превращений ЛЦМ при озонировании и определение условий проведения делигнификации, оптимальных с точки зрения расходов озона, имеет принципиальное значение.
Необходимое условие эффективной делигнификации озоном – присутствие воды в структуре ЛЦМ [4, 6–13]. Показано [9], что для обработки озоном древесины осины оптимально содержание воды 55–60%, когда степень делигнификации (СД) составляет 60–70% [6, 9]. Отмечено [4, 6, 12], что озонолитическая делигнификация ЛЦМ может сопровождаться деструкцией ГЦ и ЦЛ.
Озонированные ЛЦМ исследованы рядом физико-химических методов (ИК-, УФ-спектроскопия, рентгеновская дифракция, электронная микроскопия), проведено тестирование ЛЦМ в реакции ферментативного гидролиза в сахара; исследованы продукты озонирования древесины [6–13]. Авторами [13–15] для изучения превращений ЛЦМ при обработке озоном использован метод термического анализа.
Термогравиметрический (ТГ) анализ известен как информативный метод исследования биомассы растений и ее основных структурных компонентов [16–23]. Установлено [13, 15], что снижению термической устойчивости ЛЦМ способствует понижение содержания ЛГ, а по данным [21, 24] аналогично действует и снижение содержания кристаллической ЦЛ. В комбинации с масс-спектрометрическим (МС) анализом газообразных продуктов пиролиза синхронный термический анализ используют для изучения продуктов термодеструкции ЛГ, ГЦ и ЦЛ, а также биомассы [16, 17, 22, 25–27]. В работе [15] данные ТГ/МС-анализа показали, что делигнификация древесины сосны озоном сопровождается разрушением гемицеллюлоз.
Цель данной работы – с помощью ТГ/МС-метода изучить превращения древесины осины на различных этапах озонирования и определить условия обработки озоном, оптимальные для делигнификации. Для решения этой задачи образцы ЛЦМ, полученные при разных значениях удельного поглощения озона, исследованы методом ТГ/МС. Проведено моделирование кривых ДТГ компонентами Гаусса. Проанализированы профили выделения неконденсируемых продуктов термодеструкции ЛЦМ в инертной атмосфере. Образцы ЛЦМ охарактеризованы методом ИК-спектроскопии диффузного отражения.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Объектом исследования служил образец древесины осины (Populus tremula) (фракция с размером частиц ≤0.315 мм с содержанием воды 58–60% относительно массы абсолютно сухой древесины (а.с.д.)). Предварительная подготовка образцов описана в [11]. Озонирование проводили в проточной системе в реакторе с неподвижным слоем при концентрации озона 50–60 мг/л и скорости потока 4 л/ч. Количество поглощенного озона на 1 г а.с.д. (Qr, ммоль/г) при различной продолжительности обработки образца определено, согласно [9, 11]. После обработки озоном образцы ЛЦМ промывали водой для удаления растворимых продуктов озонирования и сушили на воздухе.
Спектры ИК-ДО образцов ЛЦМ регистрировали на ИК-фурье-спектрометре Equinox 55/S (Bruker) с приставкой диффузного отражения Selector (Specac). В качестве эталона использовали порошкообразную фракцию KBr, предварительно высушенную при 400°С в течение 8 ч. Полученные спектры отражения преобразовывали в единицы Кубелки–Мунка.
Термический анализ образцов проводили на синхронном термоанализаторе Netzsch 449 C Jupiter, совмещенном с масс-спектрометром Netzsch 409 Aoelos. Образцы древесины анализировали при скорости нагрева 10 К мин–1 в интервале от 40 до 600°С в атмосфере аргона, скорость потока газа – 8 мл/мин, масса образца 5–7 мг.
Деконволюцию ДТГ кривых на компоненты Гаусса проводили с помощью программного обеспечения OPUS 6.0 (Bruker) по алгоритму Левенберга–Марквардта. Среднеквадратичная ошибка аппроксимации составляла не более 0.05%/мин.
Интегрирование масс-спектров (МС) для различных масс проводили с учетом фоновой интенсивности ионного тока для каждой массы. Результат интегрирования нормировали к начальной навеске образца [16].
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Поглощение озона древесиной
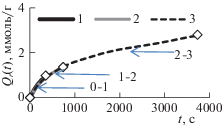
На рис. 1 приведены кинетические кривые поглощения озона образцами древесины с содержанием воды 58–60%. Рисунок 1 представляет собой кинетический профиль поглощения озона, точками отмечены значения Qr, соответствующие окончанию обработки озоном. На первом этапе за 360 с поглощено 1.0 ммоль О3/г (кривая 1); для поглощения 1.4 ммоль О3/г потребовалось 720 с (кривая 2), а за 3700 с поглощено 2.8 ммоль О3/г (кривая 3). Разная скорость поглощения озона, характерная для выделенных участков, указывает на протекание различных процессов. Далее представлен анализ образцов, соответствующих точкам на рис. 1.
ИК-спектры
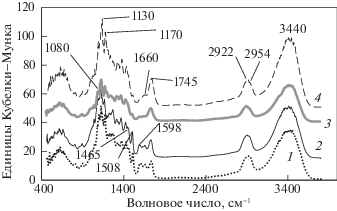
На рис. 2 представлены ИК-спектры диффузного отражения ЛЦМ при различных значениях удельного поглощения озона. Интенсивность полос 1508 и 1598 см–1, относящихся к скелетным колебаниям ароматических структур, в спектрах озонированных образцов уменьшается. Это особенно заметно в спектре образца № 4. Полосу при 1660 см–1 относят к валентным колебаниям С=О-групп, конъюгированных с ароматическим кольцом [28, 29]. По мере увеличения Qr интенсивность полос 1660 и 1465 см–1 (деформационные С–Н-колебания (асимметричные) и колебания ароматических колец) уменьшается. ИК- спектры показывают, что у образцов № 3 и № 4 возрастает интенсивность полосы 1745 см–1 колебаний С=О-групп с алифатическим заместителем [29]. С увеличением Qr возрастает интенсивность полос 1080 и 1040 см–1 валентных С–О- и С–О–С-колебаний, изменяется контур полосы валентных С–Н-колебаний (2850–3000 см–1). В спектре 4 видно плечо при 2954 см–1 (валентных колебаний С–Н в СН3-группах [28]).
Полоса при 3440 см–1 – валентные колебания ОH-групп, связанных водородной связью [28, 29]. С увеличением Qr положение полосы сохраняется, полуширина полосы уменьшается от 360 см–1 (спектр 1) до 320 см–1 (спектр 4), что свидетельствует о разрушении сетки водородных связей полимера древесины. Таким образом, данные ИКС показали уменьшение содержания ароматики в озонированных ЛЦМ и увеличение содержания алифатических структур с С–О-, С‒О–С- и С=О-заместителями.
Термический анализ
На рис. 3 приведены кривые ТГ/ДТГ исследованных образцов, а в табл. 1 представлены результаты ТГ/ДТГ-анализа. Как показывает ТГ-кривая на рис. 3 для образца исходной древесины (№ 1), в интервале 40−130°С (I интервал) потеря массы (Δm) составила 1.9%. Во втором интервале (130–600°С) Δm = 71.7%. Остаточная масса (mост) составила 25.6%. Сравнение значений Δm и mост показывает, что по мере увеличения удельного поглощения озона потеря массы в указанном интервале температур возрастает (образцы № 2 и № 3), а остаточная масса соответственно уменьшается. У образца № 4 величины Δm и mост почти совпадают с полученными для образца № 2. У озонированных образцов положение максимума на кривых ДТГ смещается в область более низких температур, во втором интервале температур скорость потери массы возрастает (табл. 1, рис. 3). Очевидно, что наблюдаемые изменения ТГ/ДТГ-кривых обусловлены изменением состава ЛЦМ в зависимости от Qr.
Рис. 3.
ТГ- и ДТГ-кривые образцов древесины и деконволюция ДТГ-кривых на компоненты гауссовой
формы; Qr = 0 (а), 1.0 (б), 1.4 (в) и 2.8 ммоль/г (г);  экспериментальная кривая,
экспериментальная кривая,  модельная кривая,
модельная кривая,  пик воды; компоненты разложения
пик воды; компоненты разложения  1,
1,  2,
2,  3,
3,  4,
4,  5,
5, 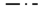 6,
6,  7,
7,  8,
8,  9.
9.
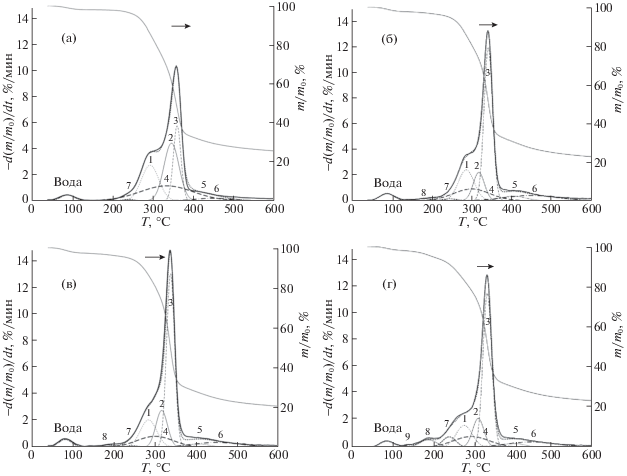
Таблица 1.
Потеря массы (–Δm) в температурных интервалах I и II, остаточная масса (mост), температуры максимума скорости потери массы (Tmax) для образцов ЛЦМ № 1–4, полученных при различных значениях удельного поглощения озона (Qr)
| № | Qr, ммоль/г | −Δ m, % | mост,% | Т1max, °С | Т2max, °С | |
|---|---|---|---|---|---|---|
| 40−130°С | 130−600°С | |||||
| 1 | 0 | 1.9 | 72.5 | 25.6 | 88 | 359 |
| 2 | 1.0 | 2.4 | 74.9 | 22.7 | 89 | 341 |
| 3 | 1.4 | 2.8 | 76.4 | 20.7 | 84 | 337 |
| 4 | 2.8 | 2.0 | 74.8 | 23.2 | 89 | 338 |
Термическую деструкцию древесины представляют как сумму реакций термического разложения отдельных компонентов – ГЦ, ЦЛ и ЛГ [18, 20, 21]. При этом известно, что интервалы термодеструкции ГЦ, ЦЛ и ЛГ перекрываются: гемицеллюлозы разрушаются при 225–325°С, целлюлоза – в интервале 305–375°С, а термодеструкция лигнина идет в широком интервале – от 150 до 500°С [20, 21]. Поэтому приведенные данные не позволяют оценить вклад этих структурных компонентов биомассы в потерю массы в условиях пиролиза. В работах [19, 21] для решения этой задачи предложено моделирование кривых ДТГ биомассы с помощью индивидуальных компонент Гаусса.
Для описания динамики деструкции озоном ГЦ, ЦЛ и ЛГ в структуре древесины нами использована математическая модель, основанная на деконволюции кривых ДТГ на симметричные компоненты гауссовой формы; определена интегральная интенсивность (площадь под кривой) каждой компоненты разложения и ее вклад в суммарную интегральную интенсивность модельной кривой ДТГ (Ar). Интегральная интенсивность отдельной компоненты соответствует относительной потере массы за счет данного индивидуального процесса. Результаты моделирования ДТГ-кривых для исходной древесины и озонированных ЛЦМ представлены на рис. 3. В табл. 2 приведены компоненты деконволюции и их параметры: температуры максимумов и вклад (Arc/Ar) компонент, относящихся к ГЦ, ЦЛ и ЛГ в биомассе (ГЦк, ЦЛк и ЛГк), а также компонент, относящихся к примесям (образец № 1) и продуктам озонирования у образцов № 2–4. Отмечен вклад алифатического и ароматического углерода, формирующегося в ходе термического анализа биомассы. Сопоставление экспериментальных значений потери массы (Δm) в табл. 1 со значениями суммарной интегральной интенсивности модельной кривой ДТГ (Ar), показывает, что для всех образцов ошибка моделирования находится в пределах 2.5–4.5%.
Таблица 2.
Температуры максимума (Тmax °С) и вклад интегральной интенсивности компонент Гаусса (Arc/Ar, %) в суммарную интегральную интенсивность (Ar, %) в интервале II для образцов ЛЦМ, полученных при различных значениях удельного поглощения озона (Qr, ммоль/г)
| Компоненты | Qr = 0 | Qr = 1.0 | Qr = 1.4 | Qr = 2.0 | |||||
|---|---|---|---|---|---|---|---|---|---|
| Тmax, ºС | Arc/Ar, % | Тmax, ºС | Arc/Ar, % | Тmax, ºС | Arc/Ar, % | Тmax, ºС | Arc/Ar, % | ||
| ГЦк | № 1* | 294 | 22.3 | 286 | 16.1 | 284 | 14.5 | 282 | 11.6 |
| ЦЛк1 | № 2 | 347 | 28.0 | 318 | 11.1 | 316 | 13,9 | 317 | 10.6 |
| ЦЛк2 | № 3 | 361 | 19.0 | 341 | 43.9 | 337 | 44.2 | 340 | 43.8 |
| ЛГк | № 4 | 335 | 25.7 | 300 | 14.3 | 300 | 13.2 | 300 | 12.6 |
| Углерод алифатический | № 5 | 405 | 1.0 | 404 | 3.6 | 405 | 2.8 | 405 | 2.9 |
| Углерод ароматический | № 6 | 450 | 3.3 | 448 | 8.8 | 450 | 8.9 | 450 | 9.2 |
| Примеси**, продукты озонирования |
№ 7 № 8 № 9 |
240** | 0.7 | 245 185 |
1.1 0.8 |
245 185 |
0.9 0.8 |
250 190 140 |
4.6 4.0 0.7 |
| Ar, % | 70.9 | 72.2 | 72.0 | 71.9 | |||||
| Arc , % (вода) | 89 | 1.9 | 88 | 2.3 | 81 | 2.5 | 88 | 2.0 | |
| ЛГ, % [9] | 25.3 | 13.7 | 11.3 | 10.0 | |||||
* Нумерация компонент соответствует номерам на рис. 3.
На рис. 3 кривая ДТГ исходного образца представлена моделью из восьми симметричных компонент Гаусса. Полоса при 294°С относится к гемицеллюлозам, которые у лиственной древесины состоят, в основном, из пентозанов (преимущественно, ксилана) [18, 20] и характеризуются низкой термической устойчивостью [20]. Термодеструкция целлюлозы характеризуется двумя компонентами № 2 – при 347°С и № 3 – при 361°С, которые можно отнести к ЦЛ с различной степенью кристалличности [23]. ЛГ представлен широкой полосой с максимумом при 335°С. Компонента № 7 относится к примесям, а высокотемпературные компоненты № 5 и № 6 – к алифатическому и ароматическому углероду в углях, образующихся в ходе термодеструкции биомассы [21].
Согласно предлагаемому подходу, вклад компоненты разложения рассматривается как эквивалент потери массы той структурой, к которой отнесена данная компонента модели. У образца № 1 для ЛГ Arc/Ar, составляет 25.7% от площади всех компонент разложения, что в рамках предлагаемого подхода соответствует такой же доле ЛГ в потере массы. Вклад ГЦ в потерю массы составляет 22.3%, а доля ЦЛ, представленная суммой двух компонент разложения (ЦЛк1 + ЦЛк2), составляет 47.0%. Эти значения коррелируют с данными [20, 30] по составу лиственной древесины (46–48% ЦЛ, 19–28% ЛГ, 26–35% ГЦ).
Интегральная интенсивность гауссовой компоненты с максимумом 88°С составляет 1.9%, что ожидаемо совпадает со значением потери массы в I интервале температур, относящемся к физически адсорбированной воде. Для озонированных ЛЦМ положение максимума (Т1max в табл. 1) практически не меняется, а интенсивность единственной компоненты Гаусса в I интервале (табл. 2) согласуется с величиной − Δm в табл. 1.
У озонированных образцов максимум экспериментальных кривых ДТГ (Т2max) сдвигается в область более низких температур (табл. 1). В работах [13, 15] уменьшение термической устойчивости озонированных образцов связывали с уменьшением содержания ЛГ (самого термически устойчивого компонента биомассы). В данной работе вклад ЛГк по мере увеличения Qr снижается, в принципе коррелируя с изменением содержания ЛГ в озонированной древесине осины, определенном ранее для аналогичной серии эксперимента [9] и приведенной в табл. 2. Результаты моделирования также согласуются с уменьшением интенсивности полос поглощения ароматики в ИК-спектрах. У озонированных образцов доля компонент ГЦк, как и ЛГк, заметно уменьшается.
Компоненты разложения № 2 и № 3, относящиеся к ЦЛ, в озонированных образцах имеют максимумы при 316–318°С и 337–341°С, а суммарный вклад этих компонент (ЦЛк1 + ЦЛк2) у озонированных образцов возрастает по сравнению с исходным образцом. Из табл. 2 следует, что Arc/Ar низкотемпературной компоненты ЦЛк1 у озонированных образцов изменяется в зависимости от Qr, а вклад компоненты № 3, относящейся к термически более устойчивой ЦЛ, близок к 44% и практически не меняется. При Qr = 1.4 ммоль/г вклад низкотемпературной компоненты ЦЛк1 максимален (13.9%), при Qr = 2.8 ммоль/г значение ЦЛк1 уменьшается, что свидетельствует о разрушении части целлюлозы при озонировании. Для образца № 4 общий вклад целлюлозы (ЦЛк1 + ЦЛк2) – 54.4%, а у образца № 2 при Qr 1.4 ммоль/г он максимален и составляет 58.1%. Сопоставление этих значений с данными по содержанию ЦЛ в ЛЦМ из озонированной древесины осины (от 50 до 65% при разных Qr [6]) свидетельствуют о том, что данные моделирования близки к реальным значениям по составу озонированных ЛЦМ.
Из данных рис. 3 и табл. 2 следует, что вклад компонент № 7–9 продуктов озонирования возрастает при увеличении Qr, а область температур их выделения расширяется при увеличении Qr. Образование продуктов озонолиза ЛГ (глиоксалевая, муравьиная, щавелевая и др. кислоты) и других продуктов озонирования – алифатических спиртов, простых и сложных эфиров отмечено нами в [9, 11], их присутствие в порах озонированного ЛЦМ объяснимо. У образца № 4 общий вклад компонент № 7–9 в потерю массы – наибольший (9.3%).
Термодеструкция всех образцов сопровождается образованием алифатического (Тmax 404–405°С) и ароматического углерода (Тmax 448–450°С). Значения Arc/Ar соответствующих компонент разложения растет при увеличении Qr (табл. 2).
Таким образом, данные ТГ/ДТГ и результаты моделирования ДТГ кривых образцов № 1–4 компонентами Гаусса позволяют отметить следующие основные тенденции: разрушение ГЦ, уменьшение вклада ЛГ и увеличение доли ЦЛ в потерю массы, возрастание продуктов углеобразования при увеличении Qr. Основным отличием образца № 4 является присутствие значительного количества продуктов окислительной деструкции биомассы и уменьшение вклада ЦЛ в потерю массы.
Масс-спектры продуктов пиролиза
В ходе термодеструкции древесины в инертной среде образуются неконденсируемые продукты. Среди них, вода (M/z 18), СО2 (M/z 44), СО (M/z 28), муравьиная кислота (M/z 46), уксусная кислота (M/z 60) и формальдегид (M/z 30). Кроме того, присутствует метан; для корректного определения его выделения используют M/z 15 [17]. Перечисленные соединения типичны для пиролиза растительной биомассы и ее структурных компонентов [16–18, 25]. Профили выделения некоторых продуктов пиролиза образцов № 1–4 представлены на рис. 4.
Рис. 4.
Профили выделения Н2О (а, M/z 18), СО (б, M/z 28), СН4 (в, M/z 15) и СО2 (г, M/z 44) при термодеструкции образцов ЛЦМ; Qr = 0 (1), 1.0 (2), 1.4 (3) и 2.8 ммоль/г (4).
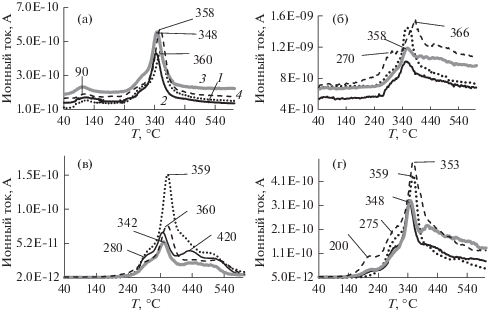
При пиролизе исходного образца наблюдаются два максимума выделения воды – при 90 и 360°С (рис. 4а). Максимум I относится к испарению физически сорбированной воды; его положение у всех образцов находится при близких значениях температур. Максимум II связан с образованием воды в ходе химических реакций, сопровождающих термодеструкцию. Профили всех продуктов пиролиза также характеризуются максимумом в области II температурного интервала потери массы. По сравнению с исходным у образцов № 2 и № 3 максимумы выделения продуктов смещены в область более низких температур, а для образца № 4 – в область более высоких температур, что согласуется с данными ДТГ.
Профили выделения продуктов пиролиза исходной древесины характеризуются небольшими максимумами в высокотемпературной области, которые относят к вторичному пиролизу продуктов первичного пиролиза биомассы [22]. На профилях выделения СО2, СО и СН4 (рис. 4б–4г) образцов № 2–4 видны интенсивные плечи в области температур выше 400ºC, присутствие которых согласуется с результатами моделирования. Возможно, как и в работе [15], высокотемпературное выделение этих соединений связано с пиролитической декомпозицией полимерных структур ЛГ, сформировавшихся при обработке ЛЦМ озоном. На кривых выделения СО2, СО и СН4 (рис. 4б–4г) образца № 4 видны интенсивные плечи при 200 и 270–280°C, положение которых коррелирует с данными рис. 3г.
Изучение состава продуктов пиролиза ЛГ, ГЦ и ЦЛ позволило оценить вклад этих компонентов биомассы в процесс образования СО, СО2, Н2О, НСНО, СН4 и других соединений при термолизе ЛЦМ [17, 18, 25]. Выделение СН4 обусловлено термодеструкцией всех компонентов ЛЦМ – ЛГ, ГЦ и ЦЛ. Показано [17, 22], что выделение метана коррелирует с содержанием ОСН3-групп в лигнинах. По данным [22], СН4 выделяется в ходе пиролиза ГЦ при 280°C, а также при 520°C, что объясняют протеканием вторичного пиролиза продуктов первичной термической декомпозиции полисахарида.
Согласно [25], количество СО2 и Н2О, образующихся при пиролизе биомассы в инертной среде согласуется с содержанием кислорода в биоматериале, а источником кислорода для образования СО2 в этих условиях является целлюлоза. Отмечают [17, 25], что СО образуется из метоксигрупп ЛГ и С–О-групп ГЦ и ЦЛ. Образованию СО2 при пиролизе ЛГ способствует присутствие карбоксильных групп и С–О-связей [17, 18].
На рис. 5 представлено количество продуктов пиролиза ЛЦМ (в относительных единицах) в зависимости от Qr. При повышении Qr идет снижение выхода СН4 и СО с минимумом при Qr = = 1.4 ммоль/г. При более высоких Qr выход этих продуктов возрастает. Количество выделенного СО2 монотонно возрастает по мере увеличения Qr.
Рис. 5.
Количество продуктов пиролиза (отн. ед.) образцов ЛЦМ в зависимости от удельного поглощения озона (Qr); СО, СО2 – левая ось Y, СН4 – правая ось Y.
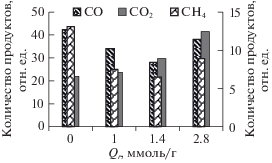
Наблюдаемые закономерности выхода продуктов пиролиза озонированных ЛЦМ объясняются сочетанием двух процессов – деструкции компонентов биомассы и сопровождающим ее образованием продуктов окисления. Отмеченное уменьшение интенсивности скелетных колебаний ароматики у озонированных образцов и приведенные в табл. 2 данные по их составу позволяют связать первоначальное уменьшение количества СН4 с разрушением ЛГ при озонировании, тем более, что основным источником выделения СН4 считают лигнин [22, 25, 26]. Как показали результаты моделирования ДТГ-кривых, делигнификация древесины озоном сопровождается разрушением ГЦ. О деградации ГЦ свидетельствуют и изменения профилей выхода СН4, СО2 и СО (рис. 4б–4г), на которых для образцов № 2 и № 3 видно уменьшение плеч в области термодеструкции ГЦ (270–280ºС). Таким образом, совокупность данных указывает на то, что в отмеченном интервале Qr происходит удаление ЛГ и ГЦ. Возрастание количества СН4 при увеличении Qr до 2.8 ммоль/г происходит за счет выделения газа при 170–250°С и при температурах выше 400°С, где в ходе термического анализа формируется уголь (рис. 4в). По-видимому, увеличение выхода СН4 связано с увеличением содержания в озонированных образцах алифатических структур, которые, как и ароматические, авторами [17, 25] отмечены как источник образования СН4. Образование карбонильных и карбоксильных соединений объясняет увеличение выхода СО2 при пиролитической деструкции образцов № 3 и № 4 (рис. 4). У образца № 4 выделение СО2 возрастает как в области высоких температур, так и в области 200–280°С. Эти данные подтверждают выводы об образовании продуктов озонирования, сделанные на основании моделирования кривых ДТГ.
Превращение древесины на разных этапах озонирования
Исследованные образцы ЛЦМ получены на разных этапах обработки озоном в условиях оптимума содержания воды, и сопоставление их характеристик позволяет рассмотреть разные стадии превращения древесины при поглощении озона. Образец № 2 соответствует линейному участку зависимости Qr(t) (рис. 1). На этом этапе озон взаимодействует с ароматическими структурами, происходит удаление из структуры биомассы лигнина и части ковалентно-связанных с ним гемицеллюлоз. Степень делигнификации, определенная по данным по содержанию ЛГ [9], при Qr = 1.0 ммоль/г составляет 45.8%. Удаление ЛГ и ГЦ приводит к падению термической устойчивости, свидетельствующей о дезорганизации структуры лигноуглеводной матрицы в целом и образованию материала, в котором содержание ЦЛ возрастает.
Образцу № 3 на рис. 1 соответствует кривая 2. В этом случае при поглощении озона делигнификация продолжается, при Qr =1.4 ммоль/г СД составляет 55.3%, разрушаются ГЦ. Одновременно образуются продукты окислительной деструкции озоном. Содержание ЦЛ в озонированном образце ЛЦМ максимально.
Образец № 4 получен при длительном озонировании (рис. 1, кривая 3). При Qr = 2.8 ммоль О3/г достигается СД 60.4%. Очевидно, что на заключительном этапе озонирования делигнификация древесины не является основным процессом. Превращение ГЦ также незначительно. Отмечено разрушение ЦЛ с термически неустойчивой структурой, к которой относятся аморфные области целлюлозного волокна. Это предположение основывается на данных работы [6], в которой отмечен процесс аморфизации целлюлозы при озонировании древесины осины, а также на известных данных по термической устойчивости кристаллической и аморфной целлюлозы. Показано [21, 24], что уменьшение степени кристалличности ЦЛ способствует понижению ее термической стабильности. Данные ТГ/ДТГ, МС и ИК-спектров указывают на заметный вклад продуктов озонирования в процессы пиролитической декомпозиции ЛЦМ. На этапе длительной обработки озоном идет также образование поликонденсированных структур, отмеченных при озонировании ряда ЛЦМ [10, 15, 31].
Результаты работы показывают, что, несмотря на относительную селективность озона по отношению к ароматическим группам, обработка озоном приводит к деградации всей структуры ЛЦМ. Тем не менее, на профиле поглощения озона рис. 1 можно выделить разные области Qr: начальный линейный отрезок (0–1) – область преимущественного разрушения ЛГ и ГЦ. На участке (1–2) деструкция ЛГ и ГЦ в биоматериале продолжается. Достигается максимальное содержание ЦЛ в озонированном материале. Длинный участок (2–3) – область, где преимущественно идут реакции озона с разнообразными продуктами озонирования ЛЦМ, идет частичное разрушение целлюлозы.
Таким образом, с помощью метода термического анализа определена область значений удельного поглощения озона, оптимальная для делигнификации древесины, и показано преимущество кратковременной обработки биоматериала озоном для получения материала с высоким содержанием целлюлозы.
Работа выполнена на оборудовании Центра коллективного пользования Химического факультета МГУ имени М.В. Ломоносова.
Список литературы
Физическая химия лигнина / Ред. К.Г. Боголицын, В.В. Лунин. Архангельск: Арханг. гос. технич. ун-т, 2009. 489 с.
Li C., Wang L., Chen Z., Li Y. et al. // Bioresour. Technol. 2015. V. 183. P. 240.
García-Cubero M.T., Coca M., Bolado S., Gonzalez-Benito G. // Chem. Eng. Trans. 2010. V. 21. P. 1273.
Travaini R., Martín-Juárez J., Lorenzo-Hernando A., Bolado-Rodriges S. // Biores. Technol. 2016. V. 199. № 1. P. 2.
Разумовский С.Д., Заиков Г.Е. Озон и его реакции с органическими соединениями. М.: Наука, 1974. 322 с.
Mamleeva N.A., Autlov S.A., Bazarnova N.G., Lunin V.V. // Russ. J. Bioorg. Chem. 2016. V. 42. № 7. P. 694.
García-Cubero M.T., Palacín L.G., González-Benito G. et al. // Bioresour. Technol. 2012. V. 107 .P. 229.
Бенько Е.М., Лунин В.В. // Химия растительного сырья. 2019. № 4. С. 305.
Мамлеева Н.А., Кустов А.Л., Лунин В.В. // Журн. физ. химии. 2018. Т. 91. № 9. С. 1402.
Мамлеева Н.А., Харланов А.Н., Лунин В.В. // Там же. 2020. Т. 94. № 9. С. 1337.
Мамлеева Н.А., Бабаева Н.А., Харланов А.Н., Лунин В.В. // Там же. 2019. Т. 93. № 1. С. 28.
Мамлеева Н.А., Харланов А.Н., Чухчин Д.Г. и др. // Химия растительного сырья. 2019. Т. 1. С. 85.
Andersen S.L., Castoldi R., Bracht A. et al. // Wood Sci. Technol. 2018. https://doi.org/10.1007/s00226-018-1061-7
Perrone O.M., Colombari F., Rossi J. et al. // Biores. Technol. 2016. V. 218. P. 69.
Мамлеева Н.А., Шумянцев А.В., Лунин В.В. // Журн. физ. химии. 2020. Т. 94. № 3. С. 526.
Шарыпов В.И., Гришечко Л.И., Тарасова Л.С. и др. // J. Siberian Federal Univ. Chemistry. 2011. V. 3. № 4. Р. 221.
Jakab E., Faix O., Till F. // J. Anal. Appl. Pyrol. 1997. V. 40–41. P. 171.
Wang S., Ru B., Lin H., Sun W. // Fuel. 2015. V. 150. P. 243.
Carrier M., Loppinet-Serani A., Denux D. et al. // Biomass&Bioenergy. 2011. V. 35. P. 298.
Лоскутов С.Р., Шапченкова О.А., Анискина А.А. // Сибирский лесной журн. 2015. № 6. С. 17.
Labbé N., Kline L. M., Moens L. et al. // Biores. Technol. 2012. V. 104. P. 701.
Yang H., Yan R., Chen H. et al. // Fuel. 2007. V. 86. P. 1781.
Zhang J., Feng L., Wang D. et al. // Biores. Technol. 2014. V. 153. P. 379.
Tsujiyama S., Miyamori A. // Thermochim. Acta. 2000. V. 351. P. 177.
Chen Y. Duan., J., Luo Y.-H. // J. Anal. Appl. Pyrolysis. 2008. V. 83. P. 165.
Laryea-Goldsmith R. and Woolard C. // Renewable Energy. 2013, Article ID 508965. https://doi.org/10.1155/2013/508965
Di Blasi C. Progress in Energy and Combustion Science. 2008. V. 34. P. 47.
Faix O., Böttcher J.H. // Holz als Roh- und Werkstoff. 1992. V. 50. P. 221.
Schwanninger M., Rodrigues J.C., Pereira H., Hinterstoisser B. // Vibr. Spectr. 2004. V. 36. № 1. P. 23.
Kushnir E.Y., Autlov S.A., Bazarnova N.G. // Russ. J. Bioorg. Chem. 2015. V. 41. № 7. P. 713.
Kádár Z., Shultz-Jensen N., Jensen J.S. et al. // Biomass. Bioenergy. 2015. V. 81. P. 26.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии