Журнал физической химии, 2021, T. 95, № 5, стр. 754-757
Жидкофазный синтез 1,2-дигидропиридазин-3,6-диона в присутствии ионитных катализаторов
С. А. Джумадуллаева a, *, А. Б. Баешов a
a Международный казахско-турецкий университет имени Ходжи Ахмеда Ясави
Туркестан, Республика Казахстан
* E-mail: sveta.jumadullayeva@ayu.edu.kz
Поступила в редакцию 24.06.2020
После доработки 24.06.2020
Принята к публикации 10.09.2020
Аннотация
Изучена каталитическая активность синтетических ионообменных смол в реакции цис-бутендиовой кислоты с гидразином (водная среда, температура 95°С, 2–4 ч) с образованием гетероциклического гидразида – 1,2-дигидропиридазин-3,6-диона. Установлено, что наиболее эффективными катализаторами процесса являются катиониты КУ-2-8 и КРФ-10П. На основании ИК-спектроскопических исследований предложен вероятный механизм процесса с образованием адсорбционных комплексов с участием фиксированных полимерносвязанных сульфониевых ионов и противоионов катионита.
1,2-Дигидропиридазиндионы и их производные находят широкое применение в качестве лекарственных препаратов, обладающих антивирусной, кардиотонической, седативной, антибактериальной, анальгетической активностью, регуляторов роста растений, гербицидов, инсектицидов, полимерных и композиционных материалов, используются при создании флуоресцентных красок электропроводящих слоев органических светодиодов [1, 2]. Так например, 1,2-дигидропиридазин-3,6-дион является эффективным гербицидом и активным стимулятором роста растений [3]. На его основе осуществляется синтез ряда других физиологически активных веществ [4].
Синтез пиридазина и его диоксопроизводных осуществляют из 1,4-дикарбонильных соединений и гидразина по методу Пааля–Кнорра в присутствии серной кислоты или кислотной ионообменной смолы Амберлит 15 [5]. В работе [4] синтез 1,2-дигидропиридазин-3,6-диона осуществляют конденсацией 2,5-фурандиона с гидразином в ДМФА или спирте с последующей внутримолекулярной дегидратацией промежуточного моногидразида цис-бутендиовой кислоты в присутствии концентрированной серной кислоты.
Более перспективным представляется синтез гетероциклических гидразидов, осуществляемый в водной среде под действием твердых ионитных катализаторов [6]. Однако в литературе отсутствуют сведения о каталитических свойствах ионитов в синтезе 1,2-дигидропиридазиндионов, а также о механизме реакции. Использование твердой ионообменной смолы в качестве катализатора имеет ряд преимуществ: катализатор легко отделяется от продуктов реакции, не требует нейтрализации и концентрирования, высокая селективность в отношении целевого продукта, смолу можно использовать многократно после соответствующей обработки, исключается возможность коррозии аппаратуры [7, 8].
Целью настоящей работы является изучение каталитической активности ряда синтетических ионитов в реакции цис-бутендиовой кислоты с водным гидразином, а также выявление оптимальных условий и механизма процесса.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В качестве катализаторов использовали высокоосновный анионит АВ-17-8 (размер зерен 0.4–0.6 мм), слабоосновные аниониты АН-31 (0.4–2.0 мм), АН-1 (0.45–0.50 мм), сильнокислотный сульфокатионит КУ-2-8 (0.40–0.55 мм), фосфорнокислотный катионит КРФ-10П (0.5–1.0 мм), которые изготовлены АО “Олайнский химический завод Биолар” (Латвия). Иониты кондиционировали и переводили в H+ (OH–)-форму по методу [9]. Обменную емкость ионитов определяли в статических условиях по методу [10].
Опыты проводили в статической системе в термостатированном стеклянном реакторе обьемом 250 см3, снабженном механической мешалкой, термометром и обратным холодильником. К водному раствору цис-бутендиовой кислоты добавляли гидразингидрат, воздушно-сухой ионит и перемешивали в течение 2–4 ч, нагревая на водяной бане при температуре 95°С. По истечении данного времени смесь охлаждали и отфильтровывали ионит от жидкой части. Водную фракцию упаривали досуха, сухой остаток перекристаллизовывали из абсолютного спирта. ИК-спектры исходных веществ и продукта реакции с KBr снимали на спектрометре Impact-410 фирмы “Melles Griot” (США) в области 400–4000 см–1. Фотоколориметрический анализ выполнен на приборе Флюорат-02-5М (Люмэкс, Россия) [11].
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В изученных условиях основным продуктом реакции цис-бутендиовой кислоты (БК) с гидразингидратом (ГГ) был 1,2-дигидропиридазин-3,6-дион (ДПД)
Как видно из табл. 1, все испытанные катализаторы активны в изучаемом процессе – конверсия БК составляет 84–93%, а выход ДПД 33–90%. Наибольшой выход ДПД (79–90%) при селективности конверсии БК в ДПД 94–97.8% получен на ионитах КУ-2-8 и КРФ-10П. При переходе от кислотных катионитов КУ-2-8 и КРФ-10П к основным анионитам АВ-17-8, АН-31 и АН-1 наблюдается заметное снижение активности и селективности катализаторов. Проявление каталитической активности анионитов в реакции, протекающей обычно в присутствии катализаторов кислотного характера, по-видимому, связано с модифицирующим влиянием субстрата – гидразингидрата [6]. Введение в реакционную смесь сильноосновного гидразингидрата нивелирует каталитическое действие ионитов с различными кислотно-основными свойствами.Таблица 1.
Каталитическая активность ионитов в реакции гидразинолиза цис-бутендиовой кислоты (БК : ГГ : Kт : Н2О = 1 : 1.44 : 2 : 16, 95°С, 3 ч; Q – обменная емкость ионита)
| Катализатор | Q, мг-экв г–1 | Конверсия БК, % | Выход ДПД, % |
|---|---|---|---|
| АВ-17-8 | 3.7 | 84 | 41 |
| АН-31 | 3.8 | 86 | 39 |
| АН-1 | 3.6 | 87 | 33 |
| КУ-2-8 | 4.0 | 93 | 90 |
| КРФ-10П | 3.9 | 92 | 79 |
Кроме состава и структуры на активность и селективность ионитов значительное влияние оказывают условия их использования. Как видно из табл. 2, для сульфокатионита КУ-2-8 в Н-форме в зависимости от времени контакта, соотношения реагентов и количества катализатора выход ДПД изменяется в пределах от 32 до 90% . Оптимальными условиями синтеза ДПД при 95°С являются: продолжительность опыта 3 ч, массовое соотношение реагентов БК : N2H4 : Kт : Н2О = = 1 : 1.44 : 2 : 16.
Таблица 2.
Синтез 1,2-дигидропиридазин-3,6-диона на катионите КУ-2-8 (Н) (95°С)
| БК : ГГ : Kт : Н2О | τ, ч | Выход ДПД, % | БК : ГГ : Kт : Н2О | τ, ч | Выход ДПД, % |
|---|---|---|---|---|---|
| 1 : 1.44 : 1 : 16 | 3.0 | 76 | 1 : 0.80 : 2 : 16 | 3.0 | 63 |
| 1 : 1.44 : 2 : 16 | 3.0 | 90 | 1 : 0.96 : 2 : 16 | 3.0 | 75 |
| 1 : 1.44 : 3 : 16 | 3.0 | 61 | 1 : 1.60 : 2 : 16 | 3.0 | 78 |
| 1 : 1.44 : 4 : 16 | 3.0 | 56 | 1 : 1.44 : 2 : 8 | 3.0 | 60 |
| 1 : 1.44 : 2 : 16 | 2.0 | 32 | 1 : 1.44 : 2 : 10 | 3.0 | 68 |
| 1 : 1.44 : 2 : 16 | 2.5 | 80 | 1 : 1.44 : 2 : 12 | 3.0 | 74 |
| 1 : 1.44 : 2 : 16 | 4.0 | 85 | 1 : 1.44 : 2 : 20 | 3.0 | 89 |
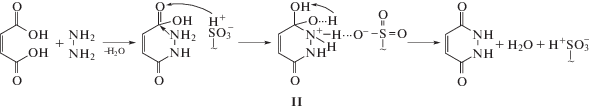
Согласно работам [1, 4] можно предположить, что реакция протекает через образование промежуточного моногидразида БК. Механизм взаимодействия цис-бутендиовой кислоты с гидразином включает в себя присоединение нуклеофила (NH2NH2) по π-связи карбонильной группы, с последующим отщеплением уходящей группы (OH) в интермедиате I, с образованием моногидразида цис-бутендиовой кислоты
Следует отметить, что дальнейшая внутримолекулярная дегидратация моногидразида цис-бутендиовой кислоты осуществляется в присутствии кислотного катализатора КУ-2-8 в Н-форме. Из литературных данных [12, 13], можно предположить, что реакция внутримолекулярной дегидратации на сульфокатионите КУ-2-8 (Н) происходит по гетерогенному катализу, где за протекание процесса отвечают фиксированные полимерносвязанные сульфониевые ионы и ионы водорода $\begin{gathered} {{{\text{H}}}^{ + }}{\text{SO}}_{3}^{ - } \\ | \\ \sim \\ \end{gathered} $.Переносчиками через границу раздела фаз в катионитах являются протоны. Поэтому адсорбция на катионитах осуществляется в результате переноса протона. По-видимому, присоединение протона катионита к атому кислорода С=О-группы моногидразида активирует карбонильную группу с образованием гидроксила и приводит к увеличению положительного заряда на атоме углерода, что способствует атаке нуклеофилом. Присоединение нуклеофила (NH2-группы) к углероду карбонильной группы обычно влечет за собой замыкание цикла и последующую быструю дегидратацию образующегося циклического интермедиата II
Существенную роль в понимании механизма реакции играют ИК спектроскопические исследования. В ИК-спектре взаимодействия БК с катионитом КУ-2-8 в Н-форме отсутствуют очень интенсивная полоса поглощения при 1740 см–1, характеризующая валентное колебание карбонильной группы и полоса поглощения при 900 см–1, относящаяся к неплоскостному деформационному колебанию ОН-группы цис-бутендиовой кислоты (рис. 1). В то же время появились очень интенсивные полосы около 1622 см–1 и 1603 см–1 соответствующие валентным колебаниям C=O- и С=С-групп дигидропиридазиндиона. Кроме того, на фоне собственных полос катионита появились интенсивные полосы с частотами около 1406, 1451, 1500 см–1 и ряд полос в диапазоне 3100–3200 см–1, которые относятся к симметричным и антисимметричным колебаниям адсорбционного комплекса ${\text{ > NH}}_{2}^{ + }$ иона дигидропиридазина с сульфогруппой катионита $\begin{gathered} {\text{ > NH}}_{2}^{ + }{\text{SO}}_{3}^{ - } \\ | \\ \sim \\ \end{gathered} $ [13–15]. Непрерывное поглощение в области 2000–2400 см–1 и 2400–3200 см–1 можно охарактеризовать образованием прочных мостиковых водородных связей между группами ${\text{ > NH}}_{2}^{ + }$ ионов дигидропиридазина и атомами кислорода сульфогруппы [13, 16]. Следовательно, в случае адсорбции ${\text{ > NH}}_{2}^{ + }$ иона дигидропиридазина катионитом, мостиковые Н-связи между сульфокислотными группами разрушаются, протоны присоединяются к кислороду карбонильной группы с образованием гидроксильных ионов, а сульфогруппы блокируются по типу $\begin{gathered} {\text{ > NH}}_{2}^{ + }{\text{SO}}_{3}^{ - } \\ | \\ \sim \\ \end{gathered} $ (интермедиат II). Можно полагать, что адсорбционный комплекс $\begin{gathered} {\text{ > NH}}_{2}^{ + }{\text{SO}}_{3}^{ - } \\ | \\ \sim \\ \end{gathered} $ распадается в результате переноса протона от NH2-группы к полимерносвязанной сульфогруппе с образованием целевого дигидропиридазиндиона и регенерацией активного центра катионита.Рис. 1.
ИК-спектры цис-бутендиовой кислоты (1) и продукта ее взаимодействия с катионитом КУ-2-8 в Н-форме (2).

Аналогичный механизм предложен для этерификации и гидролиза бензамида в присутствии катионита КУ-2-8, осуществляющийся через циклические переходные состояния с образованием комплекса ионов аммония с сульфогруппами катионита [12].
Сульфокислотный катионит КУ-2-8 после использования легко регенерируется с помощью 10%-ного раствора серной кислоты и сохраняет высокую каталитическую активность, что обеспечивает его многократное применение.
Таким образом, установлено, что наиболее эффективными катализаторами для селективного гидразинолиза цис-бутендиовой кислоты являются ионообменные смолы с кислотными свойствами КУ-2-8 и КРФ-10П. При этом конверсия цис-бутендиовой кислоты составила 84–93%, а выход ДПД – 79–90%. Найдены условия каталитического синтеза 1,2-дигидропиридазин-3,6-диона на катионите КУ-2-8 (Н) водной среде, обеспечивающие выход ДПД до 90%.
На основании результатов ИК-спектроскопических исследований предложен вероятный механизм реакции с участием фиксированных сульфониевых ионов и противоионов катионита.
Список литературы
Rubinstein H., Parnarouskis M. // J. Org. Chem. 1971. V. 38. № 12. P. 2166.
Ünal D., Sarıpınar E., Akçamur Y. // Turk. J. Chem. 2006. V. 30. P. 691.
Rizal G., Karki S., Garcia R. et al. // Plos One. 2015. V. 10. № 4. https://doi.org/10.1371/journal.pone.0125092
Vishnu J.R., Arun S., Ramendra P. The Chemistry of Heterocycles. Elsevier. 2019. 503 p. https://doi.org/10.1016/C2018-0-04877-X
Scott L.T., Naples J.O. // Synthesis. 1973. V. 4. P. 209.
Джумакаев К.Х., Исаков Я.И., Джумадуллаева С.А. и др. // Кинетика и катализ. 1988. Т. 29. № 1. С. 216.
Джумадуллаева С.А., Алтынбекова М.О. // Журн. физ. химии. 2013. Т. 87. С. 1978. https://doi.org/10.1134/S0036024413110083
Джумадуллаева С.А., Баешов А.Б. // Журн. общ. химии. 2019. Т. 89. № 2. С. 187.https://doi.org/10.1134/S1070363219020038
ГОСТ 10896-7. Иониты. Подготовка к испытанию. М.: Изд-во стандартов. 1998. 7 с.
Полянский Н.Г. Катализ ионитами. М.: Химия, 1973. 216 с.
Смоленков А.Д., Родин И.А., Шпигун О.А. // Журн. аналит. химии. 2012. Т. 67. № 2. С. 133.
Джумакаев К.Х., Май И.И., Бекова Н.С. // Кинетика и катализ. 1989. Т. 30. № 6. С. 1491.
Цундель Г. Гидратация и межмолекулярное взаимодействие. Исследование полиэлектролитов методом инфракрасной спектроскопии. М.: Мир, 1969. 310 с.
Dzhumadullaeva S.A., Baeshov A.B. Reports of the National Academy of Sciences of the Republic of Kazakhstan. Series Chemistry and Technology. 2017. V. 426. № 6. P. 87. https://doi.org/10.32014/2018.2518-1483
Накамото К. ИК-спектры и спектры КР неорганических и координационных соединений. М.: Мир, 1991. 536 с.
Киселев А.В., Лыгин В.И. Инфракрасные спектры поверхностных соединений и адсорбированных веществ. М.: Наука, 1972. 459 с.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии