Журнал физической химии, 2021, T. 95, № 6, стр. 955-957
Фазовые равновесия в трехкомпонентной системе NaCl–NaBr–Na2CrO4
М. А. Демина a, Е. М. Егорова a, *, И. К. Гаркушин a, А. В. Бурчаков a, Е. О. Игнатьева a
a Самарский государственный технический университет
Самара, Россия
* E-mail: dvoryanova_kat@mail.ru
Поступила в редакцию 08.08.2020
После доработки 08.08.2020
Принята к публикации 09.09.2020
Аннотация
Изучены фазовые равновесия в трехкомпонентной системе NaCl–NaBr–Na2CrO4. Экспериментальные исследования проводили методом дифференциального термического анализа (ДТА) с использованием АЦП, преобразующего сигнал с платина-платинородиевых термопар, изготовленных из термоэлектродной проволоки ГОСТ 10821-64. Точность измерения температур составляла ±2.5°С, при точности взвешивания составов 0.5% на аналитических весах VIBRA HT-220 CE. На кривых ДТА охлаждения составов, при постоянном содержании хромата натрия 82 экв.%, отмечены термоэффекты, характерные первичной кристаллизации хромата натрия и совместной кристаллизации его с твердыми растворами NaClxBr1 – x. На моновариантной кривой, отвечающей совместной кристаллизации, экстремумов не обнаружено.
Исследование многокомпонентных систем и построение фазовых диаграмм, выявление характера взаимодействия между веществами позволяет определить различные свойства компонентов и смесей на их основе [1–3]. Особый интерес представляют солевые расплавы и твердые растворы на их основе, такие как галогениды и хроматы s1-элементов. Изучение этих систем позволяет выявить низкоплавкие нонвариантные смеси, обладающие высокой электропроводностью, термостойкостью, низкой летучестью, малым коэффициентом объемного расширения при фазовом переходе [4]. Эти свойства необходимы для получения расплавляемых электролитов для химических источников тока с рабочей температурой в диапазоне 300–600°С. Солевые смеси находят также и другие области применения, например, флюсы для сварки и пайки, теплоаккумулирующие материалы, среды для выращивания монокристаллов, среды для органического синтеза [5–15].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Объектом исследования является трехкомпонентная система NaCl–NaBr–Na2CrO4 (рис. 1). Входящие в нее две двухкомпонентные системы NaCl–Na2CrO4 и NaBr–Na2CrO4 эвтектического типа и одна двухкомпонентная система NaCl–NaBr с образованием непрерывного ряда твердых растворов (НРТР) с минимумом при 740°С [16, 17].
Экспериментальные исследования проводили методом дифференциального термического анализа (ДТА) в стандартном исполнении [18]. Использованы реактивы следующих квалификаций: “х.ч.” (NaBr, Na2CrO4), “ч.д.а.” (NaCl). Все реактивы были предварительно обезвожены. Температуры плавления, полиморфного превращения (${{Т}_{{\alpha \rightleftarrows \beta }}}$(Na2CrO4) = 423°С) индивидуальных солей соответствовали справочным данным [19]. Составы в работе выражены в молярных долях эквивалентов (экв. %).
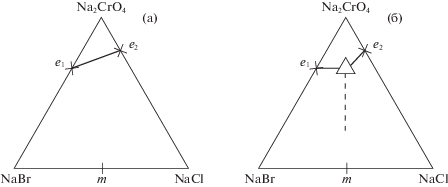
Анализ элементов огранения (двухкомпонентных систем) исследуемой системы позволил предположить следующие варианты ликвидусов (рис. 1):
1) если НРТР NaClxBr1 – x не распадается внутри системы, то ликвидус будет представлен двумя полями кристаллизации: Na2CrO4 и НРТР NaClxBr1 – x (рис. 1, вариант 1);
2) если НРТР NaClxBr1 – x претерпевает разрыв сплошности (распадается внутри тройной системы), то возможна следующая модель ликвидуса (рис. 1, вариант 2). По этой модели может образовываться тройная эвтектика.
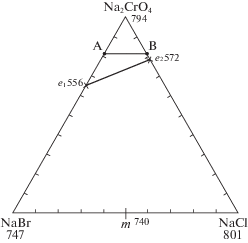
Подтверждение варианта модели ликвидуса проводили методом ДТА. Для экспериментального исследования системы NaCl–NaBr–Na2CrO4 в поле кристаллизации хромата натрия выбран политермический разрез АВ (А[18%NaBr + + 82%Na2CrO4], В[18%NaCl + 82%Na2CrO4]). Проекция ликвидуса на треугольник составов системы и расположение разреза АВ представлены на рис. 2.
Рис. 2.
Проекция ликвидуса на треугольник составов трехкомпонентной системы NaCl–NaBr–Na2CrO4 и расположение разреза АВ.
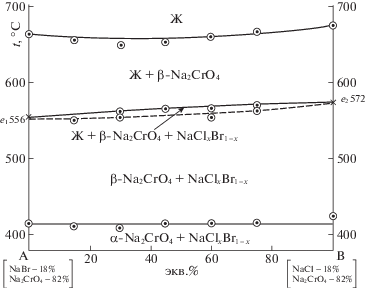
Экспериментальная Т–х-диаграмма разреза АВ приведена на рис. 3. На кривых ДТА охлаждения составов, соответствующих разрезу АВ, отмечены термоэффекты, характерные первичной кристаллизации хромата натрия и совместной кристаллизации его с твердыми растворами NaClxBr1 – x. Также на кривых охлаждения отмечены термоэффекты, характерные полиморфному превращению хромата натрия.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Таким образом, термоэффект в солидусной области Т–х-диаграммы политермического разреза АВ при температуре 417 ± 5°С отвечает полиморфному превращению хромата натрия (рис. 3), однако это несколько ниже справочных данных (423°С). Поскольку температуры плавления всех солей в тех же условиях эксперимента совпадали со справочными данными (с учетом точности измерения температур ±2.5°С), расхождение значения температуры полиморфного превращения можно объяснить наличием в смеси твердого раствора замещения NaClxBr1 – x. Запись кривой ДТА чистого компонента хромата натрия показала пик, начало которого отвечает температуре 423°С. Необходимо также отметить, что процесс кристаллизации твердого раствора происходит в небольшом диапазоне температур, что на кривой ДТА отражалось либо в виде двух наложенных друг на друга пиков, либо в виде одного пика. На кривой температуры при этом площадки, как при кристаллизации индивидуальной соли, не наблюдалось. Окончанию кристаллизации твердого раствора отвечает кривая на рис. 3, нанесенная пунктиром.
Таким образом, в трехкомпонентной системе NaCl–NaBr–Na2CrO4 отсутствуют точки нонвариантного равновесия, продуктами кристаллизации являются две фазы – хромат натрия и твердые растворы на основе хлорида и бромида натрия. Ликвидус системы NaCl–NaBr–Na2CrO4 представлен двумя полями кристаллизации: хромата натрия и НРТР на основе хлорида и бромида натрия. Фазовая реакция, протекающая на всей моновариантной кривой е1е2:
Работа выполнена при финансовой поддержке Минобрнауки РФ в рамках проектной части государственного задания № 0778-2020-0005.
Список литературы
Ильин К.К., Черкасов Д.Г., Курский В.Ф. // Журн. физ. химии. 2010. Т. 84. № 3. С. 434.
Коливердов В.Ф. // Там же. 2010. Т. 84. № 8. С. 1427.
Шишалов В.И., Ковалевский А.В. // Там же. 2011. Т. 85. № 1. С. 113.
Masset P., Poinso J.-Y., Schoeffert S. etc. // J. of the Electrochemical Society. 2005. V. 152. № 2. P. A405-A410. https://doi.org/10.1149/1.1850861
Sveinbjörnsson D., Christiansen A.S., Viskinde R. etc. // Ibid. 2014. V. 161. № 9. P. A1432-A1439. https://doi.org/10.1149/2.1061409jes
Ковалевский А.В., Елькин О.В. // Журн. физ. химии. 2011. Т. 85. № 3. С. 570.
Козырев Н.А., Крюков Р.Е., Крюков Н.Е. и др. Черная металлургия. Бюллетень научно-технической и экономической информации. 2017. № 6 (1410). С. 95.
Васина Н.А., Грызлова Е.С., Шапошникова С.Г. Теплофизические свойства многокомпонентных солевых систем. М.: Химия, 1984. 112 с.
Semwal R., Ravi C., Kumar R. etc. // J. of Organ. Chemistry. 2019. V. 84. № 2. P. 792.https://doi.org/10.1021/acs.joc.8b02637
Ge J., Wang S., Hu L. et al. // Carbon. 2016. V. 98. P. 649. https://doi.org/10.1016/j.carbon.2015.11.065
Данилов В.П., Фролова Е.А., Кондаков Д.Ф. и др. // Журн. неорган. химии. 2019. Т. 64. № 9. С. 984.
Расулов А.И., Ахмедова П.А., Гаматаева Б.Ю. // Там же. 2019. Т. 64. № 1. С. 99.
Игнатьева Е.О., Дворянова Е.М., Гаркушин И.К. // Там же. 2017. Т. 62. № 2. С. 245–248. [Ignat’eva E.O., Dvoryanova E.M., Garkushin I.K. // Ibid. 2017. V. 62. № 2. P. 236–239. doi: 10.1134/S0036023617020073].
Ghosh S., Ganesan R., Sridharan R. et al. // J. of Phase Equilibria and Diffusion. 2018. V. 39. № 6. P. 916–932. https://doi.org/10.1007/s11669-018-0695-3
Ghosh S., Ganesan R., Sridharan R. et al. // Thermochimica acta. 2017. V. 653. P. 16. https://doi.org/10.1016/j.tca.2017.03.024
Посыпайко В.И., Алексеева Е.А. Диаграммы плавкости солевых систем. Ч. III. Двойные системы с общим катионом. М.: Металлургия, 1979. 204 с.
Воскресенская Н.К., Евсеева Н.Н., Беруль С.И. и др. Справочник по плавкости систем из безводных неорганических солей. М.: Изд-во АН СССР, 1961. Т. 1. 845 с.
Егунов В.П. Введение в термический анализ. Самара, 1996. 270 с.
Термические константы веществ. Справочник // Под ред. В.П. Глушко. М.: ВИНИТИ. 1981. Вып. X. Ч. 2. 300 с.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии