Журнал физической химии, 2021, T. 95, № 6, стр. 947-954
Влияние неорганических анионов на процесс фотохимической деструкции азокрасителей
М. Р. Сизых a, А. А. Батоева a, *, В. А. Мункоева a
a Российская академия наук, Сибирское отделение, Байкальский институт природопользования
Улан-Удэ, Россия
* E-mail: abat@binm.ru
Поступила в редакцию 06.07.2020
После доработки 12.10.2020
Принята к публикации 16.10.2020
Аннотация
Изучено влияние анионов (гидрокарбонатов, хлоридов, нитратов, сульфатов) на кинетику окисления красителя метилового оранжевого в комбинированной системе УФ/S2O$_{8}^{{2 - }}$/Fe2+, с использованием УФ-излучения KrCl-эксилампы (222 нм). Установлено, что введение в раствор гидрокарбонатов и нитратов ингибирует процесс минерализации растворенного органического углерода. В присутствии хлоридов (10 мМ) и сульфатов (1–100 мМ) наблюдается увеличение степени минерализации с 31 до 60%. В реальных водных матрицах (природной воде и сточной воде от процесса крашения меха) окислительный процесс существенно ингибируется. В природной поверхностной воде этот эффект обусловлен преимущественно влиянием гидрокарбонатов, а в сточной воде – многокомпонентным характером водной матрицы, включающей технологические примеси.
Усовершенствованные окислительные процессы – AOPs (Advanced Oxidation Processes), базирующиеся на фотолизе, сонолизе, озонировании, в каталитических системах и их сочетании, высокоэффективны для удаления токсичных и биорезистентных загрязнителей различной химической природы [1–5]. При использовании АОРs многие стойкие органические вещества окисляются до нетоксичных соединений и в конечном итоге минерализуются до СО2 и Н2О [1, 2, 6–8]. Как правило, основными активными формами кислорода (АФК), участвующими в процессе, являются гидроксильные радикалы [4]. Однако неселективность ОН-радикалов – высокие скорости реакций их взаимодействия как с “таргетными” соединениями, так и с компонентами реальных водных матриц, является лимитирующим фактором применения комбинированных окислительных методов, на их основе [9, 10]. В связи с этим все большее внимание исследователей привлекают окислительные системы, в которых основными активными формами кислорода являются высокореакционноспособные сульфатные анион-радикалы (E0 = 2.5–3.1 В), отличающиеся селективностью [11, 12] и более длительным временем существования в растворе (30–40 мкс) [11].
Сульфатные анион-радикалы формируются в растворах при активации персульфатов или пероксимоносульфатов ультрафиолетовым излучением (УФ), ультразвуковым или термическим воздействием, при взаимодействии с ионами переходных металлов или некоторыми органическими соединениями, в сильно щелочной среде [13, 14]. Фотохимические процессы просты в реализации и позволяют достичь высокой эффективности деградации органических соединений. Дополнительное использование катализаторов – переходных металлов, приводит к увеличению скорости реакции окисления загрязнителей и их минерализации [15].
В качестве источников УФ-излучения в основном используют ртутные лампы низкого давления (λmax = 254 нм). Однако общемировая тенденция по сокращению использования ртути в промышленности и быту способствует разработке новых источников УФ-излучения, таких как эксилампы, светодиодные лампы и др. [16, 17]. Газоразрядные эксилампы имеют спектр с узкой полосой излучения, поэтому их называют квазимонохромными.
Анализ литературных данных [9, 10, 18–20] показал, что степень и характер влияния компонентов реальных водных матриц на процессы окислительной деструкции органических соединений в комбинированных системах, основанных на использовании в качестве окислителей персульфатов, определяется не только природой удаляемых загрязнителей, концентрацией анионов, но и способом активации персульфата. Ранее была показана высокая эффективность использования квазимонохроматического УФ-излучения KrCl-эксилампы (λmax = 222 нм) для активации персульфата в процессах окислительной деструкции азокрасителей [21]. Настоящая работа является продолжением исследования и посвящена изучению влияния анионов (гидрокарбонатов, хлоридов, нитратов, сульфатов), наиболее характерных для природных и сточных вод, на кинетику фотохимической деструкции азокрасителей в комбинированной Фентон-подобной окислительной системе УФ/S2O$_{8}^{{2 - }}$/Fe2+.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Исследования проводили на растворах кислотного азокрасителя метилового оранжевого ([4-(4-диметиламинофенилазо) бензолсульфонат натрия]) с концентрацией 30 мкМ, приготовленных на различных водных матрицах:
– дистиллированной воде (рН 5.7 ± 0.2, УЭП 2 мкСм см–1);
– природной поверхностной воде р. Селенга (рН 8.3 ± 0.2, HCO$_{3}^{ - }$ 76.25 ± 9.15 мг/л, Cl– 1.30 ± ± 0.17 мг/л, NO$_{3}^{ - }$ 0.205 ± 0.037 мг/л, SO$_{4}^{{2 - }}$ 11.27 ± ± 1.47 мг/л; Feобщ 0.372 ± 0.089 мг/л, ХПК 31 ± ± 9.3 мгО/л, растворенный органический углерод (РОУ) 6.25 ± 1.25 мг/л);
– реальной сточной воде – промывной воде от крашения меха (рН 2.7, ХПК 420 мгО/л, РОУ 210 мг/л).
Концентрацию анионов варьировали в диапазоне 1–100 мМ.
Эксперименты по изучению влияния анионов в модельных водных растворах, приготовленных на дистиллированной воде, проводили при оптимальных условиях, установленных ранее для деструкции красителя метилового оранжевого (МО) в комбинированной системе УФ/S2O$_{8}^{{2 - }}$/Fe2+: [Fe2+] : [MO] : [S2O$_{8}^{{2 - }}$] = 6 : 1 : 6, без корректировки реакции среды [21].
Для корректировки исходной реакции среды природной воды использовали 0.1% раствор серной кислоты.
Исследования проводили на установке, подробно описанной ранее [21]. В качестве источника излучения использовали KrCl-эксилампу (λmax = 222 нм, 23 Вт, KrCl_BD_P model, ЗАО “Эксилампы”, г. Томск) с интенсивностью поглощенного излучения 0.82 мВт см–2, измеренной методом химической актинометрии с атразином [22].
В работе использовали следующие реактивы: метиловый оранжевый (99.9%, Merck, Germany), персульфат калия (>99%, Sigma–Aldrich, USA), сульфат железа (II) (100%, Scharlab, Spain), сульфат натрия, хлорид натрия, нитрат натрия, карбонат натрия (ООО “Химреактивснаб”, Россия). Для измерения реакции среды использовали портативный прибор Multi 3410 с электродом SenTix®940(WTW). Изменение концентрации красителя в растворе контролировали методом ВЭЖХ (Agilent 1260 Infinity с диодно-матричным УФ-детектором, колонка Zorbax SB-C18 4.6 × 150 мм). Объем пробы 50 мкл, температура 35°С, элюент – ацетонитрил: 75 мМ раствор уксусной кислоты (40 : 60). Скорость потока 0.5 мл/мин. Перед анализом пробы доводили до рН 7–8 0.1% раствором NaOH и фильтровали через мембранные фильтры ФМПТФЭ-0.45 мкм (ЗАО “Владисарт”).
Концентрацию красителя в реальной сточной воде определяли спектрофотометрическим методом при характеристической длине волны (463 нм).
Степень минерализации органических субстратов оценивали по изменению содержания растворенного органического углерода, определяемого на приборе Shimadzu TOC-L CSN (предел обнаружения 50 мкг л–1). Калибровку прибора проводили по стандартным образцам бифталата калия и двууглекислого натрия.
Эффективность процесса окисления и степень минерализации оценивали по изменению концентрации красителя метилового оранжевого (МО) и РОУ в обрабатываемом растворе по формуле:
где С0 и Сτ − исходная и в момент времени τ (мин) концентрация МО или РОУ соответственно.Значение ХПК определяли с использованием бихроматного метода. Окисление проб проводили в ХПК-реакторе DRB200 (Hach, Германия) с прямым считыванием результатов с помощью портативного колориметра DR-890 (Hach, Германия).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Влияние анионов
Типичными компонентами реальных водных матриц – природных и сточных вод, оказывающими влияние на кинетику и эффективность окислительной деструкции органических соединений, являются гидрокарбонаты, хлориды, нитраты, сульфаты.
Известно, что гидрокарбонаты с высокой скоростью реагируют практически со всеми радикалами и, следовательно, оказывают существенное влияние на эффективность комбинированных окислительных процессов [23]. Экспериментально установлено, что гидрокарбонаты в рассмотренном концентрационном диапазоне (1–100 мМ) значительно ингибируют процесс окисления метилового оранжевого в системе УФ/S2O$_{8}^{{2 - }}$/Fe2+ (рис. 1). Так, в присутствии гидрокарбонатов начальная скорость реакции окисления (W0) “таргетного” соединения снизилась с 6.1 до 2.3 мкМ мин–1 (в 2.6 раза), эффективность окисления МО – со 100% до 60%, а минерализации РОУ не наблюдалось (табл. 1).
Рис. 1.
Влияние анионов на окисление красителя метилового оранжевого в комбинированной системе УФ/S2O$_{8}^{{2 - }}$/Fe2+; [Fe2+] = 180 мкМ, [S2O$_{8}^{{2 - }}$] = 180 мкМ; концентрация анионов, мМ: 0 (1), 1 (2), 10 (3), 50 (4), 100 (5); СМО – концентрация МО, α – доза излучения.

Таблица 1.
Влияние гидрокарбонатов на процесс окисления МО в комбинированной системе УФ/S2O$_{8}^{{2 - }}$/Fe2+; [Fe2+] = 180 мкМ, [S2O$_{8}^{{2 - }}$] = 180 мкМ, доза излучения 1.48 Дж см–2
| ${\text{HCO}}_{3}^{ - }$, мМ | W0, мкМ мин–1 | Х, % | рНисх – рНкон |
|---|---|---|---|
| 0 | 6.1 | 100 | 5.4–3.5 |
| 1 | 2.3 | 83 | 6.2–6.6 |
| 10 | 2.3 | 80 | 7.8–8.2 |
| 50 | 2.3 | 67 | 8.3–8.5 |
| 100 | 2.2 | 60 | 8.5–8.7 |
При окислении МО в системе УФ/S2O$_{8}^{{2 - }}$/Fe2+ реализуется сопряженный радикально-цепной механизм, с участием как сульфатных анион-радикалов, так и гидроксильных радикалов [21]. Он включает процессы активации персульфата Fe2+ и УФ-излучением:
(1)
${{{\text{S}}}_{2}}{\text{O}}_{8}^{{2 - }} + {\text{F}}{{{\text{e}}}^{{2 + }}} \to {\text{SO}}_{4}^{{ - \bullet }} + {\text{SO}}_{4}^{{2 - }} + {\text{F}}{{{\text{e}}}^{{3 + }}},$(2)
${{{\text{S}}}_{2}}{\text{O}}_{8}^{{2 - }} + {\text{F}}{{{\text{e}}}^{{3 + }}} \to 2{\text{SO}}_{4}^{{ - \bullet }} + {\text{F}}{{{\text{e}}}^{{2 + }}},$(3)
${{{\text{S}}}_{2}}{\text{O}}_{8}^{{2 - }}\;\mathop \to \limits^{h\nu } \;2{\text{SO}}_{4}^{{ - \bullet }},$(4)
${\text{SO}}_{4}^{{ - \bullet }} + {{{\text{H}}}_{{\text{2}}}}{\text{O}} \to {}^{ \bullet }{\text{OH}} + {\text{HSO}}_{4}^{ - },$(5)
${\text{F}}{{{\text{e}}}^{{3 + }}} + {{{\text{H}}}_{{\text{2}}}}{\text{O}} \to {\text{FeO}}{{{\text{H}}}^{{2 + }}} + {{{\text{H}}}^{ + }},$(6)
${\text{F}}{{{\text{e}}}^{{3 + }}} + {{{\text{(OOCR)}}}^{--}} \to {\text{Fe(OOCR}}{{{\text{)}}}^{{2 + }}},$(7)
${\text{FeO}}{{{\text{H}}}^{{2 + }}}\;\mathop \to \limits^{h\nu } \;{\text{F}}{{{\text{e}}}^{{2 + }}} + {}^{ \bullet }{\text{OH}},$(8)
${\text{Fe(OOCR}}{{{\text{)}}}^{{2 + }}}\;\mathop \to \limits^{h\nu } \;{\text{F}}{{{\text{e}}}^{{2 + }}} + {\text{C}}{{{\text{O}}}_{2}} + {{{\text{R}}}^{ \bullet }},$Кроме того, протекают реакции прямого фотолиза “таргетного” соединения и интермедиатов
При взаимодействии метилового оранжевого с АФК на первом этапе происходит разрыв азо-связи и образование нитро-соединений. Дальнейший окислительный процесс включает формирование многоатомных нитрофенолов, раскрытие ароматических колец, декарбоксилирование карбоновых кислот и выделение углекислого газа [26, 27].
Прежде всего, введение гидрокарбонатов приводит к “буферизации” раствора (табл. 1), сопровождающейся гидролизом ионов Fe2+, их дезактивацией и обрывом цепи в Фентон-подобной окислительной системе УФ/S2O$_{8}^{{2 - }}$/Fe2+. Наряду с этим происходит нецелевое расходование АФК, вследствие их взаимодействия с гидрокарбонатами с высокой скоростью
(10)
$\begin{gathered} {\text{SO}}_{4}^{{ - \bullet }} + {\text{HCO}}_{3}^{ - } \to {\text{SO}}_{4}^{{2 - }} + {\text{CO}}_{3}^{{ \bullet - }} + {{{\text{H}}}^{ + }} \\ k = 2.8 \times {{10}^{6}}\;{{{\text{M}}}^{{ - 1}}}\;{{{\text{с}}}^{{ - 1}}}\;[19], \\ \end{gathered} $(11)
$\begin{gathered} {\text{O}}{{{\text{H}}}^{ \bullet }} + {\text{HCO}}_{3}^{ - } \to {\text{CO}}_{3}^{{ \bullet - }} + {{{\text{H}}}_{{\text{2}}}}{\text{O}} \\ k = 8.6 \times {{10}^{6}}\;{{{\text{M}}}^{{ - 1}}}\;{{{\text{с}}}^{{ - 1}}}\;[19]. \\ \end{gathered} $Сведения о влиянии хлоридов на процесс окислительной деструкции акваполлютантов в комбинированных системах, основанных на использовании в качестве окислителей персульфатов, носят противоречивый характер. Во многих исследованиях сообщается об ингибирующем эффекте хлоридов, особенно при их высоких концентрациях [28, 29]. Это объясняется тем, что хлориды также способны с большой скоростью реагировать с образующимися в растворе гидроксильными радикалами и сульфатными анион-радикалами, и выступать в роли “радикальных ловушек” (реакции 12, 13). При активации персульфата ионами Fe2+ хлориды могут образовывать устойчивые комплексы с Fe3+, тем самым обрывать цикл восстановления железа в каталитической системе. В других работах [30, 31] при окислении смеси органических соединений, состоящей из бензола, толуола, этилбензола и ксиленов, термически активированным персульфатом, экспериментально подтверждено, что влияние хлоридов определяется не только природой окисляемого вещества, но и концентрацией анионов.
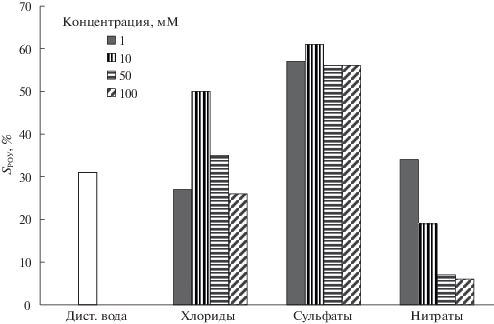
Экспериментально установлено, что хлориды с концентрацией до 1 мМ не влияют на скорость реакции окисления МО и степень минерализации РОУ в комбинированной системе УФ/S2O$_{8}^{{2 - }}$/Fe2+ (рис. 1, 2). Дальнейшее увеличение концентрации хлоридов сопровождается незначительным снижением начальных скоростей реакций окисления МО. При этом доза излучения, необходимая для полного превращения МО, практически не изменяется. Однако, необходимо отметить, что при концентрации хлоридов 10 мМ наблюдается значительное увеличение степени минерализации с 31% до 50% (рис. 2).
Рис. 2.
Влияние анионов на степень минерализации в комбинированной системе УФ/S2O$_{8}^{{2 - }}$/Fe2+; [Fe2+] = 180 мкМ, [S2O$_{8}^{{2 - }}$] = 180 мкМ, доза излучения 1.48 Дж см–2; S – минерализация.
Подобный эффект был установлен при окислении сульфометоксазола, карбамазепина, бисфенола-А при активации персульфата или пероксомоносульфата УФ-излучением [30, 31]. При этом методом лазерного флэш-фотолиза экспериментально доказано, что в растворе формируются хлорсодержащие радикалы ${\text{ClO}}{{{\text{H}}}^{{ \bullet --}}}$, ${\text{C}}{{{\text{l}}}^{ \bullet }}$, и ${\text{Cl}}_{2}^{{ \bullet - }}$, предположительно вследствие протекания реакций 12–19 [12]. Квантовохимические расчеты показали, что хлориды уменьшают энергию активации реакции образования сульфатных анион-радикалов из персульфатов [32], что также может являться причиной повышения степени минерализации РОУ.
(12)
$\begin{gathered} {\text{SO}}_{4}^{{ - \bullet }} + {\text{C}}{{{\text{l}}}^{--}}\;\underset{{k'}}{\overset{k}{\longleftrightarrow}}\;{\text{SO}}_{4}^{{2 - }} + {\text{C}}{{{\text{l}}}^{ \bullet }} \\ k = 2.0 \times {{10}^{8}}\;{{{\text{M}}}^{{--1}}}\;{{{\text{с}}}^{{--1}}}; \\ k{\kern 1pt} ' = 2.5 \times {{10}^{8}}\;{{{\text{M}}}^{{--1}}}\;{{{\text{с}}}^{{--1}}}, \\ \end{gathered} $(13)
$\begin{gathered} {\text{H}}{{{\text{O}}}^{ \bullet }} + {\text{C}}{{{\text{l}}}^{--}}\;\underset{{k'}}{\overset{k}{\longleftrightarrow}}\;{\text{ClН}}{{{\text{О}}}^{{ \bullet - }}} \\ k = 4.3 \times {{10}^{9}}\;{{{\text{M}}}^{{--1}}}\;{{{\text{с}}}^{{--1}}}, \\ k{\kern 1pt} ' = 6.1 \times {{10}^{9}}\;{{{\text{с}}}^{{--1}}}, \\ \end{gathered} $(14)
$\begin{gathered} {\text{C}}{{{\text{l}}}^{ \bullet }} + {\text{C}}{{{\text{l}}}^{--}}\;\underset{{k'}}{\overset{k}{\longleftrightarrow}}\;{\text{Cl}}_{2}^{{ \bullet - }} \\ k = 2.1 \times {{10}^{{10}}}\;{{{\text{M}}}^{{--1}}}\;{{{\text{с}}}^{{--1}}}, \\ k{\kern 1pt} ' = 1.1 \times {{10}^{5}}\;{{{\text{с}}}^{{--1}}}, \\ \end{gathered} $(15)
$\begin{gathered} {\text{C}}{{{\text{l}}}^{ \bullet }} + {{{\text{H}}}_{{\text{2}}}}{\text{O}}\;\underset{{k'}}{\overset{k}{\longleftrightarrow}}\;{\text{ClН}}{{{\text{О}}}^{{ \bullet - }}} + {{{\text{Н}}}^{ + }} \\ k = 2.1 \times {{10}^{{10}}}\;{{{\text{M}}}^{{--1}}}\;{{{\text{с}}}^{{--1}}}, \\ k{\kern 1pt} ' = 4.52 \times {{10}^{3}}\;{{{\text{M}}}^{{--1}}}\;{{{\text{с}}}^{{--1}}}, \\ \end{gathered} $(16)
$\begin{gathered} {\text{ClН}}{{{\text{О}}}^{{ \bullet - }}} + {{{\text{Н}}}^{ + }}\;\underset{{k'}}{\overset{k}{\longleftrightarrow}}\;{\text{C}}{{{\text{l}}}^{ \bullet }} + {{{\text{H}}}_{{\text{2}}}}{\text{O}} \\ k = 2.1 \times {{10}^{{10}}}\;{{{\text{M}}}^{{--1}}}\;{{{\text{с}}}^{{--1}}}, \\ k{\kern 1pt} ' = 1.3 \times {{10}^{3}}\;{{{\text{M}}}^{{--1}}}\;{{{\text{с}}}^{{--1}}}, \\ \end{gathered} $(17)
$\begin{gathered} {\text{C}}{{{\text{l}}}^{ \bullet }} + {\text{H}}{{{\text{O}}}^{ - }}\;\xrightarrow{k}\;{\text{ClН}}{{{\text{О}}}^{{ \bullet - }}} \\ k = 1.8 \times {{10}^{{10}}}\;{{{\text{M}}}^{{--1}}}\;{{{\text{с}}}^{{--1}}}, \\ \end{gathered} $(18)
$\begin{gathered} {\text{ClН}}{{{\text{О}}}^{{ \bullet - }}} + {\text{C}}{{{\text{l}}}^{--}}\;\underset{{k'}}{\overset{k}{\longleftrightarrow}}\;{\text{Cl}}_{2}^{{ \bullet - }} + {\text{H}}{{{\text{O}}}^{ - }} \\ k = {{10}^{4}}\;{{{\text{M}}}^{{--1}}}\;{{{\text{с}}}^{{--1}}}; \\ k{\kern 1pt} ' = 4.5 \times {{10}^{7}}\;{{{\text{M}}}^{{--1}}}\;{{{\text{с}}}^{{--1}}}, \\ \end{gathered} $(19)
$\begin{gathered} {\text{Cl}}_{2}^{{ \bullet - }} + {{{\text{H}}}_{{\text{2}}}}{\text{O}}\;\underset{{}}{\overset{k}{\longleftrightarrow}}\;{\text{ClН}}{{{\text{О}}}^{{ \bullet - }}} + {\text{C}}{{{\text{l}}}^{ - }}{\text{ + }}{{{\text{Н}}}^{ + }} \\ k = 1.3 \times {{10}^{3}}\;{{{\text{с}}}^{{--1}}}. \\ \end{gathered} $Влияние нитратов на процесс окисления органических соединений персульфатами зависит от способа их активации. Так установлено, что на окисление смеси органических соединений, состоящей из бензола, толуола, этилбензола и ксиленов, термически активированным персульфатом, нитраты в диапазоне концентраций 10–500 мМ существенного влияния не оказывают [20]. В то же время известно, что нитраты могут оказывать двоякое влияние на протекание фотокаталитических процессов. С одной стороны, нитраты способны поглощать ультрафиолетовое излучение (при λ = 205 нм ε = 9900 M–1 см–1 [33]), что препятствует проникновению света в объем раствора. С другой стороны, под действием УФ-излучения в водном растворе нитраты могут являться источниками образования гидроксильных и нитритных радикалов или супероксидных анион-радикалов, что способствует повышению общего окислительного потенциала системы:
(20)
${\text{NO}}_{3}^{ - } + h{v} \to {\text{NO}}_{2}^{ \bullet } + {{{\text{O}}}^{{ \bullet - }}},$(21)
${{{\text{O}}}^{{ \bullet --}}} + {{{\text{H}}}_{{\text{2}}}}{\text{O}} \to {}^{ \bullet }{\text{OH}} + {\text{O}}{{{\text{H}}}^{ - }}.$Однако, вклад реакций (20) и (21) в окислительные процессы становится существенным лишь при использовании вакуумного ультрафиолетового излучении (λ < 200 нм) [34].
В рассматриваемой нами комбинированной системе УФ/S2O$_{8}^{{2 - }}$/Fe2+ нитраты не оказывают существенного влияния на кинетику окисления МО (рис. 1). Однако, с увеличением концентрации нитратов с 1 до 100 мМ наблюдается значительное ингибирование процессов минерализации РОУ (с 31 до 6%), обусловленное прежде всего ростом вклада “экранирующего” эффекта, приводящего к снижению общего окислительного потенциала системы (рис. 2).
Изучено влияние сульфатов на процесс фотохимического окисления МО в комбинированной системе УФ/S2O$_{8}^{{2 - }}$/Fe2+. Экспериментально установлено, что в присутствии сульфат-ионов, в рассмотренном диапазоне концентраций, доза излучения, необходимая для полного превращения МО, практически не изменилась. Однако степень минерализации РОУ при этом возросла и достигла 56–61%.
Аналогичный интенсифицирующий эффект сульфатов обнаружен при окислительной деструкции хлорамфеникола фотоактивированным персульфатом [35]. Авторы предположили, что в присутствии сульфатов в растворе снижается вероятность протекания нецелевых реакций расходования АФК, в том числе взаимодействия сульфатных анион-радикалов с персульфатом:
(22)
${\text{SO}}_{4}^{{ \bullet - }} + {{{\text{S}}}_{{\text{2}}}}{\text{O}}_{8}^{{2 - }} \to {{{\text{S}}}_{{\text{2}}}}{\text{O}}_{8}^{{2 - \bullet }} + {\text{SO}}_{4}^{{2 - }}.$Влияние компонентов реальных водных матриц
Процессы деструкции микрополлютантов в комбинированных окислительных системах в реальных водных матрицах – многокомпонентных природных и сточных водах, протекают значительно медленнее, и зависят не только от концентраций анионов, но и от их взаимного влияния [37].
Экспериментально установлено влияние компонентов двух водных матриц – поверхностной природной воды р. Селенга и промывной воды от процесса крашения меха в черный цвет, на кинетику окисления МО в комбинированной системе УФ/S2O$_{8}^{{2 - }}$/Fe2+. Начальная скорость реакции окисления МО в природной воде снизилась в 4 раза (с 6.1 до 1.5 мкМ мин–1), эффективность процесса окисления красителя при дозе излучения 1.48 Дж см–2 составила лишь 50%, а минерализации РОУ не наблюдалось (рис. 3).
Рис. 3.
Кинетика фотохимического окисления МО в природной воде; [Fe2+] = 180 мкМ, [S2O$_{8}^{{2 - }}$] = 180 мкМ.
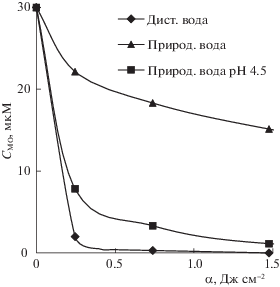
Полагаем, что снижение эффективности процесса окисления МО в данной матрице преимущественно обусловлено присутствием гидрокарбонатов (76 мг/л), так как характер кинетической кривой хорошо коррелирует с результатами, представленными выше, полученными при окислении МО в модельных растворах (в дистиллированной воде) в присутствии гидрокарбонатов.
Для нивелирования ингибирующего влияния ${\text{HCO}}_{3}^{ - }$ были выполнены эксперименты с корректировкой исходной реакции среды природной воды до 4.5. При этом начальная скорость реакции окисления МО увеличилась (до 4.43 мкМ мин–1), эффективность окисления составила 99%, а степень минерализации РОУ достигла 35%.
Промывные сточные воды от крашения меха имеют сложный многокомпонентный состав, включающий кроме красителей остаточные концентрации технологических примесей – реагентов, используемых в рецептуре красильных ванн (выравнивателей, органических кислот, поверхностно-активных веществ и т.п.), обусловливающих высокое содержание трудноокисляемых примесей (ХПК = 420 мг/л) и РОУ (210 мг/л).
Эффективность использования комбинированной окислительной системы УФ/S2O$_{8}^{{2 - }}$/Fe2+ для очистки промывных вод процесса крашения меха оценивали по изменению интегральных показателей качества воды – ХПК и концентрации РОУ. При оптимальных условиях, установленных на модельных растворах, при дозе поглощенного излучения 5.9 Дж см–2 эффективность окисления МО составила 83%, минерализации 24%, ХПК снизилось на 7% (рис. 4, 5). Увеличение концентрации окислителя в 2 раза приводит к более глубокой деструкции продуктов реакции, о чем свидетельствует существенное снижение ХПК (на 60%) (рис. 6). Удельный расход окислителя при этом составил 0.7 мкмоль S2O$_{8}^{{2 - }}$ на грамм удаленного ХПК. Дальнейшее увеличение концентрации персульфата нецелесообразно, так как приводит к его нецелевому расходованию (рис. 5.).
Рис. 4.
Влияние концентрации окислителя на изменение концентрации красителя в промывных водах процесса крашения меха; [Fe2+] = 180 мкМ.

Рис. 5.
Влияние концентрации окислителя (С) на эффективность (Х) очистки промывных вод процесса крашения меха в комбинированной окислительной системе УФ/S2O$_{8}^{{2 - }}$/Fe2+; [Fe2+] = 180 мкМ, доза излучения 5.9 Дж см–2.
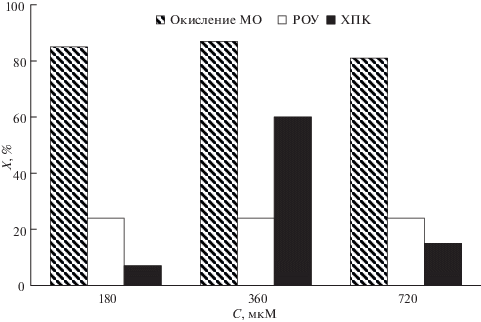
Рис. 6.
Эффективность очистки промывных вод процесса крашения меха в комбинированной окислительной системе УФ/S2O$_{8}^{{2 - }}$/Fe2+; [Fe2+] = 180 мкМ, [S2O$_{8}^{{2 - }}$] = 360 мкМ.

Таким образом, изучено влияние анионов (гидрокарбонатов, хлоридов, нитратов, сульфатов), наиболее характерных для природных и сточных вод, на кинетику окисления красителя метилового оранжевого в комбинированной системе УФ/S2O$_{8}^{{2 - }}$/Fe2+, где в качестве источника УФ-излучения использована KrCl-эксилампа (222 нм). Установлено, что введение в раствор гидрокарбонатов и нитратов ингибирует процесс минерализации растворенного органического углерода. В присутствии хлоридов (10 мМ) и сульфатов (1–100 мМ) наблюдается увеличение степени минерализации с 31 до 60%. В реальных водных матрицах (природной воде и сточной воде от процесса крашения меха) окислительный процесс существенно ингибируется. В природной поверхностной воде этот эффект обусловлен преимущественно влиянием гидрокарбонатов, а в сточной воде – многокомпонентным характером водной матрицы, включающей технологические примеси.
Работа выполнена в рамках государственного задания Федерального государственного бюджетного учреждения науки Байкальского института природопользования Сибирского отделения Российской академии наук.
Список литературы
Babuponnusami A., Muthukumar K. //Chem. Eng. J. 2012. V. 183. P. 1.
Sharma A., Ahmad J., Flora S.J.S. // Environ. Res. 2018. V. 167. P. 223.
Babu D.S., Srivastava V., Nidheesh P.V., Kumar M.S. // Sci. Total Environ. 2019. V. 696. 133961
Miklos D.B., Remy Ch., Jekel M. et al. // Water Res. 2018. V. 139. P. 118.
Zhang M.-H., Dong H., Zhao L. et al. // Sci. Total Environ. 2019. V. 670. P. 110.
Karci A., Arslan-Alaton I., Olmez-Hanci T., Bekbölet M. // J. Photochem. Photobiol. A Chem. 2012. V. 230. P. 65.
Méndez-Díaz J., Sánchez-Polo M., Rivera-Utrilla J. et al. // Chem. Eng. J. 2010. V. 163. P. 300.
Mestankova H., Schirmer K., Canonica S., von Gunten U. // Water Res. 2014. V. 66. P. 399.
Ribeiro A.R., Moreira N.F.F., Puma G.L., Silva A.M.T. // Chem. Eng. J. 2019. V. 363. P. 155.
Matta R., Tlili S., Chiron S. et al. // Environ. Chem. Lett. 2011. V. 9. P. 347.
Ghanbari F., Moradi M. // J. Hazardous Materials. 2017. V. 310. P. 41.
Huang W., Bianco A., Brigante M., Mailhot G. // J. Hazardous Materials. 2018. V. 347. P. 279.
Matzek L., Carter K.E. // Chemosphere. 2016. V. 151. P. 178.
Ike I.A., Linden K.G., Orbell J.D., Duke M. // Chem. Eng. J. 2018. V. 338. P. 651.
Yang Q., Ma Y., Chen F. et al. // Chem. Eng. J. 2019. V. 378. 1221499.
Matafonova G., Batoev V. // Water Res. 2018. V. 132. P. 177.
Matafonova G., Batoev V. // Chemosphere. 2012. V. 89. P. 637.
Fu Y., Wu G., Geng J. et al. // Water Res. 2019. V. 150. 12e2013.
Luo C., Ma J., Jiang J. et al. // Ibid. 2015. V. 80. P. 99.
Ma J., Yang Y., Jiang X. et al. // Chemosphere. 2018. V. 190. P. 296.
Сизых М.Р., Батоева А.А. // Журн. физ. химии. 2019. Т. 93, № 12. С. 1773. Sizykh M., Batoeva A. // Russ. J. of Phys. Chem. A. 2019. V. 93. №. 12. P. 2349. https://doi.org/10.1134/S003602441912029X
Canonica S., Meunier L., Gunten U. // Water Res. 2008. V. 42. P. 121.
Ma J., Graham N.J.D. // Water Res. 2000. V. 34. P. 3822.
Brillas E., Martínez C.A. // Appl. Catal. B: Environ. 2015. V. 166–167. P. 603.
Moreira F.C., Garcia-Segura S., Vilar V.J.P. et al. //Appl. Catal. B Environ. 2013. V. 142–143. P. 877.
Qin Q., Xu J., Sun T. et al. // Res. Chem. Intermed. 2019. V. 45. 3541.
Joseph J.M., Destaillats H., Hung H.-Ming, Hoffmann M.R. // J. Phys. Chem.A. 2000 V. 104. 301.
Bi W.L., Wu Y.L., Wang X.N. et al. // Chem. Eng. J. 2016. V. 302. P. 811.
Sharma J., Mishra I.M., Dionysiou D.D., Kumar V. // Chem. Eng. J. 2015. V. 276. P. 193.
Ao X.W., Liu W.J. // Chem. Eng. J. 2017. V. 313. P. 629.
Deng J., Shao Y.S., Gao N.Y. et al. // Chem. Eng. J. 2013. V. 222. P. 150.
Zhang R., Wang X., Zhou L., Crump D. // Chem. Eng. J. 2019. V. 361. P. 960.
Mack J., Bolton J.R. // J. of Photochem. Photobiol. A: Chem. 1999. V. 128. P. 1.
Han M., Mohseni M. // Water Res. 2020. V. 168. 115169.
Ghauch A., Baalbaki A., Amasha M., Asmar E.R. et al. // Chem. Eng. J. 2017. V. 317. P. 1012.
Antoniou M.G., de la Gruz A.A., Dionysiou D.D. //Appl. Catal. B Environ. 2010. V. 96. P. 290.
Hakim S.Al., Jaber S., Eddine N.Z., Xu J. // Chem. Eng. J. 2020. V. 380. 1224782.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии


