Журнал физической химии, 2021, T. 95, № 6, стр. 916-922
Особенности кинетики адсорбции макрокомпонентов воздуха на нанокомпозитах на основе альгината кальция и углеродных нанотрубок
А. О. Дудоладов a, М. Б. Алехина a, *, П. Ю. Цыганков a
a Российский химико-технологический университет им. Д.И. Менделеева
125047 Москва, Россия
* E-mail: mbalekhina@yandex.ru
Поступила в редакцию 20.07.2020
После доработки 03.11.2020
Принята к публикации 10.11.2020
Аннотация
Исследованы кинетические характеристики сорбции макрокомпонентов воздуха на нанокомпозитах на основе альгината кальция и углеродных нанотрубок с использованием модели внутридиффузионной кинетики и моделей псевдопервого и псевдовторого порядков. Установлено определяющее влияние внутридиффузионного переноса на адсорбцию аргона на нанокомпозитах. Показано, что скорость адсорбции азота на нанокомпозитах описывается моделью кинетики псевдо-второго порядка; скорость адсорбции кислорода согласуется с моделью внутридиффузионной кинетики, однако при этом с ростом содержания углеродных нанотрубок в нанокомпозитах возрастает влияние сорбции молекул кислорода на активных центрах, соответствующей модели псевдовторого порядка. Полученные результаты свидетельствуют о значительной роли локализованной адсорбции и доступности активных центров при адсорбции на гетерополярных сорбентах молекул, обладающих квадрупольным моментом.
Специфичность взаимодействия молекул газов с адсорбентами связана с химией поверхности адсорбентов. Для повышения селективности адсорбентов в отношении какого-то компонента газовой смеси необходимо контролировать и направленно изменять химию поверхности адсорбентов [1]. Адсорбционное разделение воздуха на цеолитах при комнатной температуре методом короткоцикловой безнагревной адсорбции (КБА) основано на различиях в адсорбируемости азота и кислорода [2–5]. Основные отличия в свойствах молекул макрокомпонентов воздуха заключаются в величинах квадрупольного момента у молекул азота и кислорода и его отсутствии у молекулы аргона [6]. Из-за близости адсорбционных свойств аргона и кислорода чрезвычайно сложно разделить их смесь на существующих промышленных адсорбентах. Необходимо получить адсорбенты с энергетически однородной поверхностью, что способствовало бы преимущественной адсорбции аргона за счет дисперсионных сил, вследствие его большей массы по сравнению с кислородом. Для этого активные центры сорбции кислорода (катионы металлов, гидроксильные группы и др.) нужно удалить с поверхности адсорбента или их экранировать.
Ионные адсорбенты поляризуют любые молекулы (индукционное электростатическое взаимодействие) и специфически взаимодействуют с полярными молекулами (ориентационное электростатическое взаимодействие). Связь с адсорбентом может оставаться физической, но быть достаточно сильной для того, чтобы воспрепятствовать перемещению молекулы вдоль поверхности. В этом случае наблюдается локализованная адсорбция в отличие от нелокализованной [1, 7], когда молекулы могут свободно перемещаться вдоль поверхности адсорбента. К этому типу, помимо цеолитов, относятся адсорбенты, поверхность которых содержит протонные и апротонные кислотные центры.
В работе [8] исследованы нанокомпозиты на основе альгината кальция с многослойными углеродными нанотрубками (МУНТ) для разделения газовой смеси аргон−кислород. Модифицирование альгината кальция привело к экранированию центров сорбционной активности О2 и снизило электростатический потенциал взаимодействия кислорода с адсорбционной поверхностью. Специфические взаимодействия имеют место только на свободных, не возмущенных взаимодействием с окружением и неэкранированных гидроксильных группах [9]. В результате модифицированный адсорбент на основе альгината кальция с содержанием 30 мас. % МУНТ обладал повышенной селективностью к аргону при его адсорбции из смеси с кислородом.
Альгинат натрия, природная водорастворимая соль альгиновой кислоты, представляет собой линейный полисахарид, который извлекают из бурых водорослей. Способность образовывать гидрогели является одним из основных свойств альгината натрия, которое обусловлено замещением ионов натрия из остатков гулуроновой кислоты различными двухвалентными катионами (Ca2+, Sr2+, Ba2+ и др.). Трехмерная сеть образуется в результате связывания двухвалентного катиона с α-l-гулуроновым блоком между двумя различными цепями (рис. 1) [10–12].
На поверхности альгинатного геля имеются положительные ионы Са2+, способные взаимодействовать с молекулами азота и кислорода за счет ион-квадрупольных взаимодействий (в отличие от ковалентной связи, ионная связь является ненасыщенной, так как взаимодействие ионов противоположного знака не приводит к полной взаимной компенсации их силовых полей [1]). Поверхность альгинатной матрицы содержит протонизированный атом водорода в группах ОН кислотного типа, т.е. обладает положительным зарядом.
Описание кинетических кривых адсорбции при помощи моделей диффузионной и химической кинетики позволяет определить лимитирующую стадию и охарактеризовать механизм сорбции [13–21]. Следует отметить, что данное направление в настоящее время недостаточно изучено, оно требует рассмотрения механизма сорбции с учетом природы взаимодействий в системе адсорбат–адсорбент с определением констант, характеризующих сродство адсорбентов к целевым компонентам.
Целью данной работы являлось определение кинетических характеристик адсорбции азота, кислорода и аргона на нанокомпозитах на основе альгината кальция, модифицированных МУНТ. Для описания кинетики сорбции указанных газов использовали модель внутридиффузионной кинетики физической адсорбции [14], модели псевдопервого порядка Лагергрена и псевдовторого порядка Хо и Маккей [18, 19].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Нанокомпозиты на основе альгината кальция были получены в международном учебно-научном центре трансфера фармацевтических и биотехнологий (МУНЦ фармацевтических и биотехнологий) при РХТУ им. Д.И. Менделеева. Образцы представляли собой сферические частицы, диаметром ~2 мм. Нанокомпозиты были приготовлены по золь-гель-технологии с последующей сушкой в среде сверхкритического диоксида углерода (14.5 МПа, 40°С). Углеродные нанотрубки выступали в качестве модификатора, затрудняющего доступ молекулам адсорбтива к активным центрам сорбции. Содержание МУНТ в образцах варьировали от 0 до 30 мас. %. Подробное описание методик получения нанокомпозитов, а также их текстурные характеристики приведены в [8, 22, 23].
Дифференциальные кривые распределения объемов пор по радиусам для нанокомпозитов, рассчитанные по методу BJH, показали, что образцы обладали мезопористой структурой с радиусом пор от 4 до 60 нм в образце без МУНТ. При увеличении массовой доли МУНТ в нанокомпозите наблюдали уменьшение объема пор с радиусами 20–40 нм, что соответствует размеру углеродной нанотрубки.
В качестве адсорбатов использовали азот, кислород и аргон из баллонов. В качестве калибровочного газа применяли гелий. Чистота газов: гелий марки А – 99.995 об. % He; азот марки “ос.ч.”– 99.999 об. % N2, кислород марки “ос.ч.” – 99.999 об. % О2; аргон марки “высший сорт” – 99.993 об. % Ar.
Кинетические кривые адсорбции азота, кислорода и аргона были измерены с помощью волюмометрической установки (рис. 2) при 25°С и атмосферном давлении. Измерительная система состоит из ампулы с образцом 1, помещенной в термостат 6, нитрометра 2, вакуумметра 5 и кранов 3, 4, 7, 8.
Рис. 2.
Принципиальная схема волюмометрической установки: 1 – ампула с адсорбентом, 2 – калиброванный объем (нитрометр) 3, 4, 7, 8 – краны, 5 – вакуумметр, 6 – термостат.
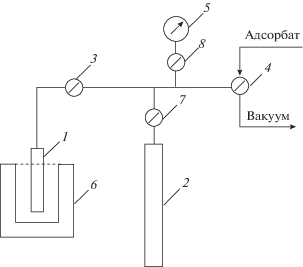
Адсорбент с известной массой (после предварительного прогрева при 50°C в токе азота) помещали в ампулу 1, которая отделена от измерительной системы краном 3. Перед началом измерений проводили дегазацию адсорбента путем вакуумной откачки при 25°С.
Далее проводили калибровку свободного объема системы по гелию, т.е. определение объема гелия, перешедшего в пространство, расположенное слева от крана 3. После дегазации гелия, осуществляли подачу рабочего газа в ампулу и определяли объем рабочего газа. Разность соответствовала величине адсорбции рабочего газа, которую фиксировали во времени.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Кинетические зависимости сорбции азота, кислорода и аргона на образцах альгинатов кальция без МУНТ и с различным содержанием модификатора обладали характерной выпуклостью в начальной области и выходили на плато в области больших времен. Время установления равновесия для азота составляло 20 мин на всех образцах нанокомпозитов. Значения равновесных емкостей, ${{а}_{{{\text{е}}\;{\text{эксп}}}}}$ по азоту для образцов, содержащих 0, 10 и 30 мас. % МУНТ составило, соответственно 6.6, 6.5 и 4.5 см3/г (табл. 1).
Таблица 1.
Кинетические характеристики адсорбции азота, кислорода и аргона на нанокомпозитах
| Содержание МУНТ в нанокомпо-зите, мас. % | ${{а}_{{{\text{е}}\;{\text{эксп}}}}}$, см3/г |
Модель псевдопервого порядка | Модель псевдовторого порядка | Модель внутридиф-фузионной кинетики | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| ${{а}_{{{\text{e}}\;{\text{расч}}}}}$, см3/г | k1, мин–1 | R2 | ${{а}_{{{\text{e}}\;{\text{расч}}}}}$, см3/г | h, см3/(г мин) | k2, г/(см3 мин) | R2 | De, см2/с | R2 | ||
| Азот | ||||||||||
| 0 | 6.6 | 4.0 | 0.082 | 0.908 | 7.0 | 3.33 | 0.068 | 0.997 | 5.2 × 10–6 | 0.809 |
| 10 | 6.5 | 5.8 | 0.098 | 0.951 | 6.5 | 8.14 | 0.193 | 0.999 | 8.1 × 10–6 | 0.629 |
| 30 | 4.5 | 2.7 | 0.083 | 0.879 | 4.7 | 2.55 | 0.116 | 0.996 | 8.1 × 10–6 | 0.818 |
| Кислород | ||||||||||
| 0 | 19.9 | 19.8 | 0.013 | 0.919 | 22.0 | 0.50 | 0.001 | 0.873 | 7.3 × 10–7 | 0.993 |
| 10 | 25.4 | 24.3 | 0.016 | 0.888 | 25.8 | 1.16 | 0.002 | 0.928 | 1.0 × 10–7 | 0.992 |
| 30 | 9.3 | 7.3 | 0.016 | 0.961 | 9.8 | 1.15 | 0.012 | 0.986 | 3.4 × 10–7 | 0.957 |
| Аргон | ||||||||||
| 0 | 20.9 | 19.8 | 0.013 | 0.919 | 20.4 | 1.44 | 0.003 | 0.957 | 1.7 × 10–7 | 0.987 |
| 10 | 20.4 | 17.3 | 0.015 | 0.934 | 23.0 | 1.02 | 0.002 | 0.937 | 1.3 × 10–7 | 0.990 |
| 30 | 18.5 | 17.4 | 0.018 | 0.923 | 18.1 | 0.90 | 0.003 | 0.947 | 1.3 × 10–7 | 0.998 |
Время установления равновесия для адсорбции кислорода и аргона составило от 150 до 180 мин на всех образцах нанокомпозитов.
При адсорбции аргона внедрение МУНТ в альгинатную матрицу слабо сказалось на скорости сорбции: она незначительно снижалась симбатно увеличению содержания МУНТ. Значения равновесных емкостей по аргону для образцов, содержащих 0, 10 и 30 мас. % МУНТ составило соответственно 20.9, 20.4 и 18.5 см3/г (табл. 1).
Видно, что модифицирование альгинатной матрицы 10 мас. % МУНТ привело сначала к увеличению скорости адсорбции О2 (и равновесной емкости), а затем к ее снижению на образце Alg-Ca + 30 мас. % МУНТ. Значения ${{а}_{{{\text{е}}\;{\text{эксп}}}}}$ составили, соответственно 19.9, 25.4 и 9.3 см3/г (табл. 1).
Как правило, тормозят адсорбционный процесс диффузионные стадии, поскольку скорость адсорбции на порядки больше скорости массопереноса. Однако, если имеет место сильное специфическое взаимодействие адсорбата с поверхностными активными центрами (ПАЦ), то скорость адсорбционного процесса может быть ограничена как стадией диффузии адсорбтива к ПАЦ, так и стадией собственно локализованной адсорбции на ПАЦ.
Полученные кинетические кривые были проанализированы при помощи моделей внутри-диффузионной и химической кинетики.
Перед анализом была определена погрешность измерения текущей величины адсорбции по методике [24], на примере адсорбции азота на образце Alg-Ca + 30 мас. % МУНТ при 25°С. Как показали результаты, наибольшая погрешность определения текущей величины адсорбции 10–15% была в первые 7 мин от начала измерений, затем ошибка снизилась до 4–5% и после 8 мин сохранялась на этом уровне до конца эксперимента.
При феноменологическом описании внутри-диффузионной кинетики физической адсорбции обычно применяется модель квазигомогенного пористого тела [14]. При диффузии в сферу применяется уравнение второго закона Фика. Кинетическая кривая выражается уравнением:
(1)
$\gamma (t) = \frac{{{{a}_{t}}}}{{{{a}_{{\text{e}}}}}} = 1 - \frac{6}{{{{\pi }^{2}}}}\sum\limits_{n = 1}^\infty {\exp ( - {{n}^{2}}\tau ){\text{/}}{{n}^{2}}} ,$Значения эффективного коэффициента диффузии, De азота, кислорода и аргона в зависимости от содержания МУНТ в нанокомпозитах при 25°С, были рассчитаны по формуле [25]:
где R – радиус зерна сорбента; t0.5 – время достижения γ = 0.5; K – коэффициент, зависящий от формы гранул, для сферического зерна K = 0.308.В области малых γ величина γ(t) пропорциональна (Det)1/2. Причем на практике [25] эта зависимость в удовлетворительном приближении выполняется до γ = 0.6–0.7.
Кинетические кривые адсорбции азота на нанокомпозитах в координатах γ = f(t1/2) (рис. 3а) были выпуклыми, причем вид этих зависимостей качественно не изменялся с ростом содержания модификатора в альгинатной матрице. Это позволило предположить, что скорость адсорбции азота определяет не только внутренняя диффузия, но и взаимодействие с доступными активными центрами поверхности. Значения эффективного коэффициента диффузии азота возросли в результате модифицирования.
Рис. 3.
Кинетические кривые адсорбции азота (а), кислорода (б) и аргона (в) на нанокомпозитах при 25°С в координатах γ = f(t1/2), где 1 − Alg-Ca + + 0 мас. % МУНТ, 2 − Alg-Ca + 10 мас. % МУНТ, 3 − Alg-Ca + 30 мас. % МУНТ.

Вид кинетических кривых адсорбции кислорода на нанокомпозитах изменялся с ростом содержания МУНТ (рис. 3б). Линейные зависимости для образца без МУНТ и образца, содержащего 10 мас. % МУНТ сменились нелинейной зависимостью для нанокомпозита с 30 мас. % МУНТ. Значения коэффициентов корреляции (табл. 1) были высоки, но величина R2 несколько снизилась для нанокомпозита с 30 мас. % МУНТ. Эти данные позволяют предполагать, что внедрение МУНТ в альгинатную матрицу привело к изменению механизма сорбции кислорода: на образце без МУНТ и с 10 мас. % МУНТ лимитировала внутренняя диффузия, при содержании в образце 30 мас. % МУНТ скорость адсорбции стала зависеть от другого фактора.
Адсорбция аргона на всех образцах в координатах γ = f(t1/2) (рис. 3в) характеризуется линейной зависимостью, при этом коэффициенты R2 при адсорбции аргона были достаточно высоки и наблюдался их рост с увеличением содержания МУНТ в образцах (табл. 1).
Как известно [26, 27], условия, гарантирующие применимость модели: 1) высокие значения R2, 2) прямая линия, проходящая через начало координат. Если есть отклонения от 1) и 2) условий, то это означает, что режим переноса зависит от более, чем одного процесса. На гетерогенных поверхностях влияния диффузионного массопереноса и химической реакции (если адсорбцию на активных центрах поверхности рассматривать как реакцию взаимодействия молекул газов с активными центрами) часто экспериментально неотделимы. Если предположить, что активные центры поверхности нанокомпозитов обладают энергетической неоднородностью, то на разных активных центрах адсорбция азота и кислорода будет идти с различной скоростью.
Обработка кинетических данных по линеаризованным уравнениям моделей псевдопервого и псевдовторого порядка, позволила рассчитать константы скорости адсорбции азота, кислорода и аргона на полученных нанокомпозитах (табл. 1).
Определение скорости процесса сорбции псевдопервого порядка производили по уравнению Лагергрена в логарифмической форме, предложенной в работе [18]:
где at – текущая величина сорбционной емкости за время t, см3/г; ae – сорбционная емкость при равновесии, см3/г; k1 – константа скорости адсорбции, мин–1.Модель псевдовторого порядка реакции в линейной форме может быть представлена уравнением [18, 19, 21]:
(4)
$\frac{1}{{{{a}_{t}}}} = \frac{1}{{{{k}_{2}}a_{{\text{e}}}^{2}}} + \frac{1}{{{{a}_{{\text{e}}}}}}t = \frac{1}{h} + \frac{1}{{{{a}_{{\text{e}}}}}}t,$Физический смысл описания кинетической зависимости моделью псевдовторого порядка состоит в том [13, 19], что скорость процесса сорбции лимитируется реакцией между адсорбатом и поверхностным активным центром сорбента в соотношении 1 : 1.
Как следует из представленных данных (табл. 1) модель псевдопервого порядка не удовлетворительно описывает процесс сорбции газов на всех образцах нанокомпозитов.
На рис. 4а–в приведены зависимости t/at – t для адсорбции на нанокомпозитах азота (а), кислорода (б) и аргона (в).
Рис. 4.
Зависимости t/at – t для азота (а), кислорода (б) и аргона (в) на нанокомпозитах с различным содержанием МУНТ, где 1 − Alg-Ca + 0 мас. % МУНТ, 2 − Alg-Ca + 10 мас. % МУНТ, 3 − Alg-Ca + 30 мас. % МУНТ.
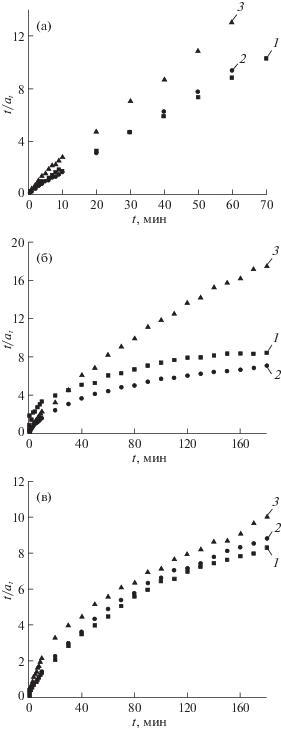
Как следует из табл. 1 и рис. 4а высокие коэффициенты корреляции при использовании модели псевдовторого порядка наблюдались для адсорбции азота на всех образцах нанокомпозитов. Сопоставление значений ${{а}_{{{\text{e}}\;{\text{расч}}}}}$ с ${{а}_{{{\text{е}}\;{\text{эксп}}}}}$ также позволяет сделать вывод о преимуществе модели псевдовторого порядка для описания адсорбции азота.
Кинетические кривые адсорбции кислорода меняли свою конфигурацию в зависимости от содержания МУНТ (рис. 4б). Зависимость t/at – t при адсорбции О2 на образце Alg-Ca + 30 мас. % МУНТ стала линейной¸ значение R2 достигло 0.986. Значения аe, рассчитанные при использовании модели псевдовторого порядка, практически совпали с ${{а}_{{{\text{е}}\;{\text{эксп}}}}}$. Тем не менее, на основании полученных результатов можно заключить, что модель псевдовторого порядка недостаточно удовлетворительно описывает адсорбцию кислорода на нанокомпозитах.
Как видно из табл. 1 и рис. 3в и 4в, характер кинетических кривых адсорбции аргона в зависимости от содержания МУНТ практически не изменялся, линейных зависимостей в координатах моделей псевдопервого и псевдовторого порядков для аргона не получили, что говорит о неприменимости кинетических моделей к адсорбции аргона на нанокомпозитах.
Как указывается в работах [21, 28], причиной отклонения от линейности зависимости t/at – t при адсорбции О2 может быть неоднородность активных центров поверхности адсорбента. Отклонения от линейности в начальной области (вплоть до 8 мин от начала эксперимента) мы не рассматриваем, поскольку в этой области наибольшая погрешность измерений. Зависимость t/at – t в случае адсорбции кислорода на Alg-Ca + + 30 мас. % МУНТ практически линейна (R2 = = 0.986), что свидетельствует об адсорбции кислорода на однородных ПАЦ, не экранированных путем внедрения МУНТ в альгинатную матрицу. Места для сорбции кислорода – это катионы кальция и протоны, но энергия взаимодействия с этими центрами у молекулы кислорода существенно меньше в силу его природы.
Подтверждением этой гипотезы служит работа [29], результаты которой свидетельствовали о том, что при адсорбции азота и кислорода на цеолитах (в изученном диапазоне температур и давлений) предельные величины адсорбции кислорода оказались существенно большими, чем у азота. В рамках модели локализованной адсорбции этот факт может быть объяснен большим количеством активных центров, на которых сорбируется кислород. Автор сделал заключение, что наряду с активными центрами, на которых сорбируются оба газа, существуют активные центры, недоступные для молекул азота.
Таким образом, в результате обработки кинетических данных показано, что механизм адсорбции макрокомпонентов воздуха на синтезированных нанокомпозитах имеет сложный характер, при этом влияние оказывают как свойства исследуемых газов, так и содержание модификатора в нанокомпозитах. Нанокомпозиты на основе альгината кальция обладают развитой мезопористостью, чем обеспечивается высокая скорость массопереноса при сорбции на исследуемом материале. Адсорбция аргона на нанокомпозитах лимитируется внутренней диффузией и с высоким уровнем достоверности описывается моделью квазигомогенного пористого тела. Значения эффективных коэффициентов диффузии достаточно высоки (1.3–1.7 × 10–7 см2/с).
Адсорбция азота на нанокомпозитах определяется взаимодействием с локальными активными центрами поверхности, которыми являются катионы Са2+. Механизм адсорбции с высокой степенью достоверности описывается моделью химической кинетики псевдовторого порядка.
В скорость сорбции кислорода на нанокомпозитах вносят вклад как внутридиффузионное лимитирование, так и скорость локализованной физической адсорбции. Причем с ростом содержания МУНТ в структуре нанокомпозита роль взаимодействия молекул кислорода с ПАЦ возрастала, что подтверждено применением модели псевдовторого порядка.
Список литературы
Курс физической химии, т. I / Под ред. Я.И. Герасимова. М.: Химия, 1969. 592 с.
Шумяцкий Ю.И. Промышленные адсорбционные процессы. М.: КолосС. 2009. 184 с.
Акулов А.К., Агабалян А.К., Устинов Е.А., Гребенников С.Ф. // ЖПХ. 1987. № 8. С. 1707.
Акулов А.К. // ЖПХ. 1988. № 7. С. 1525.
Акулов А.К. // Технические газы. 2007. № 6. С. 31.
Auerbach S.M., Carrado K.A., Dutta P.K. Handbook of Zeolite Science and Technology. CRS Press, 2003. 1204 p.
Киселев А.В. Межмолекулярные взаимодействия в адсорбции и хроматографии. М.: Высш. шк., 1986. 360 с.
Иванова Е.Н., Бурмистрова Н.Н., Алехина М.Б. и др. // ЖПХ. 2017. Т. 90. Вып. 10. 1385.
Неймарк И.Е. Синтетические минеральные адсорбенты и носители катализаторов. Киев: Наукова думка, 1982. 216 с.
Asadi S., Eris S., Azizian S. // ACS Omega. 2018. V. 3. Is. 11. P. 15140.
Lee K.Y., Mooney D.J. // Prog. Polym. Sci. 2012. V. 37. № 1. P. 106. https://doi.org/10.1016/j.progpolymsci.2011.06.003
Rocher V., Bee A., Siaugue J.-M., Cabuil V. //J. Hazard. Mater. 2010. 178. P. 434. https://doi.org/10.1016/j.jhazmat.2010.01.100
Крижановская О.О., Синяева Л.А., Карпов С.И. и др. // Сорбционные и хроматографические процессы. 2014. Т. 14. Вып. 5. С. 784.
Волощук А.М. В кн. “Физическая химия адсорбционных явлений”. М.: Издательская группа “Граница”. 211. С. 78.
Rudzinski W., Everett D.H. Adsorption of Gases on Heterogeneous Surfaces. Academic Press, 2012. p. 624.
Haerifar M., Azizian S. // J. of Physical Chemistry C. 2013. V. 117. Is. 16. P. 8310.
Douven S., Paez C.A., Gommes C.J. // J. of Colloid and Interface Science. 2015. V. 448. P. 437–450.
Ho Y.S., McKay G. // Process Biochemistry. 1999. 34. P. 451–465.
Ho Y.S. // J. Hazard. Mater. B136. 2006. V. 136, № 3. P. 681.
Chu K.H. // J. Hazard. Mater. 2002. V. 90. № 1. P. 77–95.
Azizian S. // J. of Colloid and Interface Science. 2006. V. 302. Is. 1. P. 76–81.
Меньшутина Н.В., Каталевич А.М., Смирнова И. // Сверхкритические флюиды: теория и практика. 2013. Т. 8. № 3. С. 49–55.
Иванов С.И., Цыганков П.Ю., Худеев И.И., Меньшутина Н.В. // Успехи в химии и химической технологии. 2015. Т. 29. № 4 (163). С. 83–85.
Ахназарова С.Л., Кафаров В.В. Методы оптимизации эксперимента в химической технологии. Москва: Высшая школа, 1985. 327 с.
Тимофеев Д.П. Кинетика адсорбции. М.: Издательство академии наук СССР, 1962. 252 с.
Ho Y.S., Ng J.C.Y., Mckay G. // Separation and Purification Methods. 2000. V. 29. P. 189.
Zhang Y.J., Kang L., Liu L.C. Handbook of Alkali-Activated Cements, Mortars and Concretes. 2015. P. 729.
Свешникова Д.А., Хамизов Р.Х. // Изв. академии наук. Сер. хим. 2018. № 6. С. 991.
Акулов А.К. Моделирование разделения бинарных газовых смесей методом адсорбции с колеблющимся давлением: Автореферат дис. … доктора техн. наук. Санкт-Петербург: Санкт-Петербургский гос. технологич. ин-т., 1996. 40 с.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии



