Журнал физической химии, 2021, T. 95, № 6, стр. 923-927
О скорости роста нанокластеров SiO2 при различном соотношении числа молей компонентов системы (вода–ТЭОС) при щелочном катализе
И. И. Юрасова a, *, Н. И. Юрасов a, А. И. Плохих a, Н. К. Галкин a, А. В. Синягин a, В. А. Тетянчук a
a Московский государственный технический университет им. Н.Э. Баумана
105005 Москва, Россия
* E-mail: yurasovaii@bmstu.ru
Поступила в редакцию 15.07.2020
После доработки 15.08.2020
Принята к публикации 17.09.2020
Аннотация
Использованы методы термического анализа в режиме on-line при синтезе глобул кремнезема. Определена скорость реакции синтеза золя. Найден порядок реакции в зависимости от концентрации воды и выделены диффузионная и кинетическая области. Методом ДСК исследованы высушенные, не отожженные образцы. При анализе кривых нагрева и охлаждения исследована динамика выхода молекул этанола и воды из образцов. Зафиксированы структурные фазовые превращения: образование β-кристобалита и переход его в α-форму. Обнаружена зависимость аморфности образца от количества воды в твердой фазе. Установлено, что при мольном отношение вода–ТЭОС меньше 50, процесс протекает медленно, и гидролиз проходит не полностью. Предложено объяснение этой закономерности. Записано уравнение реакции для кинетической области, когда указанное мольное отношение больше 100. С учетом наличия фрагментов кристобалита во всех образцах предложена общая химическая формула для основной структуры ядра глобулы. На основе анализа этой формулы определены условие, когда гексагональное кольцо не может быть основой структуры, а также количество химически удерживаемой воды. Получена стехиометрическая формула для продукта, образующегося в диффузионной области.
Среди многочисленных применений диоксида кремния можно выделить следующие наиболее перспективные приложения: в области медицины в качестве прекурсора микрокапсул для инициируемого высвобождения цитотоксических препаратов [1], в качестве загустителей дисперсных сред, сорбентов и кристаллизующих реактивов [2], в роли аэрогелей и УФ-фильтров [3].
Многообразие технологических параметров синтеза кремнезема: вид и концентрация компонентов системы, порядок и скорость их смешения, вид и скорость перемешивания реакционной системы, температура и термодинамический режим синтеза, наличие электромагнитных полей, форма и функциональность реактора приводит к огромному числу вариантов решения задачи синтеза наноглобул кремнезема.
Поэтому важнейшей проблемой является on-line-контроль процесса синтеза, позволяющий выявить детали многостадийного процесса и сделать первичную оценку параметров внутреннего строения и состава глобул.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Мы применили метод термического анализа для получения кинетической кривой синтеза в режиме on-line, контролируя процессы в жидкой фазе. Выбор параметров процесса проходил следующим образом.
Стандартный набор компонентов для приготовления золя кремниевой кислоты: Si(OC2H5)4 : С2Н5ОH : NH4OH : Н2О, квалификации “ос. ч.”, вода – дистиллированная [4, 5]. Скорость перемешивания – 450 об./мин [6]. Перемешивание осуществлялось магнитной мешалкой в тефлоновой оболочке. Реактором служил стеклянный стакан на 100 мл. Температура измерялась платина-родиевой термопарой, заключенной в кожух из нержавеющей стали. Точность измерения температуры составляла 0.01°С. Вся серия опытов проведена при температуре 24.5 ± 3°С в квазиадиабатических условиях.
Процесс подготовки материалов включал приготовление органической и неорганической фаз. Расчетное количество этанола делилось пополам. В первую половину добавлялся ТЭОС. При перемешивании формировалась органическая фаза. Во вторую половину – вода и аммиак и при перемешивании формировалась неорганическая фаза. Процесс вели в неорганической фазе, контролируя температуру при фиксированном числе оборотов магнитной мешалки. Это позволило гомогенизировать систему на стадии смешения компонентов.
Мольные соотношения компонентов системы представлены в табл. 1.
Таблица 1.
Мольные соотношения компонентов системы
| Компонент | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
|---|---|---|---|---|---|---|---|---|---|
| Вода | 40 | 45 | 50 | 64 | 78 | 93 | 107 | 121 | 135 |
| ТЭОС | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 |
| Аммиак | 10 | 10 | 10 | 10 | 10 | 10 | 10 | 10 | 10 |
| Спирт | 70 | 66 | 63 | 61 | 56 | 52 | 48 | 43 | 38 |
Примечание. В верхней строке таблицы 1 указаны номера образцов.
Таким образом, мы постепенно замещали растворитель – этанол на реагент – воду и, анализируя графики тепловыделения, рассчитывали скорость процесса.
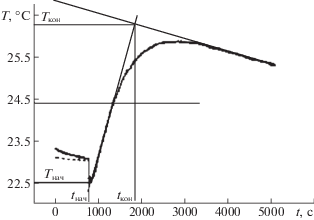
На рис. 1 представлена типичная кинетическая кривая термического анализа (ТА) начала синтеза. Сплошная кривая – температура, контролируемая в реакторе; пунктир – температура органической фазы. Касательная к графику проведена в точке максимальной скорости роста температуры. Отмечены интервалы времени и температуры, соответствующие стадии экзотермического процесса поликонденсации (взрывной нуклеации) [7].
При обработке графиков ТА (рис. 2) и расчете скорости процесса синтеза нанокластеров был использован ряд допущений.
Многостадийный процесс гидролиза и поликонденсации формально можно описать простым термохимическим уравнением (реакция брутто):
(1)
$\begin{gathered} {\text{Si(O}}{{{\text{С}}}_{{\text{2}}}}{{{\text{Н}}}_{{\text{5}}}}{{{\text{)}}}_{{\text{4}}}}({\text{ж}}{\text{.}}) + 2{{{\text{H}}}_{{\text{2}}}}{\text{O}}({\text{ж}}{\text{.}})\;\overset {{\text{O}}{{{\text{H}}}^{ - }}} \longleftrightarrow \\ \overset {{\text{O}}{{{\text{H}}}^{ - }}} \longleftrightarrow \;{\text{Si}}{{{\text{O}}}_{{\text{2}}}}({\text{тв}}{\text{.}}) + 4{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{5}}}}{\text{OH}}({\text{ж}}{\text{.}}) + {{\Delta }_{{\text{r}}}}Н, \\ \end{gathered} $Пусть глубина процессов гидролиза и поликонденсации будет полной, т.е. продукт реакции при изменении состава системы от опыта к опыту изменяться не будет. Предполагая, что состав системы во время синтеза изменяется незначительно (твердая фаза составляет 1.2 мас. %) для оценки скорости синтеза золя кремнезема можно использовать формулу:
(2)
$r = \frac{{d{{C}_{{{\text{Si}}{{{\text{O}}}_{2}}}}}}}{{dt}} = \frac{1}{{RTV}}\left( {\sum {{{{v}}_{j}}{{C}_{p}}_{j}} } \right)\frac{{dT}}{{dt}},$(3)
$\begin{gathered} \ln r = 0.523{{(\ln {{C}_{{{{{\text{H}}}_{2}}{\text{O}}}}})}^{2}} - \\ - \;8.649\ln {{C}_{{{{{\text{H}}}_{2}}{\text{O}}}}} + 36.811. \\ \end{gathered} $Анализируя полученный результат, мы обнаружили, что на начальном участке графика, в области концентраций воды, соответствующих 8–10 М, порядок процесса по воде можно принять равным 1; при средних концентрациях воды порядок плавно изменяется от 1 до 2 и при концентрациях воды больше 22 М остается постоянным и равным 2. Дальнейший рост концентрации воды не оказывает существенного влияния на скорость процесса.
Уравнения формальной кинетики по воде, в зависимости от области протекания процесса можно записать: в диффузионной по воде области (при ${{С}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}$ < 10 М), $r = k{{C}_{{{{{\text{H}}}_{2}}{\text{O}}}}}$ кинетической (при ${{С}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}}$ > 22 М): $r = kC_{{{{{\text{H}}}_{2}}{\text{O}}}}^{2}$. Данные по скорости реакции при щелочном катализе процесса (рН ≈ ≈ 12) хорошо согласуются с литературными данными [8].
После завершения синтеза золя (2 ч от момента смешения фаз) реакционные сосуды помещались в изолированный термостат с принудительной циркуляцией газовой фазы, в котором поддерживалась постоянная температура 25 ± 1°С в течение 1.5 месяцев до полного осаждения золя и испарения жидкой фазы.
Не отожженные образцы подверглись исследованию методом дифференциальной сканирующей калориметрии (ДСК) на приборе DSC 404 F1 Pegasus.
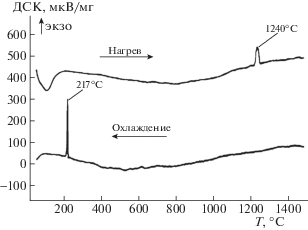
На рис. 3 приведена ДСК кривая нагрева и охлаждения для образца 1 состава.
Аналогичный вид кривых имеет образец второго состава. Структура первого эндотермического пика (рис. 3), выделенная отдельным фрагментом, соответствует испарению адсорбированных спирта (a), воды (b) и ТЭОС (c), сохранившихся в полостях твердой фазы при синтезе. Температуры кипения этих компонентов соответственно равны 78, 100 и 167°С. Эндотермический пик d соответствует выделению химически связанного спирта в составе не подвергшегося гидролизу ТЭОС. Аномальная температурная зависимость теплоемкости образцов указывает на их аморфный характер. Однако наличие высокотемпературного пика при 1200°С на графике нагрева свидетельствует о переходе части неупорядоченной структуры в β-кристобалит. Этот переход осуществляется необратимо, что подтверждается кривыми охлаждения, на которых появляется низкотемпературный (210°С) пик, соответствующий β → α переходу кристобалита. На ДСК-кривой третьего образца (рис. 4) заметно снижен эндотермический эффект разложения ТЭОС не подвергшегося гидролизу – слабый d-пик. При охлаждении образец потерял исходную структуру и при повторном нагреве показал отсутствие элементов структуры кристобалита и полностью застеклованный аморфный состав. На рис. 5 представлены кривые ДСК 4 состава. Аналогичный вид имеют кривые 5–8 составов. ДСК графики 4–8 составов существенно отличаются от кривых первых трех составов отсутствием эндотермического эффекта d, глубиной аномальной зависимости теплоемкости от температуры (часто именуемого процессом стеклования в литературе [9]) и общим наклоном 0-линии. Общим для всех полученных кривых ДСК является наличие высокотемпературного фазового перехода аморфного кремнезема в β-кристобалит на кривых нагрева.
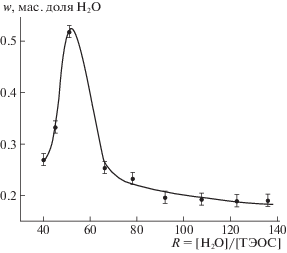
Оценивая количество воды в твердой фазе по аномальному поведению температурной зависимости теплоемкости [10] мы построили график влияния состава синтеза на содержание воды в образцах. Данные представлены на рис. 6. Максимальное количество “захваченной” воды содержится в образце третьего состава (около 53 мас. %), оказавшимся наиболее аморфным по данным анализа ДСК.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Анализ уравнения реакции брутто (1) и данных табл. 1 показывает, что для проведения процесса синтеза золя двукратного превышения концентрации воды над концентрацией ТЭОС недостаточно. Данные ДСК-исследования показали значительное количество воды в составе твердой фазы. Составы 1–3 содержат и химически связанный спирт. Для n < 50 процесс протекает медленно, в диффузионной по воде области и даже процесс гидролиза протекает не полностью, хотя избыток молекул воды относительно стехиометрических потребностей значителен. Это можно объяснить тем фактом, что вода связана ван-дер-ваальсовыми силами (водородными связями) с полярными молекулами гидроксида аммония и спирта. Молекула аммиака полярная, как и молекула воды, и в первой гидратной оболочке может содержать до четырех молекул воды, таким образом, связывая воду. ТЭОС, имея концевые этильные группы, сольватирован молекулами этанола – именно в таком виде он формируется в органической фазе, до приливания к неорганической. Такое взаимное расположение компонентов системы способствует замедлению процесса гидролиза ТЭОС и его не полному протеканию. Процессы поликонденсации могут последовать за процессом неполного гидролиза. Эти процессы также затруднены по причине малого числа гидроксильных групп в составе молекул ТЭОС. Кроме того, процесс гидролиза по оставшимся спиртовым группам может протекать параллельно с процессами поликонденсации. Таким образом, процесс не может быть описан одним формальным уравнением (1).
В реальных условиях химический процесс представляет собой сложное сочетание нескольких химических и физических процессов – гидролиз, гомогенную и гетерогенную поликонденсацию, агрегацию при коагуляции золя, переконденсацию при высоких рН. Поэтому реакцию (1) можно записать следующим уравнением с учетом воды, входящей в состав твердой фазы:
(4)
$\begin{gathered} {\text{Si(O}}{{{\text{С}}}_{{\text{2}}}}{{{\text{Н}}}_{{\text{5}}}}{{{\text{)}}}_{4}}({\text{ж}}{\text{.}}) + n{{{\text{H}}}_{{\text{2}}}}{\text{O}}({\text{ж}}{\text{.}})\;\overset {{\text{O}}{{{\text{H}}}^{ - }}} \longleftrightarrow \\ \overset {{\text{O}}{{{\text{H}}}^{ - }}} \longleftrightarrow \;{\text{Si}}{{{\text{O}}}_{2}}(m - 2n{\text{)}}{{{\text{H}}}_{{\text{2}}}}{\text{O}}({\text{тв}}{\text{.}}) + \\ + \;4n{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{5}}}}{\text{OH}}({\text{ж}}{\text{.}}) + {{\Delta }_{{\text{r}}}}Н, \\ \end{gathered} $Уравнение (4) можно использовать для образцов, полученных в условиях кинетического режима процесса синтеза при n > 100. При рассмотрении процессов в области соотношения концентраций воды к ТЭОС n < 50 в формулу осадка необходимо включать и этанол.
С учетом того факта, что все образцы содержат фрагменты кристобалита, основу которого составляют два гексагональных кольца, смещенных относительно друг друга на радиус и связанных между собой двумя силоксановыми связями [11], можно предположить, что эта структура является основой структуры ядра глобулы с общей химической формулой
Для образца состава 3 гексагональное кольцо не может быть основой структуры, так как при 53% химически связанной воды кольцо образоваться не может. Допустимое максимальное количество воды при n = 1 и l = 0 составляет 30 мас. %. Все остальные образцы вполне могут иметь гексагональную структуру, тем более, что с ростом соотношения концентраций воды к ТЭОС количество химически удерживаемой воды уменьшается и стабилизируется на уровне 20 мас. %.
С учетом того, что массовая доля хемосорбированного спирта для 1 и 2 составов по данным ДСК составляет (1.5–2)%, формула продукта, полученного в диффузионной области синтеза может быть записана как: ${{({\text{Si}}{{{\text{O}}}_{2}})}_{6}}{{({{{\text{H}}}_{2}}{\text{O}})}_{{9.75}}}{{({{{\text{C}}}_{2}}{{{\text{H}}}_{5}}{\text{OH}})}_{{0.25}}}$, т.е. каждое четвертое–шестое кольцо содержит не подвергшуюся гидролизу молекулу спирта, таким образом, гидролиз прошел по 96% всех связей кремния. Составы, начиная с 4-го подверглись полному гидролизу и описываются формулой – ${{({\text{Si}}{{{\text{O}}}_{2}})}_{{6n}}}{{({{{\text{H}}}_{2}}{\text{O}})}_{m}}$. При n = 2 (два объединенных гексагональных кольца) составы примерно одинаковы и их химическая формула – ${{({\text{Si}}{{{\text{O}}}_{2}})}_{{12}}}{{({{{\text{H}}}_{2}}{\text{O}})}_{{10}}}$. Таким образом, процесс образования силоксановых связей прошел примерно в 58% возможных случаев.
Проведенный анализ и расчеты делают обоснованными принятые при обработке данных термического анализа допущения и возможность применения формулы (2) для расчета скорости процесса синтеза можно считать обоснованной.
Предложена общая химическая формула для основной структуры ядра глобулы. Найдено условие, когда гексагональное кольцо не может быть основой структуры, а также количество химически удерживаемой воды. Получена стехиометрическая формула для продуктов, образующихся в диффузионной и кинетической областях процесса.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Ali M., Meaney S.P., Abedin M.J. et al. // J. Colloid Interface Sci. 2019. V. 552. P. 528–539.
LiY., ZhangL., Li. C. // Ibid. 2020. V. 559. P. 273.
Zaccariello G., Back M., Benedetti A. et al. // Ibid. 2019. V. 549. P. 1.
Kolbe G. Das Complexchemische Verhalten der Kieselsäure: Ph.D. Thesis. Jena. 1956.
Stöber W., Fink A., Bohn E. // J. Colloid Interface Sci. 1968. V. 26 (1). P. 62.
Галинурова М.Н., Рыкова А.И. // Вестн. Курганского гос. университета. 2005. № 4. С. 86.
La Mer V.K., Dinegar R.H. // J. Am. Chem. Soc. 1950. V. 72 (11). P. 4847.
Шабанова Н.А., Попов В.В., Фролов Ю.Г. Исследование поликонденсации кремниевой кислоты в водных растворах / МХТИ им. Д.И. Менделеева. М., 1981. 16 с. Деп. В ВИНИТИ 8.01.1981. № 125-81.
Берштейн В.А., Егоров В.М. Дифференциальная сканирующая калориметрия в физикохимии полимеров. Л.: Химия, 1990. 256 с.
Yurasov N.I., Yurasova I.I., Plokhikh A.I. et al. // J. Phys.: Conf. Ser. 2019. 1348 012082.
Heaney P.J. Reviews in Mineralogy. 1994. V. 29. P. 1.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии