Журнал физической химии, 2021, T. 95, № 6, стр. 908-915
Электронное строение и природа химической связи в BkO2
А. Е. Путков a, Ю. А. Тетерин a, b, *, М. В. Рыжков c, А. Ю. Тетерин b, К. И. Маслаков a, К. Е. Иванов b, С. Н. Калмыков a, b, В. Г. Петров a
a Московский государственный университет имени М.В. Ломоносова,
Химический факультет
119991 Москва, Россия
b Национальный исследовательский центр “Курчатовский институт”
123182 Москва, Россия
c Российская академия наук, Уральское отделение, Институт химии твердого тела
620990 Екатеринбург, Россия
* E-mail: Teterin_YA@nrcki.ru
Поступила в редакцию 31.07.2020
После доработки 14.10.2020
Принята к публикации 16.10.2020
Аннотация
Релятивистским методом дискретного варьирования (РДВ) выполнен первый расчет электронной структуры и рентгеновского фотоэлектронного спектра (РФЭС) валентных электронов BkO2 в диапазоне энергий связи от 0 до ~50 эВ. Установлено удовлетворительное согласие рассчитанного с экспериментальным спектром этого диоксида, полученного ранее в работе других авторов . Построена количественная схема МО, позволяющая понять природу химической связи и структуру РФЭС валентных электронов в BkO2. В отличие от представлений теории кристаллического поля, эффекты ковалентности в BkO2 значительны и приводят к сильному перекрыванию не только Bk6d, но и Bk6р, 5f АО с орбиталями лигандов. Найдено, что электроны внутренних валентных молекулярных орбиталей (МО) на 28% ослабляют химическую связь, обусловленную электронами внешних валентных МО.
Берклий образуется в результате ядерных реакций в небольших количествах. Несмотря на то, что наиболее долгоживущим изотопом является $_{{97}}^{{247}}{\text{Bk}}$ (T1/2 ~ 1380 лет, α), на практике наиболее доступен изотоп $_{{97}}^{{249}}{\text{Bk}}$ (T1/2 ~ 314 суток, β), который используется для изучения физико-химических свойств этого элемента и получения важного для химических исследований изотопа калифорния $_{{98}}^{{249}}{\text{Cf}}$ [1]. Кроме того, берклий и калифорний используются в качестве мишеней при синтезе сверхтяжелых элементов [2, 3]. Данные о физико-химических свойствах берклия и его оксидов отражены в работах [1, 4–8].
Рентгеновские фотоэлектронные спектры (РФЭС) валентных и остовных электронов диоксида $_{{97}}^{{249}}{\text{Bk}}{{{\text{O}}}_{2}}$ получены в диапазоне энергий связи от 0 до ~1000 эВ [9]. В статье [9] отмечено возникновение структуры в спектрах некоторых остовных электронов, которую рассматривали в ионном приближении, и не учитывали влияние кислорода на структуру РФЭС валентных и остовных электронов. В этой статье предполагалось, что Bk5f-электроны, кроме участвующих в химической связи, локализованы, а Bk6p- и O2s-электроны не участвуют в химической связи. Экспериментальный спектр остовных Bk4f-электронов $_{{97}}^{{249}}{\text{Bk}}{{{\text{O}}}_{2}}$ также приведен в работе [10]. В работе [11] теоретически проанализирована сложная структура спектра РФЭС остовных Bk4f-электронов BkO2 c целью установления связи ее параметров с энергией электронного переноса в процессе фотоэмиссии Bk4f-электронов и ковалентного вклада в химическую связь.
При расчете электронной структуры оксидов берклия основное внимание уделялось электронам внешних валентных молекулярных орбиталей (ВМО) в диапазоне энергий связи от 0 до ~15 эВ [12–14]. При этом участие в химической связи электронов внутренних валентных МО (ВВМО) в диапазоне энергий связи от ~15 до ~50 эВ не рассматривалось. Ранее [15] были выполнены нерелятивистские расчеты электронной структуры BkO2 в диапазоне энергий от 0 до ~25 эВ. Однако результаты таких расчетов не позволили расшифровать структуру РФЭС валентных электронов этого диоксида в диапазоне от 0 до ~50 эВ, которая с учетом величин сечений фотоэффекта электронов отражает полную плотность состояний валентных электронов.
Ранее, с учетом структуры спектров остовных электронов и результатов релятивистских расчетов, в частности, для NpO2 [16] и PuO2 [17], нами показано, что структура РФЭС валентных электронов этих диоксидов в основном связана с электронами МО.
В настоящей работе с целью получения теоретического спектра валентных электронов BkO2 в диапазоне энергий связи электронов от 0 до ~50 эВ был проведен первый расчет электронной структуры BkO2 в приближении МО ЛКАО (молекулярные орбитали как линейные комбинации атомных орбиталей) полностью релятивистским методом дискретного варьирования (РДВ). Это необходимо для расшифровки структуры экспериментального спектра, для построения количественной схемы МО и определения роли атомных орбиталей (АО) в формировании особенностей и характера химической связи в BkO2.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ И МЕТОД РАСЧЕТА
Приготовление образца. По данным статьи [9] изотоп берклия $_{{97}}^{{249}}{\text{Bk}}$ (Т1/2 = 314 суток, β) был нанесен в виде тонкой (~3 нм) пленки площадью 3 × 7 мм2 на платиновой фольге (12 × 10 мм2) с использованием сепаратора. Затем нагрет до 900°С и охлажден до комнатной температуры в 1 атмосфере О2 до образования BkO2.
Рентгеновская фотоэлектронная спектроскопия. РФЭС BkO2 были получены на спектрометре Hewlett-Packard 5950A с AlKα (1486.6 эВ) монохроматизированным рентгеновским излучением в вакууме 5 × 10–7 Па при комнатной температуре с использованием низкоэнергетической электронной пушки для компенсации зарядки образца в работе [9]. Разрешение спектрометра, измеренное как ширина на полувысоте линии Au4f7/2-электронов, равно 0.55 эВ. Погрешность при измерении относительных интенсивностей – ±10%. Энергии связи электронов BkO2, измеренные с погрешностью ~±0.2 эВ, равны: 18.3 (6p3/2); 34.0 (6p1/2); 120.1 (5d5/2); 245.8 (5p3/2); 498.5 (4f7/2); 514.4 (4f5/2); 901.4 (4d5/2); 957.7 (4d3/2); 23.4 (O2s); 529.5 (O1s) и 285.3 эВ (C1s).
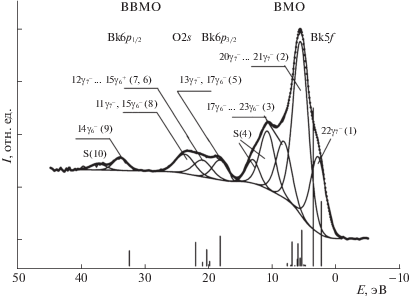
При обработке спектра BkO2, полученного в работе [9], в настоящей работе спектральный фон, обусловленный упруго рассеянными электронами, вычитался по методу Ширли [18], а деление спектра на компоненты осуществлялось с использованием программы “SPRO” [19] (рис. 1).
Рис. 1.
РФЭС валентных электронов BkO2 взят из работы [9]: показано разделение спектра на отдельные компоненты, вертикальными линиями отмечен рассчитанный спектр (РДВ). Обозначения МО те же, что и в табл. 1.
Метод расчета. Кластер ${\text{BkO}}_{8}^{{12 - }}$ точечной группы симметрии D4h, включающий ближайшее окружение берклия в BkO2, представляет собой объемно-центрированный куб, в центре которого находится берклий, а в вершинах – восемь кислородов с длиной связи RBk–O = 0.23097 нм [1, 20, 21]. Расчеты такого кластера впервые проведены в настоящей работе в приближении самосогласованного поля релятивистским методом дискретного варьирования (ССП РДВ) [22, 23], основанного на решении уравнения Дирака–Слэтера для четырехкомпонентных спиноров, с обменно-корреляционным потенциалом [24]. Расширенный базис численных атомных орбиталей, полученных при решении уравнения Дирака–Слэтера для изолированных атомов, включал помимо заполненных, также вакантные Bk7p1/2, 7p3/2 состояния. Кроме того, базис учитывал симметрию кластера, т.е. с помощью техники проекционных операторов [22] из обычных АО конструировались их линейные комбинации, преобразующиеся по неприводимым представлениям двойной группы D4h. Для этого использовалась оригинальная программа симметризации, использующая матрицы неприводимых представлений большинства двойных групп, полученных в работах [24, 25], и матрицы преобразований спиноров, приведенные в [26]. Численное диофантово интегрирование при вычислении матричных элементов секулярного уравнения проводилось по набору из 22 000 точек, распределенных в пространстве кластера, что обеспечивало сходимость энергий молекулярных орбиталей в пределах 0.1 эВ. Отсутствие muffin-tin (МТ) – аппроксимации потенциала в методе РДВ позволяет проводить расчеты кластеров любой симметрии с одинаковой точностью. Кроме того, приближение МО ЛКАО позволяют анализировать роль атомных состояний в формировании электронной структуры, химической связи, спектральных и других свойствах твердофазных соединений.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
РФЭС валентных электронов BkO2 в области энергий связи от 0 до ~50 эВ, может быть условно разделен на спектры электронов ВМО (от 0 до ~15 эВ) и ВВМО (от ~15 до ~50 эВ) (рис. 1).
Электронная структура BkO2. В основном состоянии электронная валентная конфигурация берклия – Bk6s26p65f 96d07s27p0, $^{6}{{{\text{H}}}_{{7 + 1/2}}}$ [1]. Результаты расчета электронной структуры BkO2 приведены в табл. 1. Поскольку задача настоящей работы – анализ РФЭС и химического связывания, в таблице показаны только заполненные орбитали. Кроме того, для Bk7p1/2, 7p3/2 и O2p1/2, 2p3/2 состояний, для которых спин-орбитальные взаимодействия малы, приведены суммарные вклады.
Таблица 1.
Состав (доли), энергии $Е_{0}^{{{\text{a)}}}}$ (эВ) заполненных МО кластера BkO8 и сечения фотоэффекта $\sigma _{i}^{{{\text{b)}}}}$
| –МО | –E0, эВ | Состав МО | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Bk | O | |||||||||||
| 6s | 6p1/2 | 6p3/2 | 6d3/2 | 6d5/2 | 7s | 5f5/2 | 5f7/2 | 7p2 | 2s | 2p2 | ||
| $\sigma _{i}^{{{\text{b)}}}}$ 1.22 |
0.89 | 1.40 | 0.64 | 0.53 | 0.11 | 5.68 | 5.27 | 0.05 | 0.96 | 0.07 | ||
| ВМО | ||||||||||||
| 22$\gamma _{7}^{ - }$c) | 0.00 | 0.91 | 0.09 | |||||||||
| 21$\gamma _{7}^{ - }$ | 1.21 | 0.70 | 0.13 | 0.17 | ||||||||
| 24$\gamma _{6}^{ - }$ | 1.32 | 0.01 | 0.74 | 0.02 | 0.23 | |||||||
| 20$\gamma _{7}^{ - }$ | 1.33 | 0.01 | 0.74 | 0.02 | 0.01 | 0.22 | ||||||
| 23$\gamma _{6}^{ - }$ | 2.49 | 1.00 | ||||||||||
| 19$\gamma _{7}^{ - }$ | 2.50 | 1.00 | ||||||||||
| 22$\gamma _{6}^{ + }$ | 2.72 | 1.00 | ||||||||||
| 19$\gamma _{7}^{ + }$ | 2.73 | 1.00 | ||||||||||
| 21$\gamma _{6}^{ + }$ | 2.74 | 1.00 | ||||||||||
| 18$\gamma _{7}^{ + }$ | 3.03 | 0.01 | 0.99 | |||||||||
| 20$\gamma _{6}^{ + }$ | 3.07 | 1.00 | ||||||||||
| 17$\gamma _{7}^{ + }$ | 3.07 | 0.01 | 0.99 | |||||||||
| 22$\gamma _{6}^{ - }$ | 3.08 | 0.03 | 0.19 | 0.03 | 0.75 | |||||||
| 18$\gamma _{7}^{ - }$ | 3.08 | 0.03 | 0.19 | 0.03 | 0.75 | |||||||
| 21$\gamma _{6}^{ - }$ | 3.32 | 0.10 | 0.01 | 0.89 | ||||||||
| 17$\gamma _{7}^{ - }$ | 3.66 | 0.18 | 0.11 | 0.71 | ||||||||
| 16$\gamma _{7}^{ - }$ | 3.74 | 0.01 | 0.03 | 0.01 | 0.04 | 0.91 | ||||||
| 20$\gamma _{6}^{ - }$ | 3.75 | 0.01 | 0.03 | 0.01 | 0.05 | 0.90 | ||||||
| 19$\gamma _{6}^{ - }$ | 4.15 | 0.01 | 0.04 | 0.01 | 0.94 | |||||||
| 16$\gamma _{7}^{ + }$ | 4.55 | 0.10 | 0.01 | 0.89 | ||||||||
| 15$\gamma _{7}^{ - }$ | 4.57 | 0.04 | 0.03 | 0.93 | ||||||||
| 18$\gamma _{6}^{ - }$ | 4.57 | 0.04 | 0.03 | 0.93 | ||||||||
| 19$\gamma _{6}^{ + }$ | 4.58 | 0.07 | 0.04 | 0.01 | 0.88 | |||||||
| 15$\gamma _{7}^{ + }$ | 4.59 | 0.06 | 0.05 | 0.01 | 0.88 | |||||||
| 14$\gamma _{7}^{ - }$ | 4.60 | 0.06 | 0.02 | 0.92 | ||||||||
| 18$\gamma _{6}^{ + }$ | 4.78 | 0.06 | 0.01 | 0.93 | ||||||||
| 14$\gamma _{7}^{ + }$ | 5.33 | 0.06 | 0.08 | 0.86 | ||||||||
| 17$\gamma _{6}^{ + }$ | 5.35 | 0.06 | 0.08 | 0.86 | ||||||||
| ВВМО | ||||||||||||
| 17$\gamma _{6}^{ - }$ | 15.84 | 0.52 | 0.02 | 0.42 | 0.04 | |||||||
| 13$\gamma _{7}^{ - }$ | 15.85 | 0.52 | 0.02 | 0.42 | 0.04 | |||||||
| 12$\gamma _{7}^{ - }$ | 17.50 | 0.01 | 0.01 | 0.98 | ||||||||
| 13$\gamma _{7}^{ + }$ | 17.96 | 0.05 | 0.95 | |||||||||
| 16$\gamma _{6}^{ + }$ | 17.96 | 0.03 | 0.02 | 0.95 | ||||||||
| 12$\gamma _{7}^{ + }$ | 17.97 | 0.03 | 0.03 | 0.94 | ||||||||
| 16$\gamma _{6}^{ - }$ | 18.03 | 0.01 | 0.05 | 0.94 | ||||||||
| 15$\gamma _{6}^{ + }$ | 18.62 | 0.07 | 0.93 | |||||||||
| 15$\gamma _{6}^{ - }$ | 19.69 | 0.43 | 0.02 | 0.53 | 0.02 | |||||||
| 11$\gamma _{7}^{ - }$ | 19.70 | 0.43 | 0.01 | 0.55 | 0.01 | |||||||
| 14$\gamma _{6}^{ - }$ | 30.09 | 0.98 | 0.01 | 0.01 | ||||||||
| 14$\gamma _{6}^{ + }$ | 51.38 | 1.00 | ||||||||||
b) Сечения фотоэффекта σi (килобарн на один электрон), полученные в работе [36].
В отличие от приближения кристаллического поля, где характеристики атомных состояний модифицируются под действием поля окружающих лигандов, в методе МО ЛКАО из атомных орбиталей формируются молекулярные орбитали. Вклады различных АО в каждой МО зависят от их энергий и степени перекрывания. В случае BkO2 происходит смешивание не только делокализованных Bk6d, 7s, 7р с О2р АО, но и перекрывание Bk6p, 5f с O2s, 2p АО. В отличие от результатов нерелятивистского расчета BkO2 [15], где найдено значительное участие Bk6s АО в образовании МО, из данных релятивистского расчета следует, что Bk6s оболочка практически не участвует в образовании МО, а Bk7p АО в большей степени перекрываются с орбиталями кислорода (табл. 1).
Верхнюю наполовину заполненную (ВЗМО) 22γ$_{7}^{ - }$ ВМО, содержащую 0.91 Bk5f7/2 AO, можно формально рассматривать как квазиатомную АО, а электроны в этом состоянии – как локализованные. Остальные 7.0 Bk5f-электронов делокализованы в пределах ВМО. Для этих ВМО наблюдается сильное смешивание орбиталей берклия и кислорода, а также вклады Bk5f и Bk6p АО.
Делокализованные Bk5f-электроны вносят существенный вклад в ковалентную составляющую химической связи за счет смешивания с орбиталями кислорода. Их примеси в ВМО с основными вкладами O2p-электронов могут достигать, например, 29% в 17γ$_{7}^{ - }$ МО. Примеси Bk6d АО в ВМО О2р-типа, например для 14γ$_{7}^{ + }$ МО, несколько меньше, чем для Bk5f АО, и равны 14%. Орбитали с основными вкладами Bk5f АО, например, 20γ$_{7}^{ - }$, содержат 22% O2р АО, а МО с основными вкладами Bk6d АО, например 17γ$_{6}^{ + }$ ВМО, содержат 86% О2р АО.
Вклады Bk5f АО в МО O2s-электронов остаются незначительными, как и для диоксидов легких актиноидов AnO2 (An = Np, Pu) [16, 17]. С другой стороны, примеси Bk5f АО в МО O2р-электронов в BkO2 существенно больше. Вклады Bk6d АО в ВМО О2р-электронов слабо изменяются для AnO2 (An = Np, Pu, Bk) с увеличением атомного номера Z. Структура МО, содержащих Bk6d, 7s и 7р АО в BkO2, мало меняется по сравнению с диоксидами легких актиноидов. Эти состояния вместе c МО O2s- и О2р-типа образуют “жесткий каркас”, в котором перемещаются МО, содержащие An5f АО, в соответствие со степенью их заполнения в диоксидах легких актиноидов.
Bk6p и 6d АО участвуют в образовании как ВМО, так и ВВМО. При этом значительное участие в образовании ВВМО принимают Bk6p и O2s АО. В результате возникают “разрыхляющие” 17γ$_{6}^{ - }$, 13γ$_{7}^{ - }$ (5) и “связывающие” 15γ$_{6}^{ - }$, 11γ$_{7}^{ - }$ (8) ВВМО (табл. 1, рис. 2). Гибридизация Bk6p1/2 и O2s АО с образованием “разрыхляющей” 16γ$_{6}^{ - }$ (6) и “связывающей” 14γ$_{6}^{ - }$ (9) ВВМО происходит в незначительной степени, по сравнению с соответствующими орбиталями в ThO2 [27] и UO2 [28]. Это связано с ростом спин-орбитального расщепления от ΔEs (Th6p) = 8.5 эВ до ΔEs(Bk6p) = = 15.7 эВ [29]. При этом в ряду от Th до Bk энергия An6p3/2-электронов увеличивается на 1.0 эВ, а An6p1/2-электронов – на 8.2 эВ. Одновременно существенно увеличивается разность энергий An6p1/2 и O2s АО, что приводит к уменьшению их перекрывания.
При переходе от ThO2 [27] к AmO2 [30] и BkO2 (табл. 1) наблюдается увеличение плотности заполненных состояний An5f-электронов в области ВМО и увеличение энергии “квазиатомных” An5f-электронов, начиная с UO2 [28]. При этом, малое (~1.1 эВ [9]) изменение энергии связи An6p3/2-электронов 17γ$_{6}^{ - }$ (5) ВВМО подтверждает их валентный характер, поскольку, если бы An6p3/2-электроны были полностью остовными, то энергия их связи должна была увеличиваться пропорционально ~Z2 [31].
На основании анализа ковалентного смешивания АО берклия и кислорода в валентных МО BkO2 можно заключить, что в отличие от результатов теории кристаллического поля, эффекты ковалентности в BkO2 являются значительными и приводят к сильному перекрыванию орбиталей лигандов не только с Bk6d, но и с Bk6р и 5f АО.
Электронная конфигурация и эффективный заряд иона берклия в BkO2. В ионном приближении в BkO2 валентная электронная конфигурация иона берклия есть Bk6s26p65f76d07s07p0, а его эффективный заряд QI = +4e– (электрона). Из-за перекрывания АО берклия и кислорода конфигурация иона берклия в BkO2 в результате Малликеновского анализа населенностей становится равной Bk6s26p65f7.936d1.567s0.267p0.52 (табл. 1). Вакантные в ионном приближении Bk6d07s07p0 АО оказываются населенными 1.56, 0.26 и 0.52 электронами соответственно. Повышается населенность Bk5f AO и возникают небольшие населенности Bk7s и Bk7р АО. С учетом атомной конфигурации Bk6s26p65f96d07s27p0 можно найти, что эффективный заряд берклия равен QR = +0.73e–, что существенно меньше QNR = +1.78e–, полученного в нерелятивистском Хα-ДВ расчете кластера BkO8 [15]. Значительное уменьшение величины эффективного заряда QR по сравнению с QNR в BkO2 качественно согласуется с результатами, полученными для оксидов актиноидов на основании данных [32]. Величина небольшого эффективного заряда берклия в диоксиде качественно согласуется с данными для химических сдвигов в спектрах линий актиноидов в диоксидах по отношению к металлам. Например, для Np4f7/2-электронов наблюдается сдвиг равный ΔEb = 2.4 эВ при переходе от металлического Np к NpO2 [16]. Если бы эффективный заряд был равен QNp = = +4е–, то это приводило бы к сдвигу в десятки эВ. Известно, что возникновение одной вакансии на квазиостовном уровне в CeO2 приводит к сдвигу линий, например, Ce3d-электронов на ~16.0 эВ [33, 34].
Структура РФЭС валентных электронов BkO2. РФЭС валентных электронов BkO2 содержит структуру в области электронов ВМО и ВВМО в диапазоне энергий от 0 до ~50 эВ (рис. 1). Ранее [9], в приближении свободных ионов для Bk2O3 (f 8) и BkO2 (f 7) рассчитаны возможные структуры спектров локализованных Bk5f-электронов от 0 до ~15 эВ, связанные с мультиплетным расщеплением. На основе этих данных предположено [9], что интенсивное плечо со стороны высоких энергий связи электронов ВМО при 10.8 и 13.1 эВ может быть связано с присутствием Bk2O3 в образце BkO2 (рис. 1).
Структура, наблюдаемая в области ВМО, в основном образована из Bk5f, 6d, 7s, 7p и O2p АО соседних атомов (табл. 1). В этой области также наблюдаются заполненные Bk6p и O2s состояния, а также линия, обусловленная квазиатомными Bk5f-электронами при 2.9 эВ.
Структура РФЭС электронов ВМО имеет характерные особенности и может быть условно разделена на три компоненты (1, 2, 3) при 2.9, 5.6 и 8.2 эВ (рис. 1, 2).
В области спектра электронов ВВМО наблюдается структура, которая в большой степени обусловлена перекрыванием Bk6p и O2s АО соседних атомов. Эта структура может быть условно разделена на пять (5, 6, 7, 8, 9) компонент (рис. 1, 2). Сателлит S(10) при 37.3 эВ может быть связан с многоэлектронными процессами. Формальное деление спектра на компоненты позволяет проводить качественное и количественное сравнение экспериментального и рассчитанного спектров BkO2 (рис. 1).
Для этого значения энергий (табл. 1) были увеличены по абсолютной величине на 2.36 эВ так, чтобы энергия 17γ$_{6}^{ - }$ МО была равна 18.2 эВ [9]. Рассчитанные интенсивности отдельных участков спектра BkO2 были получены с учетом состава МО (табл. 1) и сечений фотоэффекта для различных электронов [35, 36].
Теоретический спектр представлен в виде вертикальных прямых, высота которых пропорциональна интенсивности линий (рис. 1). Наблюдается удовлетворительное качественное и в некоторых случаях количественное согласие между рассчитанными и экспериментальными характеристиками РФЭС валентных электронов BkO2.
Так, рассчитанные ширины зон ВМО и ВВМО (Γ(ВМО) = 5.35 эВ и Γ(ВВМО) = 14.25 эВ) сравнимы с соответствующими экспериментальными значениями (Γ(ВМО) = 5.3 эВ и Γ(ВВМО) = 15.7 эВ). Рассчитанные интенсивности зон ВМО и ВВМО (I(ВМО) = 77.9% и I(ВВМО) = 22.1%) также находятся в качественном согласии с соответствующими экспериментальными величинами (I(ВМО) = = 82.5% и I(ВВМО) = 17.2%).
Наблюдается согласие между некоторыми экспериментальными и рассчитанными величинами энергий связи электронов (рис. 1). В области ВВМО такое согласие, например, наблюдается для 17γ$_{6}^{ - }$, 13γ$_{7}^{ - }$ (5) и 14γ$_{6}^{ - }$ (9) ВВМО, характеризующих ширину зоны спектра этих электронов. При этом в меньшей степени соответствие между теоретическими и экспериментальными данными наблюдается для средней части спектра электронов ВВМО (12γ$_{7}^{ - }$–11γ$_{7}^{ - }$).
Значительный вклад в интенсивность спектра электронов ВМО вносят Bk5f-электроны, которые имеют наибольшее сечение фотоэффекта σi (табл. 1). Так, Bk5f-электроны могут возбуждаться на Bk6d уровень и затем участвовать в образовании химической связи, а могут непосредственно в ней участвовать не теряя своего f -характера. Если при включении в химическую связь Bk5f-электроны теряют свой f-характер, то должна существенно уменьшаться интенсивность полосы ВМО. Из данных расчета следует, что Bk5f-электроны непосредственно участвуют в химической связи, частично теряя свой f-характер за счет нефелоауксетического эффекта (табл. 1).
В ионном приближении найдено [31], что отношение интенсивности спектра области электронов ВМО к ВВМО для BkO2 с электронной валентной конфигурации берклия Bk6s26p65f 76d27s27p0 равна 3.72. Эта величина несколько больше теоретического значения 3.17 для валентной конфигурации Bk6s26p65f 7.936d1.567s0.267p0.52 берклия в кластере BkO8 и отличается от экспериментальной величины 4.71 (табл. 2). Экспериментальная величина 4.71 согласуется с величиной 4.57 для конфигурации берклия Bk6s26p65f 96d07s27p0 [31]. Значительное увеличение экспериментальной величины 4.71 (рост заполненных состояний Bk5f-электронов) по сравнению с рассчитанной величиной 3.17 можно объяснить только примесью Bk2O3 на поверхности образца BkO2.
Таблица 2.
Заселённости перекрывания для BkO2 (на один лиганд, ×103), полученные в релятивистском и нерелятивистском приближении
| Связи в BkO2 | РДВa | НДВ | |
|---|---|---|---|
| парциальные | полные | ||
| Bk5f5/2 – O2p | –5 | ||
| Bk5f7/2 – O2p | 34 | 29 | 22 |
| Bk5f5/2 – O2s | –2 | ||
| Bk5f7/2 – O2s | 5 | 3 | 1 |
| Bk7p1/2 – O2p | 23 | ||
| Bk7p3/2 – O2p | 39 | 62 | 64 |
| Bk7p1/2 – O2s | 13 | ||
| Bk7p3/2 – O2s | 18 | 31 | 21 |
| Bk7s – O2p | 28 | 28 | 2 |
| Bk7s – O2s | 20 | 20 | 26 |
| Bk6d3/2 – O2p | 76 | ||
| Bk6d5/2 – O2p | 110 | 186 | 164 |
| Bk6d3/2 – O2s | 14 | ||
| Bk6d5/2 – O2s | 23 | 37 | 32 |
| $\Sigma _{{{\text{ВМО}}}}^{{\text{a}}}$ | 396 | 396 | 332 |
| Bk6p1/2 – O2p | –13 | ||
| Bk6p3/2 – O2p | –60 | –73 | –82 |
| Bk6p1/2 – O2s | –3 | ||
| Bk6p3/2 – O2s | –19 | –22 | –32 |
| Bk6s – O2p | –16 | –16 | –37 |
| Bk6s – O2s | –1 | –1 | –5 |
| $\Sigma _{{{\text{ВВМО}}}}^{{\text{a}}}$ | –112 | –112 | –156 |
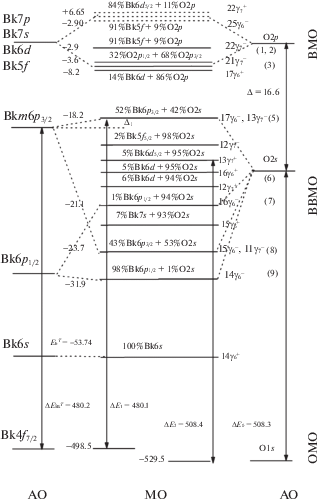
Cхема валентных МО BkO2. Количественная схема МО для BkO2 построена с учетом данных настоящей работы, энергий связи атома берклия [29], спектров РФЭС валентных и остовных электронов диоксида берклия [9] и экспериментальных разностей энергий связи валентных и остовных электронов BkO2 (рис. 2). Обозначения на схеме такие же, как и на рис. 1 и табл. 1. Слева приведены экспериментальные значения энергий связи электронов. Занятые МО отмечены в виде сплошных горизонтальных линий, а вакантные МО – в виде штрихов. Над горизонтальными прямыми МО дан их состав в %. Справа от МО даны их обозначения (табл. 1), а в скобках – номера групп МО. Разности энергий МО, отмеченные на схеме, могут быть измерены экспериментально.
На схеме отражены ВМО, ВВМО и ОМО. В области ВМО верхняя заполненная МО (ВЗМО) и нижняя незаполненная МО (ННМО) в основном состоят из Bk5f AO. У дна зоны ВМО наблюдается вклад Bk6d AO. Среди ВВМО можно формально выделить “разрыхляющие” 17γ$_{6}^{ - }$, 13γ$_{7}^{ - }$ (5) и 16γ$_{6}^{ - }$ (6) и соответствующие им “связывающие” 15γ$_{6}^{ - }$, 11γ$_{7}^{ - }$ (8) и 14γ$_{6}^{ - }$ (9) ВВМО, которые попарно соединены штрихами. “Квазиатомные” 12γ$_{7}^{ - }$, 13γ$_{7}^{ + }$, 12γ$_{7}^{ + }$, 16γ$_{6}^{ + }$ и 15γ$_{6}^{ + }$ (7) ВВМО обусловлены в основном O2s АО. Энергии “квазиатомных” ВВМО должны быть близки по величине. На основании величин ширины линий электронов ВВМО трудно сделать заключение об их относительном характере (связывающем или разрыхляющем). Однако можно предположить, например, что из-за примеси 4% О2р и 2% Bk7p АО в 17γ$_{6}^{ - }$, 13γ$_{7}^{ - }$ (5) ВВМО эти орбитали частично теряют свой разрыхляющий характер (табл. 1, рис. 2, см. также [35]).
Схема МО для BkO2 позволяет не только понять природу формирования химической связи в этом диоксиде, но и лежит в основе расшифровки структуры других рентгеновских (эмиссионных, поглощения и др.) спектров BkO2, как показано для диоксидов AnO2 (An = Th, U, Np, Pu, Am) [16, 17, 27, 28, 30].
Вклад электронов валентных МО в химическую связь в BkО2. Для оценки вклада электронов различных МО в химическую связь в работе методами НДВ (нерелятивистский ДВ) и РДВ были рассчитаны величины заселенностей перекрывания для различных МО в кластере BkO8 (табл. 2) [35, 37]. Вклад в заселенность связи от электронов связывающей МО – положителен, а вклад от электронов разрыхляющей МО – отрицателен. Положительные величины таких заселенностей характеризуют усиление (связывание) взаимодействия, а отрицательные величины – ослабление (разрыхление) связи.
Данные нерелятивистского и релятивистского расчетов отличаются. Так, вклад в заселенность связей Bk5f – O2p, Bk7s – O2p, Bk6d – O2p, Bk7p – O2s значительно увеличивается при релятивистском расчете, что характеризует усиление связи. Связи Bk6s – O2s, 2p и Bk6p – O2s, 2p в релятивистском приближении имеют меньший разрыхляющий характер, чем в нерелятивистском. Это связано с тем, что в релятивистском приближении энергия Bk6s- и Bk6р1/2-электронов существенно увеличивается по абсолютной величине (что согласуется с экспериментом) по сравнению с энергией, рассчитанной в нерелятивистском приближении.
В релятивистском приближении вклад в заселенность связей BkО2 внешней валентной оболочки равен 396 (табл. 2). Наибольший вклад в усиление связи вносят электроны Bk6d – O2p (186), Bk7p – O2p (62), Bk6d – O2s (37) и Bk5f – O2p (29). Электроны ВВМО внутренних валентных оболочек берклия разрыхляют связь в BkO2 и их общий вклад в заселенность равен (–112). Наибольший вклад в разрыхление такой связи вносят электроны Bk6р – O2p (–73). В совокупности электроны ВВМО (–112) на 28% ослабляют связь, обусловленную электронами ВМО (396). В результате суммарный вклад валентных электронов в связь в BkО2 в единицах заселенностей перекрывания равен 284.
Таким образом, проведен первый релятивистский расчет электронной структуры диоксида BkO2, получен теоретический РФЭС валентных электронов в диапазоне энергий от 0 до ~50 эВ и найдено удовлетворительное согласие с соответствующим экспериментальным спектром. Расшифрована структура экспериментального спектра, построена количественная схема МО и изучена роль атомных орбиталей (АО) в формировании особенностей и характера химической связи в BkO2.
Установлено, что в отличие от представлений теории кристаллического поля, эффекты ковалентности в BkO2 – значительные. Это связано с сильным перекрыванием не только Bk6d, но и Bk6р,5f АО с орбиталями лигандов.
Из оценки вклада электронов в составляющую химической связи найдено, что электроны ВВМО на 28% ослабляют связь, обусловленную электронами ВМО.
Полученные данные согласуются с результатами для диоксидов AnO2 (An = Th, U, Np, Pu, Am) и необходимы для установления общих закономерностей формирования особенностей и характера (ионного, ковалентного) химической связи от атомного номера Z в полном ряду диоксидов актиноидов.
Работа поддержана грантом Российского фонда фундаментальных исследований (код проекта № 20-03-00333).
Список литературы
Химия актинидов. Т. 2 // Под ред. Кац Дж., Сиборг Г., Морсс Л. Пер. под ред. Б.Ф. Мясоедова М.: Мир, 1997. С. 654. (The chemistry of the actinide elements, V. 1&2, Ed. by J.J. Katz, G.T. Seaborg, L.R. Morss London-New York: Chapman and Hall).
Oganessian Yu.Ts., Abdullin F.Sh., Bailey P.D. et al. // Physical Review Letters. 2010. 104 (14). P. 142502.
Oganessian Yu.Ts., Abdullin F.Sh., Alexander C. et al. // Physical Review Letters. 2012. 109 (16). P. 162501.
The Chemistry of the Actinide and Transactinide Elements. Fourth Edition. V. 1–6 // Ed. by Morss L.R., Edelstain N.M., Fuger J. Springen 2010. Printed in the Netherlands.
Мефодьева М.П., Крот Н.Н. Соединения трансурановых элементов. М.: Наука. 1987. 302 с.
Sevier K.D. // At. Data Nucl. Data Tables. 1979. 24. P. 323.
Moor K.T., van der Laan G. // Rev. Mod. Phys. 2009. 81. P. 235.
Krause M.O., Nestor C.W. // Physica Scripta. 1977. 16. P. 285.
Veal B.W., Lam D.J., Diamond H., Hoekstra H.R. // Phys. Rev. B. 1977. 15 (6). P. 2929.
Krause M.O., Haire R.G., Keski-Rahkonen O. et al. // J. of Electron Spectr. and Rel. Phen. 1988. 47. P. 215.
Kotani A., Ogasawara H. // Physica B: Cond. Mat. 1993. 186–188. P. 16.
Prodan D., Scuseria G.E., Martin R.L. // Phys. Rev. B. 2007. 76. P. 033101.
Petit L., Svain A., Szotek Z. et al. // Ibid. 2010. 81. P. 045108.
Wen X.-D., Martin R.L., Henderson T.M. et al. // Chem. Rev. 2013. 113. P. 1063.
Gubanov V.A., Rosen A., Ellis D.E. // J. Phys. Chem. Solids. 1979. 40. P. 17.
Teterin Yu.A., Teterin A.Yu., Ivanov K.E. et al. // Phys. Rev. B. 2014. 89. P. 035102.
Teterin Yu.A., Maslakov K.I., Teterin A.Yu. et al. // Ibid. 2013. 87. P. 245108.
Shirley D.A. // Ibid. 1972. 5. P. 4709.
Panov A.D. Packet of Programs of Spectra Processing SPRO and Programming Language SL. Preprint of the Institute of Atomic Energy, Moscow, IAE-6019/15, 1997. 31 p.
Peterson J.R., Cunningham B.B. // Transactions and J. of the British Ceramic Society. 1984. 83. P. 32.
Baybarz R.D. // J. of Inorg. and Nucl. Chem. 1968. 30 (7). P. 1769.
Rosen A., Ellis D.E. // J. Chem. Phys. 1975. 62. P. 3039.
Ellis D.E., Goodman G.L. // Int. J. Quant. Chem. 1984. 25. P. 185.
Gunnarsson O., Lundqvist B.I. // Phys. Rev. B. 1976. 13. P. 4274.
Pyykko P., Toivonen H. // Acta Acad. Aboensis. 1983. Ser. B. 43. P. 1.
Varshalovish D.A., Moskalev A.N., Khersonskii V.K. Quantum Theory of Angular Momentum. World Scientific. Singapore, 1988, 439 p.
Teterin A.Y., Ryzhkov M.V., Teterin Y.A. et al. // Radiochemistry. 2009. 51. P. 560.
Maslakov K.I., Teterin Yu.A., Ryzhkov M.V. et al. // Int. J. Quantum Chem. 2019; e26040.
Trzhaskovskaya M.B., Yarzhemsky V.G. // Atom. Data Nucl. Data. 2018. 119. P. 99.
Teterin Yu.A., Maslakov K.I., Ryzhkov M.V. et al. // Radiochemistry. 2015. 57 (6). P. 565.
Teterin Yu.A., Teterin A.Yu. // Russian Chem. Rev. 2004. 73. P. 541.
Zaitsevskii A., Skripnikov L.V., Titov A.V. // Mendeleev Communications. 2016. 26. P. 307.
Maslakov K.I., Teterin Yu.A., Popel A.J. et al. // Appl. Surf. Science. 2018. 448. P. 154.
Maslakov K.I., Teterin Yu.A., Ryzhkov M.V. et al. // Phys. Chem. Chem. Phys. 2018. 20 (23). P. 16167.
Teterin Yu.A., Gagarin S.G. // Russian Chem. Rev. 1996. 65. P. 825.
Yarzhemsky V.G., Teterin A.Yu., Teterin Yu.A. et al. // Nucl. Tech. & Rad. Prot. 2012. 27. P. 103.
Mulliken R.S. // Annu. Rev. Phys. Chem. 1978. 29. P. 1.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии