Журнал физической химии, 2021, T. 95, № 6, стр. 928-932
Адсорбция глифосата на углеродсодержащих материалах
Динь Тьиен Нгуен a, b, *, А. И. Везенцев a, **, П. В. Соколовский c, ***, А. А. Грейш c, ****
a Белгородский государственный национальный исследовательский университет
308015 Белгород, Россия
b Институт экологических технологий Вьетнамской академии наук и технологий
650000 Ханой, Вьетнам
c Российская академия наук, Институт органической химии ин. Н.Д. Зелинского
119991 Москва, Россия
* E-mail: ngudichi@yandex.ru
** E-mail: vesentsev@bsu.edu.ru
*** E-mail: carbsorb@gmail.com
**** E-mail: greish@ioc.ac.ru
Поступила в редакцию 15.07.2020
После доработки 15.07.2020
Принята к публикации 11.08.2020
Аннотация
Исследована адсорбция глифосата на углеродсодержащих материалах на основе продуктов пиролиза отходов сахарного тростника и коммерческом кокосовом активированном угле. C помощью различных экспериментальных моделей, определена адсорбционная емкость исследуемых материалов по отношению к глифосату. Согласно полученным данным, адсорбция глифосата на исследуемых образцах обусловлена химическим взаимодействием с поверхностью адсорбентов.
Применение пестицидов и гербицидов в борьбе с насекомыми и сорняками является традиционным приемом в растениеводстве для повышения урожайности сельскохозяйственных культур. Спрос на гербициды и пестициды в сельском хозяйстве с каждым годом растет. Вместе с тем, при разработке современных химических средств защиты растений необходимо стремиться к уменьшению негативных последствий их применения. Идеальный гербицид должен отвечать следующим требованиям: быть эффективным в сравнительно малых дозах, при этом должен оказывать быстрое воздействие на сорную растительность, а впоследствии должен разлагаться до относительно простых химических соединений. Однако многие используемые сегодня гербициды, в том числе глифосат, не соответствуют этому стандарту, вследствие чего регулярное применение подобных гербицидов может приводить к загрязнению почв и сопредельных сред.
Глифосат является одним из наиболее распространенных и широко применяемых гербицидов. Глифосат (N-(фосфонометил)-глицин, C3H8NO5P) является производным фосфоновой кислоты и обладает достаточно высокой растворимостью в воде (10.5 г/л). Попадание глифосата в водоемы происходит в результате небрежной транспортировки в открытых емкостях или неправильного хранения и применения. Это оказывает большое негативное воздействие на водную биоту, фитопланктон и перифитон [1–3]. По информации Международного агентства по изучению рака Всемирной организации здравоохранения глифосат относится к канцерогенным соединениям (категория опасности “2А”) [4]. Поэтому применение препаратов на основе глифосата требует особой аккуратности и осторожности.
Методы очистки воды от глифосата можно условно разделить на следующие виды: физические (процеживание, отстаивание, фильтрование (в том числе центробежное), ультрафиолетовая обработка, химические (нейтрализация, окисление, восстановление), физико-химические (флотация, сорбция, экстракция, ионный обмен, электродиализ, обратный осмос, термические методы) и биологические (биологические пруды, поля фильтрации, биофильтры, аэротенки (окситенки), метантенки). Каждый из указанных способов удаления примесей глифосфата из водных сред включает в себя множество конкретных вариантов реализации процесса очистки и его аппаратного оформления. Следует отметить, что нередко для достижения максимальной эффективности удаления вредного соединения очистку воды проводят как комплексный процесс, с использованием принципиально отличающихся между собой методов очистки.
Известно, что при попадании в почву гербицид может связываться с органическим веществом почвы или ее глинистой фракцией. Это приводит к уменьшению концентрации гербицида в почвенном растворе и, как следствие, к снижению уровня его токсичности. Известно, что при попадании в почву глифосат может потерять гербицидные свойства из-за адсорбции на минеральных или органических соединениях. Глифосат наиболее сильно связывается с неорганической частью почвы, а именно, с частицами глины, а также с оксидами алюминия и железа [5–9].
Согласно ряду исследований, адсорбция гербицида отрицательно коррелирует с pH почвы, это вызвано тем, что повышение рН может приводить к увеличению отрицательного заряда как поверхности почвы, так и самого глифосата, что, в свою очередь, приводит к ослаблению адсорбции [10, 11].
Несмотря на важную роль минеральной части почвы, для адсорбции глифосата большое значение имеет и органическая часть. В ходе исследований сорбции глифосата на семи очищенных фракциях почвенного гумуса было выявлено большое влияние ароматической составляющей гумуса, предположительно, фенольных групп. Органическая часть почвы играет более значимую роль для сорбции глифосата в песчаных почвах, чем в глинистых отложениях. Однако десорбция глифосата с гумуса происходит быстрее, чем с аморфных оксидов железа и алюминия [12]. Сохранение пожнивных остатков на поле также ведет к уменьшению мобильности глифосата и к увеличению его периода полуразложения [13].
Детальная характеристика процесса адсорбции гербицида в воде и в почве является необходимым этапом изучения его поведения в окружающей среде, т.к. характер связывания гербицида во многом определяет его способность как к перемещению, так и к его разложению. Для описания процесса адсорбции проводят эксперименты, в которых определенная масса адсорбента приводится в равновесие с известным объемом раствора с определенной концентрацией адсорбата и затем определяется равновесная концентрация адсорбата. Время установления равновесия может составлять от 2 до 48 ч. Соотношение комбинации почва (адсорбент)–раствор обычно варьируется от 1 : 0.3 до 1 : 20. Исследования проводят с использованием 4–6 различных начальных концентраций гербицида.
Согласно многочисленным исследованиям, процесс деградации глифосата в почве может быть описан двухфазной моделью кинетики первого порядка [14–17]. Количество адсорбированного в почве вещества определяют по разности начальной и равновесной концентраций. Результаты экспериментов представляют в виде изотермы адсорбции, представляющей собой зависимость количества вещества, адсорбированного единицей массы адсорбента, от равновесной концентрации адсорбата.
Различают несколько типов изотерм адсорбции:
– S-тип; наблюдается, когда молекулы растворенного вещества монофункциональны и существует конкуренция за места связывания между адсорбентом и растворителем;
– L-тип, соответствует сорбции в виде мономолекулярного слоя, по мере заполнения сорбционных мест дальнейшая сорбция затрудняется;
– Н-тип, соответствует сильному сродству сорбента к сорбату, при этом растворенное вещество практически полностью сорбируется из раствора;
– С-тип, характеризует линейную или близкую к линейной изотерму адсорбции, наблюдается в том случае, когда вещество легко проникает в сорбент.
При адсорбции гербицидов наиболее часто встречаются изотермы L- и С-типов. В первом случае для описания изотерм используют уравнение Ленгмюра, а во втором случае – уравнение Фрейндлиха.
Связывание глифосата глинистой составляющей почвы является хорошо изученным процессом. Однако процесс адсорбции глифосата в водной среде требует дополнительных исследований как со стороны разработки новых адсорбентов, так и со стороны разработки современных методов исследования. Данная работа посвящена разработке углеродсодержащих материалов, полученных пиролизом отходов сахарного тростника, а также исследованию процесса адсорбции глифосата в модельном водном растворе. Процесс проведения пиролиза сахарного тростника подробно описан в опубликованной ранее работе [18]. Для исследования адсорбционных характеристик были взяты образцы карбонизата багассы сахарного тростника − КБ и химически активированный образец (АУБ), полученный при тех же условиях, но отходы были предварительно пропитаны 1М раствором гидроксида калия. В качестве эталона выбран коммерческий кокосовый активированный уголь марки КАУ-А (КАУ).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
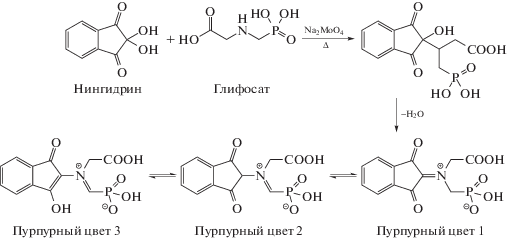
Определение сорбционной способности экспериментальных материалов по отношению к глифосату проводили в модельных монокомпонентных растворах. Исходная концентрация глифосата составляла 2–16 ммоль/л (0.338–2.704 г/л). Концентрацию глифосата определяли методом спектрофотометрии с применением раствора нингидрина при длине световой волны λ = 570 нм [19–23]. Реакция между глифосатом и нингидрином в присутствии молибдата натрия представлена на рис. 1.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
На рис. 2 приведены полученные зависимости остаточной концентрации глифосата в растворе от времени контакта для трех сорбентов – КБ, АУБ и КАУ.
Рис. 2.
Зависимости концентрации глифосата в растворе (С) от времени контакта (τ) для адсорбентов КБ, АУБ и КАУ.

Данные показывают, что равновесие в системе адсорбент–адсорбат–растворитель для всех экспериментальных образцов достигается за 6 часов. Адсорбционные характеристики полученного карбонизата багассы сахарного тростника сопоставимы с коммерческим кокосовым активированным углем марки КАУ-А (0.942 ммоль/л), а при пропитке его 1 М раствором гидроксида калия адсорбция достигает 0.956 ммоль/л.
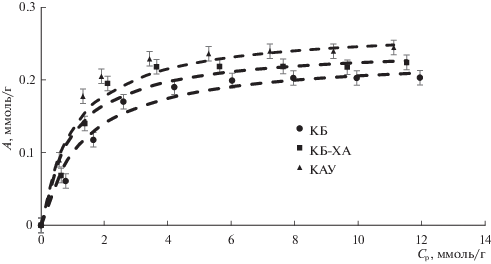
На рис. 3 приведены изотермы адсорбции глифосата на исследуемых материалах. Форма полученных изотерм позволяет предполагать, что сорбция глифосата на указанных образцах ограничивается образованием монослоя.
Рис. 3.
Изотермы адсорбции глифосата на экспериментальных материалах 1 – КБ, 2 – КБ-ХА, 3 – КАУ; А – удельная адсорбция, Ср – равновесная концентрация.
Параметры изотерм, полученные при анализе данных в рамках моделей Ленгмюра, Фрейндлиха и Дубинина–Радушкевича представлены в таблице 1.
Таблица 1.
Параметры адсорбционного процесса, отвечающие уравнениям Ленгмюра, Фрейндлиха и Дубинина–Радушкевича
| Образец | Модель Ленгмюра | Модель Фрейндлиха | Модель Дубинина–Радушкевича | |||||||
|---|---|---|---|---|---|---|---|---|---|---|
| KЛ | QЛ | R2 | KФ | 1/n | R2 | KДР | QДР | Eад | R2 | |
| КБ | 0.7504 | 0.2330 | 0.9829 | 0.0904 | 0.4056 | 0.7891 | 6 × 10–9 | 0.4891 | 9.13 | 0.8423 |
| АУБ | 1.0278 | 0.2453 | 0.9904 | 0.1102 | 0.3577 | 0.7629 | 5 × 10–9 | 0.4978 | 10.0 | 0.8133 |
| КАУ | 0.9531 | 0.2714 | 0.9917 | 0.1179 | 0.3739 | 0.7942 | 5 × 10–9 | 0.5514 | 10.0 | 0.8464 |
Из коэффициентов корреляции, представленных в таблице 1 установлено, что адсорбция глифосата на изученных образцах лучше всего описывается уравнением Ленгмюра (коэффициенты корреляции самые высокие); и в меньшей степени – моделью Дубинина–Радушкевича. Использование эмпирического уравнения Фрейндлиха меньше всего подходит для описания адсорбционных экспериментальных данных (коэффициенты корреляции самые небольшие).
Несмотря на неоднозначность описания экспериментальных данных различными адсорбционными моделями, их результаты сравнительно хорошо согласуются между собой. Так, исходя из модели Ленгмюра, максимальную сорбционную емкость по отношению к глифосату (QЛ) имеет образец КАУ (0.2714 ммоль/г), тогда как минимальной адсорбцией обладает образец КБ (0.2330 ммоль/г). Такое же соотношение сорбционной способности имеет место и при использовании уравнения Дубинина–Радушкевича (значение QДР). В случае применения уравнения Фрейндлиха имеем тот же самый результат, а именно, самой большой сорбционной емкостью обладает активированный уголь марки КАУ-А, а самой низкой – карбонизат багассы сахарного тростника (КБ).
Модели Ленгмюра и Фрейндлиха широко используются для описания адсорбционных процессов, но в то же время они имеют большой недостаток – в них отсутствует какая-либо информация, указывающая на механизм адсорбционного процесса. Напротив, в модель (уравнение) Дубинина–Радушкевича введен параметр КДР, который позволяет судить о природе сил взаимодействия сорбент–сорбат, поскольку константа КДР связана с энергией адсорбции следующим выражением:
В том случае, если значение энергии адсорбции находится в диапазоне 8–16 кДж/моль, следует полагать, что процесс адсорбции протекает путем химического взаимодействия с адсорбентом (хемосорбция); а если значение энергии меньше 8 кДж/моль, то можно считать, что адсорбционный процесс носит преимущественно физический характер [24]. Рассчитанные нами значения энергии адсорбции Еад для модели Дубинина–Радушкевича, представленные в таблице 1, превышают 9 кДж/моль. Из этого можно сделать вывод, что адсорбция глифосата на исследуемых углеродсодержащих материалах обусловлен химическим взаимодействием с адсорбентом.
Таким образом, проведенные исследования показывают, что углеродсодержащие материалы, полученные на основе растительного сырья обладают сравнительно высокой адсорбционной способностью по отношению к глифосату. Достаточно эффективным адсорбентом глифосата из воды является материал, получаемый при совместном пиролизе отходов багассы сахарного тростника с измельченной глиной. При пропитке карбонизата 1М раствором гидроксида калия можно достигнуть адсорбционных характеристик (0.956 ммоль/л), сопоставимых с коммерческим кокосовым активированным углем марки КАУ-А (0.942 ммоль/л). Согласно полученным данным, время достижения равновесия в системе глифосат–растворитель–адсорбент составляет не более 6 ч.
Исследование выполнено при финансовой поддержке Российского фонда фундаментальных исследований и Правительства Белгородской области в рамках научного проекта № 18-43-310012.
Список литературы
Botta F., Lavison G., Couturier G. et al. // Chemosphere. 2009. V. 77. № 1. P. 133.
Bradberry S.M., Proudfoot A.T., Vale J.A. // Toxicol Rev. 2004. V. 23. № 3. P. 159.
Perez G.L., Orremorell A., Mugni H. et al. // Ecol Appl. 2007. V. 17. № 8. P. 2310.
Guyton K.Z., Loomis D., Grosse Y. et al. // Lancet Oncol. 2015. V. 16. № 5. P. 490.
Skinner A., Lewis K.A., Bardon K.S. et al. // Human and Ecological Risk Assessment: An International Journal. 2016. № April (7039). P. 1050.
Gimsing A.L., Borgard O.K., Bang M. // European J. of Soil Science. 2004. № 1 (55). P. 183.
Mamy L., Barriuso E. // Chemosphere. 2005. № 6 (61). P. 844.
Pessagno R.C., Torres Sánchez R.M., Santos Afonso M. // Environmental Pollution. 2008. № 1 (153). P. 53.
Vereecken H. // Pest Management Science. 2005. № 12 (61). P. 1139.
Albers C.N., Banta G.T., Jacobsen O.S. et al. // Environmental Pollution. 2009. № 10 (157). P. 2865.
Okada E., Costa J.L., Bedmar F. // Geoderma. 2016. (263). P. 78.
Albers C.N., Pantos O., Morgan T.C. et al. // Environmental Pollution. 2009. № 10 (157). P. 2865.
Castillo M.A., Felis N., Aragón P. et al. // International Biodeterioration and Biodegradation. 2006. № 3–4 (58). P. 196.
Doublet J., Mamy L., Barriuso E. // Chemosphere. 2009. № 4 (77). P. 582.
Gimsing A.L., Borggaard O.K., Bang M. // European J. of Soil Science. 2004. № 1 (55). P. 183.
Landry D., Dousset, S., Fournier J.C. et al. // Environmental Pollution. 2005. № 2 (138). P. 191.
Stenrod M., Charnay M.-P., Benoit P. et al. // Soil Biology and Biochemistry. 2006. № 5 (38). P. 962.
Нгуен Д.Т., Везенцев А.И., Перистая Л.Ф. и др. // Вестн. технологич. ун-та. 2019. V. 22. № 7. С. 61.
Carneiro R.T.A., Taketa T.B., Neto R.J.G. et al. // J. of Environmental Management. 2015. V. 151. P. 353.
Heitkamp M.A., Adams W.J., Hallas L.E. // Canadian J. of Microbiology. 1992. V. 38. № 9. P. 921.
Assalin M.R., De Moraes S.G., Queiroz A.C.N. et al. // J. of Environmental Science and Health. Part B. 2009. V. 45. № 1. P. 89.
Bhaskara B.L., Nagaraja P. // Helvetica Chimica Acta. 2006. V. 89. № 11. P. 2686.
Rissouli L., Benicha M., Chafik T. et al. // J. of Materials and Environmental Science. 2017. V. 8. 12. P. 4544.
Зеленцов В.И., Дацко Т.Я. // Электронная обработка материалов. 2012. 48 (6). С. 65.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии