Журнал физической химии, 2021, T. 95, № 6, стр. 933-938
Характеристика сорбционных процессов на поверхности речных песков с участием ионов железа (III)
А. А. Яковлева a, *, Ч. Т. Нгуен a
a Иркутский национальный исследовательский технический университет
664074 Иркутск, Россия
* E-mail: ayakovistu@mail.ru
Поступила в редакцию 17.07.2020
После доработки 06.10.2020
Принята к публикации 08.10.2020
Аннотация
На основе классических представлений об адсорбции исследованы особенности динамики и равновесия поверхностных процессов с участием ионов Fe(III). Использованы два образца речного песка, их геохимические особенности установлены методом рентгеновской дифрактометрии: пески состоят из SiO2 (89–90 мас. %) и Аl2O3 (10–11 мас. %). По результатам работы сделан вывод об энергетической неоднородности адсорбционных центров и показано, что для описания сорбции ионов Fe(III) на речных песках пригодна модель мономолекулярной адсорбции. Близость значений констант адсорбционного равновесия и различия в значениях предельной адсорбции связаны с особенностями песков. Анализ кинетических закономерностей свидетельствует, что сорбция ионов Fe(III) имеет практически обратимый характер, однако речные пески обладают склонностью удерживать некоторое количество ионов железа на поверхности, возможно, с последующим встраиванием их в кристаллическую решетку. Исследуемый процесс характеризуется невысокими значениями энергии активации: 17.6 ± 0.5 кДж моль–1 (большее содержание кварца) и 19.01 ± 1.0 кДж моль–1 (большее содержание корунда). Обнаружена симбатность величин предельных адсорбций и значений кажущихся энергий активации для каждого типа песка.
Загрязнение окружающей среды, в том числе загрязнение водной среды тяжелыми металлами является актуальной проблемой современного общества. Ежедневно разнообразные отходы попадают на берега рек и это приводит к загрязнению как поверхностных, так и более глубинных слоев почвы, нанесению серьезного ущерба растительному и животному миру [1, 2]. Вопросы сохранения прибрежных зон весьма важны, поэтому важны и сведения о барьерных качествах береговых песков и их способности выступать преградой на пути загрязнений.
В то же время в быту, в некоторых производствах пески используются в качестве недорогого, доступного фильтровального материала, обладающего такими преимуществами. Поглотительные качества некоторых песков как фильтров рассмотрены по отношению ко многим металлам, в том числе, к ионам железа [3–8]. Приведенные в подобных публикациях сведения значимы при решении экологических задач, однако вопросы, связанные с содержанием и механизмами миграции железа по берегам и в водах рек, имеющих бытовое и промышленное значение, остаются пока мало изученными. Проблемы оценки барьерных качеств прибрежных песков, как звеньев экологической цепочки, и изучение их способности к самовосстановлению являются актуальными.
Цель статьи – оценка адсорбционного равновесия и установление некоторых кинетических закономерностей адсорбции иона железа (III) на поверхности речных песков, представленных образцами с различным соотношением кварца и корунда.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе рассмотрены образцы песков, отобранные на берегах вьетнамских рек Тхубон (обозначен Б) и Тхачхан (обозначен К). Чтобы оценить природные способности природных песков, специальной обработки образцов перед коллоидно-химическими исследованиями не проводили.
После высушивания было проведено квартование представительной пробы, а затем – ситовой анализ. В опытах использовали преимущественно фракции с максимальным выходом. Такие параметры, как средний размер зерна и коэффициент однородности, определены по ГОСТ 29234.3-91. Характеристика минеральной структуры образцов песка получена на рентгеновском дифрактометре XRD-7000 X-ray Shimadzu (Япония).
Раствор трехвалентного железа был приготовлен перед проведением опытов, при этом для исходного раствора использовали навеску 1.00 г FeCl3 ⋅ 6H2O марки “ч.” в 0.5 дм3 дистиллированной воды. Остальные растворы были получены разбавлением исходного в 1.5, 2, 3, 4, 6.67 и 10 раз.
Концентрацию ионов железа (III) определяли фотометрическим методом по ПНД Ф 14.1:2.50-96 на спектрофотометре ПЭ-5400В фирмы ПРОМЭКОЛАБ (Россия).
Во время коллоидно-химических исследований навески песка массой 3.00 г помещали в колбы с 25 см3 рабочего раствора с известной концентрацией.
Погрешность измерения массы составляла ±0.002 г.
Скорость перемешивания суспензий на водной ванне шейкера типа 357 фирмы Эльпана (Water bath shaker type Elpan-357) составляла 250 ± 50 об мин–1. Значение рН раствора поддерживали равным 3 ± 0.2. Объем рабочего раствора в адсорбционных исследованиях был постоянным. Десорбцию проводили дистиллированной водой, подкисленной соляной кислотой.
Были проведены опыты при разных температурах (288, 293, 298 и 308 K). Погрешность измерения температуры составляла ±1 K.
Для наблюдений использовали по 12 образцов каждого песка, время контакта растворов с песком составляло от 0.5 до 6 ч.
Количество адсорбированного железа $A$ (мкг г–1) рассчитывали по убыли концентрации раствора после наступления адсорбционного равновесия, степень извлечения железа $R$ (%) – из соотношения
в котором C0 и Ct – начальная концентрация используемого раствора и концентрация, достигнутая ко времени t и определяемая из калибровочного графика (мг дм–3).Для аналитического описания экспериментальных результатов и оценки природы адсорбционных сил использовали наиболее известные модели равновесной адсорбции – уравнения Ленгмюра и Фрейндлиха [9, 10].
Как известно, модель Ленгмюра выражается уравнением
где Amax – максимальная адсорбция (мкг г–1), С – концентрация ионов железа (III) (мг дм–3); KL – константа адсорбционного равновесия.Эмпирическое уравнение Фрейндлиха, обычно используемое при средних степенях заполнения поверхности адсорбента, рассматривали в традиционном виде:
Коэффициенты адсорбционных уравнений использовали для характеристики особенностей изучаемых систем, поскольку коэффициенты KL и KF отражают энергетику процесса и сродство адсорбата к адсорбенту, а коэффициент $1{\text{/}}n$ показывает интенсивность адсорбции, связанную с энергетической неоднородностью.Рассмотрение времени контакта в системе песок–раствор позволяет оценить механизм взаимодействия. Для описания кинетических закономерностей сорбционного процесса использовали модели [11, 12]:
– для псевдопервого порядка
– для псевдовторого порядка
где ${{A}_{p}}$ – количество вещества, сорбированного на единицу массы поглотителя в момент равновесия, (мкг/г); ${{k}_{1}}$ – константа скорости первого порядка, (ч–1); ${{k}_{2}}$ – константа скорости второго порядка, (г мкг–1 ч–1).Энергию активации адсорбции Ea (Дж моль–1) рассчитывали по уравнению Аррениуса
где ${{k}_{0}}$ – предэкспоненциальный множитель.Для нахождения численных значений необходимых коэффициентов использовали линеаризацию рассмотренных уравнений и представление экспериментальных данных в спрямленных координатах.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Результаты рентгенофазового анализа показывают, что основой песков является α-SiO2 (89.93 мас. % для песка Б и 89.11 мас. % для песка К). Кроме того, в состав песков входит α-Аl2O3 (10.07 мас. % для песка Б и 10.89 мас. % для песка К), то есть рассматриваемые пески биминеральны и имеют близкий, но неодинаковый химический и минеральный состав.
По результатам ситового анализа песок К оказался крупнее (средний размер зерна 1.22 мм против 0.60 мм для песка Б), но коэффициент однородности его ниже: 55.5% против 65.0% у песка Б.
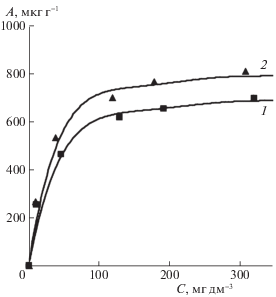
На рис. 1 для примера иллюстрируются изотермы адсорбции ионов железа (III) на песках Б и К при температуре T = 298 K.
В рассмотренном диапазоне концентраций изученные изотермы имеют типичный ленгмюровский характер (как и представленные на рис. 1). Найденные константы уравнений Ленгмюра и Фрейндлиха приведены в табл. 1.
Таблица 1.
Изотермы адсорбции по моделям Ленгмюра и Фрейндлиха
| Песок | Коэффициенты уравнения | |||||
|---|---|---|---|---|---|---|
| Ленгмюра | Фрейндлиха | |||||
| Amax, мкг/г–1 | ${{K}_{{\text{L}}}}$ | ${{R}^{2}}$ | ${{K}_{{\text{F}}}}$ | $1{\text{/}}n$ | ${{R}^{2}}$ | |
| Б | 625.69 | 0.0547 | 0.996 | 125.65 | 0.292 | 0.962 |
| К | 834.87 | 0.0503 | 0.990 | 129.14 | 0.348 | 0.970 |
Коэффициенты аппроксимации ${{R}^{2}}$ оказываются высокими и для обоих песков выше в случае модели Ленггмюра. Как известно, используемые уравнения не противоречат друг другу, более низкие ${{R}^{2}}$ для уравнения Фрейндлиха свидетельствуют лишь о том, что диапазон используемых концентраций раствора выходит за пределы линейности этого уравнения.
Значимыми при обсуждении результатов являются значения предельной адсорбции (или сорбционной емкости) ${{A}_{{{\text{max}}}}}$, неодинаковые для рассматриваемых песков. Стоит заметить, что мелкозернистый песок Б, в котором до 65 мас. % частиц имеют размер, в 2 раза меньший размера частиц песка К, характеризуется более низким значением емкости, вопреки очевидному факту роста количества сорбированного вещества при диспергировании адсорбента. Очевидно, взаимосвязь адсорбционной емкости с дисперсностью при ионном обмене имеет свои особенности и не столь очевидный характер. Для минеральных сорбентов соотношение граней кристаллов с различной активностью является некоторой природной данностью. В нашем случае это проявляется в особенностях минерального состава, связанных с разным соотношением оксидов кремния и алюминия. Для песка Б отношение SiO2/Al2O3 составляет 8.93, для песка К – 8.18 и это не может не сказываться на таких характеристиках, как рельеф поверхности кристалликов, наличие дефектов, дислокаций и других энергетических неоднородностей, обеспечивающих благоприятные условия для активного притяжения.
Близкие для обоих песков значения констант адсорбционного равновесия ${{K}_{{\text{L}}}}$ свидетельствуют об единой природе взаимодействия. В близости величин ${{K}_{{\text{L}}}}$ проявляется схожесть кристаллографических решеток в минералах, составляющих исследуемые пески. Можно считать, что в ходе взаимодействия ионы железа (III) располагаются на поверхностях, образованных в меру упорядоченными сетками атомных решеток оксидов кремния и алюминия с ярко выраженными ковалентными связями.
Время пребывания ионов адсорбата на поверхности частиц зависит от того, в каком состоянии и насколько сильно удерживаются ионы в силовом поле поверхности. Очевидно, что наличие водородных связей на поверхности кристаллов влияет на поведение ионов железа (III) и длительное его пребывание на поверхности возможно только на активных центрах, способных удерживать его за счет сильного притяжения. Результатом такого притяжения может быть либо хемосорбция с образованием поверхностных комплексов с кислородом, либо встраивание катионов металла в кристаллическую решетку за счет вытеснения или замещения атомов решетки.
Коэффициенты уравнения Фрейндлиха дополняют анализ результатов и вносят убедительные аргументы в пользу такой трактовки.
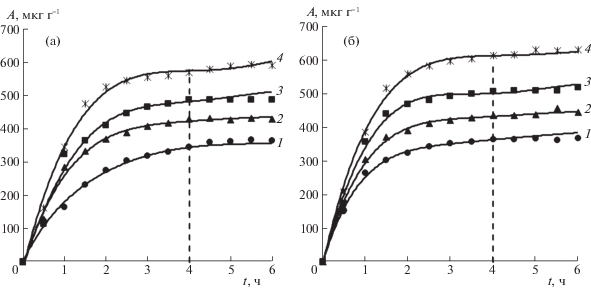
Использование кинетических уравнений дает возможность оценивать скорости адсорбции и обогащать представления о ее механизме. На рис. 2 представлена эволюция адсорбции на используемых песках при разных температурах.
Рис. 2.
Зависимости адсорбции ионов железа (III) от времени контакта на песках Б (а) и К (б) при температурах: 288 (1), 293 (2), 298 (3) и 308 K (4).
Рассматривая адсорбцию как процесс, протекающий по псевдопервому или по псевдовторому порядку, рассчитали значения констант скорости адсорбции (табл. 2).
Адсорбционное взаимодействие на поверхности минералов принято связывать с моделями первого или второго порядка [13–19]. Анализ показывает более стабильные и более высокие значения коэффициентов аппроксимации для модели псевдопервого порядка, что позволяет связать изучаемые механизмы именно с этой моделью. В защиту полученных результатов можно высказать следующее предположение. Поскольку механизм гетерогенных взаимодействий всегда сложен и состоит из отдельных стадий, то вероятно, что в данном случае конкурентные преимущества оказываются у стадии, которую можно трактовать просто: до взаимодействия был свободный ион железа (III), после взаимодействия возник единый комплекс “посадочная площадка – ион металла”. Авторы, получившие сходные результаты, склонны связывать псевдопервый порядок со спонтанным и экзотермическим характером реакции адсорбции ионов хрома на доломите [19], предполагать адсорбцию ионов уранила в мультимолекулярных или кластерных состояниях на тальке [16]. Интересно, что авторы [15] для сорбции тех же ионов уранила на бентоните получают второй порядок реакции. Авторами [17] установлено, что процесс сорбции ионов тяжелых металлов на природной глине протекает по ионообменному механизму и лучше описывается моделью реакции псевдовторого порядка. Противоречивость приведенных фактов свидетельствует о разнообразии и сложностях механизма ионного обмена на природных минеральных адсорбентах.
В формальной кинетике скорость стационарного гетерогенного процесса часто рассматривается как реакция первого порядка, кинетической особенностью такого взаимодействия являются значимость стадий массопереноса и высокие скорости непосредственно взаимодействия. Хемосорбционное взаимодействие ионов тяжелых металлов на минералах с высоким содержанием оксида кремния возможно за счет проявления сил физической природы, поскольку поверхности содержат в своем составе фиксированные функциональные ионообменные группы и допускают такое взаимодействие [18].
Судя по рис. 2, адсорбция активно протекает в течение первых 3-х часов. Затем изотермы переходят к постепенному выполаживанию, время достижения равновесного состояния составляет около 4.0 ч и оно практически не зависит от температуры. Зависимой от температуры оказывается некоторая величина адсорбции ${{A}_{p}}$, связанная с достижением максимального значения при данной температуре (табл. 3).
Таблица 2.
Кинетические параметры адсорбции ионов Fe(III) на поверхности песков
| T, K | Псевдопервый порядок | Псевдовторой порядок | ||
|---|---|---|---|---|
| ${{k}_{1}}$ (ч–1) | ${{R}^{2}}$ | ${{k}_{2}}$ (г мкг–1 ч–1) | ${{R}^{2}}$ | |
| Песок Б | ||||
| 288 | 0.946 | 0.990 | 0.608 | 0.981 |
| 293 | 1.042 | 0.993 | 0.439 | 0.955 |
| 298 | 1.133 | 0.990 | 0.006 | 0.922 |
| 308 | 1.307 | 0.992 | 0.204 | 0.964 |
| Песок К | ||||
| 288 | 1.081 | 0.993 | 1.753 | 0.975 |
| 293 | 1.102 | 0.992 | 0.982 | 0.966 |
| 298 | 1.183 | 0.987 | 0.414 | 0.947 |
| 308 | 1.275 | 0.997 | 0.446 | 0.977 |
Таблица 3.
Равновесие адсорбции (Ар) иона железа (III) на песках при разных температурах
| Т, K | Ар, мкг г–1 | |
|---|---|---|
| песок Б | песок К | |
| 288 | 345.413 | 366.176 |
| 293 | 427.520 | 438.845 |
| 298 | 486.032 | 509.626 |
| 308 | 566.251 | 617.214 |
Для определения энергии активации адсорбции по уравнению Аррениуса оказалось удобнее рассматривать величину адсорбции, которая была достигнута через 4 ч протекания процесса Аt=4. Отнесенная к одному и тому же времени 4 ч, она приобретает смысл кинетической характеристики, тождественной константе скорости: $k \cong {{A}_{{t = 4}}}{\text{/}}4,$ (мкгг–1 ч–1). Представляя эту величину в полулогарифмические координаты уравнения Аррениуса, получаем значения кажущейся энергии активации ${{E}_{{\text{a}}}}$: для песка Б – 17.6 ± 0.5 кДж моль–1, для песка К – 19.01 ± 1.0 кДж моль–1. Невысокие значения кажущейся энергии активации характерны для процессов на твердой поверхности, протекающих в диффузионной области, что не исключает химическое взаимодействие ионов железа с оксидами алюминия и кремния, а свидетельствует о высоких скоростях таких взаимодействий.
Полученные значения кажущихся энергий активации для каждого типа песка находятся в хорошем соответствии с величинами предельных адсорбций, что, возможно, связано с одинаковым механизмом адсорбции [20–22].
Результаты кинетических исследований свидетельствуют, что сорбция ионов железа на речных песках протекает в диффузионной области с невысокими значениями энергии активации.
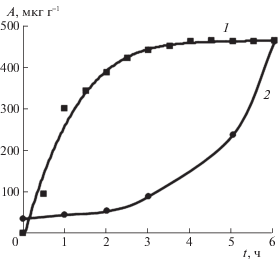
В серии экспериментов по влиянию температуры на степень извлечения железа в серии экспериментов с различной начальной концентрацией показано, что адсорбционная способность песков Б и К повышается с увеличением концентрации раствора. Это свидетельствуют об одинаковом отклике песков на присутствие ионов железа в растворе и подтверждается анализом типичных кривых десорбции, проведенной при комнатной температуре (рис. 3).
Из кривых десорбции видно, что на поверхности песков остается небольшое количество железа, очевидно, из-за вступления ионов железа в обменную реакцию с близкими по свойству ионами алюминия в кристаллической решетке или другое взаимодействие.
Таким образом, установлено, что для описания сорбции ионов Fe(III) на кварцево-корундовых речных песках оказывается пригодной модель мономолекулярной адсорбции. Эмпирические коэффициенты позволяют представить уравнения Ленгмюра в виде:
для песка Б: $A = 625.70\frac{{0.055C}}{{1 + 0.055C}}$
для песка К: $A = 834.87\frac{{0.050C}}{{1 + 0.050C}},$ если размерности величин составляют: [C] = мг дм–3, [A] = мкг г–1.
Анализ кинетических закономерностей свидетельствует, что сорбция ионов Fe(III) характеризуется невысокими значениями энергии активации:
для песка Б: 17.6 ± 0.5 кДж моль–1;
для песка К: 19.01 ± 1.0 кДж моль–1.
Показано, что сорбционный процесс на поверхности речных песков имеет преимущественно обратимый характер, однако эти природные минеральные смеси обладают склонностью накапливать ионы железа на поверхности, очевидно, с последующим встраиванием их в кристаллическую решетку по механизму обмена или замещения.
Список литературы
Водяницкий Ю.Н. Тяжелые металлы и металлоиды в почвах. М.: ГНУ Почвенный институт им. В.В. Докучаева РАСХН, 2008. 86 с.
Шершнев О.В., Ясовеев М.Г. // Вода: химия и экология. 2016. № 8. С. 3.
Ланина Т.Д., Селиванова Е.С., Донин С.Н. // Водоочистка. Водоподготовка. Водоснабжение. 2015. Т. 89. № 5. С. 32.
Никифоров А.Ф., Кутергин А.С., Низамова А. и др. // Водное хозяйство России: проблемы, технологии, управление. 2018. № 2. С. 92. https://doi.org/10.35567/1999-4508-2018-2-7
Inglezakis V.J., Loizidou M.D., Grigoropoulou H.P. // Water Res. 2002. V. 36. № 11. P. 2784. https://doi.org/ (01) 00504-8https://doi.org/10.1016/S0043-1354
Muhammad N. Removal of Heavy Metals by Slow Sand Filtration: A Doctoral Thesis. UK: Loughborough University, 1998. 347 p.
El Haouti R., Anfar Z., Et-taleb S. et al. // Euro-Mediterranean J. for Environmental Integration. 2018. V. 3. P. 1. https://doi.org/10.1007/s41207-018-0058-9
Hubicki Z., Kołodyńska D. Selective Removal of Heavy Metal Ions From Waters and Waste Waters Using Ion Exchange Methods // Ion Exchange Technologies. ed. Ayben Kilislioglu, 2012. Ch. 8. P. 193–240. https://doi.org/10.5772/51040
Товбин Ю.К. // Журн. физ. химии. 2017. Т. 91. № 9. С. 1453. https://doi.org/ (Tovbin Y.K. // Russ. J. Phys. Chem. A. 2017. V. 91. № 9. P. 1621–1634. https://doi.org/10.1134/S0036024417090308)https://doi.org/10.7868/S0044453717090333
Tien C. Adsorption Calculations and Modelling. Boston: Butterworth-Heinemann, 1994. 288 p. https://doi.org/10.1016/C2009-0-26911-X
Azizian S. // J. Colloid Interf. Sci. 2004. V. 276. № 1. P. 47. https://doi.org/10.1016/j.jcis.2004.03.048
Yiacoumi S., Tien C. Kinetics of Metal Ion Adsorption from Aqueous Solutions: Models, Algorithms, and Applications. New York: Springer Science + Business Media New York, 1995. 239 p. https://doi.org/10.1007/978-1-4615-2319-2
Яковлева А.А., Чыонг С.Н. // Журн. физ. химии. 2013. Т. 87. № 11. С. 1948–1952. https://doi.org/ (Yakovleva A.A., Chyong S.N. // Russ. J. Phys. Chem. A. 2013. V. 87. № 11. P. 1916–1920. https://doi.org/10.1134/S003602441311023X)https://doi.org/10.7868/S0044453713110277
Rauf M.A., Iqbal M.J., Ellahi I., Hasany S.M. // Adsorpt. Sci. Technol. 1995. V. 13. № 2. P. 97. https://doi.org/10.1177/026361749601300203
Wang Y.-Q., Zhang Z.-B., Li Q., Liu Y.-H. // J. Radioanal. Nucl. Chem. 2012. V. 293. P. 231. https://doi.org/10.1007/s10967-012-1659-4
Sprynskyy M., Kowalkowski T., Tutu H. et al. // Chem. Eng. J. 2011. V. 171. P. 1185. https://doi.org/10.1016/j.cej.2011.05.022
Рамазанов А.Ш., Есмаил Г.К., Свешникова Д.А. // Сорбционные и хроматографические процессы. 2015. V. 15. № 5. P. 672. https://doi.org/10.17308/sorpchrom.2015.15/320
Mirzaei N., Mahvi A.H., Hossini H. // Adsorpt. Sci. Technol. 2018. V. 36. № 1–2. P. 80. https://doi.org/10.1177/0263617416684836
Albadarin A.B., Mangwandi C., Al-Muhtaseb A.H. et al. // Chem. Eng. J. 2012. V. 179. P. 193. https://doi.org/10.1016/j.cej.2011.10.080
Saifutdinov B.R. Medium-Property Relationships and Compensation Effect in the Adsorption of Heteroaromatic Compounds from Aqueous Acetonitrile Solutions. Russian Chemical Bulletin, 2014. V. 63. P. 2609.https://doi.org/10.1007/S11172-014-0787-0
Сайфутдинов Б.Р., Даванков В.А., Петухова Г.А. и др. Термодинамика жидкофазной адсорбции на сверхсшитых полистирольных сетках с предельными степенями сшивания // Докл. АН. 2015. Т. 462. № 6. С. 675.https://doi.org/10.1134/S0012501615060056
Saifutdinov B.R., Davankov V.A., Il’in M.M. // Rus. J. of Phys. Chem. 2014. V. 88. P. 358. https://doi.org/10.1134/S0036024414030224
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии