Журнал физической химии, 2021, T. 95, № 6, стр. 939-946
Влияние длины волны и интенсивности возбуждающего света на эффективность фотогенерации синглетного кислорода фотодитазином в присутствии плюроника F-127 в модельных процессах фотоокисления
А. С. Курьянова a, b, *, А. Б. Соловьева a, Н. Н. Глаголев a, Н. А. Аксенова a, b, П. С. Тимашев a, b
a Федеральное государственное бюджетное учреждение науки
Федеральный исследовательский центр химической физики им. Н.Н.Семенова РАН
Москва, Россия
b Институт регенеративной медицины, Первый Московский государственный
медицинский университет им. И.М. Сеченова
Москва, Россия
* E-mail: kuryanovaanastasi@gmail.com
Поступила в редакцию 12.07.2020
После доработки 12.07.2020
Принята к публикации 30.07.2020
Аннотация
Изучены активность и фотостабильность фотодитазина (ФЗ) в фотогенерации синглетного кислорода (1О2) в модельной реакции фотоокисления триптофана в воде при возбуждении светом с λ = 400 нм и 660 нм при разных плотностях мощности света и влияние на этот процесс амфифильного полимера (АП) плюроника F-127. Показано, что наибольшие фотокаталитическая активность и фотостабильность фотодитазина в генерации 1О2 наблюдаются при возбуждении светом с длиной волны 400 нм при средней плотности мощности излучения и введении в реакционную среду плюроника F-127. Отмечено, что на модельных реакциях можно “подбирать” фотосенсибилизаторы (ФС) системы (наличие АП, других добавляемых вместе с ФС систем) и характерные для каждого ФС режимы низкоэнергетических фотодинамических (ФД) воздействий на субстраты, наиболее благоприятных для реальной терапии, а именно, способствующих инициированию регенеративных, иммунных процессов.
Процесс генерации синглетного (1О2) и других активных форм кислорода (АФК) возбужденными фотосенсибилизаторами (ФС) лежит в основе фотодинамической терапии (ФДТ) – метода лечения злокачественных опухолей, а также неонкологических локализованных инфекций (гнойных ран, пролежней, трофических язв) [1, 2]. Метод основан на введении фотосенсибилизирующего препарата в патогенные ткани организма с последующим облучением пораженных участков светом с определенной для каждого ФС длиной волны. Возбужденные молекулы фотосенсибилизаторов (3ФС*) способны инициировать фотохимические реакции двух типов [3]. Возможно непосредственное взаимодействие 3ФС* с биомолекулами (отрыв электрона или непосредственно атомов водорода), что ведет к образованию свободных радикалов, которые при взаимодействии с молекулярным кислородом, растворенным в тканях, образуют радикальные формы кислорода. В реакциях второго типа происходят перенос энергии от 3ФС* к молекулам кислорода и генерация активных форм кислорода (АФК), важнейшие из которых, в первую очередь, синглетный 1О2 кислород, а также анион-радикал супероксида (${\text{O}}_{2}^{{-- \bullet }}$), гидроксильный радикал (${\text{O}}{{{\text{H}}}^{ \bullet }}$), а также пероксид водорода (H2O2) и органические пероксиды. На конечных этапах фотодинамического (ФД) воздействия оба типа фотохимических реакций приводят к деструктивным процессам в жизненно важных структурах клеток и их гибели [4]. Следует учитывать, что время жизни синглетного и других активных форм кислорода в клетке весьма мало (~1 мкс), и вследствие этого 1О2 реагирует с окружающими молекулами на расстояниях не более 0.1 мкм от места генерации [5]. При этом синглетный кислород, помимо взаимодействия с молекулами субстрата, способен реагировать с молекулами фотосенсибилизатора, что ведет к разрушению системы сопряженных двойных связей, характерной для молекул используемых ФС, и дезактивации ФС (так называемый фотобличинг ФС) [6, 7].
Общая схема фотодинамического процесса может быть представлена в виде [8]:
Следует отметить, что ФДТ новообразований и локализованных инфекций подразумевает не только прямые воздействия на патологические ткани с некрозом или апоптозом пораженных клеток, но и фотоиндуцируемую динамику последующих регенеративных процессов. Такие процессы в условиях ФДТ инициируются локальной иммунной системой организма в тканях, приграничных с патологически развивающимися областями. В частности, было отмечено локальное повышение гуморального и клеточного иммунитета у онкологических больных при проведении фотодинамической терапии [9]. Было показано также, что в крови пациентов, получивших ФДТ, обнаруживаются повышенные концентрации цитокинов (факторов роста) [10]. Эти результаты свидетельствуют об иммуностимулирующем действии ФДТ [11]. Именно по этой причине энергетические воздействия при ФДТ, в том числе при лечении инфицированных ран следует минимизировать до определенного уровня, чтобы инициировать, но не подавлять возможности регенеративных систем организма.
Для возбуждения фотосенсибилизаторов используют одну из полос поглощения ФС в видимом или ближнем инфракрасном диапазоне спектра. При лечении опухолей используется красный (инфракрасный) свет, поскольку так называемое “окно прозрачности” биологических тканей заключено приблизительно между 600 и 1200 нм. Именно в этом диапазоне длин волн поглощение света биокомпонентами клеток не столь велико, и излучение проникает в биологические ткани, что делает возможным лечение достаточно глубоких пораженных тканевых структур [12, 13]. В то же время при ФДТ поверхностных гнойных ран или других инфекционно-воспалительных процессов, где для эффективного лечения не требуется проникновения света в глубь тканей, возможно использование для фотовозбуждения ФС сине-зеленой области спектра, где, как правило, у фотосенсибилизиторов более интенсивные полосы поглощения. Это позволяет контролируемым образом понижать уровень световых воздействий при ФДТ и, тем самым, создавать условия для оптимального инициирования последующих регенерационных процессов [14].
Контролируемое понижение уровня световых воздействий при ФДТ связывается с возможным снижением до определенных значений концентрации фотосенсибилизаторов, что крайне важно и для снижения фототоксичности таких соединений. Кроме того, важно отметить, что тип гибели клеток (апоптоз/некроз) зависит не только от природы и концентрации ФС, но и от дозы облучения [15]. Использование высоких доз световой энергии приводит к некрозу, в результате которого клетка набухает [16, 17], так что может теряться целостность цитоплазматической мембраны, и содержимое некротических клеток может попадать на соседние клетки, что приводит к развитию воспалительных процессов и гибели таких клеток (“эффект свидетеля”) [18, 19]. Некротические изменения в клетках провоцируют регионарную и системную реакцию. При проведении ФДТ с использованием низких доз световой энергии запускается, как правило, механизм апоптоза [20]. При этом клетка перестает функционировать, и происходит ее упорядоченная самоликвидация, проявляющаяся в уменьшении ее размера, конденсации и фрагментации хроматина, уплотнении цитоплазматической мембраны без выхода содержимого клетки в окружающую среду. Однако определенный оптимальный уровень ФД-воздействий, не подавляющих апоптоз, должен сохраняться. Поэтому одна из проблем ФДТ при минимально допустимом уровне ФД-воздействий – использование оптимальных режимов (длины волны и дозы возбуждающего света) фотодинамических воздействий на патологические ткани, чтобы регенеративные системы организма могли проявлять свою активность в полной мере. Естественно, при допустимой минимизации ФД-воздействий будут минимизированы и процессы фотодеструкции ФС и максимально снижен уровень фототоксичности ФДТ.
В данной работе показано, что решение указанных проблем ФДТ частично может быть найдено на основе физико-химических исследований фотосенсибилизированного окисления модельных органических субстратов при использовании различных типов ФС-систем. При исследовании реакции окисления триптофана проведен сопоставительный анализ активности и фотостабильности фотодитазина (ФЗ) (одного из наименее токсичных ФС из использующихся в клинической практике ФДТ в настоящее время) в фотогенерации 1О2 при возбуждении светом разной мощности при λ = 400 и 660 нм (длины волн, соответствующие двум наиболее интенсивным полосам поглощения ФЗ в видимой области). При этом исследовано влияние плюроника F-127 (одного из наиболее известных амфифильных полимеров, используемых в лекарственных формах для ФДТ совместно с ФС [21]) на скорость процессов фотоокисления триптофана и фотодеструкции ФС. Ранее нами было показано [21], что совместное использование ФС с плюроником F-127 повышает активность ФС в 10–30 раз при фотовоздействии на культуры раковых клеток, а также в экспериментах in vivo при ФДТ опухолей поверхностной локализации и модельные раны у животных.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В качестве фотосенсибилизатора использовали N-метил-три-D-глюкаминовую соль хлорина е6 (Фотодитазин, ФЗ), производство фирмы “Вета-Гранд”, Россия. Изучали фотокаталитическую активность ФЗ в зависимости от концентрации амфифильного полимера (АП) – плюроника F‑127, M = 12 600 (фирма BASF, США).
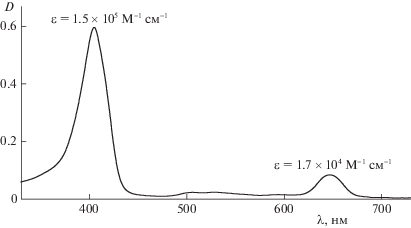
Модельную реакцию фотоокисления субстрата – L,D-триптофана (Sigma-Aldrich, США) в воде проводили в кварцевой кювете (толщина l = 1 см) при предварительном перемешивании раствора, содержащего все компоненты реакции (t ~ 15 мин). Отсчет времени реакции начинали с момента включения освещения реакционной смеси. Время облучения варьировали (18–200 с). Освещение осуществляли с помощью светодиодного аппарата “AФС-Соларис” (ООО “Полироник”, Россия), снабженного светоизлучателями с λ = 400 и 660 нм. Кинетику процесса фотоокисления фиксировали по уменьшению оптической плотности поглощения в УФ-спектре триптофана в воде (λ = = 280 нм). Аналогичным образом следили за кинетикой процесса “фотодеградации” ФЗ по уменьшению оптической плотности полосы поглощения его в видимом спектре (λ = 655 нм). Электронные спектры поглощения (ЭСП) растворов снимали на спектрофотометре Cary50 (Varian, Австрия) (рис. 1).
При проведении реакций фотоокисления концентрация триптофана составляла 1 × 10–4 М, концентрации ФЗ – 2 × 10–6 и 5 × 10–6 М, концентрацию плюроника F-127 варьировали в диапазоне от 5 × 10–5 до 8 × 10–4 М. Определение наблюдаемой константы kobs скорости фотоокисления триптофана на основе проводимых экспериментов осложнялось тем, что при включении светодиода в момент времени t = 0 одновременно с уменьшением концентрации ${{C}^{{TP}}}(t)$ триптофана в реакционной среде фиксировалось уменьшение концентраций $C_{{}}^{{PD}}(t)$ фотодитозина соответственно. Для кинетики фотоокисления триптофана использовали следующее уравнение:
Здесь k – константа скорости фотосенсибилизированного окисления триптофана, так что при ${{C}^{{TP}}}(0) \equiv C_{0}^{{TP}}$ получаем(2)
${{C}^{{TP}}}(t) = C_{0}^{{TP}}\exp \left[ { - k\int\limits_0^t {{{C}^{{PD}}}(\tau )d\tau } } \right].$(3)
$\chi (\Delta t) \equiv C_{0}^{{PD}}\int\limits_0^{\Delta t} {\left[ {{{C}^{{PD}}}(\tau ){\text{/}}C_{0}^{{PD}}} \right]d\tau } \approx C_{0}^{{PD}}\xi \Delta t,$Кинетика процесса окисления триптофана на указанном интервале представляется в виде:
(4)
$\Delta {{C}^{{TP}}} \equiv C_{0}^{{TP}} - {{C}^{{TP}}}(\Delta t) = C_{0}^{{TP}}C_{0}^{{PD}}k\xi \Delta t.$Мы анализировали также константы ${{k}_{d}}$ скорости фотодеструкции ФЗ, которые рассчитывали по линейному участку соответствующих кинетических кривых согласно: ${{k}_{d}} = \Delta {{C}^{{PD}}}{\text{/}}(C_{0}^{{PD}}\Delta t)$, где $\Delta {{C}^{{PD}}}$ – изменение концентрации фотодитазина при окислении триптофана за время Δt. Ошибка измерений получаемых данных обычно составляла ~10%.
С помощью измерителя средней мощности и энергии лазерного излучения ИМО-2Н определяли мощности (мВт) светового потока с длиной волны 400 и 660 нм, генерируемого светодиодным аппаратом “AФС-Соларис”, и вычисляли плотность мощности света, действующего на реакционную смесь. Плотность мощности излучения света рассчитывали по формуле: Р = W/S, где W – мощность излучения на расстоянии 3 см между светом и кюветой (мВт), S – площадь облучаемой поверхности кюветы объемом 3 мл (см2). Кинетику процесса фотоокисления субстрата и фотодеградации ФЗ анализировали при трех различных плотностях мощности светодиода. Плотность Р мощности (“Высокая”, “Средняя”, “Низкая”, табл. 1) подбирали таким образом, чтобы они находились в пределах значений стимулирующих доз низкоинтенсивного лазерного излучателя (от 0.5–9 мВт/см2) [23].
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
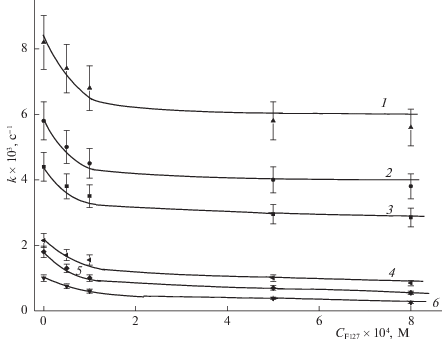
Исследование фотокаталитической активности и фотодеградации ФЗ проводили при двух концентрациях Сpz фотодитазина (5 × 10–6 и 2 × × 10–6 М) и облучении светом 400 и 660 нм при разных плотностях мощности световых потоков, условно обозначаемых как “высокая”, “средняя” и “низкая”. На рис. 2–5 приведены зависимости величины эффективной константы keff скорости фотоокисления триптофана в присутствии ФЗ и константы kpz фотодеградации ФЗ от концентрации плюроника F-127, полученные при указанных концентрациях фотодитазина – 5 × 10–6 М (рис. 2 и 3) и 2 × 10–6 М (рис. 4 и 5).
Рис. 2.
Зависимости эффективной константы keff скорости фотоокисления триптофана (1 × 10–4 М) в присутствии ФЗ (5 × 10–6 М) от концентрации плюроника F-127 при разных плотностях мощности света и длинах волн падающего света (400 нм): 1 – 6, 2– 4, 3 – 2.4 мВт/см2 ; (660нм): 4 – 2, 5 – 1, 6 – 0.5 мВт/ см2.
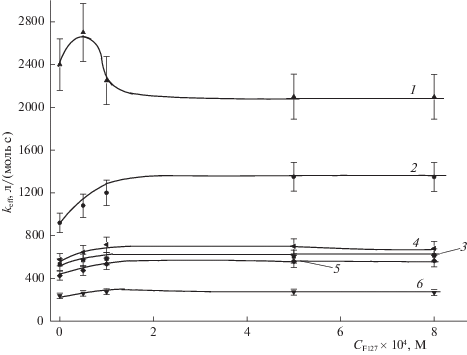
Рис. 3.
Зависимости констант kpz скорости фотодеградации ФЗ (5 × 10–6 М) от концентрации плюроника F-127 при различных плотностях мощности света с различными длинами волн света; обозначения см. рис.2.
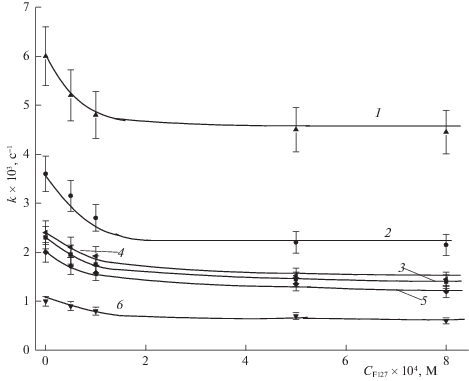
Рис. 4.
Зависимости эффективной константы keff скорости фотоокисления триптофана (1 × 10–4 М) в присутствии ФЗ (2 × 10–6 М) от концентрации плюроника F-127 при различных плотностях мощности света с различными длинами волн света; обозначения см. рис.2.
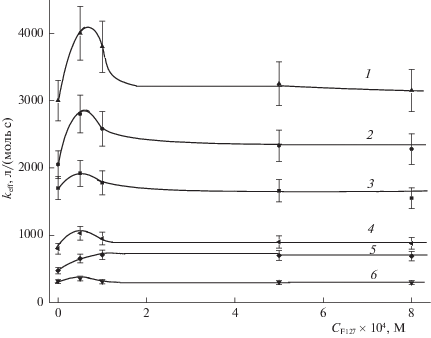
Рис. 5.
Зависимости констант kpz скорости фотодеградации ФЗ (2 × 10–6 М) от концентрации плюроника F-127 при различных плотностях мощности света с различными длинами волн света; 400 нм: (1) 6 мВт/см2, (2) 4 мВт/см2, (3) 2.4 мВт/см2 ; 660 нм: (4) 2 мВт/см2, (5) 1 мВт/см2 , (6) 0.5 мВт/ см2.
Отметим основные особенности представленных на рис. 2–5 зависимостей для величин ${{k}_{{{\text{eff}}}}}({{C}^{{Pl}}})$ и ${{k}_{d}}({{C}^{{Pl}}})$ от концентрации ${{C}^{{Pl}}}$ плюроника F-127 в реакционной среде.
1. Эффективные константы keff скорости фотоокисления триптофана при облучении светом с длиной волны 400 нм превосходят по величине соответствующие константы при воздействии на исследуемые системы излучений при 660 нм и обеих используемых в работе концентрациях ФЗ в реакционной среде для всех исследуемых концентраций плюроника F-127. Этот факт просто определяется большей эффективностью (величиной экстинкции) возбуждения молекул ФЗ в полосе поглощения ~400 нм, нежели в полосе возбуждения ~660 нм. При этом во всех случаях наблюдается очевидная зависимость – большей величине мощности воздействия соответствуют большие величины фиксируемых величин keff.
2. Все представленные зависимости ${{k}_{{{\text{eff}}}}}({{C}^{{Pl}}})$ возрастают при введении плюроника F-127 в реакционную среду. При этом зависимости, полученные при меньшей концентрации фотодитазина $C_{0}^{{PD}}$ = 2 × 10–6 М в реакционной среде и при воздействиях света с длиной волны 400 нм характеризуются максимумом при относительно малых ${{C}^{{Pl}}}$ ≈ 1 × 10–4 М значениях концентрации плюроника, который в большей мере проявляется при больших мощностях падающего света. В экспериментах при $C_{0}^{{PD}}$ = 5 × 10–6 М такой максимум проявляется лишь при световых воздействиях с длиной волны 400 нм и наибольшей мощностью (6 мВт/см2). Во всех случаях зависимости ${{k}_{{{\text{eff}}}}}({{C}^{{Pl}}})$ выходят на постоянные значения при ${{C}^{{Pl}}}$ > 2 × 10–4 М.
Для понимания такого характера зависимостей ${{k}_{{{\text{eff}}}}}({{C}^{{Pl}}})$ необходимо рассмотреть полученные в наших экспериментах зависимости ${{k}_{d}}({{C}^{{Pl}}})$. Для всех этих зависимостей характерно достаточно резкое падение величин ${{k}_{d}}({{C}^{{Pl}}})$ в области малых значений ${{C}^{{Pl}}}$ (от нулевых, при которых константы выгорания ФЗ максимальны, до 2 × 10–4 М). При последующем возрастании ${{C}^{{Pl}}}$ зависимости ${{k}_{d}}({{C}^{{Pl}}})$ изменяются слабо, т.е. введение в реакционную среду плюроника при концентрации ~2 × × 10–4 M оказывается достаточным для эффективной защиты ФЗ от фотодеградации, которая естественным образом связывается с воздействием молекул ${}^{1}{{{\text{O}}}_{2}}$, продуцируемых фотодитазином. Известно [24], что при концентрациях выше 5 × × 10–6 М плюроник F-127 в водных растворах образует мицеллы, и молекулы ФЗ, локализующиеся во внешней, гидрофильной части таких мицелл и образующиеся координационные связи с фрагментами плюроника оказываются защищенными от разрушающего действия молекул ${}^{1}{{{\text{O}}}_{2}}$. Фактически эффективность фотосенсибилизирующего окисления молекул органических субстратов определяется тем, насколько молекулы субстрата окажутся локализованными вблизи молекул фотосенсибилизатора, чтобы синглетный кислород преимущественно атаковал молекулы субстрата и в меньшей степени – молекулы фотосенсибилизатора.
Как следует из сопоставления рис. 2 и 3, особенно кривых 1, соответствующих наибольшей мощности при облучении светом в полосе около 400 нм, сильное уменьшение константы деградации указывает на то, что защитные функции плюроника оказываются определяющими. Ранее было показано, что и ФЗ, и триптофан, в силу достаточной полярности своих молекул локализуются в верхней части мицелл плюроника в гидрофильной этиленоксидной “опушке” мицелл плюроника F-127 [24], причем молекулы ФЗ оказываются (особенно при меньших концентрациях) разнесенными на расстояния ~ 20 нм. В этих условиях вероятность фотодеградации “соседних” молекул ФЗ может быть малой, поскольку время жизни синглетного кислорода в водной среде составляет $\tau $ ~ 1 мкс, и за такое характерное время частица (синглетного кислорода) в воде при грубых оценках (коэффициент диффузии D ~ ${{10}^{{ - 8}}}$ см2/с) перемещается на характерное расстояние $l\sim \sqrt {2D\tau } $ ~ 1 нм. В то же время молекулы субстрата (при достаточно большой их концентрации, ${{C}^{{TP}}}$ ~ 1 × 10–4 M) в среднем локализуются на взаимных расстояниях ~ 2–3 нм, что и определяет большую вероятность взаимодействия синглетного кислорода именно c молекулами аминокислотного субстрата.
3. Формирование координационных связей ФЗ с фрагментами плюроника F-127 обусловливает разагрегирование молекул ФЗ, которые обычно формируют ассоциаты в достаточно концентрированных (С > 5 × 10–6 M) водных растворах. Согласно [24], размеры фиксируемых ассоциатов обычно невелики, ~10–20 нм. С этой точки зрения, интерес представляют зависимости ${{k}_{{{\text{eff}}}}}({{C}^{{Pl}}})$ при двух исследуемых концентрациях фотосенсибилизатора ($C_{0}^{{PD}}$ = 2 × 10–6 и 5 × 10–6 М), полученные при воздействии света в полосе 400 нм и представленные на рис. 2 и 3 (кривые 1–3). Превышение эффективных констант ${{k}_{{{\text{eff}}}}}({{C}^{{Pl}}})$ окисления триптофана при разных значениях мощности светового воздействия в случае, когда концентрация ФЗ в растворе составляет $C_{0}^{{PD}}$ = 2 × × 10–6 М, в 1.5, 2.3 и 3 раза по сравнению с полученными при $C_{0}^{{PD}}$ = 5 × 10–6 М, может указывать именно на дезагрегацию ассоциатов ФЗ при включении их в мицеллы плюроника. Поэтому можно полагать, что такие ассоциаты ФЗ при солюбилизации в мицеллах плюроника уменьшают свой размер в 2–3 раза. Обычно полагается, что ФЗ при концентрациях в водных растворах, меньших 1 × 10–6 М, практически не агрегирован. Наши данные показывают, что при концентрациях 2 × 10–6 М небольшая степень агрегированности может еще оставаться.
Следует подчеркнуть, что эффект дезагрегированности молекул ФЗ при наличии в растворе плюроника F-127 удалось зафиксировать только на основе зависимостей ${{k}_{{{\text{eff}}}}}({{C}^{{Pl}}})$, полученных при воздействии света с длиной волны ~400 нм. На основе данных, полученных при воздействии света с λ ~ 660 нм, надежную информации на этот счет получить не удалось. Естественно связать такое заключение с существенно меньшей экстинкцией при таком воздействии на ФЗ и меньшими величинами мощности воздействия, используемыми в таких экспериментах.
ЗАКЛЮЧЕНИЕ
1. Показано, что концентрации ФС, плотности мощностей излучения и длины волн света влияют на фотокаталитическую активность и фотодеградацию ФЗ в модельной реакции.
2. Значения эффективной константы keff скорости фотоокисления триптофана при облучении светом с длиной волны 400 нм в 1.5–3 раза выше, чем для аналогичных систем при воздействии света с длиной волны 660 нм при концентрациях Сpz фотодитазина (5 × 10–6 и 2 × 10–6 М) в реакционной среде для всех исследуемых концентраций плюроника F-127. Данный результат связан с ЭСП фотодитазина, а именно с большим возбуждением молекул ФЗ в полосе поглощения с λ ~ ~ 400 нм, нежели в полосе возбуждения с λ ~ 660 нм.
3. Показаны характерные зависимости констант фотодеградции ФЗ от концентрации плюроника в реакционной системе. Для всех этих зависимостей установлено резкое падение значений ${{k}_{d}}({{C}^{{Pl}}})$ при концентрации плюроника ${{C}^{{Pl}}}$ = = 0–2 × 10–4 М и дальнейший выход на плато величин ${{k}_{d}}({{C}^{{Pl}}})$ при последующем возрастании ${{C}^{{Pl}}}$. Увеличение концентрации плюроника (>~2 × × 10–4 M) в реакционной системе эффективно защищает ФЗ от процесса фотодеградации, что показывает взаимосвязь процесса фоторазрушения ФЗ с фотокаталитической активностью ФС в модельной реакции, поскольку связывается с воздействием молекул ${}^{1}{{O}_{2}}$, продуцируемых фотодитазином.
4. Показано, что амфифильный полимер плюроник F-127 способен повысить фотокаталитическую активность ФС систем в модельных реакциях фотоокисления триптофана в воде вследствие разогрегации ассоциатов ФЗ при включении их в мицеллы плюроника. Данный эффект зафиксирован только при воздействии света с длиной волны ~400 нм, что, вероятно, связано наибольшей плотностью мощности света и наибольшим коэффициентом экстинкции при данном воздействии на ФС, чем при облучении светом с длиной волны 660 нм.
5. Данная модельная реакция позволит “подобрать” ФС системы (в присутствии или в отсутствие других компонентов) и характерные для каждого ФС режимы низкоэнергетических ФД-воздействий на субстраты, которые должны быть наиболее благоприятными для реальной терапии – инициировании регенеративных, иммунных процессов.
Работа выполнена при финансовой поддержке Государственного задания (№ 0082-2019-0012).
Список литературы
Juzeniene A., Nielsen K.P., Moan J.E. // J. Environ. Pathol. Toxicol. Oncol. 2006. V. 25. P. 7.
Brown S.B., Brown E.A., Walker. I. // The Lancet Oncol. 2004. V. 5. P. 497.
Красновский А.А. // Биофизика. 2004. Т. 49. № 2. С. 305.
Jonson P.G., Bellnier D.A., Henderson B.W. // Photochem and Photobiology. 1993. V. 57. P. 50.
Henderson B.W., Bellnier D.A. // Ciba Found. Symp. 1989. V. 146. P. 112.
Wilkinson F., Helman W.P., Ross A.B. // J. Phys. Chem. Ref. Data. 1995. V. 24. № 2. P. 663.
McCaughan Jr.J.S. // Drugs & Aging. 1999. V. 15. P. 49.
Plaetzer K., Krammer B., Berlanda J., Berr F. et al. // Lasers Med Sci. 2009. V. 24. P. 259.
Canti G., De Simone A., Korbelik M. // Photochem. Photobiol. Sci. 2002. V. 1. P. 79.
Allison R.R., Moghissi K. // Clin. Endosc. 2013. V. 46. P. 24.
Акопов А.Л., Казаков Н.В., Русанов А.А., Карлсон А. // Фотодинамическая терапия и фотодиагностика. 2015. № 2. С. 9.
Оптическая биомедицинская диагностика / Под ред. проф. В.В. Тучина. М.: Физматлит, 2007. Т. 1. С. 560. Т. 2. С. 368.
Красников И.В., Привалов В.Е., Сетейкин А.Ю., Фотиади. А.Э. // Вестн. СПбГУ. 2013. Сер. 11. Вып. 4.
Solovieva A.B., Tolstih P.I., Melik-Nubarov N.S. et al. // Las.Phys. 2010. № 5. P. 1068–1074.
Oleinick N.L., Morris R.L., Belichenko I. // Photochem. Photobiol. Sci. 2002. № 1. P. 1.
Ding X., Xu Q., Liu F. et al. // Cancer Lett. 2004. V. 26. P. 43.
Henderson B.W., Donovan J.M. // Cancer Res. 1989. V. 49. P. 6896.
Henderson B.W., Owczarczak B., Sweeney J., Gessner T. // Photochem. Photobiol. 1992. V. 56. № 1. P. 513.
Agarwal M.L., Clay M.E., Harvey E.J., Evans H.H. et al. // Cancer Res. 1991. V. 51. P. 5993.
Мачинская Е.А., Иванова-Радкевич В.И. // Фотодинамическая терапия и фотодиагностика. 2013. № 4. С. 19.
Rudenko T.G., Shekhter A.B., Guller A.E., Aksenova N.A. et al. // Photochem. Photobiol. 2014. V. 90. P. 1413.
Соловьева А.Б., Глаголев Н.Н., Аксенова Н.А. и др. // Журн. физ. химии. 2019. Т. 93. № 9. С. 1428.
Беликов А.В., Скрипкин А.В. Лазерные биомедицинские технологии (часть 1). Учебное пособие. СПб.: СПбГУ ИТМО. 2008. 116 с.
Zhientaev T.M., Melik-Nubarov N.S., Litmanovitch E.A., Aksenova N.A. et al. // Polymer Science. Ser. A. 2009. V. 51. № 5. P. 502.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии