Журнал физической химии, 2021, T. 95, № 6, стр. 884-889
Композиция [хелаты Ni(II) + цетилтриметиламмоний бромид]: особенности каталитической активности на примере реакции разложения гидропероксида трет-бутила
Л. А. Смурова a, *, З. С. Карташева a
a Федеральный исследовательский центр химической физики им. Н.Н. Семенова РАН
Москва, Россия
* E-mail: smurova.lid@yandex.ru
Поступила в редакцию 24.01.2020
После доработки 20.11.2020
Принята к публикации 21.11.2020
Аннотация
Показано, что внутрикомплексные соединения Ni(II) в сочетании с цетилтриметиламмоний бромидом (CTAB) проявляют высокую каталитическую активность в процессе разложения гидропероксида трет-бутила (ROOH); аналогичный эффект имеет место при использовании композиции свободного лиганда (основание Шиффа L(ON) и CTAB). Установлено, что суммарная скорость распада W∑ в случае присутствия в реакции одновременно Ni(II) или L(ON) + СТАВ превышает сумму скоростей в опытах, где данные компоненты присутствуют по отдельности: β = W∑/(WNi,L(ON) + + Wстав) > 1. Сделан вывод, что исследуемые бинарные системы являются эффективными композициями, обладающими каталитическими свойствами, отличными от свойств отдельно взятых компонентов, ее составляющих. Методом спектрофотометрии показано образование и расходование комплексов [Ni(II)исх⋅⋅⋅ROOH]. Исследовано влияние СТАВ на этот процесс.
Общая проблема для каталитических процессов – обеспечение высокой скорости, селективности реакции и условий поддержания катализатора в активной форме. Известно, что эффективность гомогенных катализаторов (в основном используются d-металлы) уменьшается в ходе реакции вплоть до остановки в результате полной пассивации на небольших глубинах конверсии. Это – один из факторов, который делает применение таких катализаторов недостаточно эффективным. Каталитическая активность может быть увеличена при использовании активирующих добавок. Установлено значительное увеличение активности Ni(acac)2 посредством модификации добавками монодентатных лигандов в реакции селективного окисления этилбензола в гидропероксид [1]. Достаточно актуально исследование механизма активации комплексов никеля с помощью различных модификаторов.
Известно, что добавки поверхностно-активных веществ (ПАВ) могут существенно влиять на скорость и механизм окисления углеводородов. Катионный ПАВ цетилтриметиламмоний бромид (СТАВ) служит эффективным катализатором окисления этилбензола, лимонена [2, 3].
Цель настоящей работы – экспериментальное исследование каталитической активности композиции [Ni(II) + СТАВ], каждый компонент которой проявляет каталитические свойства. В качестве модельной реакции использовали реакцию распада гидропероксида трет-бутила (ГПТБ) в хлорбензоле.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В качестве катализаторов использовали внутрикомплексные соединения бис(2-фенилиминометилен-3-оксибензо[b]тиофенаты) никеля c бидентатными лигандами – Ni(ON)2 и Ni(OO)2, а также соответствующие им свободные лиганды – L(ON) и L(OO), предоставленные Институтом органической химии им. Н.Д. Зелинского РАН. Структурные формулы хелатов никеля представлены ниже:
Хлорбензол фирмы “Acros Organics” и цетилтриметиламмоний бромид (СТАВ) фирмы “Serva” использовали без предварительной очистки. ГПТБ экстрагировали хлорбензолом из 70%-го водного раствора, затем осушали безводным Na2SO4. Разложение ГПТБ проводили в токе азота “0” (содержание кислорода 0.003%) в ячейке барботажного типа, которая представляет собой стеклянный сосуд с обратным холодильником, снабженный пробоотборником и капиллярной трубкой для ввода газа. В ячейку заливали раствор катализатора определенной концентрации продували в течение 10 мин азотом “0” для удаления следов кислорода. Затем ячейку погружали в термостат, вводили необходимое количество раствора (10–12 мл) гидропероксида определенной базовой концентрации и отбирали нулеваю пробу. Далее отбирали пробы (0.5 мл) через необходимые промежутки времени. Концентрацию (C) ГПТБ определяли йодометрическим методом. Электронные спектры поглощения исследуемых хелатов отдельно и в присутствии ROOH и СТАВ записывали на спектрофотометре Specord UV-VIS при комнатной температуре в кварцевой кювете толщиной 1 см. Коэффициенты экстинкции (ɛ) исследуемых комплексных соединений никеля определяли согласно закону Бугера–Ламберта–Бера по формуле D = εCl, где D – оптическая плотность, l – толщина кюветы.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Кинетика катализированного разложения ГПТБ
На рис. 1 представлены кинетические кривые термического распада ГПТБ в хлорбензоле при 60°С и в присутствии Ni(ON)2 или Ni(OO)2, только СТАВ и с добавками катализаторов. Из рисунка видно, что термолиз ГПТБ происходит с небольшой скоростъю (W1 = 1.4 × 10–6 моль/(л с)). Начальные скорости разложения пероксида с добавками компексов никеля, СТАВ и их сочетаний представлены в табл. 1, из которой следует, что и СТАВ, и комплексные соединения Ni(II) ускоряют разложение ГПТБ.
Рис. 1.
Кинетические кривые распада ГПТБ без добавок (1) и в присутствии: 2 – Ni(NO)2, 3 – Ni(OO)2, 4 – СТАВ, 5 – Ni(OO)2 + CTAB, 6 – Ni(ON)2 + CTAB; [Ni(ON)2], [Ni(OO)2] = 10–4 М, [CTAB] = 10–2 М, хлорбензол, 60°С.

Таблица 1.
Начальные скорости разложения пероксида в различных каталитических системах
| Каталитическая система | W0 ×106, моль/(л с) |
|---|---|
| СТАВ | 7.2 |
| Ni(ON)2 | 6.1 |
| Ni(ON)2 + СТАВ | 128 |
| Ni(OO)2 | 6.1 |
| Ni(OO)2 + СТАВ | 22 |
Известно, что каталитическое действие катионных ПАВ, к которым относится СТАВ, заключается в ускоренном распаде гидропероксидов в мицеллярных микроагрегатах, образованных этими компонентами, с выходом в объем органического растворителя пероксильных радикалов ${\text{RO}}_{2}^{ \bullet }$ [3]:
Как видно из сравнения начальных скоростей распада в присутствии СТАВ и Ni(ON)2 или Ni(OO)2, их каталитическая активность примерно одинакова. Отличительной особенностью каталитического распада ГПТБ при одновременном присутствии хелатов никеля и СТАВ (рис. 1, кривые 5, 6) является расходование гидропероксида с высокими начальными скоростями. Суммарная скорость распада (W∑) в случае присутствия в реакции обоих соединений превышает сумму скоростей в опытах, где компоненты присутствуют по отдельности (WNi) и (Wстав):
Из анализа экспериментальных данных (рис. 1) следует, что двухкомпонентная система [Ni(II) + + CTAB] является эффективной каталитической композицией в реакции разложения ГПТБ. Наибольшая каталитическая активность наблюдается в случае Ni(ON)2..
Можно предположить несколько механизмов каталитической активности двухкомпонентной системы [Ni(II)–CTAB]: 1) активация в среде интермедиатов реакционной смеси отдельно каждого из компонентов независимо друг от друга, 2) активация одного из компонентов в большей степени, чем другого и 3) в результате непосредственного взаимодействия между компонентами в реакционной среде образуется новая каталитическая частица, обладающая своими физико-химическим характеристиками и соответственно своей каталитической активностью [6]. Образование такой эффективной каталитической частицы наблюдалось в случае хелатов меди и цетилтриметиламмоний бромида в реакции распада ГПТБ [7].
Для понимания каталитического эффекта бинарной системы Ni(II) + СТАВ представлялось целесообразным исследовать электронные спектры поглощения исходных хелатов Ni(II)исх и соответствующих им лигандов с добавками ГПТБ и цетилтриметиламмоний бромида отдельно и при их совместном присутствии.
Исходные хелаты Ni(ON)2исх и Ni(OO)2исх представляют собой координационно ненасыщенные внутрикомплексные соединения с основанием Шиффа, принадлежащего к классу азометиновых красителей, и альдегида в качестве лигандов (см. структурные формулы), и имеют электронные полосы поглощения в видимой части спектра, обусловленные переходом металл–лиганд. Согласно [8], они относятся к поглощению хелатного узла (ПЗ) при λmax = 350 нм и внутримолекулярному переносу заряда (ВМПЗ) при λmax = 430 нм для Ni(ON)2исх (ε = 4.28 × 103 л моль–1 см–1) и λmax = = 420 нм для Ni(OO)2исх (ε = 6.0 × 103 л моль–1 см–1) (рис. 2а, 2б, спектры 0).
Рис. 2.
Электронные спектры поглощения Ni(ON)2исх – 0 (а), Ni(OO)2исх – 0 (б); то же в присутствии ГПТБ (1), Ni(OO)2мод(2) и Ni(OO)2мод + СТАВ (3); [Ni(ON)2исх] = 1.12 × 10–4 М, [Ni(OO)2исх] = 9 × 10–5 М, [CTAB] = 10–2 М, [ГПТБ] = 10–1 М, хлорбензол, комнатная температура.

Исходная форма катализатора претерпевает в процессе реакции дальнейшие превращения с образованием модифицированных каталитических частиц, обладающих различной активностью вплоть до полной дезактивации.
При добавлении ГПТБ (реакция в кювете спектрофотометра при комнатной температуре) наблюдается медленное увеличение поглощения для обоих хелатов (рис. 2, спектры 1) в течение нескольких минут до максимального значения, определяемого концентрацией ROOH. Кинетика спектральных изменений свидетельствует о непосредственном взаимодействии хелата никеля с продуктами распада пероксида (свободными радикалами). Скорость распада ГПТБ при комнатной настолько мала, что невозможно анализировать его концентрацию йодометрическим методом. Большой коэффициент экстинкции и достаточный временной интервал реакции позволяют контролировать реакцию непосредственно в кювете спектрофотометра с автоматической записью оптической плотности.
Наблюдаемые спектральные изменения могут свидетельствовать об образовании комплексов: [Ni(ON)2исх, Ni(OO)2исх⋅⋅⋅ROOH]. Предел в изменении интенсивности при определенном соотношении концентраций компонентов может быть обусловлен полным связыванием хелатов в комплекс с соответствующими коэффициентами экстинкции:
Существование промежуточных комплексов соединений металлов переменной валентности с гидропероксидами доказано различными физико-химическими методами [9, 10]. Характер спектральных изменений в случае используемых хелатов Ni(II) – постепенное увеличение интенсивности поглощения в присутствии ГПТБ – может свидетельствовать об относительно медленной перестройке лигандного окружения иона Ni(II) при вхождении молекул гидропероксида во внутреннюю координационную сферу иона никеля (рис. 2, спектры 1). Аналогичное соединение меди Cu(ON)2 образует комплекс с различными гидропероксидами мгновенно, практически в момент смешивания растворов [10].
Система Ni(ON)2–ГПТБ–СТАВ
Спектральные изменения связаны с относительно медленным взаимодействием компонентов реакции при комнатной температуре в кювете спектрофотометра, когда кинетика расходования гидропероксида недоступна измерению и можно проследить только за превращением исходных форм катализатора.
Кинетическая кривая изменения оптической плотности комплекса [Ni(ON)2исх⋅⋅⋅ГПТБ] (λmax = = 430 нм) представлена на рис. 3 (кривая 1). Наблюдается уменьшение интенсивности поглощения комплекса во времени без смещения максимума, что связано с реакцией каталитического распада ГПТБ. При этом меняется лигандное окружение иона Ni и образуется новая хромофорная система в молекуле катализатора.
Рис. 3.
Кинетические кривые изменения оптической плотности в присутствии ГПТБ: 1 – Ni(ON)2исх, 2 – с добавкой СТАВ; 3 – L(ON), 4 – с добавкой СТАВ; [Ni(ON)2исх] = 1.12 × 10–4 М, [L(ON)] = 4.3 × 10–5 М, [ГПТБ] =10–1 М, [CTAB] = 10–2 М, хлорбензол, комнатная температура.

Особенность используемых соединений металлов с шиффовыми основаниями в качестве лигандов (см. структурную формулу) состоит в том, что свободный L(ON) обладает отчетливо выраженной активностью по отношению к пероксирадикалам [11]. Предположительно антиокислительное действие обусловлено альдиминовой группой –CH=N–. Было также установлено, что основания Шиффа служат ингибиторами при окислении полиолефинов. Предполагается, что продуктами превращения альдиминовой группы являются азиридины [12].
Исходя из изложенного выше, можно считать, что изменение лигандного окружения Ni(ON)2исх (образование новой хромофорной системы, поглощающей в ультрафиолетовой области спектра) происходит в результате взаимодействия альдиминовой группы лиганда с интермедиатами реакционной смеси, образовавшимися в результате каталитического распада ГПТБ.
В присутствии СТАВ наблюдается увеличение скорости спада оптической плотности комплекса [Ni(ON)2исх⋅⋅⋅ГПТБ] в W2/W1 = (6.2 × 10–4/3.1 × × 10–4) опт. ед. с–1 = 2 раза (ср. кривые 1, 2 рис. 3), что может свидетельствовать об увеличении каталитической активности Ni(ON)2исх в присутствии СТАВ.
Свободный лиганд (основание Шиффа – L(ON)исх) также имеет характерный спектр поглощения при λmax = 442 нм (молярный коэффициент экстинкции εL(ON) = 1.6 × 104 л/(моль см)). В присутствии ГПТБ наблюдается постепенное уменьшение интенсивности поглощения на данной длине волны (кривая 3, рис. 3), что можно интерпретировать как непосредственное взаимодействие L(ON)2исх с продуктами распада гидропероксида.
Характерные свойства шиффовых оснований обусловлены полярностью альдиминовой группы, строение которой может быть описано резонансом структур: >C=N– ↔ >C+–N−–. Электрофильные реагенты реагируют по атому “N”, нуклеофильные – по атому “С”. В присутствии СТАВ (кривая 4, рис. 3) скорость исчезновения полосы поглощения L(ON) происходит в 100 раз быстрее (W4 = 3.2 × 10–3 опт. ед. с–1), чем в его отсутствие (W3 = 3.0 × 10–5 опт. ед. с–1). Такой эффект увеличения скорости можно объяснить образованием активной каталитической частицы [L(ON)исх – СТАВ].
Каталитическое влияние основания Шиффа и активирующего действия СТАВ подтверждают также опыты по распаду ГПТБ при температуре 60°С с добавками этих компонентов отдельно и при совместном присутствии (рис. 4, кривые 0, 1, 2, 3). Из анализа кинетических кривых следует, что лиганд оказывает катализирующее действие на распад гидропероксида (кривые 1 и 4), увеличивая скорость в W1/W0 = (4.5 × 10–6 моль/(л с): 1.4 × 10–6 моль/(л с)) = 3.2 раза.
Рис. 4.
Кинетические кривые распада ГПТБ без добавок (0) и присутствии L(ON) (1), СТАВ (2) и L(ON) + + CTAB (3); [L(ON)] = 2×10–4М, [CTAB] =10–2 М, хлорбензол, 60°С.
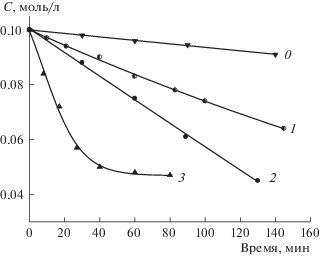
Интересным оказался факт, что при одновременном присутствии L(ON) и СТАВ распад гидропероксида происходит с суммарной скоростью W∑3 = 4.5 × 10–5 моль/(л с) (кривая 3, рис. 4), которая превышает сумму начальных скоростей (W1 + W2) в опытах, где компоненты присутствуют по отдельности: β = W∑3/(W1 + W2) > 1. Из этого следует, что сочетание свободного лиганда с цетилтриметиламмоний бромидом [L(ON) + СТАВ] является эффективной композицией в реакции разложения ГПТБ, обладающей каталитическими свойствами, отличными от свойств отдельно взятых ее составляющих. В связи с этим можно полагать, что в каталитическую активность данного хелата никеля, а также бинарной системы [Ni(ON)2 + CТАВ] большой вклад вносит лиганд, хотя свободный лиганд и лиганд, находящийся в комплексе с металлом, могут обладать разной каталитической активностью.
Система NI(OO)2–ГПТБ–СТАВ
Для хелата Ni(OO)2исх с альдегидом в качестве лиганда (см. структурную формулу) в спектрах поглощения в присутствии гидропероксида (реакция в кювете спектрофотометра при комнатной температуре) наблюдается участок медленного нарастания плотности, который связан с образованием комплекса [Ni(ОО)2исх⋅⋅⋅ГПТБ], без дальнейшего изменения интенсивности во времени (рис. 5, кривая 1). Несмотря на видимое отсутствие изменения поглощения комплекса [Ni(OO)2исх⋅⋅⋅ГПТБ] за время проведения реакции, каталитический процесс происходит и в этом случае, но очень медленно – небольшое изменение интенсивности спектра можно было наблюдать только через 24 ч после начала эксперимента.
Рис. 5.
Кинетические кривые изменения оптической плотности Ni(OO)2исх в присутствии ГПТБ (1), ГПТБ + СТАВ (2), Ni(OO)2мод (3) и Ni(OO)мод + + СТАВ (4); [Ni(OO)2исх] = 9 × 10–5 М, [CTAB] = = 10‒2 М, [ГПТБ] = 10–1 М (1, 2) и 4 × 10–2 М (3, 4), хлорбензол, комнатная температура.

В присутствии СТАВ спад интенсивности поглощения комплекса происходит с большей скоростью W2 = 1.5 × 10–3 опт. ед. с–1 – (ср. кривые 1, 2, рис. 5). Образуется эффективная каталитическая композиция с исходной формой [Ni(ОО)исх + + СТАВ].
Как известно, в результате каталитического цикла в реакционной среде катализатор модифицируется с образованием различных частиц, обладающих своими каталитическими свойствами:
Добавка СТАВ в реакционную смесь приводит к изменению спектра Ni(OO)2мод (исчезает максимум поглощения при 380 нм, и наблюдается гипсохромный сдвиг полосы 420 нм, рис. 2, спектр 3). Такие спектральные изменения могут свидетельствовать о непосредственном взаимодействии компонентов с образованием новой частицы (комплекса):
Интенсивность поглощения модифицированной формы Ni(OO)2мод при добавке СТАВ уменьшается во времени даже при комнатной температуре (рис. 5, кривая 4), что свидетельствует о распаде ГПТБ с вновь образовавшейся каталитически активной частицей, обладающей своими физико-химическими свойствами. Можно с большой долей вероятности предположить, что образование подобного рода каталитически активных частиц в бинарных системах хелатов Ni(II) и СТАВ происходит со всеми формами катализатора, возникающими в процессе каталитического цикла. Цетилтриметиламмоний бромид можно рассматривать как активирующую добавку, усиливающую каталитические свойства хелатов никеля.
Работа выполнена в рамках государственного задания ФАНО России (0082-2018-0006, № АААА-А18-118020890097-1).
Список литературы
Матиенко Л.И., Мосолова Л.А., Заиков Г.Е. // Успехи химии. 2009. Т. 78 (3). С. 227.
Максимова Т.В., Сирота Т.В., Коверзанова Е.В. и др. // Нефтехимия. Т. 42. № 1. С. 50.
Касаикина О.Т., Потапова Н.В., Круговов Д.А., Писаренко Л.М. // Кинетика и катализ. 2017. Т. 58. № 5. С. 567.
Frankel E.N. Lipid Oxidation – Second Edition. Scotland: The Oily Press, 2005.
Касаикина О.Т., Карташева З.С., Писаренко Л.М. // Журн. общ. химии. 2008. Т. 78. № 8 С. 1298.
Швец В.Ф. // Введение в химию каталитических реакций. Российский химико-технологический университет им. Д.И. Менделеева, 1996.
Смурова Л.А., Карташева З.С. // Хим. физика. 2019. Т. 38. № 75. С. 88.
Литвинов В.П., Гольдфарб Я.Л., Остапенко Э.Г. // Изв. АН СССР. Сер. хим. 1974. № 10. С. 2279.
Булгакова Г.М., Шупик А.Н., Скибида И.П. и др. // Докл. АН СССР. 1971. Т. 199. № 1. С. 376.
Гагарина А.Б., Смурова Л.А. // Кинетика и катализ. 1980. Т. 21. № 2. С. 371.
Смурова Л.А., Гагарина А.Б. // Изв. АН СССР. Сер.хим. 1985. № 1. С. 40.
Постников Л.М., Зарубин Н.Г., Вичутинская Е.В. и др. // Там же. 1968. С. 260.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии



