Журнал физической химии, 2021, T. 95, № 6, стр. 838-845
Фазовые равновесия жидкость–пар и термодинамические свойства растворов бинарных систем толуол–н-алкилбензолы
Ю. К. Сунцов a, *, Н. С. Сунцова a
a Воронежский государственный университет
Воронеж, Россия
* E-mail: jsyntsov@mail.ru
Поступила в редакцию 19.05.2020
После доработки 20.11.2020
Принята к публикации 24.11.2020
Аннотация
Исследованы фазовые равновесия жидкость–пар растворов бинарных систем, образованных н-алкилбензолами. Рассчитаны вклады межмолекулярных взаимодействий в термодинамические функции н-алкилбензолов и их бинарных растворов с толуолом. Установлено, что вклады межмолекулярных взаимодействий в энергию Гельмгольца для бинарных растворов постоянных мольных концентраций, образованных толуолом и н-алкилбензолами, линейно зависят от молярной массы н-алкилбензола в гомологическом ряду. Предложены соответствующие уравнения.
Для установления связи молярных характеристик компонентов с термодинамическими свойствами растворов наибольшую ценность имеют данные о свойствах бинарных систем, образованных веществами гомологического ряда [1]. Существующие методы расчета свойств многокомпонентных систем также базируются на свойствах их бинарных составляющих [2]. При производстве толуола и его гомологов часто встречаются растворы, образованные н-алкилбензолами [3, 4]. Литературные данные о свойствах этих растворов носят фрагментарный характер, так как исследования часто проводились в технологических целях. Нами исследованы фазовые равновесия жидкость–пар и объемные свойства растворов бинарных систем, образованных толуолом (общий растворитель) и бензолом, этилбензолом, н-пропил бензолом, н-бутилбензолом (вторые компоненты растворов) от состава систем при различных температурах. В предлагаемой работе предпринята попытка расширить границы установленной ранее закономерности изменения энергии Гельмгольца от состава и молярной массы компонентов растворов с включением в круг объектов исследования растворы систем толуол – н-алкилбензолы. Ранее эта закономерность была установлена для растворов 150 бинарных систем, образованных веществами, относящимися к различным классам органических соединений.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Бензол и этилбензол – марки “х.ч.”, толуол марки “ос.ч.”, н-пропилбензол и н-бутилбензол – фирмы “Merk” марки “for synthesis” очищали методами, описанными в [5], и перегоняли без доступа воздуха на лабораторной ректификационной колонне. Контроль остаточной влаги в реактивах осуществляли потенциометрическим титрованием с использованием реактива Фишера [6], при этом содержание воды в реактивах не превышало 0.01%. Физические константы очищенных веществ, приведенные в табл. 1, удовлетворительно совпадают с данными [7–9]. Давление насыщенного пара (Р) измеряли при температуре кипения жидкости (Т) в эбуллиометрах Свентославского. Постоянство давления в системе поддерживали изодромным регулятором с отрицательной обратной связью с точностью ±6.6 Н/м2. Давление насыщенного пара растворов измеряли ртутным манометром с использованием катетометра В-630 ГОСТ 15150-69 с точностью ±6.6 Н/м2; а атмосферное давление – ртутным барометром первого класса с той же точностью. Плотности растворов измеряли пикнометрами Оствальда с точностью ±0.1 кг/м3 [10].
Таблица 1.
Свойства очищенных веществ
| Эксперимент | Литературные данные | |||||
|---|---|---|---|---|---|---|
| Вещество | $\rho _{4}^{{20}}$ | T, K | $n_{D}^{{20}}$ | $\rho _{4}^{{20}}$ | T, K | $n_{D}^{{20}}$ |
| Бензол | 0.8789 | 353.3 | 1.5008 | 0.8790 | 353.25 | 1.5011 |
| Толуол | 0.8671 | 383.8 | 1.4965 | 0.8669 | 383.77 | 1.4969 1.4961 |
| Этилбензол | 0.8672 | 409.4 | 1.4959 | 0.8671 | 409.3 | 1.4959 |
| н-Пропилбензол | 0.8620 | 432.3 | 1.4916 | 0.8619 | 432.4 | 1.4920 |
| н-Бутилбензол | 0.8613 | 456.4 | 1.4898 | 0.8609 | 456.4 | 1.4898 |
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Построенные на основе экспериментальных зависимостей P = f(T) изотермы давления насыщенного пара P = f(x) растворов послужили основой для расчета составов равновесных паровых фаз систем. Ранее экспериментально было установлено, что при пониженных давлениях паровая фаза растворов подчиняется законам идеального газа с точностью, сравнимой с точностью проведенного нами эксперимента [11]. Составы равновесных паровых фаз растворов систем рассчитывали численным интегрированием на ЭВМ уравнения Дюгема–Маргулеса, которое при Т = const и условии идеальности паровой фазы приобретает вид [11]:
где х и y – мольные доли высококипящего компонента в жидкости и паре; P – давление насыщенного пара бинарного раствора. Анализ экспериментальных данных и результаты расчетов показывают, что растворы систем обладают положительными и отрицательными отклонениями от идеального состояния раствора, при этом относительное содержание толуола в паровой фазе систем увеличивается с возрастанием молярной массы второго компонента раствора (табл. 2). При ректификации растворов концентрация толуола в паровой фазе систем больше, чем концентрации этил-, пропил- и бутилбензола, и меньше, чем концентрация молекул бензола. Повышение температуры (давления) увеличивает содержание этил-, пропил- и бутилбензолов в паровой фазе систем, что согласуется с законом Вревского [12]. На основе полученных P–X–Y–T-данных по известным термодинамическим соотношениям рассчитаны значения коэффициентов активности (γi) и избыточных химических потенциалов компонентов в смесях ($\mu _{i}^{e}$), а также значения избыточной энергии Гиббса (Ge) растворов систем [1, 12]: где xi и yi – концентрация i-го компонента в жидкой и паровой фазе раствора; P и $P_{i}^{0}$ – соответственно давление насыщенного пара раствора и чистого i-го компонента; R – универсальная газовая постоянная; T – температура, K. Результаты расчетов показывают, что для компонентов системы толуол–бензол значения γi > 1, $\mu _{i}^{e}$ > 0 во всем интервале концентраций. С увеличением молекулярной массы второго компонента растворов в ряду систем: толуол–этилбензол, толуол–н-пропилбензол, толуол–н-бутилбензол появляются отрицательные отклонения свойств растворов от идеального состояния (Ge < 0) (рис. 1). Энтальпии смешения (избыточные энтальпии) растворов (He) рассчитывали с использованием экспериментальных и литературных данных [9, 12, 13] по уравнению:(5)
${{H}^{e}} = - R{{T}^{2}}\left[ {{{x}_{1}}{{{\left( {\frac{{\partial \ln {{\gamma }_{1}}}}{{\partial T}}} \right)}}_{{{{x}_{2}}}}} + \left( {1 - {{x}_{1}}} \right){{{\left( {\frac{{\partial \ln {{\gamma }_{2}}}}{{\partial T}}} \right)}}_{{{{x}_{1}}}}}} \right],$Таблица 2.
Фазовые равновесия жидкость–пар и термодинамические свойства растворов систем толуол–н-алкилбензолы при T = 353 K
| Параметр | Толуол–бензол | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| х | 1.0000 | 0.9000 | 0.8000 | 0.7000 | 0.6000 | 0.5000 | 0.4000 | 0.3000 | 0.2000 | 0.1000 | 0.0000 |
| y | 1.0000 | 0.7712 | 0.6040 | 0.4734 | 0.3674 | 0.2793 | 0.2054 | 0.1431 | 0.0906 | 0.0453 | 0.0000 |
| p | 39.69 | 46.32 | 52.72 | 58.99 | 65.27 | 71.57 | 77.89 | 84.11 | 90.10 | 95.63 | 100.52 |
| V | 113.7 | 112.0 | 110.2 | 108.4 | 106.6 | 104.8 | 103.1 | 101.3 | 99.51 | 97.74 | 95.96 |
| –He | 0 | 1.698 | 2.116 | 2.334 | 2.352 | 2.230 | 2.258 | 2.146 | 1.964 | 1.632 | 0 |
| –Se | 0 | 4.8 | 6.1 | 6.7 | 6.8 | 6.5 | 6.4 | 6.2 | 5.7 | 4.8 | 0 |
| H | 35.88 | 33.90 | 33.20 | 32.70 | 32.40 | 32.24 | 31.93 | 31.76 | 31.66 | 31.71 | 33.06 |
| Ur | 32.95 | 30.97 | 30.27 | 29.78 | 29.47 | 29.31 | 29.00 | 28.83 | 28.73 | 28.78 | 30.14 |
| Ar | 16.09 | 15.84 | 15.60 | 15.37 | 15.14 | 14.91 | 14.68 | 14.45 | 14.23 | 14.02 | 13.86 |
| Sr | 47.7 | 42.8 | 41.5 | 40.7 | 40.5 | 40.8 | 40.5 | 40.7 | 41.0 | 41.7 | 46.0 |
| Толуол–этилбензол | |||||||||||
| y | 1.0000 | 0.9571 | 0.9071 | 0.8494 | 0.7825 | 0.7043 | 0.6122 | 0.5024 | 0.3695 | 0.2058 | 0.0000 |
| p | 39.69 | 37.36 | 34.96 | 32.58 | 30.24 | 27.90 | 25.60 | 23.32 | 21.07 | 18.83 | 16.66 |
| V | 113.7 | 115.4 | 117.1 | 118.8 | 120.4 | 122.1 | 123.8 | 125.5 | 127.1 | 128.8 | 130.5 |
| –He | 0 | 0.585 | 1.180 | 1.555 | 1.700 | 1.625 | 1.360 | 0.995 | 0.580 | 0.215 | 0 |
| –Se | 0 | 1.64 | 3.28 | 4.34 | 4.74 | 4.51 | 3.79 | 2.75 | 1.59 | 0.56 | 0.00 |
| H | 35.88 | 35.66 | 35.43 | 35.42 | 35.64 | 36.08 | 36.71 | 37.44 | 38.22 | 38.95 | 39.53 |
| Ur | 32.95 | 32.72 | 32.50 | 32.48 | 32.71 | 33.15 | 33.77 | 34.51 | 35.29 | 36.02 | 36.60 |
| Ar | 16.09 | 16.30 | 16.53 | 16.75 | 16.96 | 17.18 | 17.39 | 17.60 | 17.82 | 18.03 | 18.23 |
| Sr | 47.7 | 46.5 | 45.2 | 44.5 | 44.6 | 45.2 | 46.3 | 47.8 | 49.4 | 50.9 | 52.0 |
| Толуол–н-пропилбензол | |||||||||||
| y | 1.0000 | 0.9809 | 0.9565 | 0.9264 | 0.8869 | 0.8352 | 0.7682 | 0.6788 | 0.5485 | 0.3364 | 0.0000 |
| p | 39.69 | 35.68 | 32.14 | 28.84 | 25.66 | 22.52 | 19.37 | 16.24 | 13.16 | 10.24 | 7.621 |
| V | 113.7 | 117.2 | 120.6 | 124.1 | 127.5 | 131.0 | 134.4 | 137.8 | 141.3 | 144.7 | 148.2 |
| –He | 0 | 2.384 | 3.238 | 3.412 | 3.286 | 3.140 | 3.064 | 2.948 | 2.552 | 1.596 | 0 |
| –Se | 0.0 | 5.2 | 7.6 | 8.2 | 8.0 | 7.8 | 7.7 | 7.6 | 6.6 | 4.2 | 0.0 |
| H | 35.88 | 34.31 | 34.27 | 34.91 | 35.85 | 36.81 | 37.70 | 38.63 | 39.84 | 41.61 | 44.02 |
| Ur | 32.95 | 32.44 | 32.56 | 32.82 | 33.24 | 33.82 | 34.61 | 35.65 | 36.99 | 38.74 | 41.08 |
| Ar | 16.09 | 16.57 | 17.01 | 17.43 | 17.82 | 18.21 | 18.61 | 19.03 | 19.44 | 19.80 | 20.15 |
| Sr | 47.7 | 44.9 | 44.0 | 43.5 | 43.6 | 44.2 | 45.3 | 47.0 | 49.7 | 53.6 | 59.2 |
| Толуол–н-бутилбензол | |||||||||||
| y | 1.0000 | 0.9922 | 0.9815 | 0.9680 | 0.9503 | 0.9262 | 0.8910 | 0.8360 | 0.7407 | 0.5477 | 0.0000 |
| p | 39.69 | 35.20 | 31.36 | 27.65 | 24.01 | 20.38 | 16.74 | 13.12 | 9.572 | 6.213 | 3.110 |
| V | 113.7 | 118.7 | 123.9 | 129.0 | 134.2 | 139.3 | 144.5 | 149.6 | 154.8 | 160.0 | 165.3 |
| –He | 0 | 2.205 | 3.500 | 4.465 | 5.310 | 6.015 | 6.380 | 6.145 | 5.050 | 2.955 | 0 |
| –Se | 0 | 6.0 | 9.6 | 12.3 | 14.7 | 16.7 | 17.7 | 17.1 | 14.1 | 8.3 | 0.0 |
| H | 35.88 | 35.05 | 35.13 | 35.54 | 36.07 | 36.74 | 37.75 | 39.36 | 41.83 | 45.30 | 49.63 |
| Ur | 32.95 | 32.12 | 32.20 | 32.61 | 33.14 | 33.81 | 34.82 | 36.43 | 38.90 | 42.37 | 46.69 |
| Ar | 16.09 | 16.80 | 17.44 | 18.08 | 18.71 | 19.35 | 19.98 | 20.61 | 21.23 | 21.85 | 22.46 |
| Sr | 47.7 | 43.3 | 41.7 | 41.1 | 40.8 | 40.9 | 42.0 | 44.7 | 50.0 | 58.1 | 68.6 |
Обозначения: х и y – мол. доли толуола в жидкой и паровой фазе систем соответственно (х – относится к растворам всех систем) ; p – давление насыщенного пара растворов (кПa); V – мольный объем растворов (см3/моль); H – энтальпия испарения растворов (кДж моль–1); He – избыточная энтальпия растворов (кДж моль–1); Se – избыточная энтропия растворов (Дж моль–1 K–1); Ur – внутренняя энергия растворов (кДж моль–1); Ar– энергия Гельмгольца растворов (кДж моль–1); Sr – энтропия растворов (Дж моль–1 K–1).
Рис. 1.
Зависимости избыточной энергии Гиббса (Ge) от состава растворов систем при Т = 353 К; 1 – толуол–бензол, 2 – толуол–этилбензол, 3 – толуол–н-пропилбензол, 4 – толуол–н-бутилбензол; х – содержание толуола.
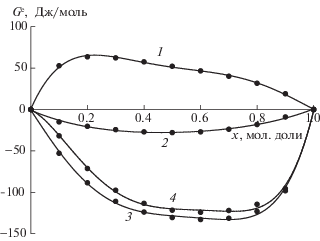
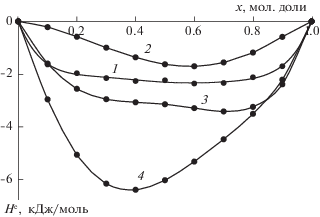
Рис. 2.
Зависимости избыточной энтальпии (He) от состава растворов систем при Т = 353 К; 1–4– см. рис. 1.
Примем два положения; первое – определяет “отсчетное состояние” системы. “Отсчетное состояние” системы без межмолекулярного взаимодействия при любых степенях сжатия – идеальный газ, взятый при температуре (Т), объеме (V) и составе реальной жидкости. Второе положение – вклады межмолекулярного взаимодействия в изменение термодинамической функции определяются как разность значений этой функции для “отсчетного состояния” системы и реальной жидкой системы:
где Fr – вклад межмолекулярного взаимодействия в изменение термодинамической функции, F – в реальном состоянии; F* – в состоянии идеального газа, используемого в качестве “отсчетного состояния” системы. Разность F* – F обеспечивает положительные значения F r. Отметим, что при включении межмолекулярного взаимодействия в жидкости знак F r изменится.Рассмотрим бинарный жидкий раствор при температуре Т, находящийся в равновесии с насыщенным паром при давлении P. Мольная энергия Гельмгольца для бинарного раствора (A) определяется как:
где x1 and x2 – мольные доли; μ1 and μ2 – химические потенциалы компонентов в растворе; P и V – давление насыщенного пара и мольный объем раствора. Для химического потенциала компонента в растворе имеем: где $\mu _{i}^{0}$ – функция, зависящая только от температуры; ${{\bar {p}}_{i}}$ – парциальное давление i-го компонента в растворе. Поскольку абсолютные значения энергии Гельмгольца неизвестны, берем в качестве “ отсчетного” состояния системы смесь идеальных газов той же концентрации, что и жидкий бинарный раствор, при той же температуре (Т) и с тем же мольным объемом (V). Давление в этом “отсчетном” состоянии определяется как P* = = RT/V, а мольная энергия Гельмгольца (A*): где $\mu _{1}^{*}$ и $\mu _{2}^{*}$ – химические потенциалы компонентов 1 и 2 в “отсчетном” состоянии смеси; R – универсальная газовая постоянная. Для химического потенциала компонента в “отсчетном” состоянии идеального газа имеем:Так как P* = RT/V, то уравнение (11) преобразуется к виду:
Определим вклад ММВ в изменение мольной энергии Гельмгольца (Ar) как разность ее значений в “ отсчетном” состоянии системы и реальном:
(13)
$\begin{gathered} {{A}^{r}}~ = ~A{\kern 1pt} {\text{*}} - A = {{x}_{1}}(\mu _{1}^{*} - {{\mu }_{1}}) + \\ + \;{{x}_{2}}(\mu _{2}^{*} - {{\mu }_{2}}) - RT + PV. \\ \end{gathered} $(14)
$\frac{{{{A}^{r}}}}{{RT}} = {{x}_{1}}\ln \frac{{{{x}_{1}}RT}}{{{{{\bar {p}}}_{1}}V}} + {{x}_{2}}\ln \frac{{{{x}_{2}}RT}}{{{{{\bar {p}}}_{2}}V}} - 1 + \frac{{PV}}{{RT}}.$(15)
$\frac{{A_{1}^{r}}}{{RT}} = \ln \frac{{RT}}{{{{P}_{1}}{{V}_{1}}}} - 1 + \frac{{{{P}_{1}}{{V}_{1}}}}{{RT}},$(16)
$\frac{{A_{2}^{r}}}{{RT}} = \ln \frac{{RT}}{{{{P}_{2}}{{V}_{2}}}} - 1 + \frac{{{{P}_{2}}{{V}_{2}}}}{{RT}},$(17)
$\frac{{{{A}^{e}}}}{{RT}} = \frac{{{{A}^{r}}}}{{RT}} - {{x}_{1}}\frac{{A_{1}^{r}}}{{RT}} - {{x}_{2}}\frac{{A_{2}^{r}}}{{RT}}.$Это уравнение, при объединении с уравнениями (14)–(16) и с учетом выражения для коэффициента активности компонента раствора (${{\gamma }_{i}} = {{\bar {p}}_{i}}{\text{/}}{{x}_{i}}{{P}_{i}}$) преобразуется к виду:
(18)
$\begin{gathered} \frac{{{{A}^{e}}}}{{RT}} = {{x}_{1}}\ln \frac{1}{{{{\gamma }_{1}}}} + {{x}_{2}}\ln \frac{1}{{{{\gamma }_{2}}}} + {{x}_{1}}\ln \frac{{{{V}_{1}}}}{V} + \\ + \;{{x}_{2}}\ln \frac{{{{V}_{2}}}}{V} + \frac{{PV - {{x}_{1}}{{P}_{1}}{{V}_{1}} - {{x}_{2}}{{P}_{2}}{{V}_{2}}}}{{RT}}. \\ \end{gathered} $Представим два соотношения для избыточных энергии Гиббса (Ge) и мольного объема (Ve) бинарного раствора:
C учетом соотношений (19), (20) уравнение (18) преобразуется к виду:
(21)
$\begin{gathered} \frac{{{{A}^{e}}}}{{RT}} = \frac{{{{G}^{E}}}}{{RT}} - \ln ({{V}^{e}} + {{x}_{1}}{{V}_{1}} + {{x}_{2}}{{V}_{2}}) + {{x}_{1}}\ln {{V}_{1}} + \\ + \;{{x}_{2}}\ln {{V}_{2}} + ~\frac{{P{{V}^{e}} + {{x}_{1}}{{V}_{1}}(P - {{P}_{1}}) + {{x}_{2}}{{V}_{2}}(P - {{P}_{2}})}}{{RT}}. \\ \end{gathered} $Уравнение (21) устанавливает связь между значениями избыточных величин энергии Гиббса (Ge–рассчитанной по стандарту идеального раствора) и энергии Гельмгольца (Ae – в “отсчетном” состоянии). Используем известные термодинамические соотношения для внутренней энергии (U r) и энтропии (Sr) [1, 12]:
(23)
${{U}^{r}} = - {{T}^{2}}{{\left( {\frac{{\partial ({{A}^{r}}{\text{/}}T)}}{{\partial T}}} \right)}_{{V,X}}}{\kern 1pt} .$После дифференцирования и преобразований для бинарного раствора получим:
(24)
${{S}^{r}} = \frac{H}{T} - R\left( {{{x}_{1}}\ln \frac{{{{x}_{1}}RT}}{{{{{\bar {p}}}_{1}}V}} + {{x}_{2}}\ln \frac{{{{x}_{2}}RT}}{{{{{\bar {p}}}_{2}}V}}} \right),$(29)
$\begin{gathered} {{A}^{r}} = (--150.12x + 153.18)M + \\ + \;13\,900x + 1892.5, \\ \end{gathered} $Рис. 3.
Зависимости внутренней энергии растворов (Ur) от состава систем при Т = 353 К; 1–4 – см. рис. 1.
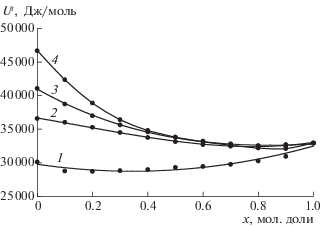
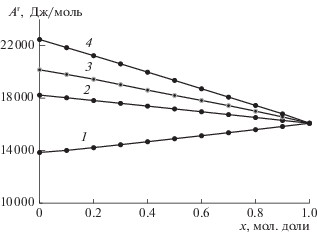
Рис. 5.
Зависимости энергии Гельмгольца (Ar) от молярной массы н-алкилбензола (М) для растворов постоянных мольных концентраций систем толуол–н‑алкилбензол при Т = 353 К; х = 0 (1), 0.2 (2), 0.4 (3), 0.6 (4), 0.8(5) и 0.9 мол. доли толуола (6).
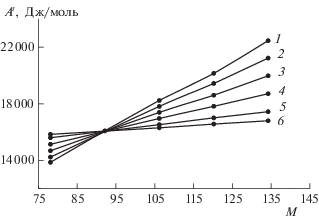
Таким образом, установлено, что значения энергии Гельмгольца (Аr) линейно зависят от молярной массы вещества (числа групп –CH2– в молекуле) в гомологическом ряду н-алкилбензолов. Возрастание энергии Гельмгольца для веществ в гомологическом ряду н-алкилбензолов связано с линейным увеличением мольных объемов жидких веществ и уменьшением давления насыщенного пара веществ по экспоненциальной зависимости.
Энергия Гельмгольца (Аr) для бинарных растворов постоянных мольных концентраций, образованных толуолом и членами гомологического ряда н-алкилбензолов, линейно зависит от молярной массы н-алкилбензола (числа групп –CH2–) в гомологическом ряду. Полученное на основе этой закономерности уравнение (29) описывает энергию Гельмгольца для растворов систем с отклонениями ±50 Дж/моль от ее значений, рассчитанных по экспериментальным P,V,T,X,Y-данным. Установленная закономерность подтверждает правомерность гипотезы об аддитивном вкладе функциональных групп в термодинамические свойства растворов, лежащей в основе статистических моделей растворов, известных как “групповые”. Установленная закономерность позволяет также прогнозировать термодинамические свойства растворов неисследованных бинарных систем с использованием свойств чистых компонентов и всего двух растворов одинаковой мольной концентрации, что ускоряет процесс исследования фазовых равновесий жидкость–пар и термодинамических свойств бинарных систем в ~300 раз. Точность прогнозирования термодинамических свойств растворов зависит только от точности используемых экспериментальных данных.
Список литературы
Уэйлес С. Фазовые равновесия в химической технологии. В 2-х частях. М.: Мир, 1989.
Сунцов Ю.К. // Журн. физ. химии. 2019. Т. 93. № 3. С. 1259.
Петлюк Ф.Б., Серафимов Л.А. Многокомпонентная ректификация, теория и расчет. М.: Химия, 1983. 304 с.
Батуева И.Ю., Гайле А.А., Поконова Ю.В. и др. Химия нефти. Л.: Химия, 1984. 360 с.
Becker H., Berger W. u.a. Organikum. VEB Deutscher Verlag der Wissennschaften, Berlin, 1976. 253 c.
Шарло Г. Методы аналитической химии. М.: Химия, 1965.
TCI American Organic Chemical 88/89 Catalog. Portland.: American Tokyo Kasei, 1988.
Справочник химика / Под ред. Б.К. Никольского. М.: Химия, 1971. Т. 2, 4
William M. Haynes [Electronic resource]. URL: https://chemdb.net/ru/paper/A2xZLJnbJe/(data of treatment: 24.08.2020).
Сунцов Ю.К. // Вестн. ВГУ. Сер. Химия. Биология. Фармация. 2009. № 1. С. 42.
Перелыгин В.М., Сунцов Ю.К. // Изд. вузов СССР. Пищевая технология. 1974. № 2. С. 133.
Морачевский А.Г. и др. Термодинамика равновесия жидкость–пар. Л.: Химия, 1989. 342 c.
TCI American Organic Chemical 88/89 Catalog. Portland.: American Tokyo Kasei, 1988. https://www.nist.gov/libraries/nist-component-library/dist/img/logo/nist_logo_sidestack_rev.svg
Сунцов Ю.К., Семенов А.А. // Конденсированные среды и межфазные границы. 2004. Т. 6. № 3. С. 283.
Белоусов О.П., Панов М.Ю. Термодинамика водных растворов неэлектролитов. Л.: Химия, 1983. 264 с.
Скрышевский A. Структурный анализ жидкостей. М.: Высшая школа, 1971. 254 с.
Раковский А.В. Предисловие к книге И.Д. Ван-дер-Ваальса, Ф. Констамма. Курс термостатики. М.: Изд-во иностр лит., 1936.
Rowlinson J.B. Liquids and Liquid Mixtures. L., 1959.
Никольский Б.П. // Вестн. ЛГУ. Сер. Физ. хим. 1960. Т. 22. Вып. 4.
Рудаков Е.С. Молекулярная, квантовая и эволюционная термодинамика / НАН Украины, Ин-т физ.-орган. химии и углехимии им. Л.М. Литвиненко. Донецк, 1998. 139 с.
Suntsov Yu. Legitimacies Change of Properties of Binary Systems on an Example of Solutions Formed by n‑Alcohols and Complex Ethers of Organic Acids / Yu. Suntsov. – Thermodynamics 2003. University of Cambridge. U.K., 2003. P. 99.
Сунцов Ю.К. Закономерности изменения свойств бинарных систем на примере растворов, образованных н-спиртами и сложными эфирами органических кислот: Дис. …докт. хим. наук. Воронеж, 2004. 697 с.
Suntsov Y.K. // J. Chem. Chem. Eng. 2014. V. 8. P. 306.
Сунцов Ю.К. // Журн. физ. химии. 2008. Т. 82. № 4. С. 625.
Харченко Г.Ю. Фазовые равновесия и термодинамические свойства растворов, образованных н‑алифатическими спиртами и сложными эфирами уксусной кислоты: Дис. … канд. хим. наук. Санкт- Петербург, 2004. 236 с.
Власов М.В. Фазовые равновесия и термодинамические свойства бинарных систем, образованных спиртами и алифатическими кетонами...: Дис…. канд. хим. наук. Воронеж, 2013. 238 с.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии