Журнал физической химии, 2021, T. 95, № 6, стр. 846-851
Температурные зависимости некоторых характеристик хлороводорода в спиртах
a Восточно-Сибирский государственный университет технологий и управления
Улан-Удэ, Республика Бурятия, Россия
* E-mail: tanganov@rambler.ru
Поступила в редакцию 26.06.2020
После доработки 19.11.2020
Принята к публикации 20.11.2020
Аннотация
Оценены предельные значения электропроводности, степень диссоциации, термодинамические константы диссоциации хлороводорода в н-спиртах в диапазоне температур 278–328 К с шагом 10 К. Методом многоуровневого моделирования разработаны модельные уравнения оценки предельных электропроводностей и констант диссоциации на некотором базисе растворителей в большом диапазоне температур раствора. Получены надежные и воспроизводимые результаты с высокой степенью надежности и достоверности.
Существующие теории растворов электролитов не дают полной картины ион-дипольных, ион-ионных и диполь-дипольных взаимодействий, имеющих место в растворителях с разными диэлектрическими постоянными, константами автопротолиза, вязкостями и дипольными моментами.
Плазменно-гидродинамическая концепция в отношении водных растворов сильных электролитов, основанная на предположениях Дебая, была разработана на кафедре “Неорганическая и аналитическая химия” Восточно-Сибирского государственного университета технологий и управления проф. Балдановым М.М. в качестве модели для процессов электропроводности. Им была предложена модель переноса количества заряда водных растворов сильных электролитов [1].
Данная теория была в дальнейшем развита, расширена и углублена автором данной работы в отношении сильных и слабых электролитов не только в водном растворе, но и в органических растворителях, коренным образом отличающихся своими свойствами от воды. Так, были выведены модельные уравнения для характеристик сольватированных ионов (ион-дипольные взаимодействия), процессов переноса количества заряда, массы, энергии и количества движения в неводных растворах с учетом вязкости, диэлектрической проницаемости, собственных размеров, дипольного момента, степени диссоциации слабого электролита, коэффициентов активности ионов (ион-ионные взаимодействия), энергии межмолекулярных взаимодействий в молекулах органического растворителя (диполь-дипольные взаимодействия) [2].
Целью данной работы было проверить справедливость плазмоподобной теории электролитов в неводных растворителях, в качестве которых были выбраны четыре н-спирта (этанол, пропанол, бутанол и пентанол). В качестве электролита была выбрана хлороводородная кислота, в качестве измеряемого параметра – эквивалентная электропроводность и термодинамическая константа диссоциации.
Расчет эквивалентной электропроводности производился по уравнению плазменно-гидродинамической теории электролитов [3]:
(1)
$ \times \;{{\left[ {\frac{2}{{{{\mu }_{s}}}}\left( {\frac{5}{2}RT - 2{{{\left( {\frac{{2\pi {{z}^{2}}{{e}^{2}}{{\hbar }^{2}}C{{N}_{{\text{A}}}}}}{{1000{{\mu }_{0}}}}} \right)}}^{{1/2}}}} \right)} \right]}^{{1/2}}} \times $Исследованиям процессов переноса – электрической проводимости в растворах и диссоциации сильных и слабых электролитов посвящено много статей. Среди них отметим электрохимические работы [4–11] с использованием электрометрических и других методов. Александров В.В. [12] приводит рK хлороводородной кислоты в среде спиртов: 1.95 в этаноле, 2.87 – в бутаноле. В указанных публикациях приведены величины констант диссоциации сильных и слабых электролитов, различающихся большим диапазоном в воде и в растворах органических растворителей (в частности показатели констант диссоциации хлороводородной кислоты приведены даже в воде от –7.0 до 3.0…7.0. Применяются компьютерное моделирование [7, 8], публикуются рK HCl, полученные с помощью эмпирических моделей.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Все спирты марки “х.ч.” были предварительно обезвожены согласно стандартным методикам [13], окончательно высушены над молекулярными ситами, хранились под вакуумом. Содержание воды по модернизированному методу Карла Фишера не превышало 0.05%. Хлороводород был получен взаимодействием хлорида калия (“х.ч.”) с концентрированной серной кислотой (“х.ч.”), осушен пропусканием последовательно через две склянки с кислотой и под вакуумом пропускался через колбу со спиртом. Растворы готовились методом последовательных разбавлений по массе, исходные концентрации были установлены трехкратным титрованием 0.1–0.001 М водным раствором гидроксида калия (“х.ч.”). Установка для измерения электропроводности растворов электролитов состояла из трех основных элементов: измерительной части, кондуктометрической ячейки и термостата [3]. Для измерений использовалась вакуумная ячейка из пирекса с тремя плоскопараллельными круглыми платиновыми электродами, покрытыми платиновой чернью. Измерение сопротивления растворов проводилось при частоте 1000 Гц. Для поддержания температуры в термостате использовалась схема с применением регулятора температуры ВРТ-3. Точность поддержания температуры составляла ±0.05°С. Константа ячейки была установлена измерением сопротивления водных растворов KCl исследуемого диапазона концентраций. Погрешность определения константы ячейки не превышала 0.25%, средняя погрешность определения сопротивления не более 1.4% [3]. В качестве примера в табл. 1 приведены значения экспериментальной эквивалентной электропроводности в среде этанола. Отметим, что оцененные электропроводности HCl во всех спиртах по модельному уравнению (1), отличаются от экспериментальных на ±5%, что свидетельствует о приемлемости плазмоподобной теории электрической проводимости. Поэтому расчетных данных по уравнению (1) здесь не приведено.
Таблица 1.
Экспериментальные данные эквивалентной электропроводности хлороводорода в этаноле при различных температурах λ [См см2 моль–1], С [моль/л], степень диссоциации, коэффициент активности (f ) и термодинамические константы диссоциации
| С | λ | α | fHCl | KHCl | pKдисс | С | λ | α | fHCl | KHCl | pKдисс |
|---|---|---|---|---|---|---|---|---|---|---|---|
| 278 К | 288 К | ||||||||||
| 0.09808 | 24.48 | 0.5290 | 0.9561 | 0.1002 | 0.9992 | 0.09706 | 28.61 | 0.4794 | 0.9598 | 0.07024 | 1.1533 |
| 0.04904 | 26.53 | 0.5733 | 0.9675 | 0.0620 | 1.2075 | 0.04852 | 31.16 | 0.5222 | 0.9702 | 0.04363 | 1.3602 |
| 0.02452 | 28.81 | 0.6226 | 0.9759 | 0.03986 | 1.3994 | 0.02426 | 35.72 | 0.5986 | 0.9773 | 0.03356 | 1.4741 |
| 0.01226 | 33.23 | 0.7181 | 0.9817 | 0.03532 | 1.4519 | 0.01213 | 39.93 | 0.6691 | 0.9830 | 0.02496 | 1.6026 |
| 0.00613 | 34.10 | 0.7369 | 0.9868 | 0.01905 | 1.7199 | 0.006066 | 44.36 | 0.7434 | 0.9873 | 0.01959 | 1.7079 |
| 0.003065 | 37.59 | 0.8124 | 0.9902 | 0.01609 | 1.7933 | 0.003032 | 48.29 | 0.8092 | 0.9906 | 0.01540 | 1.8123 |
| 0.001532 | 38.90 | 0.8407 | 0.9929 | 0.009860 | 2.0061 | 0.001516 | 50.80 | 0.8513 | 0.9932 | 0.01071 | 1.9701 |
| 0.000766 | 41.64 | 0.8999 | 0.9948 | 0.008958 | 2.0477 | 0.0007581 | 54.2 | 0.9083 | 0.9950 | 0.009857 | 2.0062 |
| 0.000383 | 42.91 | 0.9273 | 0.9963 | 0.006446 | 2.1906 | 0.0003791 | 55.55 | 0.9309 | 0.9964 | 0.006740 | 2.1712 |
| 0.000192 | 43.97 | 0.9502 | 0.9973 | 0.004893 | 2.3103 | 0.0001895 | 56.94 | 0.9542 | 0.9974 | 0.005282 | 2.2771 |
| 0.0000958 | 44.60 | 0.9639 | 0.9981 | 0.003375 | 2.4716 | 0.0000948 | 57.05 | 0.9560 | 0.9981 | 0.002683 | 2.5712 |
| 0.0000479 | 44.79 | 0.9680 | 0.9986 | 0.001892 | 2.7229 | 0.0000474 | 57.5 | 0.9636 | 0.9987 | 0.001614 | 2.7918 |
| 0 | 46.27 | 1 | 1.8600 | 59.67 | 1.9082 | ||||||
| 298 К | 308 К | ||||||||||
| 0.09602 | 33.46 | 0.4468 | 0.9627 | 0.05459 | 1.2628 | 0.09498 | 37.60 | 0.4129 | 0.9654 | 0.03159 | 1.5003 |
| 0.04801 | 37.10 | 0.4954 | 0.9721 | 0.03567 | 1.4475 | 0.04749 | 42.03 | 0.4616 | 0.9740 | 0.02057 | 1.6865 |
| 0.02400 | 42.04 | 0.5614 | 0.9789 | 0.02583 | 1.5877 | 0.02374 | 48.27 | 0.5301 | 0.9802 | 0.01505 | 1.8223 |
| 0.01200 | 47.64 | 0.6362 | 0.9840 | 0.01970 | 1.7054 | 0.01187 | 55.03 | 0.6043 | 0.9850 | 0.01137 | 1.9441 |
| 0.00613 | 53.17 | 0.7100 | 0.9879 | 0.01553 | 1.8087 | 0.005936 | 62.60 | 0.6875 | 0.9887 | 0.009193 | 2.0365 |
| 0.003065 | 59.23 | 0.7910 | 0.9910 | 0.01328 | 1.8767 | 0.002968 | 69.00 | 0.7578 | 0.9916 | 0.007145 | 2.1459 |
| 0.001532 | 63.11 | 0.8428 | 0.9934 | 0.009866 | 2.0058 | 0.001468 | 76.35 | 0.8385 | 0.9937 | 0.006453 | 2.1902 |
| 0.00075 | 67.97 | 0.9077 | 0.9952 | 0.009540 | 2.0204 | 0.0007419 | 80.70 | 0.8863 | 0.9954 | 0.005158 | 2.2874 |
| 0.00037 | 69.01 | 0.9216 | 0.9966 | 0.005560 | 2.2548 | 0.000371 | 82.48 | 0.9058 | 0.9967 | 0.003245 | 2.4886 |
| 0.00019 | 69.81 | 0.9322 | 0.9975 | 0.003302 | 2.4811 | 0.0001855 | 84.91 | 0.9325 | 0.9976 | 0.002396 | 2.6203 |
| 0.00009 | 70.40 | 0.9401 | 0.9983 | 0.001758 | 2.7548 | 0.0000928 | 86.33 | 0.9481 | 0.9983 | 0.001610 | 2.7929 |
| 0.00004 | 70.90 | 0.9468 | 0.9987 | 0.001028 | 2.9878 | 0.0000464 | 87.71 | 0.9633 | 0.9988 | 0.001174 | 2.9299 |
| 0 | 73.59 | 1 | 2.0161 | 0 | 91.05 | 1 | 2.2037 | ||||
| 318 К | 328 К | ||||||||||
| 0.09389 | 41.83 | 0.3823 | 0.9679 | 0.02557 | 1.5921 | 0.09275 | 45.02 | 0.3413 | 0.9707 | 0.01897 | 1.7218 |
| 0.04694 | 46.83 | 0.428 | 0.9759 | 0.01652 | 1.7819 | 0.04637 | 50.85 | 0.3855 | 0.9779 | 0.01236 | 1.9079 |
| 0.02347 | 55.09 | 0.5035 | 0.9814 | 0.01272 | 1.8953 | 0.02318 | 58.67 | 0.4448 | 0.9832 | 0.008798 | 2.0555 |
| 0.01173 | 62.47 | 0.5709 | 0.9860 | 0.009261 | 2.0332 | 0.01159 | 69.03 | 0.5233 | 0.9871 | 0.006928 | 2.1593 |
| 0.005868 | 71.9 | 0.6571 | 0.9893 | 0.007571 | 2.1208 | 0.005796 | 79.80 | 0.6051 | 0.9901 | 0.005507 | 2.2590 |
| 0.002933 | 80.5 | 0.7357 | 0.9920 | 0.006101 | 2.2146 | 0.002898 | 91.34 | 0.6924 | 0.9925 | 0.004588 | 2.3383 |
| 0.001467 | 88.34 | 0.8074 | 0.9941 | 0.005015 | 2.2996 | 0.001449 | 102.01 | 0.7733 | 0.9944 | 0.003860 | 2.4133 |
| 0.0007334 | 95.24 | 0.8704 | 0.9956 | 0.004315 | 2.3649 | 0.000724 | 113.93 | 0.8637 | 0.9958 | 0.003987 | 2.3993 |
| 0.0003667 | 98.61 | 0.9012 | 0.9968 | 0.003027 | 2.5188 | 0.000362 | 116.12 | 0.8803 | 0.9970 | 0.002353 | 2.6282 |
| 0.0001833 | 101.8 | 0.9304 | 0.9977 | 0.002286 | 2.6407 | 0.000181 | 120.71 | 0.9151 | 0.9978 | 0.001790 | 2.7470 |
| 0.0000917 | 103.94 | 0.95 | 0.9983 | 0.001658 | 2.7802 | 0.000091 | 123.88 | 0.9392 | 0.9984 | 0.001323 | 2.8784 |
| 0.0000458 | 104.21 | 0.9524 | 0.9988 | 0.0008740 | 3.0584 | 0.000045 | 125.01 | 0.9477 | 0.9989 | 0.0007738 | 3.1113 |
| 0 | 109.41 | 1 | 2.275 | 0 | 131.9 | 1 | 1 | 2.3849 | |||
Для расчетов коэффициента активности HCl привлечена плазмоподобная концепция [1–3]. Базисные уравнения для расчетов искомых величин α, f, Kдисс и pKдисс приведены ниже:
(2)
$\alpha = {{\lambda }_{{{\text{эксп}}}}}{\text{/}}{{\lambda }_{0}},\quad [{\text{ROH}}_{2}^{ + }] = Сf\alpha ,$(3)
$f = {\text{exp}}[ - {{(4\pi {{z}^{2}}{{e}^{2}}{{\hbar }^{2}}C{{N}_{{\text{A}}}}{\text{/}}1000{{\mu }_{0}}k_{{\text{Б}}}^{2}{{T}^{2}})}^{{1/2}}}],$(4a)
${{K}_{{{\text{дисс}}}}} = a{{[{\text{ROH}}_{2}^{ + }]}^{2}}{{\alpha }^{2}}f{\text{/}}C(1 - \alpha ).$После преобразования уравнение (4а) можно упростить:
Значения концентрационных и предельных электропроводностей, степени диссоциации, коэффициентов активности HCl и термодинамических констант диссоциации хлороводорода в среде этанола, оцененные по уравнениям (2), (3) и (5), представлены в табл. 1.На рис. 1 представлены температурные зависимости термодинамических констант диссоциации хлороводородной кислоты в спиртах. Соответствующие уравнения параболических зависимостей характеризуются высокими значениями коэффициентов корреляции от 0.979 до 0.999 (подписи под рис. 1), оцененные по этим уравнениям (табл. 2, 3, рис. 1) константы диссоциации свидетельствуют о высокой вероятности применяемых методов. То же самое можно отметить (табл. 3, рис. 2) для электропроводностей.
Рис. 1.
Зависимости показателей констант диссоциации HCl в спиртах от температуры (Т, К); ($ - \diamondsuit - $): pK(HCl/EtOH) = (3 × 10–5 )T2 – 0.00688T + 1.453 (R2 = 0.979), ($ - \,\blacksquare \, - $): pK(HCl/PrOH) = (8 × 10–5 )T2 – ‒ 0.0378T + 6.595 (R2 = 0.989), ($ - \blacktriangle - $): pK(HCl/BuOH) = = (33.35 × 10–5)T2 – 0.1771T + 25.82 (R2 = 0.980), ($--\,{\text{х}}\,--$): pK(HCl/AmOH) = –(5.35 × 10–5)T2 + 0.049T – 6.587 (R2 = 0.999).
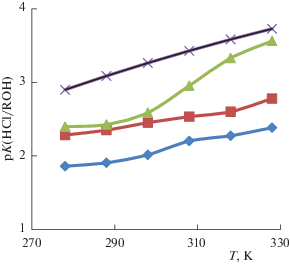
Таблица 2.
Температурные зависимости экспериментальных и рассчитанных величин термодинамических констант диссоциации хлороводородной кислоты в некоторых спиртах
| Т, К | EtOH | PrOH | BuOH | PeOH | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| pKэксп | pKрис. 1 | pKММУМ | pKэксп | pKрис. 1 | pKММУМ | pKэксп | pKрис. 1 | pKММУМ | pKэксп | pKрис. 1 | pKММУМ | |
| 278 | 1.861 | 1.859 | 1.861 | 2.285 | 2.269 | 2.285 | 2.398 | 2.360 | 2.398 | 2.903 | 2.900 | 2.903 |
| 288 | 1.908 | 1.959 | 1.908 | 2.351 | 2.344 | 2.351 | 2.428 | 2.428 | 2.428 | 3.092 | 3.087 | 3.092 |
| 298 | 2.016* | 2.066 | 2.016 | 2.453 | 2.435 | 2.453 | 2.589** | 2.660 | 2.589 | 3.254 | 3.263 | 3.254 |
| 308 | 2.204 | 2.180 | 2.204 | 2.535 | 2.542 | 2.535 | 2.956 | 2.910 | 2.956 | 3.412 | 3.429 | 3.412 |
| 318 | 2.275 | 2.298 | 2.275 | 2.601 | 2.664 | 2.601 | 3.331 | 3.227 | 3.331 | 3.541 | 3.584 | 3.541 |
| 328 | 2.385 | 2.423 | 2.385 | 2.781 | 2.803 | 2.781 | 3.565 | 3.610 | 3.565 | 3.693 | 3.729 | 3.693 |
Таблица 3.
Температурные зависимости экспериментальных и рассчитанных величин предельных электропроводностей хлороводородной кислоты в спиртах (λ0 HCl/ROH (См см2/моль))
| Т, К | EtOH | PrOH | BuOH | PeOH | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ${{\lambda }_{{{\text{0}}\;{\text{эксп}}}}}$ | ${{\lambda }_{{{\text{0}}\,({\text{рис}}{\text{.}}\,{\text{2}})}}}$ | ${{\lambda }_{{{\text{0}}\;{\text{ММУМ}}}}}$ | ${{\lambda }_{{{\text{0}}\;{\text{эксп}}}}}$ | ${{\lambda }_{{{\text{0}}\,({\text{рис}}{\text{.}}\,{\text{2}})}}}$ | ${{\lambda }_{{{\text{0}}\;{\text{ММУМ}}}}}$ | ${{\lambda }_{{{\text{0}}\;{\text{эксп}}}}}$ | ${{\lambda }_{{{\text{0}}\,({\text{рис}}{\text{.}}\,{\text{2}})}}}$ | ${{\lambda }_{{{\text{0}}\;{\text{ММУМ}}}}}$ | ${{\lambda }_{{{\text{0}}\;{\text{эксп}}}}}$ | ${{\lambda }_{{{\text{0}}\,({\text{рис}}{\text{.}}\,{\text{2}})}}}$ | ${{\lambda }_{{{\text{0}}\;{\text{ММУМ}}}}}$ | |
| 278 | 46.27 | 45.92 | 46.27 | 23.24 | 23.33 | 23.24 | 15.08 | 15.08 | 15.08 | 11.89 | 11.21 | 11.89 |
| 288 | 59.67 | 61.18 | 59.67 | 29.07 | 29.64 | 29.07 | 19.58 | 20.32 | 19.58 | 17.21 | 17.35 | 17.21 |
| 298 | 84.62* | 77.13* | 84.62 | 38.78 | 38.21 | 38.78 | 27.95 | 29.11 | 27.95 | 23.27 | 23.28 | 23.27 |
| 308 | 91.05 | 93.75 | 91.05 | 50.1 | 49.05 | 50.1 | 41.64 | 41.45 | 41.64 | 29.73 | 28.99 | 29.73 |
| 318 | 109.41 | 111.0 | 109.41 | 59.90 | 62.16 | 59.90 | 57.34 | 57.33 | 57.34 | 35.39 | 34.49 | 35.39 |
| 328 | 131.90 | 129.0 | 131.90 | 78.36 | 77.54 | 78.36 | 75.86 | 76.75 | 75.86 | 39.83 | 39.77 | 39.83 |
Рис. 2.
Зависимости предельных электропроводностей HCl в этаноле, пропаноле, бутаноле, пентаноле от температуры (Т, К); $ - \diamondsuit - $: λ(HCl/EtOH) = 0.0034T2 – 0.397T – 106.2 (R2 = 0.985), $ - \,\blacksquare \, - $: λ(HCl/PrOH)= 0.01134T2 – 5.788T +756.0 (R2 = 0.996), $ - \blacktriangle - $: λ(HCl/BuOH) = 0.01772T2 – 9.505T + 1288.0 (R2 = 0.999), $--\,{\text{х}}\,--$: λ(HCl/AmOH) = –0.00100T2 + + 1.222T – 245.5 (R2 = 0.998).
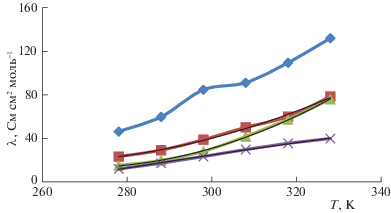
Как видно, значения констант диссоциации и предельной электропроводности в спиртах, определенные экспериментально и оцененные по уравнениям под рисунками и методом многоуровневого моделирования (ММУМ), удовлетворительно совпадают.
Традиционные классические методы исследования, требующие больших затрат труда, времени, уникального оборудования, дорогих реактивов, могут быть заменены на косвенные методы с применением компьютеров, которые гораздо быстрее, позволяют не только интерпретировать результаты, но и с высокой степенью достоверности предсказывать, прогнозировать свойства веществ.
Для уточнения, проверки значений pKHCl/ROH и λ0 применен следующий метод – многоуровневого моделирования (ММУМ), разработанный нами ранее, позволяющий математически моделировать, прогнозировать, уточнять и оценивать характеристики физико-химических систем [14].
Разработаны модельные уравнения, позволяющие теоретически оценить искомые показатели с помощью уравнений (I) и (II)
(I)
$\begin{gathered} {\text{p}}{{K}_{{{\text{HCl/ROH}}}}} = {{A}_{1}}{{M}_{{{\text{ROH}}}}} + {{B}_{1}}{{T}_{{{\text{кип}}}}} + {{C}_{1}}{{\rho }_{{{\text{ROH}}}}} + \\ + \;{{D}_{1}}{{\eta }_{{{\text{ROH}}}}} + {{E}_{1}}, \\ \end{gathered} $(II)
$\begin{gathered} {{\lambda }_{{{\text{0}}\;{\text{HCl/ROH}}}}} = {{A}_{2}}{{M}_{{{\text{ROH}}}}} + {{B}_{2}}{{T}_{{{\text{кип}}}}} + {{C}_{2}}{{\rho }_{{{\text{ROH}}}}} + \\ + \;{{D}_{2}}{{\eta }_{{{\text{ROH}}}}} + {{E}_{2}}, \\ \end{gathered} $Таблица 4.
Базовые характеристики спиртов для метода многоуровневого моделирования
| Спирт | МROH, г/моль |
Ткип, К | ρ, г/см3 | η, сП |
|---|---|---|---|---|
| EtOH | 46.0 | 351.3 | 0.7851 | 1.052 |
| PrOH | 60.1 | 370.2 | 0.7995 | 1.968 |
| BuOH | 74.1 | 390.2 | 0.8057 | 2.616 |
| PeOH | 88.1 | 411.0 | 0.8098 | 3.718 |
В табл. 5 внесены значения коэффициентов уравнений (I) и (II) при температурах 278, 288, 298, 308, 318 и 328 К, позволяющие рассчитать константы и электропроводность кислоты в изучаемых растворителях при других температурах. Оцененные по уравнениям (I) и (II) величины для этанола, пропанола, бутанола и пентанола в диапазоне температур (278 – 328 К) представлены в табл. 2, 3. Как видно из подписей под рис. 1 и 2 уравнения параболической зависимости характеризуются достаточно высокими коэффициентами парной регрессии более 0.975. Между тем, соответствующие коэффициенты метода многоуровневого моделирования R1 и R2 (табл. 5) для всех спиртов при данных температурах равны 1.000, а оцененные величины констант диссоциации и электропроводностей практически совпадают с экспериментальными. Это свидетельствует о корректности, достоверности и приемлемости метода многоуровневого моделирования для исследования температурной зависимости обсуждаемых характеристик спиртовых растворов хлороводородной кислоты.
Таблица 5.
Коэффициенты уравнений ММУМ (I), (II) и корреляции RММУМ для расчетов температурных зависимостей констант диссоциации и предельных электропроводностей HCl/ROH (R1, R2 = 1.000)
| Т, К | A1 | B1 | C1 | D1 | E1 | A2 | B2 | –C2 | D2 | E2 |
|---|---|---|---|---|---|---|---|---|---|---|
| 278 | –0.01877 | 16.55946 | 1.10239 | 0.11739 | –8.55967 | –2.19877 | 1.60185 | 1595.9767 | 0.74223 | 836.9055 |
| 288 | –0.02196 | 24.8301 | 1.75008 | 0.27565 | –18.4115 | –1.91902 | 1.55420 | 2402.3684 | 1.83187 | 1486.127 |
| 298 | –0.01497 | 20.4008 | 1.56272 | 0.2513 | –16.4911 | –1.79022 | 2.10540 | 3723.7791 | –7.38823 | 2358.653 |
| 308 | 0.03025 | 4.29919 | 0.16985 | 0.11458 | –14.7628 | 1.18014 | 0.48616 | 3556.6909 | 23.2745 | 2368.780 |
| 318 | 0.05716 | –32.6835 | –1.74607 | –0.3330 | 17.8027 | –1.14159 | 3.70667 | 3131.6801 | –63.7266 | 1385.491 |
| 328 | 0.05841 | –32.5282 | –2.18290 | –0.4401 | 20.3920 | 1.37129 | 2.78265 | 2861.2381 | –91.9928 | 1434.411 |
ВЫВОДЫ
1. Оценены степень диссоциации, коэффициенты активности и термодинамические константы диссоциации HCl в четырех спиртах при температурах от 278 до 328 К.
2. Установлена температурная зависимость констант диссоциации и предельных проводимостей HCl в спиртах, выведены уравнения этих зависимостей. Уравнения параболического приближения функции характеризуются достаточно высокими коэффициентами вероятности, а рассчитанные характеристики в спиртах и температурах от 278 до 328 К достаточно сопоставимы с экспериментальными.
3. Методом многоуровневого моделирования выведены зависимости констант диссоциации и предельных электропроводностей от базисных характеристик спиртов (молярной массы молекул спиртов, температуры кипения, плотности и вязкости) в рассматриваемом диапазоне температур раствора. Коэффициенты метода многоуровневого моделирования практически равны единице и оцененные величины совпадают с опытными.
Список литературы
Балданов М.М. // Химия и химическая технология. 1986. Т. 29. № 8. С. 38.
Tanganov B.B. // J. of Chemistry and Chemical Engineering (USA). 2013. V. 7. № 8. P. 711.
Ангапов В.Д., Танганов Б.Б. // Успехи современного естествознания. 2010. № 5. С. 43.
Година Е.Н., Щербаков В.В. // Успехи в химии и химической технологии. Вып. XIII. РХТУ им. Д.И. Менделеева. М., 1999. Ч. 3. С. 35.
Иванов A.A. // Изв. вузов. Химия и хим. технол. 1989. Т. 32. № 10. С. 3.
Tikhonov N.A., Sidel’nikov G.B. // Rus. J. of Physical Chemistry. 2017. V. 91. № 10. P. 1890.
Lysova S.S., Skripnikova T.A., Zevatskii Yu.E. // Rus. J. of Physical Chemistry. 2017. V. 91. № 12. 2366.
Леванов А.В., Курбанова У.Д., Исайкина О.Я., Лунин В.В. // Журн. физ. химии. 2019. Т. 93. № 1. С. 86.
Alekseev V.G., Markova E.V. // Rus. J. of Physical Chemistry. 2016. V. 90. № 3. P. 586.
Usobiaga A., De Diego A., Madariaga J.M. // Chem. and Eng. Data. 2000. 45. № 1. P. 23.
Hamman S.D., Linton M. // Trans. Faraday Soc-1969. V. 65. P. 2186.
Александров В.В. Кислотность неводных растворов. Харьков. Изд. Вища школа. Харьков: ХГУ. 1981. 152 с.
Крешков А.П. Аналитическая химия неводных растворов. М.: Химия, 1982. 120 с.
Танганов Б.Б., Балданов М.М., Мохосоев М.В. // Журн. физ. химии. 1992. Т. 66. № 6. С. 1476.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии


