Журнал физической химии, 2021, T. 95, № 7, стр. 1110-1117
Исследование адсорбционных свойств поверхности кремнеземов с привитыми комплексами малонатов переходных металлов
Е. А. Пахнутова a, *, Ю. Г. Слижов a, Ж. В. Фаустова a
a Томский государственный университет, Химический факультет
634050 Томск, Россия
* E-mail: pakhnutovae@mail.ru
Поступила в редакцию 21.08.2020
После доработки 21.08.2020
Принята к публикации 09.09.2020
Аннотация
С применением комплекса физико-химических методов анализа исследованы кремнеземы на основе Силохрома C-120, химически модифицированные хелатами малонового эфира. С помощью газовой хроматографии изучено влияние поверхностно-привитого слоя малонатов никеля, кобальта и меди на термодинамические характеристики адсорбции (ТХА) разных классов органических соединений на кремнеземе. В качестве тестовых соединений применяли н-алканы (C6–C9) и хлоралканы, алкены, а также адсорбаты, молекулы которых обладают различными электронодонорными и электроноакцепторными свойствами. Из экспериментальных данных по удерживанию адсорбатов рассчитаны их дифференциальные мольные теплоты адсорбции ${{\bar {q}}_{{{\text{dif,1}}}}}$, изменение стандартной дифференциальной молярной энтропии $\Delta \bar {S}_{{1,C}}^{{\text{S}}}$ вклады $\Delta {{\bar {q}}_{{{\text{dif,1(спец)}}}}}$ в энергии дисперсионных и специфических взаимодействий. Показано влияние иона металла в составе модифицирующего малоната на термодинамические характеристики удерживания.
Нанопористые минеральные оксиды, обладая развитой поверхностью, механической прочностью, термостойкостью, высокой степенью химической чистоты, обеспечивающей их низкую каталитическую активность, являются не только прекрасными адсорбентами в первоначальном виде, но и способны радикально менять свои физико-химические свойства в результате химического модифицирования поверхности, что способствует развитию методов направленного синтеза материалов на их основе [1–3].
Широкий спектр практического применения оксидов кремния и их модифицированных форм в различных областях существующих сегодня научных технологий стал причиной огромного числа работ в области исследования поверхностных свойств этих материалов с применением современных физико-химических методов, в числе которых газовая хроматография [4, 5]. Особый интерес при этом представляют материалы с привитым слоем комплексных соединений, которые позволяют в широком диапазоне варьировать их физико-химические и хроматографические свойства. Изменение природы и взаимного расположения ионов металла и лигандов в составе модифицирующего хелатного комплекса обеспечивает широкие возможности регулирования термической устойчивости сорбентов, их хроматографических свойств, кислотно-основных центров, скорости установления сорбционного равновесия, параметров десорбции и элюирования веществ [6]. При этом сочетание нескольких механизмов удерживания и избирательность реакций комплексообразования дают преимущества перед неспецифичными адсорбентами, синтетическими полимерами, используемыми для концентрирования и разделения различных смесей органических соединений [7–9].
Настоящая работа посвящена изучению термодинамических характеристик адсорбции органических соединений различных классов на Силохроме C-120 и химически модифицированных на его основе адсорбентах с привитым слоем малонатов никеля, кобальта и меди методом газовой хроматографии.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для приготовления химически модифицированных адсорбентов использовали кремнезем марки Силохром C-120 (0.20–0.355 мм). Химическую реакцию на поверхности SiO2 осуществляли методом последовательной сборки, при этом Силохром подвергали хлорированию с использованием SOCl2 при комнатной температуре. Для получения хелата синтезировали натриевую соль малонового эфира, которую на стадии введения лиганда растворяли в диметилформамиде и наносили на поверхность хлорированного кремнезема путем постепенного испарения растворителя. На заключительном этапе получения привитых хелатных комплексов модифицированный малоновым эфиром Силохром C-120 обрабатывали этанольным раствором хлоридов меди, никеля, кобальта [10].
Для подтверждения закрепления малонатов на поверхности SiO2 использовали метод КР- и ИК-спектроскопии с использованием КР-спектрометра “Nicolet NXR 9650” в диапазоне 4000–200 см–1 и фурье-спектрометра “Nicolet 6700” в области 4000–400 см–1.
Термическую устойчивость материалов определяли по результатам термогравиметрии на приборе “Netzsch STA 449 C”. Кривая ДСК получена в интервале температур 25–900°C со скоростью нагрева 10 К мин–1 в воздушной атмосфере.
Площади удельной поверхности и пористость адсорбентов оценивали по методу БЭТ с применением автоматического газо-адсорбционного анализатора “TriStar II” в автоматическом режиме после вакуумирования при 200°С в течение 2 ч по изотерме низкотемпературной сорбции паров азота с помощью объемного варианта сорбционного метода. Поверхностную концентрацию привитых групп, количество привитого соединения и его толщину определяли по данным о содержании углерода в образцах, изменении площади удельной поверхности адсорбентов до и после химического модифицирования [1].
Газохроматографические параметры удерживания тестовых органических соединений различных классов определяли на газовом хроматографе “Chrom 5” с пламенно-ионизационным детектором с использованием стеклянных колонок длиной 1.2 м и внутренним диаметром 3 мм. Хроматографирование проводили в изотермическом режиме при температурах от 140 до 200°С с объемной скоростью газа-носителя (гелий) 30 мл/мин, использовали ввод малых проб сорбатов (0.05 мкл) в виде паровоздушных смесей, мертвое время удерживания определяли по метану.
Основными величинами, определяемыми из экспериментальных данных, являлись удельные объемы удерживания, отнесенные к единице поверхности адсорбента Vg,1, которые при малых объемах вводимой пробы представляют собой константы Генри адсорбции K1,С (см3/м2) [7]. Термодинамические характеристики адсорбции ${{\bar {q}}_{{{\text{dif}},1}}}$ и $\Delta \bar {S}_{{1,C}}^{{{{S}^{0}}}}$ рассчитывали из линейной зависимости [11]:
Погрешность экспериментального определения величин удельного удерживаемого объема (Vg,1, см3/г) не превышала 4.5%, величин дифференциальных молярных теплот адсорбции (${{\bar {q}}_{{{\text{dif}},1}}}$, кДж/моль) и изменений энтропии ($\Delta \bar {S}_{{1,C}}^{{{{S}^{0}}}}$, Дж/(моль K)) адсорбции – 2.9 кДж/моль и 7.0 Дж/(моль K) соответственно. Оценку вклада малонатов металлов в удерживание адсорбатов (δ, %) проводили согласно [8] на основе удельных удерживаемых объемов на колонках с модифицированным и исходным Силохромом C-120:
Для специфически сорбирующихся веществ определяли также вклад энергии специфического взаимодействия $\Delta {{\bar {q}}_{{{\text{dif}},1(спец)}}}$ в общую энергию адсорбции, который оценивали по разности ${{\bar {q}}_{{{\text{dif}},1}}}$ сорбата и неспецифически сорбирующего нормального алкана с тем же значением поляризуемости α:ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
На процессы адсорбции-десорбции с участием хелатсодержащих хроматографических адсорбентов оказывает влияние не только химическая природа материала, но и текстурные характеристики кремнезема. Химическое модифицирование исходного SiO2 хелатами металлов приводит к изменению геометрии поверхности, о чем свидетельствуют результаты исследования площади удельной поверхности и пористости изучаемых адсорбентов, представленные в табл. 1.
Таблица 1.
Текстурные характеристики исследуемых адсорбентов
| Адсорбент | Sуд, м2/г (Δ ± 10%) |
Vсум, см3/г | rср, нм | СБЭТ | KГ |
|---|---|---|---|---|---|
| Силохром C-120 | 112 | 1.08 | 38 | 119 | 22 |
| Силохром C-120 + малонат никеля | 93 | 1.01 | 38 | 114 | 17 |
| Силохром C-120 + малонат кобальта | 84 | 0.80 | 32 | 112 | 14 |
| Силохром C-120 + малонат меди | 77 | 0.90 | 32 | 110 | 12 |
При образовании поверхностно-привитого слоя происходит уменьшение площади удельной поверхности от 112 до 77 м2/г, при этом объем и средний размер пор изменяются незначительно. Согласно данным расчета констант Генри адсорбции (KГ) и константы БЭТ (СБЭТ), характеризующих силу взаимодействия адсорбат–адсорбент, модель БЭТ хорошо описывает адсорбцию азота на исследуемых адсорбентах [12], о чем свидетельствуют достаточно высокие численные значения KГ и СБЭТ.
По результатам термогравиметрии полученных адсорбентов температуры начала деструктивных процессов, протекающих с изменением массы модификаторов, превышают 200°С, что позволяет использовать их в условиях газохроматографического анализа для разделения низкокипящих и высококипящих органических соединений.
По данным элементного анализа расчетное количество привитого слоя малонового эфира составляет 0.56 ммоль/г, поверхностная плотность привитых хелатов – 3.09 групп/нм2 (5.12 мкмоль/м2), толщина привитого слоя –1.102 нм.
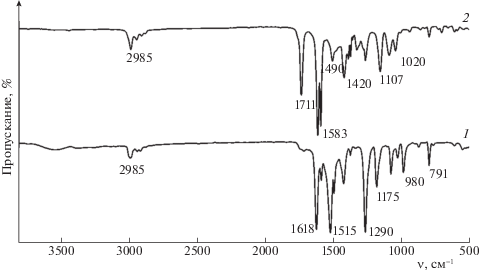
Для подтверждения образования поверхностно-привитых комплексов малонатов металлов на поверхности SiO2 получали ИК-спектры вычитания, в которых проявляются колебания основных функциональных групп модификатора, совпадающие с колебаниями натриевой соли малонового эфира (рис. 1).
Полоса в области 2983–2987 см–1 характерна для валентных ассиметричных колебаний метильных групп. Колебание 1711 см–1 относится к валентным симметричным $v$(С=О). Сопряженная система связей $v$(С=C–C–О) проявляется в ИК-спектрах в виде полос 1581, 1583, 1586 см–1, что свидетельствует об образовании енольной формы β-дикарбонильных соединений, стабилизированной водородной связью. Полосы поглощения 1490 см–1 и 1501, 1508, 1515 см–1 характеризуют систему валентных $v$(С=О) и деформационных δ(C–Н) колебаний. Сумма колебаний $v$(C–С=C–О) + δ(OH) + δ(C–Н) + $v$(C–CH3) представлена полосами 1396 и 1415 см–1 для малонового эфира. В ИК-спектрах присутствуют полосы поглощения 1290 см–1 и 1260 см–1, относящиеся к валентным ассиметричным колебаниям связей ${{v}_{{as}}}$(C–О–С) сложноэфирной группировки малонового эфира. В области 950 см–1 проявляются колебания связи Si–C [13, 14].
В КР-спектрах малонового эфира и хелатов на его основе (рис. 2), привитых к поверхности SiO2, полоса 1405 см–1 описывает $v$(C–С=C–О) + + δ(OH) + δ(C–Н) + $v$(C–CH3), колебания в области 1467 см–1 характеризует δ(СН3).
Рис. 2.
КР-спектры малонатов никеля (1), кобальта (2), меди (3), малонового эфира (4), привитых к поверхности Силохрома C-120.
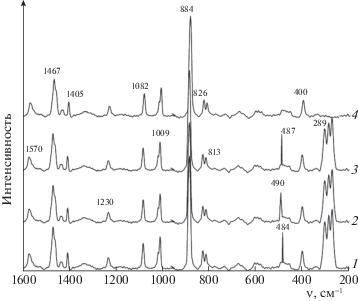
Поглощение в области 1082 и 1009 см–1 принадлежит $v$(C–С) и ρ(СН3). Колебания в области 884, 826 и 813 см–1 относятся $v$(C–CH3) + $v$(C–О) и ρ(Н2О) соответственно. Образование трехгорбого пика в области 273–274 см–1 соответствует колебаниям хелатного кольца малонатов металлов. Наличие связи металл–кислород подтверждается наличием полос в КР-спектре в области 484–490 см–1 [15, 16].
При изучении термодинамики адсорбции органических соединений различных классов на исследуемых сорбентах газохроматографическим методом при достаточно высоких температурах колонки, малых объемах проб изотерма адсорбции подчиняется закону Генри с константой адсорбционного равновесия K1,С [17]. В качестве тестовых соединений были выбраны вещества, способные к проявлению различных типов межмолекулярных взаимодействий: алканы – дисперсионные, спирты – ориентационные и образование водородных связей, бутанон-2 и нитропропан – протоно-акцепторные и ориентационные, ароматические углеводороды – π–π-взаимодействие [18], а также хлоралканы и алкены.
В табл. 2 приведены данные по константам Генри адсорбции при 150°C на сорбентах на основе Силохрома C-120 с привитым слоем малонатов металлов. Значения констант K1,Сн-алканов (С6–С9), адсорбция которых происходит за счет дисперсионных взаимодействий, на исходном и модифицированном Силохроме C-120 существенно отличаются, при этом наблюдается увеличение констант Генри адсорбции K1,С(модиф)/K1,С(I) в 1.3 раза для малонатов никеля и в 2.1 раза – малонатов меди, что может указывать как на увеличение неспецифической активности сорбционных центров, так и на увеличение их концентрации. Ароматические углеводороды различного строения, помимо дисперсионных взаимодействий с поверхностью кремнезема, способны к взаимодействиям π-электронов ароматического кольца с гидроксильными группами поверхности SiO2. Поэтому бензол сорбируется на гидрофильных кремнеземах значительно сильнее, чем н-алканы с тем же числом атомов углерода в молекуле (табл. 2). Химическое модифицирование малонатами при частичном экранировании гидроксильного покрова Силохрома C-120 не приводит к снижению удерживания бензола, что свидетельствует о специфическом π–π-взаимодействии c привитым слоем. При этом увеличение числа атомов углерода в ряду алкилбензолов приводит к значительному росту констант Генри для всех сорбентов, а значения K1,С(модиф)/K1,С(I) = изменяются в диапазоне 1.10–1.65. Для спиртов, адсорбирующихся на поверхности химически модифицированных кремнеземов за счет ориентационных взаимодействий и образования водородных связей, константы Генри увеличиваются в ряду: малонат никеля < малонат кобальта < малонат меди. Значения K1,С(модиф)/K1,С(I) при этом возрастают в 1.04–1.66 раза.
Таблица 2.
Константы Генри адсорбции (K1,С) тестовых соединений и значения K1,С(модиф)/K1,С(I) на исходном Силохроме C-120 (I) и модифицированном малонатами никеля (II), кобальта (III) и меди (IV) при 150°С
| Соединение | K1,С (см3/м2) | K1,С(модиф)/K1,С(I) | |||||
|---|---|---|---|---|---|---|---|
| I | II | III | IV | II | III | IV | |
| н-Гексан | 0.04 | 0.06 | 0.07 | 0.08 | 1.53 | 1.82 | 2.11 |
| н-Гептан | 0.09 | 0.13 | 0.14 | 0.15 | 1.41 | 1.60 | 1.64 |
| н-Октан | 0.17 | 0.23 | 0.24 | 0.26 | 1.34 | 1.41 | 1.51 |
| н-Нонан | 0.30 | 0.41 | 0.41 | 0.42 | 1.38 | 1.38 | 1.40 |
| CCl4 | 0.05 | 0.07 | 0.08 | 0.08 | 1.36 | 1.60 | 1.66 |
| Хлороформ | 0.04 | 0.07 | 0.07 | 0.08 | 1.65 | 1.83 | 2.00 |
| 1,2-Дихлорэтан | 0.08 | 0.13 | 0.14 | 0.14 | 1.61 | 1.74 | 1.78 |
| Нитропропан | 0.26 | 0.66 | 0.68 | 0.85 | 2.56 | 2.65 | 3.32 |
| Бензол | 0.12 | 0.13 | 0.14 | 0.15 | 1.10 | 1.12 | 1.20 |
| Толуол | 0.23 | 0.26 | 0.28 | 0.30 | 1.12 | 1.20 | 1.27 |
| о-Ксилол | 0.33 | 0.47 | 0.49 | 0.51 | 1.43 | 1.48 | 1.54 |
| п-Ксилол | 0.43 | 0.44 | 0.48 | 0.59 | 1.03 | 1.12 | 1.36 |
| Мезитилен | 0.59 | 0.76 | 0.87 | 0.97 | 1.29 | 1.47 | 1.65 |
| Псевдокумол | 0.67 | 0.91 | 0.92 | 1.10 | 1.35 | 1.37 | 1.64 |
| Этанол | 0.40 | 0.42 | 0.44 | 0.45 | 1.04 | 1.10 | 1.13 |
| Пропанол | 0.58 | 0.60 | 0.79 | 0.95 | 1.04 | 1.37 | 1.66 |
| Бутанон-2 | 0.49 | 0.83 | 0.95 | 1.09 | 1.71 | 1.94 | 2.23 |
| Гептен-1 | 0.15 | 0.18 | 0.20 | 0.22 | 1.19 | 1.34 | 1.46 |
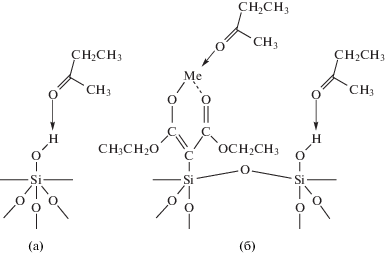
Наиболее сильные межмолекулярные протоно-акцепторные и ориентационные взаимодействия с поверхностью сорбентов установлены для нитропропана и бутанона-2 (K1,С(модиф)/K1,С(I) = = 2.56–3.32 и 1.71–2.23 соответственно). Для хлорсодержащих адсорбатов также наблюдается тенденция к значительному росту констант Генри адсорбции при переходе от исходного кремнезема к модифицированным малонатами металлов. На рис. 3 представлены возможные центры адсорбции исследуемых сорбентов, относящихся по классификации А.В. Киселева ко II типу, с локализованными на их поверхности положительными зарядами и электроноакцепторными центрами, в качестве которых выступают атомы металла хелатного кольца (на примере адсорбции метилэтилкетона).
Рис. 3.
Возможная схема адсорбции бутанона-2 на поверхности исходного Силохрома C-120 (а) и модифицированного малонатами металлов (б).
На рис. 4 представлены зависимости логарифма констант Генри адсорбции от обратной температуры на Силохроме C-120 и модифицированных малонатами металлов сорбентов для бутанона-2 и этанола.
Рис. 4.
Зависимости логарифма константы Генри адсорбции бутанона-2 (а) и этанола (б) от обратной температуры на исходном Силохроме C-120 (1) модифицированных малонатами никеля (2), кобальта (3) и меди (4).
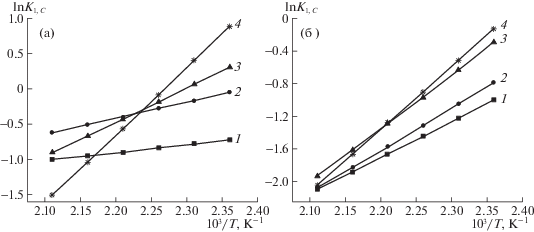
Для всех адсорбентов наблюдается линейная зависимость между $\ln {{K}_{{1,С}}}$ сорбатов и 103/T и монотонное уменьшение значений K1,С с ростом температуры. В случае адсорбции бутанона-2 (рис. 4а) и этанола (рис. 4б) при модифицировании поверхности SiO2 наблюдаются изменения угла наклона прямой зависимости $\ln {{K}_{{1,С}}}$ от 103/T, что объясняется изменением силы и концентрации активных центров поверхности, способных к проявлению ориентационных и донорно-акцепторных взаимодействий сорбат–сорбент [19]. При этом кремнеземы со слоем малоната меди отличаются самыми высокими значениями K1,С. Аналогичные зависимости наблюдаются для нитропропана и аренов. При переходе от исходного к модифицированным адсорбентам в случае адсорбции алканов, хлоралканов, алкенов изменений угла наклона прямых $\ln {{K}_{{1,С}}}$ – 103/T не происходит.
Значения дифференциальных молярных теплот адсорбции и изменения дифференциальных молярных энтропий адсорбции органических соединений различных классов на исходном SiO2 и модифицированных адсорбентах приведены в табл. 3. Рассчитанные на основе хроматографических данных термодинамические характеристики адсорбции указывают на повышение адсорбционного потенциала хелатсодержащих материалов, отражающееся в возрастании теплот адсорбции предельных, ароматических углеводородов, кетонов, спиртов, хлоралканов (на 10–53 кДж/моль). При этом увеличение ${{\bar {q}}_{{{\text{dif}},1}}}$ наблюдается для сорбатов алканового ряда вследствие роста дисперсионных взаимодействий в ряду малонат никеля < < кобальта < меди. Для хлорорганических веществ значения ${{\bar {q}}_{{{\text{dif}},1}}}$ возрастают от 2 кДж/моль для исходного кремнезема и до 48 кДж/моль в случае модифицированного малонатом меди. Для алкилбензолов, склонных к π-комплексообразованию с хелатами малонового эфира, изменения ${{\bar {q}}_{{{\text{dif}},1}}}$ составляют порядка 10–15 кДж/моль. В случае ориентационных взаимодействий теплота адсорбции возрастает до 53 кДж/моль (для кетонов) и образования водородных связей – до 26 кДж/моль. Следует отметить, что максимальное значение ${{\bar {q}}_{{{\text{dif}},1}}}$ характерно для сорбентов с привитым слоем малоната меди.
Таблица 3.
Термодинамические характеристики адсорбции на исходном Силохроме C-120 (I) и модифицированном малонатами никеля (II), кобальта (III) и меди (IV)
| Соединение | ${{\bar {q}}_{{{\text{dif}},1}}}$ | $ - \Delta S_{{1,C}}^{{{{S}^{0}}}}$ | ||||||
|---|---|---|---|---|---|---|---|---|
| I | II | III | IV | I | II | III | IV | |
| н-Гексан | 11.5 | 38.2 | 40.7 | 69.6 | 59.3 | 120.9 | 125.1 | 193.4 |
| н-Гептан | 18.7 | 39.2 | 41.9 | 59.9 | 70.5 | 116.4 | 121.5 | 165.9 |
| н-Октан | 25.8 | 35.6 | 44.3 | 56.7 | 74.9 | 100.4 | 122.8 | 154.1 |
| н-Нонан | 30.3 | 39.7 | 48.5 | 61.5 | 89.9 | 108.6 | 127.9 | 161.1 |
| CCl4 | 11.1 | 29.3 | 39.9 | 57.6 | 44.8 | 98.8 | 120.3 | 162.8 |
| Хлороформ | 6.9 | 37.7 | 42.8 | 44.2 | 33.9 | 119.8 | 125.2 | 130.6 |
| 1,2-Дихлорэтан | 1.9 | 28.5 | 47.9 | 52.8 | 21.7 | 90.7 | 138.0 | 145.9 |
| Нитропропан | 18.4 | 43.6 | 49.9 | 71.6 | 48.9 | 114.7 | 125.2 | 177.5 |
| Бензол | 26.8 | 38.8 | 41.6 | 49.1 | 88.1 | 117.3 | 122.1 | 140.5 |
| Толуол | 20.4 | 38.0 | 43.4 | 44.6 | 66.16 | 110.4 | 118.9 | 124.4 |
| о-Ксилол | 27.9 | 37.7 | 48.9 | 49.9 | 83.6 | 101.5 | 109.3 | 127.3 |
| п-Ксилол | 26.9 | 41.3 | 47.7 | 49.8 | 76.5 | 107.2 | 124.4 | 130.5 |
| Мезитилен | 36.9 | 42.8 | 48.9 | 50.8 | 92.2 | 109.7 | 126.2 | 127.8 |
| Псевдокумол | 37.8 | 44.9 | 52.4 | 55.1 | 100.8 | 113.5 | 127.8 | 136.0 |
| Этанол | 36.9 | 55.4 | 62.8 | 67.1 | 102.8 | 141.6 | 162.8 | 169.4 |
| Пропанол | 48.0 | 58.7 | 62.3 | 70.9 | 123.7 | 146.4 | 159.7 | 173.1 |
| Бутанон-2 | 9.4 | 40.6 | 62.1 | 80.4 | 36.5 | 101.6 | 155.6 | 190.7 |
| Гептен-1 | 23.7 | 33.9 | 41.3 | 50.9 | 77.8 | 101.2 | 116.3 | 138.7 |
Изменение энтропии органического соединения при переходе от исходного Силохрома C-120 к поверхностно-привитому со слоем малоната металла свидетельствует об изменении подвижности молекул адсорбатов в адсорбированном состоянии. Увеличение абсолютных величин энтропии адсорбции на модифицированных сорбентах позволяет сделать вывод о снижении подвижности адсорбатов на хелатсодержащей поверхности. Наиболее выраженный эффект наблюдается для бутанона-2, алкенов, нитропропана и хлоралканов. При этом для SiO2 со слоями малонатов при варьировании иона металла увеличение значений ${{\bar {q}}_{{{\text{dif}},1}}}$ и $\left| {\Delta \bar {S}_{{1,C}}^{{{{S}^{0}}}}} \right|$ наблюдается в ряду Ni(II) < Co(II) < Cu(II). Такая закономерность, по-видимому, обусловлена электронным строением и свойствами ионов металлов, входящих в состав хелатов малонового эфира при образовании координационно-ненасыщенных комплексов на поверхности SiO2 различной стехиометрии, преимущественно состава Me : L = 1 : 2 для ионов никеля и кобальта с плоско-квадратной координацией. Медные комплексы малонового эфира с 17-электронной оболочкой и конфигурацией иона d9, характеризующиеся плоско-квадратной и тетрагонально-искаженной октаэдрической координацией в основном состоянии, вследствие вырожденности, претерпевают изменения согласно эффекту Яна–Теллера [19] c образованием хелатов металлов состава преимущественно Me : L = 1 : 1, что подтверждается данными по изучению кислотно-основных центров поверхности исследуемых адсорбентов и газовой хроматографии [20].
Для оценки вклада специфических межмолекулярных взаимодействий в общую энергию адсорбции рассчитывали значения $\Delta {{\bar {q}}_{{{\text{dif}},1(спец)}}}$, сопоставляя полученные экспериментальные данные с теплотой адсорбции гипотетического н-алкана с тем же значением поляризуемости, что и у молекул исследуемого адсорбата (табл. 4).
Таблица 4.
Значения энергии специфического взаимодействия $\Delta {{\bar {q}}_{{{\text{dif}},1(спец)}}}$ для исходного Силохрома C-120 (I) и модифицированного малонатами никеля (II), кобальта (III), меди (IV) и их вклад (%) в общую энергию адсорбции
| Адсорбат | $\Delta {{\bar {q}}_{{{\text{dif}},1(спец)}}}$ | % | $\Delta {{\bar {q}}_{{{\text{dif}},1(спец)}}}$ | % | $\Delta {{\bar {q}}_{{{\text{dif}},1(спец)}}}$ | % | $\Delta {{\bar {q}}_{{{\text{dif}},1(спец)}}}$ | % |
|---|---|---|---|---|---|---|---|---|
| I | II | III | I–IV | |||||
| Бензол | 4.3 | 16 | 9.9 | 25 | 13.2 | 32 | 14.6 | 30 |
| Этанол | 10.9 | 59 | 22.3 | 51 | 32.2 | 64 | 41.9 | 58 |
| Бутанон-2 | 2.7 | 28 | 19.0 | 46 | 19.2 | 31 | 51.5 | 64 |
| Нитропропан | 29.3 | 79 | 32.6 | 59 | 35.9 | 57 | 42.4 | 63 |
Вклад специфических взаимодействий сорбат–сорбент в общую энергию адсорбции на поверхности исходного SiO2 для бензола составляет 16%, а на образце с малонатом меди – до 30%. Величина $\Delta {{\bar {q}}_{{{\text{dif}},1(спец)}}}$ для нитропропана и бутанона-2 достигает 64%, что свидетельствует о проявлении сильных донорно-акцепторных взаимодействий, а для этанола – 59%, что указывает на образование водородных связей.
На рис. 5 представлена линейная зависимость дифференциальных молярных теплот адсорбции н-алканов от поляризуемости их молекул и соответствующие величины для остальных адсорбатов.
Рис. 5.
Зависимость теплоты адсорбции от поляризуемости для Силохрома C-120 с привитым слоем малоната меди: 1 – н-гексан, 2 – н-гептан, 3 – н-октан, 4 – н-нонан, 5 – бензол, 6 – нитропропан, 7 – бутанон-2, 8 – этанол.
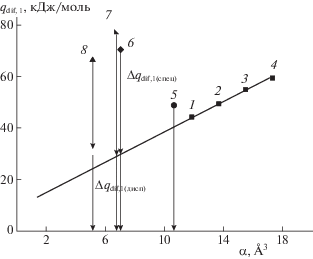
Полученные результаты показывают, что н-алканы адсорбируются на модифицированной поверхности неспецифично в отличие от бензола и кислородсодержащих органических веществ, что также подтверждается значениями $\Delta {{\bar {q}}_{{{\text{dif}},1(спец)}}}$ (табл. 4).
Таким образом, для адсорбентов на основе Силохрома C-120 с химически привитым слоем малонатов переходных металлов изучены текстурные свойства поверхности, термическая устойчивость концентрация привитых групп. Установлено, что на адсорбционные свойства поверхности хелатсодержащих хроматографических материалов оказывает влияние состав малонатов. При варьировании иона металла в ряду Ni(II) < Co(II) < Cu(II) наблюдается рост констант Генри, теплоты и энтропии адсорбции по отношению ко всем сорбатам, обусловленный стехиометрией образующихся хелатов. Химическое модифицирование Силохрома C-120 малонатами металлов приводит к увеличению вклада специфических взаимодействий в теплоту адсорбции, при этом наибольшие значения $\Delta {{\bar {q}}_{{{\text{dif}},1(спец)}}}$ характерны для органических соединений, склонных к образованию водородных связей и донорно-акцепторному комплексообразованию.
Работа выполнена в рамках государственного задания Минобрнауки России (проект № 0721-2020-0037).
Список литературы
Лисичкин Г.В. Химия привитых поверхностных соединений. М.: Физматлит, 2003. 592 с.
Wasiak W. // J. Chromatogr. A. 1993. V. 653. P. 63.
Snow N.H. // Trends Analytical Chemistry. 2001. V. 21. № 9. P. 608.
Marcinko S., Helmy R., Fadeev A.Y. // Langmuir. 2003. V. 19. № 7. P. 2752.
Rykowska I., Wasiak W. // Analytica Chimica Acta. 2002. V. 451. № 2. P. 271.
Хартли Ф. Закрепленные металлокомплексы. Новое поколение катализаторов: Пер. с англ. М.: Мир, 1989. 122 с.
Рощина Т.М., Шония Н.К. // Журн. физ. химии. 2019. Т. 93. № 10. С. 1529. (Roshchina T.M., Shoniya N.K. // Russ. J. Phys. Chem. A. 2019. Т. 93. № 10. С. 1931).
Онучак Л.А., Бурматнова Т.С., Спиряева Е.А. и др. // Журн. физ. химии. 2012. Т. 86. № 8. С. 1424.
Авгуль Н.Н., Киселев А.В., Пошкус Д.П. Адсорбция газов и паров на однородных поверхностях. М.: Химия, 1975. 384 с.
Пахнутова Е.А., Слижов Ю.Г. // Сорбционные и хроматографические процессы. 2016. Т. 16. № 4. С. 280.
Лопаткин А.А. // Росс. хим. журн. 1996. Т. 40. № 2. С. 5.
Минакова Т.С. Адсорбционные процессы на поверхности твердых тел. Учебное пособие. Томск: Изд-во Том. ун-та, 2007. 284 с.
Паукштис Е.А. Инфракрасная спектроскопия в гетерогенном кислотно-основном катализе. Новосибирск: Наука, 1992. 254 с.
Накамото К. ИК-спектры и спектры КР неорганических и координационных соединений. М.: Мир, 1991. 536 с.
Tayyari S.F. Spectrochimica Acta Part A. 2000. № 56. P. 2679.
Ristova M. // J. of molecular structure. 2009. P. 93.
Паркаева С.А., Белякова Л.Д., Ревина А.А. и др. // Сорбционные и хроматографические процессы. 2010. Т. 10. № 5. С. 713.
Яшин Я.И., Яшин Е.А., Яшин А.Я. Газовая хроматография. М.: ТрансЛит, 2009. 528 с.
Гринвуд Н. Химия элементов: в 2 т. М.: Бином, 2011. Т. 2. 670 с.
Пахнутова Е.А., Слижов Ю.Г. // Неорган. материалы. 2015. Т. 51. № 6. С. 634. (Pakhnutova E.A., Slizhov Y.G. Inorganic Materials. 2015. Т. 51. № 6. С. 572).
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии