Журнал физической химии, 2021, T. 95, № 7, стр. 1101-1109
Кристаллы п-кватерфенила: поверхностные свойства и зародышеобразование в растворах и паровой фазе
В. А. Постников a, *, А. А. Кулишов a, М. С. Лясникова a, Г. А. Юрасик a, А. С. Степко a, П. В. Лебедев-Степанов a, О. В. Борщев b
a Российская академия наук, ФНИЦ “Кристаллография и фотоника”
Москва, Россия
b Российская академия наук, Институт синтетических полимерных материалов имени Н.С. Ениколопова
Москва, Россия
* E-mail: postva@yandex.ru
Поступила в редакцию 24.08.2020
После доработки 24.08.2020
Принята к публикации 28.09.2020
Аннотация
Представлены результаты исследования роста кристаллических пленок п-кватерфенила в условиях парового физического транспорта. Экспериментально изучена поверхностная энергия их наиболее развитой грани (001) методом контактного угла смачивания. В приближении метода атомно-силового поля OPLS определены значения поверхностной энергии граней кристалла п-кватерфенила (100), (010), (110) и (001). С учетом кристаллического строения и полученных значений поверхностной энергии граней проведен анализ морфологии кристаллов. В рамках классической нуклеационной теории исследованы параметры зародышеобразования кристаллов п-кватерфенила в экспериментальных условиях роста из растворов на межфазной границе “раствор–воздух” и из паровой фазы (метод парового физического транспорта).
Линейные сопряженные олигомеры представляют большой интерес для задач органической электроники и фотоники с точки зрения возможности получения на их основе органических полупроводниковых кристаллов с высоким структурным совершенством [1–4]. В формировании кристаллов основную роль играют их поверхностные свойства и внешние условия ростовой среды. В условии термодинамического равновесия внешний облик кристалла (габитус) определяется принципом Гиббса–Кюри–Вульфа [5]. В реальных условиях кристаллы линейных олигомеров при взаимодействии с внешней средой, как правило, имеют выраженную двумерную (пленки, пластины) или одномерную (иглы, стержни) анизотропию роста [6]. Линейные олигомеры, у которых кристаллическая структура состоит из параллельных плотноупакованных в “паркетно-елочном” порядке молекулярных слоев, склонны к 2D-кристаллизации на границе раздела фаз [7–10]. По этой причине в настоящее время уделяется пристальное внимание методам роста из растворов, позволяющим получать обширные ультратонкие (в пределе 1–3 монослоев) монокристаллические пленки [2, 3, 11]. В случае низкой растворимости для получения крупных монокристаллических пленок целесообразно использовать метод парового физического транспорта (ПФТ) [1, 12]. В условиях метода ПФТ скорость роста кристаллов и степень их химической чистоты существенно выше, чем в растворных способах, однако в данном случае для крупных кристаллических пленок гораздо сложнее добиться качественной огранной морфологии боковых граней и стабильного роста на межфазной границе с подложкой [10].
Молекула п-кватерфенила состоит из четырех сопряженных фенильных групп и характеризуется высоким внешним квантовым выходом фотолюминесценции в растворах и кристаллическом состоянии [8]. При низкой растворимости (0.2 г/л в толуоле при 20°С) методы роста из растворов позволяют выращивать образованные спонтанным образом монокристаллы п-кватерфенила длиной до 8 мм и толщиной ~50 мкм в течение 25 сут [4, 8]. При высыхании в течение нескольких часов на подложке капли раствора при постоянной температуре могут сформироваться монокристаллические пленки длиной до 2 мм, толщина которых может составлять 5–10 мономолекулярных слоев [13], однако данный процесс пока плохо воспроизводим, поскольку в целом закономерности образования и роста такого рода объектов еще мало изучены. Результаты теоретического моделирования методами теории функционала электронной плотности поверхностных свойств кристаллов нескольких гомологических семейств линейных олигомеров, в том числе и п-кватерфенила, представлены в работах Набока и его соавт. [14–16]. На основании полученных значений поверхностной энергии основных низко индексных граней кристаллов с использованием принципа Гиббса–Кюри–Вульфа предсказана равновесная форма кристаллов рассматриваемых линейных олигомеров. Однако исследований, посвященных анализу зародышеобразования органических кристаллов в реальных условиях роста с учетом анизотропии поверхностных свойств и структуры кристаллов в литературе немного [17–21], а для линейных сопряженных олигомеров они почти отсутствуют.
Данная работа посвящена исследованию поверхностных свойств кристаллов п-кватерфенила методом атомно-силового поля OPLS и анализу в рамках классической теории нуклеации [22–24] параметров образования кристаллических зародышей из раствора на границе раздела “жидкость–воздух” и из паровой фазы. Представлены результаты по выращиванию монокристаллических пленок п-кватерфенила в условиях парового физического транспорта.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалы. Для выращивания кристаллов использовали п-кватерфенил, синтезированный по схеме металлоорганического синтеза в условиях Сузуки [8]. Использовали толуол (“ос.ч.”) и изопропанол (“ч.д.а.”). В качестве инертного газа для продувки ростовой трубы в процессе роста кристаллов использовали азот (марки 6) производства НИИ КМ (Москва).
Рост кристаллов. Для получения кристаллических пленок п-кватерфенила из раствора применяли метод “растворитель–осадитель”, детали которого и особенности роста кристаллов ранее описаны в работах [4, 8]. Для анализа морфологии граней кристаллов привлекали выращенные из капель раствора толуола на стеклянных подложках в условии медленного изотермического испарения микрокристаллы с правильной огранной формой [13]. Крупные кристаллические пленки также получали методом парового физического транспорта (ПФТ) на ростовой установке в двухзонном исполнении: в “горячей” зоне при T0 = 523 К располагали стеклянную лодочку с веществом в порошкообразном мелкокристаллическом состоянии, а “холодную” зону для роста кристаллов поддерживали при температуре на 40 К ниже T0. Крупные кристаллические пленки длиною до 10 мм и толщиною до 20 мкм (рис. 1) выращивали в течение 48 ч в слабом потоке азота (0.2 л/ч). Формирование крупных свободно лежащих кристаллов (отсутствие адгезии с поверхностью ростовой трубы) происходило на узком участке в начале “холодной” зоны (перешеек между “горячей” и “холодной” зонами 2–3 см).
Оптическая микроскопия. Морфологию кристаллических пленок и их толщину изучали с помощью лазерного сканирующего конфокального микроскопа Olympus LEXT OLS 3100.
Рентгеноструктурный анализ. Структуру наиболее крупных монокристаллических пленок п-кватерфенила, выращенных методом ПФТ, исследовали на порошковом рентгеновском дифрактометре Miniflex 600 (Rigaku, Япония). Излучение CuKα, λ = 1.54178 Å. Скорость записи 2 град/мин. Предварительно выполняли ламинирование кристаллических образцов на кварцевую подложку за счет сил межмолекулярного взаимодействия и рентгенодифракционное отражение фиксировали от плоской поверхности кристаллов.
Поверхностные свойства растворов и кристалла. Исследования поверхностного натяжения растворов и краевого угла смачивания проводили на оптическом приборе OCA 15EC (Dataphysics, Германия) при 22–24°С. Поверхностное натяжение насыщенного раствора п-кватерфенила в толуоле определяли по методу висячей капли. Во избежание испарения каплю раствора выдавливали внутрь небольшой герметичной кварцевой кюветы с прозрачными стенками. Поверхностное натяжение капли насыщенного раствора также определяли в условиях атмосферы, насыщенной парами изопропилового спирта, который предварительно наливали на дно кварцевой кюветы. Поверхностную энергию $\sigma _{{001}}^{V}$ определяли только для наиболее развитой грани (001) с помощью модифицированного уравнения Юнга с использованием экспериментально измеренных значений краевого угла смачивания θ001 дистиллированной водой [25]: $\cos {{\theta }_{{001}}}$ = −1 + 2($\sigma _{{001}}^{V}\sigma _{W}^{d}$)1/2/σW, где σW = = 72.8 мДж/м2 и $\sigma _{W}^{d}$ = 21.8 мДж/м2 [26] – поверхностное натяжение воды и вклад дисперсионных сил в данную величину соответственно. Для измерений использовали несколько наиболее крупных кристаллических пленок п-кватерфенила, выращенных методом ПФТ.
МЕТОДИКА РАСЧЕТА ПОВЕРХНОСТНОЙ ЭНЕРГИИ КРИСТАЛЛА
Поверхностную энергию граней кристалла п-кватерфенила рассчитывали методом атомного силового поля OPLS [27]. В расчетах использовали рентгеноструктурные данные монокристального эксперимента [8] о взаимном расположении молекул в кристалле, а также – о положениях атомов в молекуле, на основе чего строили параллельные молекулярные бислои (кластеры), лежащие в одной из трех кристаллографических плоскостей (001), (010), (110) или (100), содержащие 78 молекул в случае расчета энергии плоскости (001) и по 54 молекулы в трех остальных указанных ориентациях плоскостей. Определяли полную ван-дер-ваальсову энергию ориентированного бислоя Uhkl. Далее аналогично вычисляли энергию идентичных монослоев, составляющих бислой, U1hkl. Энергия связи бислоев равна ΔUhkl = Uhkl – ‒ 2U1hkl. В модели принято, что положительно определенная энергия когезии равна – ΔUhkl, а поверхностная энергия равна отношению энергии когезии к удвоенной площади монослоя: σhkl = –ΔUhkl/2S1hkl [25, 26].
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Поверхностные свойства. В табл. 1 представлены полученные данные о поверхностном натяжении чистых растворителей и насыщенного раствора п-кватерфенила в толуоле. Для оценки воздействия диффузии изопропанола на поверхностные свойства жидкой фазы в условиях роста кристаллов на границе раздела раствор–воздух (метод “растворителя–осадителя” [7–9, 23]) нами проведены соответствующие исследования по методу висячей капли, выдавливаемой внутрь закрытой кварцевой кюветы с небольшим количеством изопропилового спирта на дне. Как видно из табл. 1, наличие в атмосфере насыщенных паров изопропанола приводит к заметному снижению поверхностного натяжения как чистого толуола ($\sigma _{L}^{i}$), так и его раствора с п-кватерфенилом ($\sigma _{{LV}}^{i}$).
Таблица 1.
Поверхностные свойства растворителей и насыщенных растворов п-кватерфенила (20°С), мДж/м2
| Растворитель | $\sigma _{L}^{{}}$ | $\sigma _{L}^{i}$ | $\sigma _{{LV}}^{{}}$ | $\sigma _{{LV}}^{i}$ |
|---|---|---|---|---|
| Толуол | 29.1 28.5 [28] |
26.4 | 27.7 | 26.0 |
| Изопропанол | 21.8 21.7 [28] |
– | – | – |
Обозначения: $\sigma _{L}^{{}}$ и $\sigma _{L}^{i}$ – поверхностное натяжение чистого растворителя на открытом воздухе и внутри кварцевой кюветы с атмосферой, насыщенной парами изопропанола соответственно; $\sigma _{{LV}}^{{}}$ и $\sigma _{{LV}}^{i}$ – поверхностное натяжение насыщенного раствора толуола в воздухе, насыщенном парами толуола и смесью паров толуола и изопропанола соответственно.
В табл. 2 представлены рассчитанные по методу OPLS значения поверхностной энергии низкоиндексных граней кристалла п-кватерфенила. Для сравнения также представлены имеющиеся соответствующие литературные сведения [14–16]. Определенные методом атомного силового поля значения поверхностной энергии граней, как видно из табл. 2, оказались ниже литературных, однако наблюдается согласование соответствующих величин относительно анизотропии значений для рассмотренных кристаллографических направлений. Также в табл. 2 представлено значение поверхностной энергии $\sigma _{{001}}^{V}$, определенное на основе измерений контактного угла смачивания каплей воды. Как видно, экспериментальная оценка величины $\sigma _{{001}}^{V}$ для реального кристалла оказалось приблизительно в середине диапазона значений, рассчитанных для идеальной кристаллической поверхности. В ходе экспериментов также установлено, что на поверхности кристаллов п-кватерфенила капля насыщенного раствора толуола практически полностью растекается (θ001 ≈ 0).
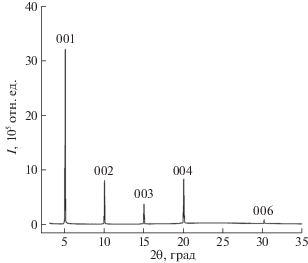
Рентгеноструктурный анализ, кристаллическая структура и габитус кристаллов. Рентгеновская дифрактограмма монокристаллической пленки п-кватерфенила, выращенной методом ПФТ, приведена на рис. 2. Спектр дифракционных рефлексов представляет собой набор узких пиков, положение которых кратно положению первого максимума при 2θ1 = 5.0°. Согласно экспериментальным данным [8], наблюдаемая дифракционная картина соответствует отражению от семейства плоскостей (00l). Расчет межплоскостного расстояния по уравнению Вульфа–Брэгга для первого максимума дает значение толщины мономолекулярного слоя в ориентации (001) h001 ≈ 1.77 нм.
Рис. 2.
Рентгеновская дифрактограмма монокристаллической пленки п-кватерфенила, выращенной методом ПФТ.
Кристаллическая структура п-кватерфенила состоит из стопки эквивалентных монослоев, параллельных плоскости (001) [8]. Анизотропия роста кристаллов обусловлена анизотропным характером межмолекулярных связей. Наиболее сильные связи соответствуют боковым взаимодействиям между молекулами внутри монослоев (00l) в направлениях [100], [010], [110]. В данных направлениях скорость роста кристаллов п-кватерфенила наиболее высокая. Когезионное взаимодействие между соседними монослоями в семействе плоскостей (00l) обеспечивается более слабыми торцевыми контактами между молекулами. Таким образом, среди низкоиндексных плоскостей поверхностная энергия грани (001) в кристалле является минимальной, что обусловливает наиболее низкую скорость роста кристаллов в направлении нормали к данной грани. Между геометрией упаковки молекул и габитусом выращенных из раствора кристаллов (рис. 3а, 3б) нетрудно определить взаимосвязь.
Рис. 3.
Конфокальное (а) и оптическое в отраженных лучах (б) изображения монокристаллов п-кватерфенила; в – схематическое изображение шестиугольного кристаллического кластера молекул п-кватерфенила внутри монослоя (001); г – равновесная форма кристалла п-кватерфенила, построенная на основе рассчитанных методом OPLS значений поверхностной энергии граней.
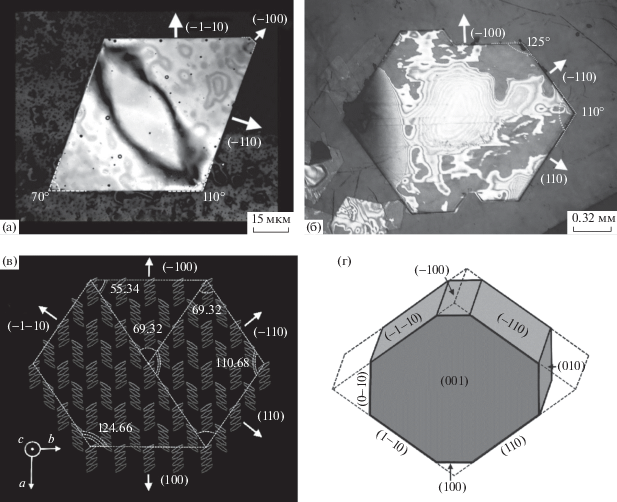
В качестве примера на рис. 3а и 3б представлены выращенные из растворов плоские кристаллы с типичными формами: параллелограмм с внутренними углами ~70° и ~110° (рис. 3а) и многоугольник (для микрокристалликов, как правило, шестиугольник) с внутренними углами ~110° и ~125° (рис. 3б). Рассмотрим структурную модель кристаллической упаковки молекул п-кватерфенила [8]. Выделим внутри монослоя (001) компактный шестиугольный кластер молекул, ограниченный плоскостями (100), (110), (–110), (‒100), (–1–10) и (1–10), как показано на схематическом изображении (рис. 3в). Внутренние углы между боковыми гранями сформированного таким способом кристаллического прообраза имеют значения 125.12° и 109.76° (рис. 3в). Данный шестиугольный кластер в силу свойств симметрии кристалла п-кватерфенила (пространственная группа P21/a), можно разложить на три параллелограмма с ориентацией боковых сторон (110) и (–110) (внутренние углы 69.32° и 110.68°), два из которых совпадают друг с другом при трансляции вдоль оси b, а третий по малой диагонали разделен пополам на два треугольника, разнесенных друг относительно друга вдоль оси a (рис. 3в). Опираясь на схематическую структурную модель, представленную на рис. 3в, по значениям внутренних углов выращенных монокристаллов можно установить кристаллографическую ориентацию их боковых граней, как, например, показано на фотоизображениях на рис. 1, 3а и 3б.
Равновесная форма кристалла п-кватерфенила, построенная на основе принципа Гиббса–Кюри–Вульфа с использованием данных о поверхностной энергии граней, рассчитанных методом OPLS (табл. 2), представлена на рис. 3г.
Термодинамическая модель зародышеобразования кристалла. Рассмотрим модель кристалла п-кватерфенила, образующегося на межфазной границе раствор – воздух при наличии движущей силы кристаллизации в области границы раздела фаз (рис. 4а). Для учета основных низкоиндексных граней рассмотрим зародыш толщиною h с шестиугольным основанием, длина сторон которого l1 и l2. Верхняя грань, ориентированная параллельно плоскости (001), не имеет контакта с раствором, а нижняя и боковые грани смачиваются. Боковые грани зародыша, таким образом, ориентированы вдоль кристаллографических плоскостей (100) и (110) в соответствии со структурной схемой на рис. 3в. В выбранной геометрии противоположные стороны в основании параллельны и равны, а стороны l1 и l2 связаны между собой соотношением:
(1)
${{l}_{2}} = \frac{{{{l}_{1}}}}{2}{{\left( {\frac{{{{a}^{2}}}}{{{{b}^{2}}}} + 1} \right)}^{{1/2}}} = A{{l}_{1}},$(2)
$S = \frac{3}{2}l_{1}^{2}{{\left( {{{{\left( {\frac{{{{l}_{2}}}}{{{{l}_{1}}}}} \right)}}^{2}} - \frac{1}{4}} \right)}^{{1/2}}} = \frac{3}{2}l_{1}^{2}{{\left( {{{A}^{2}} - \frac{1}{4}} \right)}^{{1/2}}} = Bl_{1}^{2}.$(3)
$\begin{gathered} \Delta G = - \left( {\frac{{Bl_{1}^{2}h}}{\Omega }} \right)\Delta {{\mu }} + B(\sigma _{{001}}^{V} + \sigma _{{001}}^{L} - {{\sigma }_{{LV}}})l_{1}^{2} + \\ \; + 2(\sigma _{{100}}^{L} + 4A\sigma _{{110}}^{L})l_{1}^{{}}h, \\ \end{gathered} $(4)
$\frac{h}{{{{l}_{1}}}} = \frac{{B(\sigma _{{001}}^{V} + \sigma _{{001}}^{L} - {{\sigma }_{{LV}}})}}{{\sigma _{{100}}^{L} + 4A\sigma _{{110}}^{L}}}.$(5)
$\begin{gathered} l_{{1с}}^{{}} = \frac{{2\Omega }}{{B\Delta \mu }}(\sigma _{{100}}^{L} + 4A\sigma _{{110}}^{L}), \\ {{h}_{с}} = \frac{{2\Omega }}{{\Delta \mu }}(\sigma _{{001}}^{V} + \sigma _{{001}}^{L} - {{\sigma }_{{LV}}}). \\ \end{gathered} $(7)
$\begin{gathered} l_{{1c}}^{{}} = \frac{{2\Omega }}{{B\Delta \mu }}(\sigma _{{100}}^{V} + 4A\sigma _{{110}}^{V} - {{\sigma }_{{LV}}}(1 + 4A)), \\ {{h}_{c}} = \frac{{4\Omega }}{{\Delta \mu }}(\sigma _{{001}}^{V} - {{\sigma }_{{LV}}}). \\ \end{gathered} $Рис. 4.
Схематическая модель зародыша кристалла п-кватерфенила (а), зависимость размеров критического зародыша от относительного пересыщения раствора толуола при 293 К (б), зависимость функции ΔG в полулогарифмических координатах от толщины зародыша h при различных пересыщениях (ξ = 20 (1), 50 (2) 100% (3)) раствора толуола при 293 К (в, пунктир – значения в условиях атмосферы, насыщенной парами изопропанола); зависимость функции ΔGvap от толщины зародыша h при различных переохлаждениях (ΔТ = 20 (1), 40 (2) и 60 К (3)) пара при температуре источника T0 = 523 К (г). Линейные размеры зародыша представлены в единицах толщины монослоя h001 = 1.768 нм.
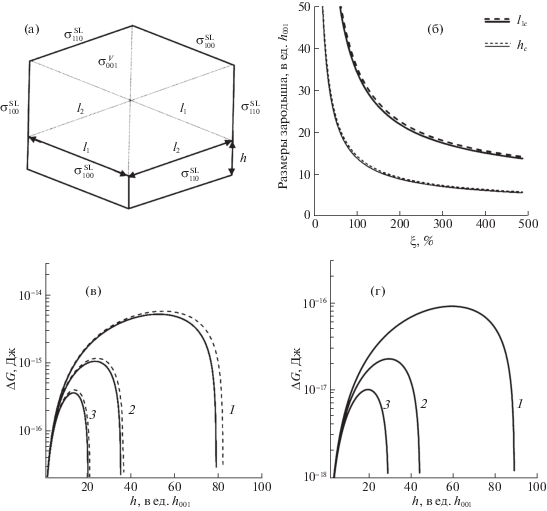
Для линейных размеров критического зародыша l1c и hc функция ΔG имеет максимум, значение которого определяет работу образования критического зародыша AN:
(8)
$\begin{gathered} {{A}_{N}} = {{\left( {\frac{{2\Omega }}{{\Delta \mu }}} \right)}^{2}}{\kern 1pt} (\sigma _{{100}}^{V} + 4A\sigma _{{110}}^{V} - \\ - \;{{\sigma }_{{LV}}}(1 + 4A)){{(\sigma _{{001}}^{V} - {{\sigma }_{{LV}}})}^{2}}. \\ \end{gathered} $На рис. 4в представлены зависимости изменения свободной энергии Гиббса ΔG от толщины зародыша (с учетом соотношения (4)) при различных пересыщениях ξ раствора толуола при 293 К. Как видно, при увеличении пересыщения от 20 до 100% энергетический барьер для образования зародыша снижается в ~20 раз, а его толщина при этом снижается в 4 раза: от 52 до 13 монослоев. Ранее при исследовании особенностей роста кристаллических пленок п-кватерфенила из капель раствора толуола на открытых подложках было установлено, что формирование обширных тонких пленок толщиною (5–10)h001, как правило, происходит на завершающей стадии высыхания капли, когда поверхность жидкой фазы еще относительно велика, а объем уже многократно уменьшился от первоначального [13]. В этих условиях концентрация пересыщенного раствора может в несколько раз превышать равновесное значение, в связи с чем, в соответствии с представленными на рис. 4б графиками, вероятно зарождение кристаллов, состоящих из нескольких монослоев. Образованные в данных условиях кристаллы, судя по наблюдениям, преимущественно разрастаются в направлениях плоскости (001) на поверхности жидкой фазы, поскольку рост по толщине лимитируется относительно низкой скоростью послойного роста и ограниченным количеством вещества. Таким образом, полученная количественная оценка параметров зародышеобразования кристаллов п-кватерфенила из раствора толуола не противоречит экспериментальным сведениям о росте тонких монокристаллических пленок из капель раствора на подложках.
Пунктирные кривые на рис. 4в – результат расчет величин ΔG для поверхностного натяжения насыщенного раствора толуола в атмосфере со смесью насыщенных паров толуола и изопропанола. В этом случае, как видно из рисунка, работа образования зародыша AN увеличивается относительно исходных значений на ~10%. Данный результат, возможно, объясняет причину улучшения роста и морфологии кристаллических пленок п-кватерфенила, формируемых на границе раздела раствор–воздух в процессе диффузии паров осадителя – изопропанола в сравнении с методом выращивания при изотермическом испарении растворителя: наблюдается значительное уменьшение числа образуемых центров роста на поверхности раствора, а также не возникает пояс паразитных кристалликов на стенках ростового сосуда в области контактной линии жидкой фазы.
Рассмотрим изменение свободной энергии Гиббса ΔGvap при гомогенном образовании кристаллического зародыша кристалла п-кватерфенила формы, аналогичной приведенной на рис. 4а, из паровой фазы:
(9)
$\begin{gathered} \Delta {{G}_{{{\text{vap}}}}} = - \left( {\frac{{Bl_{1}^{2}h}}{\Omega }} \right)\Delta {{\mu }_{{{\text{vap}}}}} + \\ + \;2B\sigma _{{001}}^{V}l_{1}^{2} + 2(\sigma _{{100}}^{V} + 4A\sigma _{{110}}^{V})l_{1}^{{}}h. \\ \end{gathered} $(11)
$l_{{1c}}^{{}} = \frac{{2\Omega }}{{B\Delta \mu }}(\sigma _{{100}}^{V} + 4A\sigma _{{110}}^{V}),\quad {{h}_{c}} = \frac{{4\Omega }}{{\Delta \mu }}\sigma _{{001}}^{V}.$Зависимости величины ΔGvap от толщины зародыша h в пределах значений переохлаждения пара ΔТ = 20–60 К относительно температуры источника вещества T0 = 523 К представлены на рис. 4г. Как видно, в рассматриваемом диапазоне переохлаждений паровой фазы толщина критического зародыша кристалла п-кватерфенила на порядок меньше, чем при образовании из пересыщенных растворов толуола (рис. 4в). В частности, при переохлаждении ΔТ = 40 K, для которого в наших условиях наблюдался рост крупных кристаллических образцов, оценочная толщина критического зародыша составляет всего 3h001. В качестве наглядного примера на рис. 5 представлена 3D-модель такого кристаллического зародыша, построенная с учетом соотношения между его высотой и толщиной.
ЗАКЛЮЧЕНИЕ
На основе принципа Гиббса–Кюри–Вульфа с использованием рассчитанных в рамках метода OPLS значений поверхностной энергии граней кристалла и с учетом кристаллического строения предсказана равновесная форма кристалла п-кватерфенила. Экспериментальная оценка поверхностной энергии грани (001), выполненная для выращенных методом ПФТ крупных кристаллических пленок путем измерения контактного угла смачивания, показала несколько более высокое значение в сравнении с рассчитанным по методу атомно-силового поля для идеальной поверхности кристалла. На основе значений поверхностной энергии основных низкоиндексных граней, рассчитанных методом OPLS, проведен термодинамический анализ параметров зародышеобразования кристаллов п-кватерфенила из раствора толуола и паровой фазы. Рассмотренная анизотропная классическая модель нуклеации дает представление о масштабе и форме образуемых кристаллических зародышей в растворе и паровой фазе в экспериментальных условиях роста кристаллов п-кватерфенила в зависимости от степени пересыщения раствора или величины переохлаждения пара относительно температуры в области источника вещества соответственно. Согласно полученным результатам, на критические размеры и работу образования кристаллического зародыша на межфазной границе жидкость–воздух существенное влияние оказывает поверхностное натяжение раствора, что подтверждается и экспериментальными наблюдениями. При выращивании кристаллов методом парового физического транспорта в условиях слабого изменения давления насыщенных паров и большого температурного градиента в рамках рассматриваемой нуклеационной модели основным фактором, влияющим на параметры гомогенного зародышеобразования, служит переохлаждение пара относительно источника вещества и зоной роста.
Список литературы
Wang C., Dong H., Jiang L. and Hu W. // Chem. Soc. Rev. 2018. V. 47. P. 422. https://doi.org/10.1039/c7cs00490g
Wang C., Fu B., Zhang X. et al. // ACS Cent. Sci. 2020. V. 6. P. 636. https://doi.org/10.1021/acscentsci.0c00251
Shi Y.-L., Zhuo M.-P., Wang X.-D. and Liao L.-S. // ACS Appl. Nano Mater. 2020. V. 3. P. 1080.https://doi.org/10.1021/acsanm.0c00131
Постников В.А., Лясникова М.С., Кулишов А.А. др. // Журн. физ. химии. 2019. Т. 93. № 9. С. 1362. https://doi.org/10.1134/S0044453719090188
Шаскольская М.П. Кристаллография. М.: Высш. школа, 1984. 376 с.
Постников В.А., Лясникова М.С., Кулишов А.А. и др. // Физика тв. тела. 2019. Т. 61. Вып. 12. С. 2322.
Postnikov V.A., Odarchenko Y.I., Iovlev A.V. et al. // Cryst. Growth Design. 2014. V. 14. P. 1726. https://doi.org/10.1021/cg401876a
Постников В.А., Сорокина Н.И., Алексеева О.А. и др. // Кристаллография. 2018. Т. 63. №1. С. 152.https://doi.org/10.7868/S0023476118010150
Постников В.А., Сорокина Н.И., Алексеева О.А. и др. // Кристаллография. 2018. Т. 63. № 5. С. 801.https://doi.org/10.1134/S0023476118050247
Postnikov V.A., Sorokina N.I., Lyasnikova M.S. et al. // Crystals. 2020. V. 10. P. 363. https://doi.org/10.3390/cryst10050363
Bruevich V.V., Glushkova A.V., Poimanova O.Y. et al. // Appl. Mater. Interfaces. 2019. V. 11. P. 6315. https://doi.org/10.1021/acsami.8b20700
Laudise R.A., Kloc C., Simpkins P.G., Siegrist T. // J. Cryst.Growth. 1998. V. 187. P. 449. https://doi.org/10.1016/S0022-0248(98)00034-7
Юрасик Г.А., Кулишов А.А., Лебедев-Степанов П.В. и др. // Поверхность. Рентгеновские, синхротронные и нейтронные исследования. 2021. № 2. С. 78 – 87. https://doi.org/10.31857/S1028096021020163.
Nabok D., Puschnig P. and Ambrosch-Draxl C. // Phys. Rev. B. 2008. B 77. 245316. https://doi.org/10.1103/PhysRevB.77.245316
Puschnig P., Nabok D. and Ambrosch-Draxl C. Interface Controlled Organic Thin Films. Springer Proceedings in Physics 129 / Ed. by H.-G. Rubahn, H. Sitter, K. Al-Shamery. Springer, 2009. P. 3. https://doi.org/10.1007/978-3-540-95930-4
Nabok D. Cohesive Properties of Organic Crystals and Organic/Metal Interfaces: A Density-Functional Study Including VdW Interactions. Diss. … Dr. mont. Montanuniversität Leoben, 2009.
Carter W.P., Ward M.D. // J. Am. Chem. Soc. 1993. V. 115. P. 11521.https://doi.org/10.1021/ja00077a059
Ward M.D. // Current Opinion in Colloid & Interface Science. 1997. V. 2. № 1. P. 51. https://doi.org/10.1016/S1359-0294(97)80008-8
Александров В.Д., Постников В.А., Щебетовская Н.В. // Журн. физ. химии. 2010. Т. 84. № 6. С. 1013.
Erdemir D., Lee A.Y., Myerson A.S. Crystal Nucleation. Handbook of Industrial Crystallization / Ed. by A.S. Myerson, D. Erdemir, A.Y. Lee. Cambridge University Press, 2019. P. 76–114. https://doi.org/10.1017/9781139026949.003
Постников В.А., Кулишов А.А., Островская А.А. и др. // Физика тв. тела. 2019. Т. 61. № 12. С. 2432.
Александров В.Д. Кинетика зародышеобразования и массовой кристаллизации переохлажденных жидкостей и аморфных сред. Донецк: Донбасс, 2011. 590 с.
Постников В.А., Чертопалов С.В. // Кристаллография. 2015. Т. 60. № 4.С. 651.https://doi.org/10.7868/S0023476115030133
Александров В.Д., Покинтелица Е.А. // Журн. физ. химии. 2016. Т. 90. № 9. С. 1385. https://doi.org/10.7868/S0044453716090028
Щукин Е.Д., Перцов А.В., Амелина Е.А. Коллоидная химия. М.: Высшая школа, 2004. 445 с.
Джейкок М., Парфит Д. Химия поверхностей раздела фаз. М.: Мир, 1984. 269 с.
Jorgensen W.L., Maxwell D.S., Tirado-Rives J. // J. Am. Chem. Soc. 1996. V. 118. P. 11225. https://doi.org/10.1021/ja9621760
Yaws C.L. Thermophysical Properties of Chemicals and Hydrocarbons. William Andrew Inc.: Beaumont. TX. 2008.
Чернов А.А., Гиваргизов Е.И., Багдасаров Х.С. и др. Современная кристаллография. Т. 3. Образование кристаллов. М.: Наука, 1980. 401 с.
Hanshaw W., Nutt M., Chickos J.S. // J. Chem. Eng. Data. 2008. V. 53. № 8. P. 1903.https://doi.org/10.1021/je800300x
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии




