Журнал физической химии, 2021, T. 95, № 7, стр. 1036-1050
Рекуррентная аппроксимация температурной зависимости растворимости неорганических солей в воде
a Санкт-Петербургский государственный университет, Институт химии
Санкт-Петербург, Россия
* E-mail: izenkevich@yandex.ru
Поступила в редакцию 16.06.2020
После доработки 16.06.2020
Принята к публикации 23.09.2020
Аннотация
Показаны эффективность и преимущества аппроксимации данных по температурной зависимости растворимости неорганических солей в воде (С) с использованием рекуррентных соотношений первого порядка вида С(Т) = аС(Т + ΔТ) + b, где ΔТ – постоянный шаг вариаций температуры (например, 10 или 20°С), а и b – коэффициенты, вычисляемые методом наименьших квадратов. Линейность рекуррентных зависимостей с коэффициентами корреляции R > 0.999 подтверждает отсутствие превращений растворенных веществ в растворах в рассматриваемых температурных интервалах. Отмечено, что появление аномалий таких зависимостей, легко выявляемых на графиках визуально, следует рассматривать как наглядный признак образования гидратов, их деструкции или изменения состава. Группировка точек на графиках рекуррентных зависимостей вдоль нескольких (чаще всего двух) прямых линий однозначно подтверждает существование различных гидратных форм одной и той же соли в водных растворах. Сделан вывод, что коэффициенты a и b рекуррентных зависимостей не одинаковы для разных солей, так как они образованы разными катионами и анионами, не связанными друг с другом какими-либо таксономическими признаками. Тем не менее, в результате рассмотрения данных для 84 солей в диапазоне температур от 0 до 100°С установлена интересная закономерность: коэффициенты b рекуррентных соотношений для солей, существующих в виде гидратов или образующих гидраты в водных растворах, удовлетворяют неравенству b < 0. Столь простое правило обеспечивает правильное предсказание образования растворенной солью гидратов приблизительно в 91% случаев. Предложена интерпретация этой закономерности.
Сведения о растворимости химических соединений в различных растворителях настолько важны в химии, а сама проблема рассмотрена настолько подробно [1], что, казалось бы, не требует особых комментариев. Справочную информацию о растворимости (С)11 неорганических солей в воде при разных температурах можно найти в справочных изданиях [2–5], учебных руководствах и многочисленных Интернет-источниках (достаточно подробные таблицы приведены, например, на сайте Wikipedia). Современные публикации в этой области затрагивают более сложные специальные вопросы, например растворимость в сверхкритических условиях [6, 7], фазовые равновесия в многокомпонентных системах, образование двойных солей [8], растворимость в бинарных растворителях [9] и другие.
Зависимости растворимости бóльшей части солей от температуры С(T) в диапазоне 0–100°С чаще всего относятся к монотонным, возрастающим и нелинейным; нарушения монотонности наблюдаются при изменении состава гидратных форм растворенных веществ [1, 3]. Для аппроксимации таких данных используют либо полиномы степеней n ≥ 2, либо достаточно “экзотические” функции, например [1]:
где Si – мольная доля растворенного вещества, Т – абсолютная температура, К, a, b, c – коэффициенты, вычисляемые методом наименьших квадратов.С целью повышения точности аппроксимации температурной зависимости растворимости такое уравнение усложняют, добавляя в него дополнительное слагаемое dT, линейно зависящее от температуры [3]:
Особенность приведенных уравнений состоит в том, что они применимы только для определенной формы выражения концентраций (мольные доли), тогда как для других могут оказаться некорректными. Данные по растворимости представляют в различных единицах, а именно массовых долях растворенного вещества wi = mi/(mi + + mраств) (значение 100wi – равно массовой доле в процентах) [3], массах растворенных веществ на 100 г растворителя (исторически чаще всего используют для водных растворов) ri = 100wi/(1 – wi) [10], мольных долях Si и (для плохо растворимых веществ) показателях растворимости pSi = $ - \lg {{S}_{{\text{i}}}}$ [11, 12].Поиск более универсальных способов представления данных по температурной зависимости растворимости обусловливает необходимость детального рассмотрения свойств линейных рекуррентных соотношений. Такие соотношения применимы к монотонным функциям целочисленных (n, уравнение 3) или равноотстоящих (x, Δx = = const, уравнение 4) значений аргумента и обладают рядом необычных математических особенностей. Они сочетают свойства арифметических и геометрических прогрессий, а их математическими эквивалентами являются полиномы переменных степеней (5) [12, 13]:
Как функции целочисленных аргументов (3) рекуррентные соотношения аппроксимируют зависимости большинства физико-химических свойств органических соединений от числа атомов углерода (nC) в молекулах гомологов, так как такой аргумент по определению не может быть нецелочисленным. Для большинства физико-химических свойств рекуррентные уравнения (3) обеспечивают аппроксимацию их гомологических вариаций в пределах различных рядов с коэффициентами корреляции R не менее 0.999. Применимость к функциям равноотстоящих значений аргумента (4) позволяет распространить рекуррентные соотношения на свойства, зависящие от температуры, давления или концентраций компонентов смесей [14]. Важным преимуществом рекуррентных соотношений для аппроксимации температурных вариаций растворимости является возможность их применения при любых способах выражения концентраций растворенных компонентов (Ci), как wi, так и ri:
где ΔT = const – постоянный “шаг” изменения температуры, a и b – коэффициенты, вычисляемые методом наименьших квадратов.Использование рекуррентных соотношений для аппроксимации температурной зависимости растворимости неорганических солей в воде впервые было кратко упомянуто в сообщении [15] и далее в публикациях [11, 12], целью которых в первую очередь была демонстрация уникальных возможностей уравнений вида (3) и (4). Однако важность задачи аппроксимации данных по температурной зависимости растворимости заставляет обратиться к ее более детальному рассмотрению, причем не только общих закономерностей применения рекуррентных соотношений, но и, не менее важно, интерпретации аномалий, выявляемых в результате такого подхода.
ОБРАБОТКА ЭКСПЕРИМЕНТАЛЬНЫХ ДАННЫХ
Данные по растворимости неорганических солей в воде, так же как и органических соединений [11, 12], заимствованные из разных источников информации могут отличаться друг от друга. Иногда такие различия весьма значительны, но обсуждение их причин выходит за рамки настоящей работы. Например, растворимость безводного карбоната натрия Na2CO3 при 60°С по данным [3] составляет 31.7 г/100 г воды, а по данным Wikipedia – 45.62 г/100 г. Кроме того, растворимость образующих гидраты солей в различных источниках указывают как непосредственно, так и в пересчете на безводные соли. Такой пересчет может быть одной из причин разброса данных за счет не учитываемых вариаций содержания гидратной воды. Объединение и совместную обработку справочных значений из разных источников, аналогичную статистической обработке данных для органических соединений [11, 12], проводили только в единичных случаях (например, для MnSO4 ⋅ H2O и AgF) с целью выявления и устранения наиболее заметных несоответствий. Использовали данные справочника [3] и сайта [10], преимуществом которого по сравнению с [3] является указание гидратных форм для большинства солей, а растворимость указана в шкале ri (массы растворенных веществ на 100 г растворителя) в интервале температур от 0 до 100°С с шагом 20°С (максимум шесть значений для каждого соединения). В массиве [3] данные по растворимости приведены без указания гидратных форм солей в шкале 100wi (мас. %) в интервале температур от 0 до 100°С с шагом 10°С (максимум 11 значений для каждого соединения). Необходимо отметить, что характеристика всех солей, упомянутых в [3, 10], выходит за рамки возможностей журнальной публикации, поэтому в приведенные далее табл. 1 и 2 включена только выбранная случайным образом часть из них (84 соединения).
Таблица 1.
Результаты аппроксимации температурной зависимости растворимости некоторых неорганических солей в воде Сi(Т) рекуррентными уравнениями ri(T + 20) = ari(T) + b (0°С ≤ T ≤ 100°С) и wi(T + 10) = awi(T) + b (0°С ≤ T ≤ 100°С), не имеющие заметных аномалий
| Соль | Растворимость, ri (г/100 г Н2О) [8] или wi (мас.%) [3] при температуре (T, °С) | Параметры уравнений C(T + ΔТ) = aC(T) + b | Комментарии | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 0 | 20 | 40 | 60 | 80 | 100 | a | b | R | S0 | ||
| AlNH4(SO4)2 ⋅ 12H2O | 2.6 | 6.6 | 12.4 | 21.1 | 35.2 | – | 1.55 ± 0.03 | 2.3 ± 0.4 | 0.9997 | 0.4 | |
| AlCl3 ⋅ 6H2O | w(T): 30.84(0), 30.91(10), 31.03(20), 31.18(30), 31.37(40), 31.60(50), 31.87(60), 32.17(70), 32.51(80), 32.90(90), 33.32(100) | 1.16 ± 0.01 | –4.8 ± 0.4 | 0.9996 | 0.03 | ||||||
| Al(NO3)3 ⋅ 9H2O | w(T): 37(0), 38.2(10), 39.9(20), 42(30), 44.5(40), 47.3(50), 50.4(60), 53.8(70), 61.5(100) | 1.15 ± 0.02 | –4.2 ± 0.7 | 0.9994 | 0.2 | ||||||
| KAl(SO4)2 ⋅ 12H2O | 2.96 | 6.01 | 13.6 | 33.3 | 72.0 | – | 2.16 ± 0.10 | 1.1 ± 1.8 | 0.998 | 2.4 | Незначительная нелинейность (выпуклая зависимость); изменение состава гидратов с высоким содержанием воды |
| Al2(SO4)3 ⋅ 18H2O | 31.2 | 36.4 | 45.6 | 58 | 73 | 89 | 1.24 ± 0.06 | –0.3 ± 2.3 | 0.997 | 1.9 | То же |
| NH4Br | 60.6 | 75.5 | 91.1 | 107.8 | 126.7 | 145.6 | 1.07 ± 0.01 | 10.7 ± 1.1 | 0.9998 | 0.6 | |
| NH4Cl | 29.7 | 37.6 | 46 | 55.3 | 65.6 | 77.3 | 1.107 ± 0.007 | 4.5 ± 0.4 | 0.99994 | 0.2 | |
| NH4H2PO4 | 22.7 | 36.8 | 56.7 | 82.9 | 120.7 | 174 | 1.40 ± 0.01 | 4.7 ± 0.7 | 0.99992 | 0.8 | |
| (NH4)2HPO4 | 57.5 | 68.6 | 81.8 | 97.6 | 115.5 | – | 1.17 ± 0.01 | 1.4 ± 0.9 | 0.99991 | 0.3 | |
| NH4I | 154.2 | 172.3 | 190.5 | 208.9 | 228.8 | 250.3 | 1.05 ± 0.01 | 10.4 ± 2.2 | 0.9998 | 0.7 | |
| (NH4)2Fe(SO4)2 ⋅ 6H2O | 17.8 | 26.9 | 38.5 | 53.4 | 72 | – | 1.268 ± 0.006 | 4.4 ± 0.2 | 0.99998 | 0.2 | |
| **NH4NO3 | 118.5 | 187.7 | 283 | 415 | 645* | 1000 | 1.56 ± 0.03 | –8.2 ± 11.7 | 0.9994 | 12.8 | *) Значение r = 610 (Т = 80) заменено на r = 645. Соль гигроскопична |
| (NH4)2SO4 | 70.4 | 75.4 | 81.2 | 87.4 | 94.3 | 102 | 1.109 ± 0.006 | –2.6 ± 0.5 | 0.99995 | 0.1 | Образует гидрат (PubChem). Соль гигроскопична |
| **NH4NCS | 115 | 163 | 235 | 347 | – | – | 1.535 ± 0.015 | –14.2 ± 2.7 | 0.99995 | 1.3 | |
| BaCl2 ⋅ 2H2O | 30.7 | 35.7 | 40.8 | 46.4 | 52.5 | 58.7 | 1.062 ± 0.009 | 3.0 ± 0.4 | 0.9998 | 0.15 | |
| Ba(OH)2 ⋅ 8H2O | 1.5 | 3.5 | 8.2 | 21 | – | – | 2.63 ± 0.08 | –0.7 ± 0.4 | 0.9995 | 0.4 | |
| B2O3 | 1.1 | 2.2 | 4 | 6.2 | 9.5 | – | 1.41 ± 0.05 | 0.7 ± 0.2 | 0.998 | 0.2 | |
| H3BO3 | 2.7 | 5.04 | 8.7 | 14.8 | 23.6 | 39.7 | 1.64 ± 0.04 | 0.3 ± 0.6 | 0.998 | 0.7 | |
| CaCl2 ⋅ 2H2O | – | – | 128.1 | 136.8 | 147 | 159 | 1.175 ± 0.001 | –13.7 ± 0.2 | 1.000 | 0.01 | Известен гидрат CaCl2 ⋅ 6H2O [3] |
| CsCl | 161 | 187 | 208 | 230 | 250 | 271 | 0.95 ± 0.02 | 33 ± 5 | 0.998 | 1.7 | |
| CsNO3 | 9.3* | 23 | 47.2 | 83.8 | 134 | 197 | 1.34 ± 0.04 | 18.8 ± 3.1 | 0.9992 | 3.1 | *) Незначительное отрицательное отклонение значения r(0) от линии регрессии |
| CrO3 | w(T): 62.2(0), 62.3(10), 62.6(20), 64.0(30), 63.5(40), 54.1(50), 64.7(60), 65.5(70), 66.2(80), 67.1(90), 67.9(100) | 1.09 ± 0.02 | –5.4 ± 1.3 | 0.998 | 0.08 | *) Незначительное отрицательное отклонение значения r(0) от линии регрессии (рис. 1). Возможен гидролиз | |||||
| CuCl2 ⋅ 2H2O | 70.65 | 77 | 83.8 | 91.2 | 99.2 | 107.9 | 1.083 ± 0.002 | 0.5 ± 0.1 | 1.000 | 0.03 | |
| Cu(NO3)2 ⋅ 3H2O | – | – | 160 | 179 | 208 | 257 | 1.63 ± 0.04 | –83 ± 8 | 0.9996 | 1.5 | |
| CuSO4 ⋅ 5H2O | 14.8 | 20.8 | 29 | 39.1 | 53.6 | 73.6 | 1.36 ± 0.02 | 0.4 ± 0.5 | 0.9997 | 0.5 | |
| CuSO4 | 25.5 | 36.2 | 48 | 60 | 71.5 | 83 | 1.01 ± 0.01 | 11.0 ± 0.7 | 0.9997 | 0.5 | |
| FeCl3 ⋅ 6H2O | 83.5 | 100 | 125 | 169.5 | – | – | 1.64 ± 0.03 | –37.2 ± 2.7 | 0.9998 | 0.8 | |
| PbCl2 | 0.67 | 0.99 | 1.45 | 1.98 | 2.6 | 3.3 | 1.18 ± 0.02 | 0.24 ± 0.04 | 0.9993 | 0.04 | |
| Pb(NO3)2 | 36.4 | 52.2 | 69.4 | 88 | 107.5 | 127.3 | 1.057 ± 0.009 | 14.1 ± 0.7 | 0.9998 | 0.5 | |
| LiCl ⋅ H2O | – | 82.8 | 90.4 | 100 | 113 | 127.5 | 1.24 ± 0.04 | –11.5 ± 3.7 | 0.9990 | 0.8 | |
| LiOH ⋅ H2O | w(T): 10.8(0), 10.8(10), 11.0(20), 11.3(30), 11.7(40), 12.2(50), 12.7(60), 13.4(70), 14.2(80), 15.1(90), 16.1(100) | 1.18 ± 0.01 | –1.7 ± 0.2 | 0.9995 | 0.06 | *) Незначительное отрицательное отклонение значения r(0) от линии регрессии | |||||
| LiI | w(T): 59.4(0), 60.5(10), 61.7(20), 63.0(30), 64.3(40), 65.8(50), 67.3(60), 68.8(70), 81.3(80), 81.7(90), 82.6(100) | 0.97 ± 0.01 | 3.2 ± 0.8 | 0.9995 | 0.3 | Скачок растворимости в диапазоне 70 ≤ Т ≤ 80°С; изменение состава гидрата; параметры уравнения вычислены для диапазонов 0 ≤ Т ≤ 60 и 80 ≤ Т ≤ 100°С. Известен гидрат LiI ⋅ 3H2O [3] | |||||
| Li2SO4 ⋅ H2O | w(T): 26.3(0), 25.9(10), 25.6(20), 25.4(30), 25.0(40), 24.7(50), 24.5(60), 24.3(70), 24.0(80), 23.8(90), 23.6(100) | 0.93 ± 0.02 | 1.4 ± 0.4 | 0.998 | 0.04 | Пример убывающей зависимости w(T); | |||||
| MgCl2 ⋅ 6H2O | 52.8 | 54.6 | 57.5 | 60.7 | 65.9 | 72.7 | 1.38 ± 0.04 | –18.1 ± 2.1 | 0.998 | 0.4 | |
| MgCl2 ⋅ 4H2O | 63.6 | 73.6 | 88.7 | 111.5* | – | – | 1.51 ± 0.00 | –22.4 ± 0.0 | 1.000 | 0.00 | *) Значение r = 106 (Т = 58.1) заменено значением r = 111.5 (Т = 60) |
| Mg(NO3)2 ⋅ 6H2O | w(T): 38.4(0), 39.5(10), 40.5(20), 42.4(30), 44.1(40), 45.9(50), 47.9(60), 50.0(70), 52.2(80), 70.6(90), 72.0(100) | 1.00 ± 0.02 | 1.5 ± 0.8 | 0.999 | 0.5 | Скачок растворимости в диапазоне 80 ≤ Т ≤ 90°С; изменение состава гидрата; значения r(90 ≤ Т ≤ 100) соответствуют уравнению для T ≤ 80°C. Образует несколько гидратов | |||||
| HgBr2 | 0.62 | 0.96 | 1.65* | 2.8 | 4.9 | – | 1.79 ± 0.03 | –0.12 ± 0.05 | 0.9997 | 0.05 | *) Значение r = 1.7 (Т = 60) заменено значением r = 1.65. Образует гидрат (PubChem) |
| HgCl2 | w(T): 4.24(0), 5.05(10), 6.17(20), 7.62(30), 9.53(40), 12.02(50), 15.18(60), 19.16(70), 24.06(80), 29.90(90), 26.62(100) | 1.24 ± 0.01 | 1.11 ± 0.16 | 0.9997 | 0.26 | Возможно, образует дигидрат | |||||
| CH3CO2K | w(T): 68.4(0), 70.29(10), 72.09(20), 73.7(30), 75.08(40), 76.27(50), 77.31(60), 78.22(70), 79.04(80). 79.8(90), 80.55(100) | 0.888 ± 0.005 | 9.6 ± 0.3 | 0.9998 | 0.05 | Образует моно- (CAS № 254966-93-3) и тригидрат | |||||
| KBrO3 | 3.1 | 6.8 | 13.1 | 22 | 33.9 | 49.7 | 1.38 ± 0.03 | 3.3 ± 0.5 | 0.9993 | 0.04 | |
| KBr | 54 | 65.8 | 76.1 | 85.9 | 95.3 | 104.9 | 0.95 ± 0.02 | 14.2 ± 1.2 | 0.9996 | 0.5 | |
| K2CO3 | w(T): 51.3(0), 51.7(10), 52.3(20), 53.1(30), 54.0(40), 54.9(50), 56.0(60), 57.2(70), 58.4(80), 59.6(90), 61.0(100) | 1.10 ± 0.01 | –4.5 ± 0.8 | 0.9993 | 0.12 | Образует сескви– (CAS № 6381-79-9) и дигидрат (CAS № 16799-90-9) | |||||
| KClO3 | w(T): 3.03(0), 4.67(10), 6.74(20), 9.21(30), 12.06(40), 15.26(50), 18.78(60), 22.65(70), 26.77(80), 31.53(90), 36.65(100) | 1.115 ± 0.006 | 1.62 ± 0.10 | 0.9998 | 0.17 | ||||||
| KCl | 28.2 | 34.2 | 40.3 | 45.6 | 51 | 56.2 | 0.96 ± 0.01 | 7.2 ± 0.5 | 0.9997 | 0.2 | |
| w(T): 27.6(0), 31(10), 34(20), 37(30), 40(40), 42.6(50) | 0.95 ± 0.01 | 4.8 ± 0.5 | 0.9996 | 0.14 | |||||||
| K2CrO4 | w(T): 37.1(0), 38.1(10), 38.9(20), 39.8(30), 40.5(40), 41.3(50), 41.9(60), 42.6(70), 43.2(80), 43.8(90), 44.3(100) | 0.94 ± 0.01 | 3.3 ± 0.4 | 0.9995 | 0.07 | ||||||
| KH2PO4 | 14.3 | 22.7 | 33 | 48.6 | 68 | – | 1.34 ± 0.04 | 3.5 ± 0.2 | 0.9991 | 1.0 | |
| K2S2O5 | 27.5 | 44.9 | 63.9 | 85 | 108 | 133 | 1.095 ± 0.002 | 14.8 ± 0.2 | 0.99999 | 0.15 | |
| K2[PtCl6] | 0.74 | 1.1 | 1.7 | 2.6 | 3.8 | 5.2 | 1.33 ± 0.05 | 0.23 ± 0.11 | 0.998 | 0.04 | Нелинейная (выпуклая) зависимость |
| K4[Fe(CN)6] ⋅ 3H2O | 15 | 28.9 | 42.7 | 56 | 68.9 | 82.7 | 0.99 ± 0.01 | 13.9 ± 0.5 | 0.9998 | 0.4 | |
| K3[Fe(CN)6] | 29.9 | 46 | 59.5 | 70.9 | 81.8 | 91.6 | 0.88 ± 0.01 | 19.2 ± 0.8 | 0.9996 | 0.5 | |
| KHCO3 | 22.6 | 33.3 | 45.3 | 60 | – | – | 1.18 ± 0.03 | 6.5 ± 1.0 | 0.9996 | 0.5 | |
| KHSO4 | 36.3 | 51.4 | 67.3 | 82.7 | 100.8 | 121.6 | 1.09 ± 0.02 | 11.3 ± 1.6 | 0.9993 | 1.2 | |
| KOH ⋅ H2O | 136.4 | 147 | 160 | 178 | – | – | 1.32 ± 0.04 | –33 ± 7 | 0.9994 | 0.7 | Известны гидраты [3] KOH ⋅ H2O и KOH ⋅ 2H2O |
| KIO3 | 4.7 | 8.1 | 12.9 | 18.5 | 24.8 | 32.3 | 1.19 ± 0.02 | 2.9 ± 0.3 | 0.9994 | 0.4 | |
| KI | 127.8 | 144.5 | 161 | 176.2 | 191.5 | 208 | 0.99 ± 0.02 | 17.7 ± 2.5 | 0.9996 | 0.8 | |
| 127.5(0), 136(10), 144(20) 152(30), 160(40), 168(50) | 0.988 ± 0.007 | 9.9 ± 1.0 | 0.9999 | 0.18 | |||||||
| KNO3 | 13.3* | 31.7 | 63.9 | 109.9 | 169 | 245.2 | 1.35 ± 0.04 | 19.0 ± 3.4 | 0.998 | 4.5 | *) Незначительное отрицательное отклонение точки r(0) от линии регрессии |
| KClO4 | 0.76 | 1.7 | 3.6 | 7.2 | 13.4 | 22.2 | 1.62 ± 0.06 | 1.0 ± 0.4 | 0.9997 | 0.6 | То же |
| KMnO4 | 2.8 | 6.4 | 12.6 | 22.4 | – | – | 1.63 ± 0.04 | 2.0 ± 0.3 | 0.9997 | 0.3 | |
| K2SO4 | 7.3 | 11.1 | 14.8 | 18.2 | 21.3 | 24.1 | 0.926 ± 0.008 | 4.4 ± 0.1 | 0.9998 | 0.09 | |
| NaCl | – | 35.9 | 36.4 | 37.1 | 38.1 | 39.2 | 1.28 ± 0.06 | –9.3 ± 2.2 | 0.997 | 0.1 | |
| r(T): 35.7(0)*, 35.8(10), 36(20), 36.3(30), 36.6(40), 37(50) | 1.22 ± 0.06 | –7.6 ± 2.1 | 0.997 | 0.04 | *) Незначительные отрицательные отклонения точек r(0), w(0) и w(10) от линии регрессии. Образует дигидрат, CAS № 23724-87-0. **) Значение w(110) вычислено экстраполяцией | ||||||
| w(T): 26.27(0)*, 26.30(10)*, 26.38(20), 26.50(30), 26.65(40), 26.83(50), 27.04(60), 27.27(70), 27.52(80), 27.80(90), 28.08(100), 28.37(110)** | 1.09 ± 0.01 | –2.1 ± 0.3 | 0.9996 | 0.02 | |||||||
| Na2Cr2O7 ⋅ 3H2O | w(T): 62.1(0), 63.1(10), 64.4(20), 65.2(30), 68.0(40), 70.1(50), 72.3(60), 74.6(70), 77.0(80), 79.6(90), 80.7(100) | 1.11 ± 0.02 | –6.2 ± 1.4 | 0.999 | 0.29 | ||||||
| Na2S2O5 | w(T): 38.4(10), 39.5(20), 40.6(30), 41.8(40), 43.0(50), 44.2(60), 45.5(70), 46.8(80), 48.1(90), 49.5(100) | 1.03 ± 0.03 | –0.01 ± 0.14 | 0.99996 | 0.03 | Возможен гидролиз | |||||
| NaHCO3 | 6.89 | 9.6 | 12.7 | 16 | 19.7 | 23.6 | 1.092 ± 0.008 | 2.1 ± 0.1 | 0.99992 | 0.08 | |
| 6.9(0), 8.15(10), 9.6(20), 11.1(30), 12.7(40), 14.45(50) | 1.079 ± 0.010 | 0.75 ± 0.09 | 0.9998 | 0.04 | |||||||
| NaNO2 | 73 | 84.5 | 95.7 | 112.3 | 135.5 | 163 | 1.29 ± 0.04 | –10.7 ± 3.9 | 0.998 | 1.8 | Образует гидрат (PubChem) |
| Na3PO4 ⋅ 12H2O | w(T): 4.28(0), 7.3(10), 10.8(20), 14.1(30), 16.6(40), 22.9(50), 28.4(60), 32.4(70), 37.6(80), 40.4(90), 43.5(100) | 1.02 ± 0.03 | 3.3 ± 0.7 | 0.997 | 1.1 | Отклонения значений w в диапазоне 40 ≤ Т ≤ 60°С от линии регрессии | |||||
| Na2B4O7 | 1.2 | 2.7 | 6 | 20.3 | 31.5 | 52.5 | 1.60 ± 0.07 | 0.85 ± 1.2 | 0.998 | 1.7 | |
| AgNO3 | 122 | 219.2 | 334.8 | 471 | 652 | 912 | 1.30 ± 0.03 | 48 ± 14 | 0.998 | 14.4 | |
| Ag2SO4 | 0.57 | 0.79 | 0.98 | 1.15 | 1.32 | 1.5 | 0.94 ± 0.02 | 0.24 ± 0.02 | 0.998 | 0.01 | |
| SrCl2 ⋅ 6H2O | 44.1 | 53.9 | 66.6 | 85.2 | – | – | 1.39 ± 0.05 | –8.0 ± 2.6 | 0.9994 | 0.8 | |
| Sr(OH)2 ⋅ 8H2 O | 0.35 | 0.7 | 1.5 | 3.1 | 7 | –* | 2.29 ± 0.07 | –0.15 ± 0.12 | 0.9991 | 0.14 | *) Аномально большое значение r(T = 100) = 24.2 исключено |
| Tl(I)NO3 | 3.81 | 9.5 | 20.9 | 46.2 | 111 | –* | 2.42 ± 0.08 | –2.0 ± 2.0 | 0.998 | 2.6 | *) Аномально большое значение r(T = 100) = 413 исключено Образование гидратов известно для Tl(III)(NO3)3 |
Примечание: *) значение коэффициента b < 0 (уравнение 5) выявлено всего для двух солей, для которых не обнаружены доказательства образования гидратов [NH4NO3 (соль гигроскопична) и NH4NCS].
Таблица 2.
Примеры аномалий рекуррентной аппроксимации растворимости некоторых неорганических солей в воде Сi(Т) рекуррентными уравнениями ri(T + 20) = ari(T) + b (0°С ≤ T ≤ 100°С) и wi(T + 10) = awi(T) + b (0°С ≤ T ≤ 100°С) и их интерпретация
| Соль | Растворимость, ri (г/100 г Н2О) [8] или wi (% масс.) [3] при температуре (T, °С) | Параметры уравнений C(T + ΔТ) = aC(T) + b | Комментарии | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 0 | 20 | 40 | 60 | 80 | 100 | a | b | R | S0 | ||
| NH4HCO3 | 11.9 | 21.2 | 36.6 | 59.2 | 109.2* | 355* | 1.53 ± 0.05 | 3.4 ± 1.3 | 0.9994 | 0.9 | *) Значения r(80) и r(100) завышены (разложение при нагревании). Параметры уравнения вычислены для диапазона 0 ≤ Т ≤ 60°С |
| SbCl3 | 601.6 | 931.5 | 1368 | 4531 | – | – | – | – | – | – | Нелинейная (вогнутая) зависимость; гидролиз хлорида при нагревании |
| 3CdSO4 ⋅ 8H2O | w(T): 43.1(0), 43.1(10), 43.2(20), 43.6(30), 44.1(40), 43.5(50), 42.5(60), 41.4(70), 40.1(80), 38.5(90), 36.7(100) | 1.20 ± 0.03 | –9.8 ± 1.3 | 0.998 | 0.14 (б) | Значения r(0 ≤ T ≤ 40) не соответствуют линейной зависимости; образование гидратов разного состава (рис. 2) | |||||
| FeSO4 ⋅ 7H2O | w(T): 13.5(0), 17.0(10), 20.8(20), 24.8(30), 28.8(40), 32.8(50), 35.5(60), 33.6(70), 30.4(80), 27.1(90), 24.0(100) | 1.03 ± 0.01 | 3.2 ± 0.2 | 0.9998 | 0.13 (а) | Два прямолинейных участка в диапазонах температур 0–60°С (а) и 70–100°С (б). Изменение состава гидратов в диапазоне 60 ≤ Т ≤ 70°С (рис. 3). Образует несколько гидратов | |||||
| 0.98 ± 0.03 | –2.7 ± 0.8 | 0.9996 | 0.12 (б) | ||||||||
| LiBr | w(T): 58.4(0), 60.1(10), 62.7(20), 65.9(30), 67.8(40), 68.3(50), 69.0(60), 69.8(70), 70.7(80), 71.7(90), 72.8(100) | 1.34 ± 0.08 | –18 ± 4.9 | 0.998 | 0.25 (а) | “Перегиб” на графике зависимости (6) в диапазоне 30 ≤ Т ≤ 40°С; изменение состава гидратов (рис. 4). Образует несколько гидратов, в том числе моно- (CAS № 95017-82-9), ди- ([3]) и с неопределенным числом молекул кристаллизационной воды (CAS № 23303-71-1) | |||||
| 1.14 ± 0.02 | –9.0 ± 1.2 | 0.9995 | 0.06 (б) | ||||||||
| MgSO4 ⋅ 7H2O | w(T): 18.2(0), 21.7(10), 25.1(20), 28.2(30), 30.9(40), 33.4(50), 35.6(60), 36.9(70), 35.9(80), 34.7(90), 33.3(100) | 0.911 ± 0.008 | 5.2 ± 0.2 | 0.9998 | 0.10 (а) | Два прямолинейных участка в диапазонах температур 0–60°С (а) и 70–100°С (б). Изменение состава гидратов в диапазоне 50 ≤ Т ≤ 70°С (рис. 5) | |||||
| 1.181 ± 0.009 | –7.7 ± 0.3 | 0.9997 | 0.01 (б) | ||||||||
| MnSO4 ⋅ H2O | w(T): 34.6(0), 37.3(10), 38.6(20), 38.9(30), 37.7(40), 36.3(50). 34.6(60), 32.8(70), 30.8(80). 28.8(90), 26.7(100) | 0.48 | 20.6 | 1.000 | – (а) | Два прямолинейных участка в диапазонах температур 0–20°С (а) и 30–100°С (б). Изменение состава гидрата в диапазоне 20 ≤ Т ≤ 30°С (рис. 6). Данные из разных источников отличаются | |||||
| 1.08 ± 0.01 | –4.2 ± 0.5 | 0.9996 | 0.10 (б) | ||||||||
| K2Cr2O7 | 4.7 | 12.5 | 26.3 | 45.6 | 73 | 103 | 1.27 ± 0.06 | 12.0 ± 2.7 | 0.997 | 2.7 | Нелинейная (выпуклая) зависимость; изменение состава гидратов |
| NaBr | r(T): 80.2(0), 85.2(10), 90.8(20), 98.4(30), 107(40), – (50), 118(60)*, – (70), 120(80)*, 121(90)*, 121(100)* | 1.21 ± 0.03 | –12.0 ± 2.8 | 0.9993 | 0.4 | *) Значения r(T > 50°C) не соответствуют рекуррентной зависимости при Т < 50°C. При Т < 50.4°С образует дигидрат (CAS № 13466-08-5) (рис. 7) | |||||
| Na2CO3 ⋅ 10H2O | w(T): 6.44(0), 10.8(10), 17.9(20), 28.7(30), 32.8(40), 32.2(50), 31.7(60), 31.3(70), 31.1(80), 30.9(90), 30.9(100) | 1.56 ± 0.03 | 0.88 ± 0.36 | 0.9998 | 0.2 (а) | Два прямолинейных участка в диапазонах температур 0–20°С (а) и 40–100°С (б). Изменение состава гидратов в диапазоне 20 ≤ Т ≤ 40°С (рис. 8). Образует моногидрат (CAS № 5968-11-6), декагидрат (CAS № 24551-51-7) и другие | |||||
| 0.70 ± 0.04 | 9.0 ± 1.4 | 0.992 | 0.07 (б) | ||||||||
| Na4P2O7 ⋅ 10Н2О | w(T): 2.23(0), 3.28(10), 4.81(20), 7.0(30), 10.1(40), 14.38(50), 20.07(60), 27.31(70), 36.03(80), 32.37(90)*, 30.67(100) | 1.31 ± 0.02 | 0.76 ± 0.23 | 0.9995 | 0.4 | **) Значения w(90) и w(100) не соответствуют линии регрессии (изменение состава гидратов) | |||||
| AgF | 85.8 | 119.8 | 172* | 190 | 202 | 214.7 | 0.81 ± 0.01 | 50.6 ± 3.0 | 0.9995 | 1.6 | *) Аномальное значение 172 исключено; объединены данные из разных источников |
| Sr(NO3)2 | w(T): 28.2(0), 34.6(10), 41.0(20), 47.0(30), 47.4(40), 47.9(50), 48.4(60), 48.9(70), 49.5(80), 50.1(90), 50.7(100) | 0.97 ± 0.02 | 7.3 ± 0.6 | 0.9998 | 0.16 (а) | Два прямолинейных участка в диапазонах температур 0–20°С (а) и 30–100°С (б). Изменение состава гидратов или гидролиз в диапазоне 20 ≤ Т ≤ 30°С (рис. 9). Образует продукт гидролиза Sr(OH)NO3 ⋅ H2O и гидрат Sr(NO3)2 ⋅ 4H2O ([3]) | |||||
| 1.06 ± 0.01 | 2.4 ± 0.6 | 0.9996 | 0.04 (б) | ||||||||
Статистическую обработку данных, вычисление коэффициентов рекуррентных регрессионных уравнений и построение графиков зависимостей проводили с использованием ПО Excel (Microsoft Office 2010) и Origin (версии 4.1 и 8.1).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Результаты аппроксимации температурной зависимости растворимости выбранных для рассмотрения неорганических солей в воде Сi(Т) рекуррентными уравнениями вида (6) ri(T + 20) = = ari(T) + b (0°С ≤ T ≤ 100°С) и wi(T + 10) = = awi(T) + b (0°С ≤ T ≤ 100°С) разделены на две таблицы. В первой из них (табл. 1) представлены данные для 71 соединения, аппроксимация данных для которых не имеет каких-либо существенных аномалий. Кроме неорганических солей в таблицах приведены данные для соли органической кислоты (ацетат калия), гидроксида калия, двух оксидов (B2O3 и CrO3) (табл. 1) и хлорида сурьмы (табл. 2). Все представленные в таблицах соединения охарактеризованы коэффициентами а и b рекуррентных уравнений (6) с соответствующими стандартными отклонениями sa и sb, коэффициентами корреляции R и значениями генеральной дисперсии S0, то есть “стандартным” набором параметров линейных регрессий. Только в двух случаях из 71 (табл. 1) значения коэффициентов корреляции зависимостей (6) меньше 0.998 (равны 0.997). Оба случая относятся к гидратам с аномально высоким содержанием воды [Al2(SO4)3 ⋅ 18H2O и Na3PO4 ⋅ 10H2O], когда даже незначительные вариации стехиометрии приводят к заметным вариациям значений Сi(Т), ухудшающим линейность зависимостей (6). Во вторую таблицу (табл. 2) включены 13 примеров, иллюстрирующих типичные аномалии рекуррентной аппроксимации температурной зависимости растворимости, прежде всего – ее нелинейность. Бóльшая часть таких аномалий специально прокомментирована в табл. 2 и проиллюстрирована графиками на рис. 2–9. Как отмечено выше, возможности рекуррентных уравнений позволяют аппроксимировать данные по растворимости, выраженные в любой шкале без их приведения к какой-либо единой форме. Вследствие этого, в табл. 1 и 2 как эквивалентные объединены данные, представленные как в виде масс растворенных веществ на 100 г воды (ri), так и в форме их массовых долей (wi, %).
Рис. 1.
График рекуррентной зависимости (6) для CrO3; Незначительное отрицательное отклонение точки при температуре Т = 0°С от линии регрессии типично для многих солей (см. обсуждение в тексте).
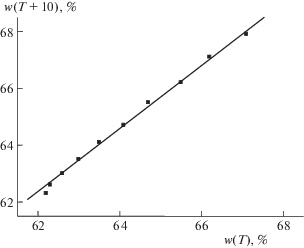
Рис. 2.
График рекуррентной зависимости (6) для 3CdSO4 ⋅ 8H2O; перегиб в диапазоне Т ≥ 50°С соответствует изменению состава гидратов. Параметры уравнения линейной регрессии для линейного участка приведены в табл. 2.
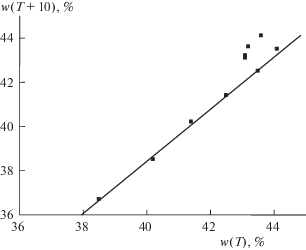
Рис. 3.
График рекуррентной зависимости (6) для FeSO4 ⋅ 7H2O; перегиб в диапазоне 60 ≤ Т ≤ 70°С соответствует изменению состава гидратов. Параметры уравнений линейной регрессии для двух линейных участков приведены в табл. 2.
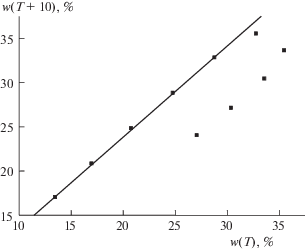
Рис. 4.
График рекуррентной зависимости (6) для LiBr; перегиб в диапазоне 30 ≤ Т ≤ 40°С соответствует изменению состава гидратов. Параметры уравнений линейной регрессии для двух линейных участков приведены в табл. 2.

Рис. 5.
График рекуррентной зависимости (6) для MgSO4 ⋅ 7H2O; перегиб в диапазоне 60 ≤ Т ≤ 70°С соответствует изменению состава гидратов. Параметры уравнений линейной регрессии для двух линейных участков приведены в табл. 2.
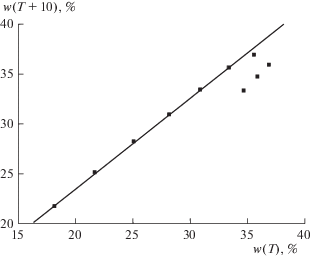
Рис. 6.
График рекуррентной зависимости (6) для MnSO4 ⋅ H2O; перегиб в диапазоне 20 ≤ Т ≤ 30°С соответствует изменению состава гидратов. Параметры уравнений линейной регрессии для двух линейных участков приведены в табл. 2.
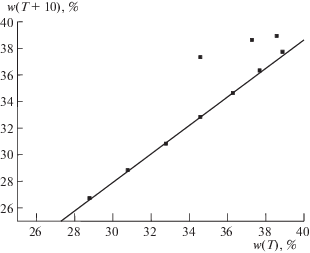
Рис. 7.
График рекуррентной зависимости (6) для системы NaBr ⋅ 2H2O $ \rightleftarrows $ NaBr; перегиб в диапазоне Т = = 50°С соответствует потере гидратной воды. Параметры уравнений линейной регрессии для двух линейных участков приведены в табл. 2.
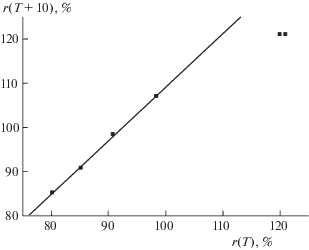
Рис. 8.
График рекуррентной зависимости (6) для системы Na2CO3 ⋅ 10H2O $ \rightleftarrows $ Na2CO3; перегиб в диапазоне 20 ≤ Т ≤ 40°С соответствует потере гидратной воды. Параметры уравнения линейной регрессии для двух линейных участков приведены в табл. 2.
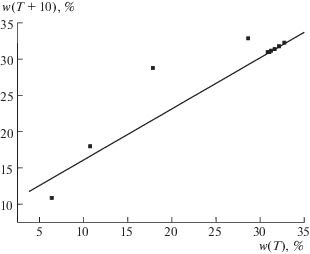
Рис. 9.
График рекуррентной зависимости (6) для Sr(NO3)2; перегиб в диапазоне 20 ≤ Т ≤ 30°С соответствует изменению состава гидрата и/или гидролизу соли. Параметры уравнений линейной регрессии для двух линейных участков приведены в табл. 2.
На графиках “обычных” функций y = f(x) каждая точка соответствует одному значению аргумента и одному значению функции, тогда как на графиках рекуррентных зависимостей – двум значениям функции; значения аргумента на них не представлены. По этой причине минимальное количество значений Сi(Т) для рекуррентной аппроксимации не может быть менее трех, а для реализации метода наименьших квадратов с оценкой погрешностей параметров уравнения линейной регрессии – не менее четырех. По этой причине наборы справочных данных [3, 10], содержащие менее четырех значений, не включены в табл. 1 и 2. Важно заметить, что если рекуррентная аппроксимация зависимости Сi(Т) не имеет аномалий, то пяти значений в интервале температур 0°С ≤ T ≤ 100°С с шагом 20°С вполне достаточно для подтверждения их отсутствия. Если же задачей является выявление аномалий, то наборы 11 значений wi в интервале температур 0°С ≤ T ≤ 100°С, с шагом 10°С предпочтительнее. Использование бóльших шагов температуры ΔТ может сопровождаться искажениями результатов и получаемых на их основании выводов.
Поскольку данные табл. 1 не имеют существенных аномалий, то 44 из 71 представленных в ней соединений не требуют никаких комментариев (последний столбец таблицы); зависимости Сi(Т) для них линейны в диапазонах температур 0°С ≤ T ≤ 100°С. Один пример в табл. 1 (NaCl) иллюстрирован данными в двух шкалах ri(T) и wi(T) для подтверждения их эквивалентности. Напротив, в табл. 2 специальные комментарии приведены для каждого из 13 объектов.
Как отмечено во Введении, зависимости растворимости бóльшей части солей от температуры Сi(T) в диапазоне 0–100°С чаще всего являются монотонными, возрастающими и нелинейными. Известны примеры солей, характеризующихся убывающими зависимостями Сi(T), например Li2SO4 ⋅ H2O (табл. 1) или Na2CO3 ⋅ H2O при T > > 35.4°C (табл. 2). Подобное изменение знака первой производной dCi/dT не предполагает какие-либо ограничения в применении рекуррентных соотношений. Более того, вид графиков при этом не изменяется. Из других незначительных поправок в массивах исходных данных можно отметить исключение аномально больших значений ri для двух солей [Sr(OH)2 ⋅ 8H2O и Tl(I)NO3] при температуре 100°С, что может быть обусловлено изменением состава гидратов. Для нитрата одновалентного таллия сведений об образовании гидрата найти не удалось, но нитрат таллия(III) образует тригидрат Tl(NO3)3 ⋅ 3H2O, подтверждением чего служит CAS № 13453-38-8 этой соли. Для нескольких солей отмечены незначительные отклонения рекуррентных зависимостей от линейности в некоторых интервалах температур, в том числе LiI (LiI ⋅ 3H2O) в области 70–80°С, Mg(NO3)2 ⋅ 6H2O в области 80–90°С и Na3PO4 ⋅ ⋅ 12H2O в области 40–60°С. Все эти соли представляют собой гидраты, так что такие отклонения также вполне могут быть обусловлены изменением их состава при разных температурах водных растворов.
Уникальные возможности рекуррентных зависимостей связаны и с тем, что на их графиках каждая точка соответствует двум значениям функции. Это позволяет эффективно выявлять выбросы в наборах экспериментальных данных Ci(T). Если на таких графиках обнаруживаются пары соседних точек, отклоняющихся от линий регрессии в разные стороны, то с высокой степенью вероятности это обусловлено единичными ошибочными значениями Ci(T), которые таким образом легко могут быть обнаружены и скорректированы (критерий – достижение максимального значения коэффициента корреляции R). Для представленных в табл. 1 данных такая операция была проделана дважды: для NH4NO3 (значение ri 610 при 80°С заменено значением 645) и HgBr2 (значение 1.7 при 60°С заменено значением 1.65). Кроме этого, в наборе значений ri(T) для MgCl2 ⋅ ⋅ 4H2O присутствовала величина r = 106 (Т = = 58.1°С) [10], которую нельзя использовать, так как она не соответствует условию ΔT = 20°С. Однако значение ri(T = 60) можно оценить с применением рекуррентного уравнения (6) по данным для трех меньших температур, что дает незначительно бóльшую величину r = 111.5 (Т = 60), пригодную для дальнейших вычислений.
Одной из наиболее часто встречающихся аномалий неорганических солей, выявляемых на основании рекуррентных соотношений, являются незначительные отклонения точки С(Т = 0°С) от линии регрессии. На рис. 1 эта аномалия проиллюстрирована на примере триоксида хрома. Ее причинами, скорее всего, являются общие особенности экспериментального определения растворимости солей при температуре 0°С. Такие же аномалии наблюдаются для CsNO3, LiOH ⋅ H2O, KNO3, KClO4, NaCl (отмечено в табл. 1) и других солей, не включенных в эту таблицу.
Комментарии к рекуррентной аппроксимации температурной растворимости некоторых солей [в том числе KAl(SO4)2 ⋅ 12H2O, Al2(SO4)3 ⋅ 18H2O, K2[PtCl6] (табл. 1) и K2Cr2O7 (табл. 2)] содержат указание на некоторую ее нелинейность (выпуклые функции, d2C/dT2 > 0), которая настолько незначительна, что заметно не сказывается на уменьшении коэффициентов корреляции R. Для первых двух солей это, как отмечено выше, может быть обусловлено изменением состава гидратов. Примером вогнутой рекуррентной аппроксимации (d2C/dT2 < 0) является трихлорид сурьмы (табл. 2), для которого весьма вероятен гидролиз в водных растворах при повышении температуры. Дополнительные комментарии данных табл. 1 включают указания на образование гидратов, даже если эта информация отсутствует в массиве исходных данных [10].
При необходимости использования результатов рекуррентной аппроксимации для вычисления растворимости при любых, а не только для эквидистантных значений температуры можно рекомендовать следующий способ [15]. Преобразование полинома (5) для первого числа в аппроксимируемой серии данных A(1) дает значение коэффициента k:
подстановка которого в выражение (5) при z = T1 – ‒ (T – T1)/ΔT позволяет вычислять значения A(z) при любых значениях z.Аномалии рекуррентной аппроксимации температурной зависимости растворимости неорганических солей. Как можно заключить из предыдущего раздела, даже незначительные аномалии рекуррентной аппроксимации данных по температурной зависимости растворимости неорганических солей чаще всего связаны с изменением состава их гидратов в водных растворах. Следовательно, именно рекуррентные зависимости можно рассматривать как простой и наглядный способ выявления подобных эффектов. Таблица 2 объединяет 13 солей, для которых эта причина приводит к более ярко выраженным аномалиям рекуррентных зависимостей. Некоторые из других причин достаточно очевидны, например разложение гидрокарбоната аммония при нагревании [16], что проявляется в существенно бóльших значениях r(80) и r(100) по сравнению с r(0 ≤ T ≤ 60), что невозможно описать одним рекуррентным уравнением. Изменение состава гидратов для некоторых солей приводит к появлению точек перегиба на графиках зависимостей Ci(T) и изменению знака производных dC/dT, например, для Na2CO3 ⋅ 10H2O и Na3PO4 ⋅ ⋅ 10H2O. Если каждой из различных гидратированных форм соответствует несколько (более трех) значений Ci(T), то на графиках рекуррентных зависимостей могут наблюдаться два прямолинейных участка, что можно рассматривать как легко визуально воспринимаемое доказательство существования различных гидратов. Именно такие примеры проиллюстрированы рисунками для следующих солей: 3CdSO4 ⋅ 8H2O (рис. 2), FeSO4 ⋅ ⋅ 7H2O (рис. 3), LiBr ⋅ 2H2O (рис. 4), MgSO4 ⋅ 7H2O (рис. 5), MnSO4 ⋅ H2O (рис. 6), NaBr (рис. 7), Na2CO3 ⋅ 10H2O (рис. 8) и Sr(NO3)2 (рис. 9).
Для шести из этих солей два прямолинейных участка на графиках рекуррентных зависимостей прослеживаются настолько отчетливо, что для них в табл. 2 приведены по два рекуррентных уравнения, соответствующих каждому из этих участков: [FeSO4 ⋅ 7H2O (рис. 3), LiBr ⋅ 2H2O (рис. 4), MgSO4 ⋅ 7H2O (рис. 5), MnSO4 ⋅ H2O (рис. 6), Na2CO3 ⋅ 10H2O (рис. 8) и Sr(NO3)2 (рис. 9)]. На всех рисунках изображена только одна прямая линия, соответствующая фрагменту, содержащему наибольшее количество точек. Каждый из этих участков соответствует какой-либо гидратной форме, превращающейся в другую при некоторых температурах водных растворов. Температурные интервалы таких превращений указаны в табл. 2 и в подписях к рис. 2–9.
Для такой соли как 3CdSO4 ⋅ 8H2O (рис. 2) на графике рекуррентной аппроксимации температурной зависимости растворимости отчетливо выражен только один линейный участок в области T ≥ 50°C. Количество данных для меньших температур недостаточно для выявления какой-либо зависимости и они группируются в виде некоторого “роя” точек в правой верхней части графика. Аналогичная ситуация наблюдается для NaBr (рис. 7): линейный участок рекуррентной зависимости выявляется только в диапазоне температур 0 ≤ Т ≤ 40°С, тогда как данные для бóльших температур (табл. 2) позволяют лишь отметить их отклонения от линии регрессии, обусловленные потерей гидратной воды в области температур выше ∼50°С.
Общие закономерности рекуррентной аппроксимации температурной зависимости растворимости неорганических солей. Важнейшей особенностью рекуррентной аппроксимации различных физико-химических свойств органических соединений в пределах гомологических рядов представляются настолько близкие значения коэффициентов уравнений вида (3), что единые уравнения такого вида можно применять к любым гомологическим рядам с одной и той же гомологической разностью (СН2, CF2 и другие) [11, 12]. Для неорганических солей подобная степень общности рекуррентных соотношений недостижима, так как они отличаются как катионами, так и анионами и, дополнительно, еще и числом молекул гидратной воды. Тем не менее, некоторые важные выводы можно сделать и в этом случае.
Совместное рассмотрение данных табл. 1 и 2 позволяет выявить диапазоны вариаций коэффициентов а и b (92 пары значений) рекуррентных соотношений (6). Значения коэффициентов а варьируют в диапазоне от менее 0.7 до более 2.0, но бóльшая их часть локализована в диапазоне 0.9 ≤ ≤ а < 1.4 (68 из 92 значений, 74% от их общего числа). Примечательно, что почти все аномально малые и большие значения коэффициента а принадлежат гидратам: MgSO4 ⋅ H2O (a = 0.48), KAl(SO4)2 ⋅ 12H2O (2.16), Sr(OH)2 ⋅ 8H2O (2.29), Ba(OH)2 ⋅ 8H2O (2.63) и TlNO3 (2.42). Аналогичным образом можно охарактеризовать распределение значений коэффициентов b, которые варьируют в диапазоне от менее –40 до более +40, но основная их часть попадает в диапазон от –20 до +20 (84 из 92 значений, что составляет 91% их общего числа).
Важнейшую особенность коэффициентов b рекуррентной аппроксимации температурной зависимости растворимости неорганических солей в воде (уравнение 5) необходимо подчеркнуть специально. По объединенным данным табл. 1 и 2 значениями b < 0 характеризуются 33 соединения. При этом бóльшая часть отрицательных значений коэффициентов b принадлежит солям, которые существуют в виде гидратов или образуют гидраты в водных растворах (28 соединений). Еще для двух соединений (CrO3 и Na2S2O5) весьма вероятно их взаимодействие с водой (гидролиз). Для двух солей (NH4NO3 и NH4NCS) сведений об образовании гидратов найти не удалось, однако для первой из них отмечена гигроскопичность. У такой соли как TlNO3 образование гидратов не очевидно, но исключать его нельзя. Следовательно, итоговая эффективность предложенного критерия предсказания существования гидратных форм неорганических солей в водных растворах весьма высока и составляет не менее 30/33 ≈ 91%.
Выявленная закономерность представляется достаточно интересной и заслуживает формулировки в виде некоторого правила: отрицательные значения коэффициентов b рекуррентной аппроксимации температурной зависимости растворимости неорганических солей в воде характеризуют только соли, существующие в водных растворах в виде гидратов или способные к их образованию.
Столь неожиданная закономерность требует дополнительных комментариев. Прежде всего, существование такой закономерности не запрещает существование гидратов, для которых b > 0. По данным табл. 1 и 2 таких солей выявлено 13, но для девяти из них значения коэффициента удовлетворяют неравенству b < 3. Только для четырех образующих гидраты солей b ≥ 3: (NH4)2Fe(SO4)2 ⋅ ⋅ 6H2O (b = 4.4), BaCl2 ⋅ 8H2O (3.0), K4Fe(CN)6 ⋅ ⋅ 3H2O (13.9) и Na3PO4 ⋅ 12H2O (3.3). Если так, то в качестве граничного значения коэффициента b для классификации “гидрат – не гидрат” можно было бы принять величину b = 3, но это привело бы к увеличению числа ошибок II-го рода за счет ошибочного отнесения некоторых безводных солей к гидратам, вследствие чего условие b < 0 оставлено без изменения.
Кроме того, при формулировке столь общего правила было необходимо уточнить информацию об образовании различными солями гидратов, не указанных в использованных сводках справочных данных [3, 10]. Прежде всего, подтверждением существования гидратов можно считать присвоенные им номера CAS (приведены в столбце “Комментарии” в табл. 1 и 2). Только недавно было показано, что образование различных гидратов характерно для большинства галогенидов лития [17]. Например бромид лития (CAS № 7550-35-8) образует моногидрат (CAS №№ 85017-82-9 и 23303-71-1), а также ди-, три- и пентагидраты. По данным сайта PubChem гидраты образуют такие соли как (NH4)2SO4, HgBr2 и NaCl. Образование дигидрата хлорида натрия установлено в многочисленных независимых работах [18–20]. Для HgCl2 возможность образования гидратов подтверждена теоретическими расчетами методом Монте-Карло [21]. Для нитрата магния [10] кроме гексагидрата известны ди- и нонагидраты, а для ацетата калия (CAS № 127-08-2) кроме моногидрата (CAS № 254966-93-3) еще и тригидрат. Карбонат натрия Na2CO3 (CAS № 497-19-8) образует несколько гидратов: дека- (CAS № 24551-51-7, устойчив при температурах от –2.1 до 32°С), гепта- (устойчив в узкой области от 32 до 35.4°С) и моногидрат (CAS № 5968-11-6) устойчив при Т > > 35.4°С [22]. Нитрат стронция кроме гидрата образует продукт гидролиза SrNO3(OH) [23]. Перечисленная информация полностью согласуется со сформулированным выше выводом, что значения коэффициентов b рекуррентной аппроксимации температурной зависимости растворимости неорганических солей в воде удовлетворяют условию b < 0 в тех случаях, если эти соли существуют в растворах в виде гидратов.
Интерпретация отрицательных значений коэффициентов b рекуррентной аппроксимации температурной зависимости растворимости гидратов. Выявленная необычная закономерность значений коэффициентов b рекуррентной аппроксимации C(T), несомненно, заслуживает интерпретации. Учитывая разнородную химическую природу гидратов, для которых выявлены значения b < 0, можно полагать, что этот эффект определяется не столько составом солей, сколько уникальными математическими свойствами рекуррентных соотношений. Для подтверждения такого предположения наиболее эффективным представляется, как и в работах [12, 24], использование простейшего численного эксперимента.
Для его реализации необходимо выбрать некоторую числовую последовательность и аппроксимировать ее рекуррентным соотношением (3), например, последовательность чисел Фибоначчи F(n):
Для решения рассматриваемой задачи вполне можно ограничиться последовательностью всего девяти значений F(n), причем с отбрасыванием первых двух, закономерно характеризующихся наибольшими отклонениями от рекуррентной аппроксимации, т.е. набором чисел 2, 3, 5, 8, 13, 21 и 34. Далее необходимо проследить влияние простейших арифметических преобразований этого набора чисел на коэффициенты a и b рекуррентной зависимости (3). Минимальный набор таких преобразований включает прибавление постоянной величины к исходным числам (+2), вычитание постоянной величины (–2) и умножение на постоянный сомножитель (×2). Результаты такого тестирования представлены в табл. 3.
Таблица 3.
Результаты выявления влияния арифметических преобразований набора чисел Фибоначчи на коэффициенты его рекуррентной аппроксимации (3)
| Операция с исходным набором чисел Фибоначчи F(3)–F(9) | Набор чисел | Параметры рекуррентной зависимости (3) | |||
|---|---|---|---|---|---|
| a ± sa | b ± sb | R | S0 | ||
| нет | 2, 3, 5, 8, 13, 21, 34 | 1.622 ± 0.009 | –0.1 ± 0.1 | 0.99994 | 0.14 |
| –2 | 0, 1, 3, 6, 11, 19, 22 | 1.622 ± 0.009 | 1.2 ± 0.1 | 0.99994 | 0.14 |
| +2 | 4, 5, 7, 10, 15, 23, 36 | 1.622 ± 0.009 | –1.3 ± 0.1 | 0.99994 | 0.14 |
| ×2 | 4, 6, 10, 16, 26, 42, 68 | 1.622 ± 0.009 | –0.1 ± 0.2 | 0.99994 | 0.28 |
Из данных табл. 3 следует, что любые арифметические преобразования исходного набора чисел Фибоначчи F(3)–F(9) закономерно не влияют на значения коэффициентов а и коэффициентов корреляции R. Умножение всех чисел на постоянную величину проявляется в некотором увеличении генеральной дисперсии S0 и стандартного отклонения коэффициента b (sb). Значение самого коэффициента b для исходного набора чисел равно –0.1 ± 0.1; уменьшение всех чисел на постоянную величину (–2) приводит к увеличению коэффициента b до 1.2 ± 0.2, а их увеличение на +2 – к его уменьшению до –1.3 ± 0.1. Все остальные параметры рекуррентной регрессии при этом сохраняются постоянными. Таким образом, причиной появления отрицательных значений коэффициентов b (а в общем случае – их уменьшения) является сохранение закона формирования числовой последовательности, но увеличение образующих ее чисел на постоянную или приблизительно постоянную величину.
Такое заключение легко интерпретируемо применительно к параметрам рекуррентной аппроксимации температурной зависимости растворимости неорганических солей в воде. Можно полагать, что растворимость гидратов в целом выше, чем растворимость солей, не образующих гидратов в водных растворах. Иными словами, их растворимость при низких температурах сопоставима с вариациями растворимости при ее повышении. Это положение легко проиллюстрировать данными табл. 1 и 2, но можно ограничиться только одним примером. Отношение растворимостей нитрата магния при 100 и 0°С составляет ∼1.9 [образует гидрат Mg(NO3)2 ⋅ 6H2O], а для нитрата цезия (гидрат не образует) – ∼21, т.е. на порядок больше.
Таким образом, показана эффективность аппроксимации данных по температурной зависимости растворимости неорганических солей в воде (С) с использованием рекуррентных уравнений первого порядка вида С(Т + ΔТ) = аС(Т) + b, где ΔТ – постоянный шаг изменения температуры (чаще всего 10 или 20°С) , а и b – коэффициенты, вычисляемые методом наименьших квадратов, интервал вариаций Т, как правило, составляет от 0 до 100°С. Линейность рекуррентных зависимостей подтверждает отсутствие превращений растворенных веществ в водных растворах. Появление аномалий рекуррентных зависимостей следует рассматривать как эффективный и наглядный признак изменения состава гидратов, их образования или деструкции и, следовательно, может быть рекомендовано как способ выявления таких эффектов. В частности, формирование на графиках двух “семейств” точек, группирующихся вдоль двух прямых линий, подтверждает существование двух различных гидратных форм одной и той же соли в водных растворах.
Поскольку соли, образованные разными катионами и анионами, не связаны друг с другом какими-либо общими таксономическими признаками (в отличие от гомологических рядов органических соединений), то трудно было ожидать проявления каких-либо закономерностей коэффициентов а и b рекуррентных зависимостей. Тем не менее, удалось выявить интересную закономерность: коэффициенты b рекуррентных соотношений для солей, существующих в виде гидратов или образующих гидраты в водных растворах, удовлетворяют неравенству b < 0. Оценка предсказательных возможностей этой закономерности показывает, что такой критерий корректен не менее, чем в 91% случаев.
Список литературы
Broul M., Nyvlt J., Sohnel O. Solubility in Inorganic Two-Component Systems. Amsterdam: Elsevier, 1981. 574 p.
Patnaic P. Handbook of Inorganic Chemicals. New York: McGraw-Hill, 2003. 1086 p.
Handbook of Chemistry and Physics. Ed. D.R. Lide. Boca Raton, FL: Taylor & Francis, Version 2006. (CD–ROM).
Dean J.A. Lange’s Handbook of Chemistry. 15th Edn. New York: McGraw-Hill, 1999. 1291 p.
IUPAC-NIST Solubility Database, Version 1.1. 2007. srdata.nist.gov/solubility/IUPAC/iupac.aspx (дата обращения: май 2020 г.). https://doi.org/10/18434/T4QC79.
Skerget M., Knez Z., Knez-Hrncic M. // J. Chem. Eng. Data. 2011. V. 56. № 4. P. 694–719. https://doi.org/10.1021/je1011373
Masoodiyeh F., Mozdianfard M.R., Karimi-Sabet J. // J. Chem. Thermodynamics. 2014. V. 78. P. 260–268. https://doi.org/10.1016/j.jct.2014.06.018
Пестова О.Н., Баранаускайте В.Э., Хрипун М.К. // Журн. общ. химии. 2016. Т. 86. № 4. С. 577–580. https://doi.org/19/1134/S1070363216040010.
Filbo O.C., Rasmussen P. // Braz. J. Chem. Eng. 2000. V. 17. № 2. P. 117–1312. https://doi.org/10.1590/S0104-66322000000200001
http://www.chemdat.info/mda/int_en/labtool/table_solina.html Lab Tools – Tables for laboratory use (дата обращения 2016 г.).
Зенкевич И.Г. // Журн. физ. химии. 2008. Т. 82. № 5. С. 807–816. https://doi.org/10.1134.S0036024408050014
Zenkevich I.G. // J. Chemometr. 2010. V. 24. P. 158–167. https://doi.org/10.1002/cem.1297
Zenkevich I.G. // J. Math. Chem. 2009. V. 46. P. 913–933. https://doi.org/10.1007/s10910-009-9559-8
Zenkevich I.G. // J. Chemometr. 2009. V. 23. P. 179–187. https://doi.org/10.1002/cem.1214
Зенкевич И.Г. // Успехи современного естествознания. 2007. № 4. С. 11–16.
Kiyama R., Minomura S. // Rev. Phys. Chem. Japan. 1952. V. 22. № 1. P. 43–45.
Sohr J., Schmidt H., Voigt W. // Acta Cryst. 2018. V. C74. P. 194–202. https://doi.org/10/1107/S2053229618001183
Klewe B., Pedersen B. // Ibid. 1974. V. B30. P. 2363–2371. https://doi.org/10.1107/S0567740874007138
Bode A.A., Pulles P.G.M., Lutz M. et al. // Cryst. Growth Des. 2015. V. 15. № 7. P. 3166–3174. https://doi.org/10.1021/acs.cgd.5b00061
Drebushchak V.A., Drebushchak T.N., Ogienko A.G., Yunoshev A.S. // J. Crystal Growth. 2019. V. 517. № 1. P. 17–23. https://doi.org/10.1016/j.jcrysgro.2019.04.009
Hernandez-Cobos J., Ramirez-Solis A., Maron L., Ortega-Blake I. // J. Chem. Phys. 2012. V. 136. № 1. P 367–378. https://doi.org/10.1063/1.3673780
Hartman M., Trnka O., Vesely V., Svoboda K. // Chem. Eng. Commun. 2001. V. 185. № 1. P. 1–16. https://doi.org/10.1080/00986440108912851
Liu L., Yang Y., Li L., Yang Z., Pan S. // J. Alloys Comp. 2017. V. 695. P. 1719–1724. https://doi.org/10.1016/j.jallcom.2016.11.001
Зенкевич И.Г. // Журн. структур. химии. 2007. Т. 48. № 6. С. 1072–1081. https://doi.org/10.1007/s10947-007-0164-z
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии


