Журнал физической химии, 2021, T. 95, № 7, стр. 1051-1058
Квантово-химические расчеты электронных спектров поглощения некоторых антоцианидинов
В. И. Дейнека a, *, Я. Ю. Кульченко a
a Белгородский государственный национальный исследовательский университет
308015 Белгород, Россия
* E-mail: deineka@bsu.edu.ru
Поступила в редакцию 30.08.2020
После доработки 30.08.2020
Принята к публикации 10.09.2020
Аннотация
С использованием полуэмпирического метода РМ3 выполнены расчеты электронных спектров поглощения окрашенных форм неметилированных антоцианидинов (аурантинидина, пеларгонидина, цианидина и дельфинидина). Показано, что положение максимума полосы поглощения зависит от ориентации гидроксильных групп в структуре агликона, но в целом найденная тенденция к батохромному сдвигу при добавлении ОН-групп в кольцо В соответствует экспериментальным данным. Для незаряженных хиноноидных форм пеларгонидина полученные результаты (гипсохромный сдвиг полос поглощения) не согласуются с господствующим мнением специалистов о батохромном сдвиге в этом случае. И хотя это мнение подтверждено расчетами в рамках теории функционала электронной плотности, надежных экспериментальных данных для оценки справедливости расчетов к настоящему времени нет. При этом образование однократно (отрицательно) заряженных хиноноидных структур однозначно приводит к батохромному сдвигу полос поглощения, что соответствует экспериментальным данным. Показано, что при увеличении кратности заряда (до –2) вновь прогнозируется гипсохромный сдвиг полос поглощения до экспериментально наблюдаемой желтой окраски антоцианов в щелочных растворах.
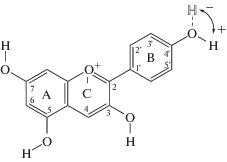
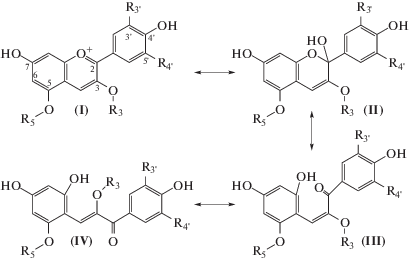
Антоцианы – уникальные соединения обширного класса флавоноидов. Их уникальность в химическом отношении состоит в существовании нескольких рН-зависимых форм [1, 2]. Антоцианы являются гликозидами антоцианидинов. Флавилиевая форма отвечает за окраску плодов, цветков, листьев и других частей растений в красные цвета с зависящими от строения антоцианов оттенками. Но многообразие окраски растительности определяется не только флавилиевой формой, но и сложными супрамолекулярными структурами, которые могут вовлекать и иные формы антоцианов. К настоящему времени известно, что при повышении рН от 1 и менее (условие существования антоцианов и антоцианидинов только во флавилиевой форме I, схема 1), эта форма превращается за счет нуклеофильной атаки молекулой воды в бесцветное псевдооснование (полуацетальная форма II, схема 1). Полуацетальная форма находится в равновесии со слабоокрашенной цис-халконной формой (III, схема 1), которая может изомеризоваться также в слабо окрашенную транс-халконную форму (IV, схема 1).
Схема 1.
Превращения флавилиевой формы по направлению с гидратацией; формы: I – флавилиевая, II – псевдооснование, III – цис-халконная, IV – транс-халконная.
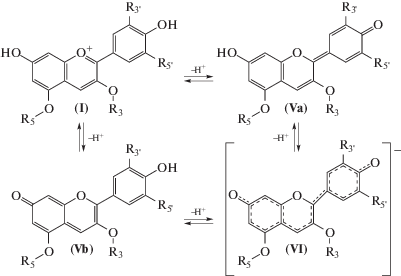
Но возможно и иное направление превращения флавилиевой формы при повышении рН (схема 2) – депротонирование с образованием незаряженных (Va и Vb) хиноноидных структур, число которых зависит от строения (от наличия гликозидных заместителей в положении 5, а иногда и в положении 7) антоцианов. Далее эти структуры могут превращаться в однократно (VI, схема 2) и (для антоцианов с отсутствием гликозидного заместителя в положении 5) двукратно заряженные хиноноидные структуры. Считается, что хиноноидные формы также окрашены, но в иные по сравнению с флавилиевой формой цвета.
Схема 2.
Превращения флавилиевой формы по направлению депротонирования; формы: I – флавилиевая, Va и Vb – хиноноидные незаряженные, VI – заряженная хиноноидная.
Несмотря на то, что известно множество публикаций по исследованию переходов между формами антоцианов и антоцианидинов, электронные спектры этих форм кроме флавилиевой не известны. Считается, что окраска хиноноидных форм смещена в синюю область (с пурпурной окраской относительно флавилиевой формы), а отрицательно заряженная хиноноидная форма обладает синей окраской [1–4]. К сожалению, спектры индивидуальных форм природных антоцианов (кроме флавилиевых) получить невозможно из-за одновременного присутствия многих форм в разных соотношениях и нестабильности нефлавилиевых форм. Нами был предложен способ разделения спектров антоцианов на индивидуальные путем получения разностных спектров [5], но этот подход не имеет строгого обоснования, хотя ВЭЖХ с записью спектра диодно-матричным детектором позволяет избавиться от второй причины – от нестабильности форм. Поэтому большое значение имеет расчет электронных спектров поглощения различных форм антоцианов и антоцианидинов квантово-химическим методом. Известно несколько публикаций применительно к антоцианам и антоцианидинам [6–11] с использованием как методов ab initio (в том числе и в различных вариантах методов в рамках теории функционала электронной плотности), так и полуэмпирических методов. При этом нефлавилиевым формам уделено меньше внимания [9, 11].
Цель настоящей работы – выполнение квантово-химических расчетов электронных спектров поглощения некоторых антоцианидинов во флавилиевой, а также в незаряженных и в заряженных хиноноидных формах. Антоцианидины были выбраны вместо антоцианов как соединения наиболее простые по строению, но с бóльшими возможностями по разнообразию структуры форм.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Полуэмпирические квантово-химические расчеты выполняли в программном пакете HyperChem 8.0. Оптимизацию геометрии проводили полуэмпирическим методом РМ3 [12] в вакууме. Для оптимизации молекулярной геометрии использовали алгоритм Polak-Ribiere с ограничением по градиенту 0.0001 ккал/(Å моль) и по числу циклов (1000). Расчет электронных спектров осуществляли в условиях однократного возбуждения и только для синглетных состояний при конфигурационном взаимодействии при ограничении по энергии (10 эВ) в РМ3 и ZINDO/S.
В работе использовали экспериментальные значения длин волн, полученные для растворителя (метанол – 1% HCl), как в работе [7]: 499 нм – для аурантинидина (3,4',5,6,7-тетрагидроксифлавилия); 520 нм – для пеларгонидина (3,4',5,7-тетрагидроксифлавилия); 535 нм – для цианидина (3,3',4',5,7-пентагидроксифлавилия); 546 нм – для дельфинидина (3,3',4',5,5',7-гексагидроксифлавилия).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Расчеты флавилиевых ионов. При выполнении расчетов было установлено, что результат (значение λmax) зависит от ориентации гидроксильных групп в структуре флавилиевых ионов. В цитированных выше работах на ориентацию этих групп вообще не было обращено внимания, за исключением ориентации ОН-группы в положении 3, в одном из которых нарушается планарность молекулы [7]. Ориентацию ОН-групп в ионе антоцианидина обозначали знаками +, если ОН-группа ориентирована по направлению движения часовой стрелки, и знаком – для групп с противоположной ориентацией (схема 3).
Полученные значения полной энергии частицы, длины волны электронного перехода в спектре поглощения и величины дипольных моментов для иона пеларгонидина – антоцианидина – с наименьшим среди обычных природных антоцианидинов числом гидроксильных групп, представлены в табл. 1.
Таблица 1.
Результаты квантово-химического расчета флавилиевой формы пеларгонидина (Е – энергия частицы, λ – длина волны перехода, μ – дипольный момент частицы)
| Ориентация ОН-групп в положениях | –Е, ккал/моль | λ, нм | μ, D | ||||
|---|---|---|---|---|---|---|---|
| 7 | 5 | 3 | 4' | PM3 | ZINDO/S | ||
| + | + | + | + | 3412.4932 | 485.62 | 468.00 | 1.931 |
| + | + | + | – | 3412.3516 | 486.46 | 468.24 | 1.921 |
| + | – | + | + | 3409.6530 | 491.79 | 472.12 | 2.608 |
| – | + | + | + | 3412.4114 | 486.57 | 468.12 | 4.104 |
| + | – | + | – | 3409.5432 | 492.65 | 472.35 | 0.984 |
| – | + | + | – | 3412.3263 | 487.38 | 468.36 | 3.587 |
| – | – | + | + | 3410.2277 | 493.69 | 472.27 | 0 |
| – | – | + | – | 3410.1749 | 494.55 | 472.50 | 1.398 |
| – | – | – | – | 3410.4853 | 483.22 | 2.506 | |
| – | + | – | – | 3412.3497 | 469.51 | 4.907 | |
Различие между расчетными длинами волн полосы абсорбции (λmax) для различных (кроме ОН-группы в положении 3) ориентаций гидроксильных групп составили ~9 нм (от 485.62 до 494.55 нм). При этом разность в энергиях конформаций составила не более 3.84 ккал/моль, что сопоставимо с энергией теплового движения молекул. Поэтому в качестве ориентировочного параметра можно взять среднее значение λmax = = 489.29 нм. Однако вследствие быстрых (вертикальных) переходов электрона в различных конформациях реальные спектры будут суммой спектров индивидуальных конформаций с весом, определенным, например, при конформационном анализе. Таким образом, полоса в спектре антоцианов или антоцианидинов может быть уширенной и несимметричной даже при наличии только одного разрешенного перехода.
Анализ данных табл. 1 показывает, что значительный вклад в энергию состояния вносит ориентация дипольного момента в положении 5: при направлении + значение λmax = 486.5 ± 0.9 нм, а при противоположном направлении λmax = 493.5 ± ± 1.4 нм. Из двух способов расчета (PM3 и ZINDO/S) первый дает результаты, более близкие к экспериментальному значению (520 нм), поэтому в дальнейшем применяли именно этот метод.
При расчетах были исключены ориентации ОН-группы в положении 3 против часовой стрелки, как приводящие к очень большим стерическим напряжениям в частице и к нарушению планарности. Так, для конформации со всеми отрицательными направлениями ОН-групп (при плоской структуре всех конформаций с положительной ориентацией ОН-группы в положении 3 торсионный угол О1–С2–С1'–С2' возрастает до 45.5°, но уменьшение сопряжения между кольцом В и С почти не влияет на положение λmax. Для ориентации + ОН-группы в положении 5 этот же торсионный угол мало изменяется (до 47°), а λmax гипсохромно сдвигается на ~14 нм (от 483.2° до 469.5°).
Корреляция между λmax и величиной дипольного момента в настоящей работе не обнаружена для частицы в вакууме. Но, вполне вероятно, что этот параметр может иметь значение при сольватохромных эффектах при переходе от вакуума к реальным полярным растворам, при этом расширяется диапазон возможных значений λmax для различных конформаций частицы.
При переходе к цианидину, для которого возможны два типа конформаций с торсионными углами по цепи связей С2–О1–С1'–C2', равными 0° для типа I и 180° для типа II, и к дельфинидину (содержит шесть ОН-групп) число возможных различных ориентаций гидроксид-ионов заметно возрастает, поэтому расчет всех возможных длин волн не производили. Результаты расчетов для некоторых ориентаций ОН-группы для флавилиевой формы цианидина, представлены в табл. 2.
Таблица 2.
Результаты квантово-химического расчета иона цианидина
| Ориентация ОН-групп в положениях | –Е, ккал/моль | λ, нм | μ, D | ||||
|---|---|---|---|---|---|---|---|
| 3 | 5 | 7 | 3' | 4' | |||
| Тип конформаций I | |||||||
| + | – | – | + | + | 3511.7828 | 499.16 | 4.78 |
| + | – | + | – | – | 3510.9769 | 502.92 | 1.193 |
| + | – | + | – | + | 3509.2081 | 504.68 | 2.766 |
| + | + | – | – | + | 3512.0558 | 497.57 | 6.185 |
| Тип конформаций II | |||||||
| + | – | – | – | – | 3511.6523 | 504.81 | 2.272 |
| + | + | – | + | – | 3512.1126 | 503.40 | 5.994 |
| + | + | – | + | + | 3514.0668 | 499.80 | 6.112 |
| + | + | + | + | + | 3514.1656 | 499.14 | 3.929 |
| Тип конформаций II (3–) | |||||||
| – | – | – | + | + | 3511.9115 | 502.50 | 4.136 |
| – | + | + | + | + | 3513.9567 | 485.10 | 4.37 |
Разброс λmax составил менее 6 нм для положительных ориентаций ОН-группы в положении 3 при среднем значении λmax = 501.4 нм, и при разности энергий начальных состояний менее 5 ккал/моль. Следовательно, расчет предсказывает батохромный сдвиг λmax при переходе от пеларгонидина к цианидину на 12 нм, что несколько меньше экспериментально найденного различия в длинах волн (15 нм). Для отрицательной ориентации ОН-группы в положении 3 наблюдаются, как и в случае пеларгонидина, выход кольца из плоскости сопряжения и расширение диапазона λmax для электронных переходов в различных конформациях. В поддержку предложенной выше идеи о том, что электронные спектры поглощения могут быть суперпозицией индивидуальных спектров различных конформаций, рассмотрим экспериментальный спектр поглощения цианидина (записан в кювете детектора при разделении антоцианидинов методом обращенно-фазовой ВЭЖХ в подвижной фазе 10 об. % муравьиной кислоты и 14 об. % ацетонитрила, рис. 1).
Рис. 1.
Представление электронного спектра поглощения цианидина индивидуальными полосами гауссового типа.
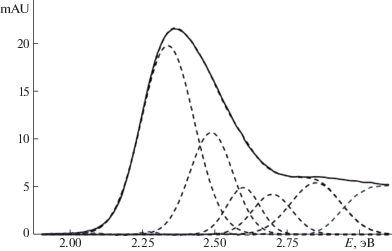
Как следует из рис. 1, экспериментальный спектр цианидина – сложная суперпозиция нескольких индивидуальных полос при наличии только одного разрешенного перехода по данным квантово-химических расчетов для каждой из конформаций частицы. Отметим, что анализ экспериментальных спектров поглощения ни в одной из цитированных работ не производили, а его сложная структура может быть следствием вертикальности переходов электрона для всего набора существующих конформаций.
Для дельфинидина диапазон разброса λmax для восьми случайно выбранных конформаций составил 20 нм при среднем значении 505.7 нм, что предсказывает батохромный сдвиг полосы поглощения при переходе от цианидина к дельфинидину, в согласии с экспериментальными данными (изменение λmax от 535 до 546 нм). При этом наблюдаемый рост λmax коррелирует с ростом энергии частицы в основном состоянии; такая же зависимость найдена и для цианидина, но если результаты сгруппировать по типам конформаций (рис. 2, для возможности сопоставления трех зависимостей на одном графике поменяли оси координат).
Рис. 2.
Корреляция между и расчетными значениями максимумов полос электронных спектров поглощения и расчетными значениями энергий конформаций основного электронного состояния цианидина (1 – тип конформаций I, 2 – тип конформаций II) и дельфинидина (3).
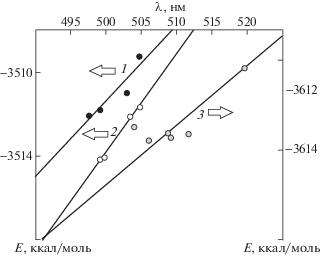
Переход от пеларгонидина к аурантинидину благодаря добавлению ОН-группы в положение 6 при ориентации всех групп по часовой стрелке привел к гипсохромному сдвигу полосы поглощения на 9 нм, что соответствует направлению изменения λmax в экспериментальных электронных спектрах.
К сожалению, расчет изменения электронных спектров поглощения при метилировании ОН-групп в цианидиновом (для пеонидина) и дельфинидиновом (для петунидина и мальвидина) рядах квантово-химическим методом оказался малоперспективным. Это связано с найденным большим диапазоном длин волн для различных конформаций флавилиевых ионов при том, что экспериментальные значения длин волн остаются без изменения в первом случае и последовательно вырастают лишь на 1.0–1.5 нм во втором ряду.
Расчеты хиноноидных структур. Для пеларгонидина возможно существование трех различных хиноноидных структур, которые могут быть названы по положению кето-группы как 4', 5 и 7-структуры (схема 4).
При расчетах исключили структуры, в которых ориентация гидроксильной группы в положении 3 была против часовой стрелки, из-за больших стерических напряжений, вследствие которых молекула принимает сложную неплоскую конформацию.
В случае 4'-хиноноидной структуры изменение ориентации ОН-групп в положениях 5 и 7 мало влияет на величины длин волн в максимуме абсорбции, (табл. 3), но среднее значение 405.3 ± 0.7 нм никак не согласуется с мнением о небольшом батохромном смещении длины волны полосы при переходе от флавилиевой к хиноноидной форме [9, 11, 13]. Для наиболее устойчивой (по энергии) 5-хиноноидной формы максимум смещен до 455.2 ± 0.7 нм, но эта полоса по-прежнему смещена гипсохромно относительно полосы флавилиевой формы. В работе [9] по расчетам для ряда синтетических антоцианов с известными спектральными характеристиками для флавилиевых и хиноноидных структур было отмечено, что расчеты λmax для хиноноидных структур, выполненные полуэмпирическим методом, оказались менее удачными, чем по вариантам в рамках теории функционала электронной плотности. Впрочем, в работе [14] незаряженная хиноноидная форма не упоминается вообще, и изменение окраски приписывают появлению одно- и двукратно-заряженных хиноноидных структур. А по нашим данным, отчетливая пурпурная окраска возникает только для антоцианов, ацилированных замещенными коричными кислотами, и поэтому такое смещение полосы поглощения может быть следствием внутримолекулярной копигментации [15].
Таблица 3.
Результаты квантово-химических расчетов незаряженных хиноноидных структур пеларгонидина
| Тип структуры | Ориентация ОН-групп в положениях: | –Е, ккал/моль | λ, нм | |||
|---|---|---|---|---|---|---|
| 7 | 5 | 3 | 4 | |||
| 4'-Хиноноидная | + | + | + | 3493.5349 | 405.42 | |
| – | + | + | 3492.9957 | 404.61 | ||
| + | – | + | 3493.7887 | 405.86 | ||
| – | – | + | 3493.8306 | 405.18 | ||
| 5-Хиноноидная | + | + | + | 3497.2040 | 453.97 | |
| + | + | – | 3497.1413 | 454.00 | ||
| – | + | + | 3498.1748 | 456.40 | ||
| – | + | – | 3498.5490 | 456.35 | ||
| 7-Хиноноидная | + | + | + | 3494.9837 | 450.20 | |
| + | + | – | 3495.0242 | 449.91 | ||
| – | + | + | 3493.4099 | 447.47 | ||
| – | + | – | 3468.0212 | 446.48 | ||
К неожиданностям структурных особенностей хиноноидных форм (при сравнении с флавилиевой формой) можно отнести влияние положения карбонильной группы на планарность структур даже при положительной ориентации гидроксильной группы в положении 3 (табл. 4). Только 4'-хиноноидная форма планарна во всех конформациях, а для 5- и 7-хиноноидных структур наблюдается выход сопряженных связей из плоскости. Изменение валентного угла при атоме углерода № 2 (О1–С2–С1'), указывает на отталкивание кольца В от кольца С по стерическим причинам. Эти же причины вызывают изменение торсионных углов: угла О1–С2–С1'–С2', выводящего из плоскости сопряжения кольцо В с кольцами А и С, и угла С2–С3–ОС3–Н, частично выводящего ОН-группу из плоскости молекулы. Но ослабление сопряжения при этом приводит к росту длины волны в максимуме полосы поглощения.
Таблица 4.
Влияние положения карбонильной группы на планарность хиноноидных структур
| Тип структуры | Ориентация ОН-группы в положении | Валентный угол О1–С2–С1' | Торсионные углы, град | |||
|---|---|---|---|---|---|---|
| 5 | 7 | 4' | О1–С2–С1'–С2' | С2–С3–ОС3–Н | ||
| 4' | + | + | 114 | 0 | 180 | |
| – | – | 114 | 0 | 180 | ||
| 5 | + | + | 112 | –12.8 | –168.9 | |
| – | – | 112 | –12.5 | –168.7 | ||
| 7 | + | + | 112 | –14.6 | –154.9 | |
| – | – | 112 | –15.9 | –132.2 | ||
Расчеты заряженных хиноноидных структур. Специфика заряженных хиноноидных структур с зарядом –1 состоит в том, что существуют две эквивалентные формы, например,
• 4'-хиноноидная структура с потерей протона гидроксильной группой в положении 7,
• 7-хиноноидная структура с потерей протона гидроксильной группой в положении 4'.
Обе имеют заметное искажение структуры, включая изменение ориентации гидроксильной группы в положении 3. Для них найден значительный батохромный сдвиг максимума абсорбции до 550–560 нм (табл. 5). Появление именно такой структуры может обеспечить экспериментально наблюдаемое в ряде случаев образование синей окраски при повышении рН водных растворов антоцианов. При этом следует учесть, что все расчетные длины волн полос поглощения, найденные в настоящей работе, смещены гипсохромно относительно экспериментальных значений. Это может быть следствием сольватохромного эффекта, тем более, что он наблюдается уже и при замене метанола на воду в качестве растворителя по нашим данным (при указанной замене наблюдается гипсохромный сдвиг на 10–20 нм). Возможность существования подобных структур среди антоцианов велика, поскольку положения 7 и 4' обычно остаются свободными от заместителей. Две другие эквивалентные пары структур могут встречаться в природе реже из-за частого гликозилирования ОН-группы в положении 5, но и для них получен заметный, хотя и менее выраженный гипсохромный сдвиг полос поглощения (табл. 5).
Таблица 5.
Результаты квантово-химических расчетов хиноноидных структур пеларгонидина с зарядом –1
| Тип структуры | Ориентация ОН-групп в положениях: | Углы в основном состоянии в структурах | –Е, ккал/моль | λ, нм | |||||
|---|---|---|---|---|---|---|---|---|---|
| 3 | 5 | 7 | 4' | I* | II** | III** | |||
| 4', заряд в 7(–) ≡ 7, заряд в 4'(–) | + | – | 112.4 | 20.7 | 14.4 | 3494.2075 | 560.45 | ||
| + | + | 112.4 | 21.0 | 14.8 | 3493.4878 | 555.98 | |||
| 4', заряд в 5(–) ≡ 5, заряд в 4'(–) | + | + | 113.6 | –5.8 | –104.2 | 3495.2769 | 514.86 | ||
| + | – | 113.7 | –5.7 | –103.8 | 3495.4416 | 516.05 | |||
| 5, заряд в 7(–) ≡ 7, заряд в 5(–) | + | + | 112.1 | –7.2 | –177.8 | 3483.3197 | 434.87 | ||
| + | – | 112.0 | –6.6 | –178.1 | 3483.4473 | 434.45 | |||
Для двукратно заряженных анионных структур, которые неожиданно разделились на две не совсем эквивалентные структуры, (табл. 6) характерно резкое падение длины волны максимума полосы поглощения до желтой области электромагнитного спектра, что согласуется с экспериментально наблюдаемыми для антоцианов изменениями в щелочных средах с образованием вначале зеленых растворов (как смеси синих с желтыми форм), постепенно заменяющихся (даже при стоянии) на окрашенные в желтый цвет растворы.
Таблица 6.
Результаты квантово-химических расчетов хиноноидных структур пеларгонидина с зарядом –2 (f – сила осциллятора)
| Тип структуры | Углы в основном состоянии в структурах, град | –Е, ккал/моль | λ, нм | f | ||
|---|---|---|---|---|---|---|
| I | II | III | ||||
| 4', заряды в 7 и в 5 ≡ 5, заряды в 7 и в 4' | 112.3 | –40.3 | 7.6 | 3425.8875 | 457.06 438.69 |
0.191 0.493 |
| 7, заряды в 5 и в 4' | 113.2 | –54.0 | –3.7 | 3426.2969 | 457.01 424.32 |
0.100 0.522 |
Список литературы
Trouillas P., Sancho-García J.C., De Freitas V. et al. // Chem. Rev. 2016. V. 116 P. 4937. https://doi.org/10.1021/acs.chemrev.5b00507
Dangles O., Fenger J.-A. // Molecules. 2018. V. 23. 1970. https://doi.org/10.3390/molecules23081970
Lima J.C., Vautier-Giongo C., Lopes A. et al. // J. Phys. Chem. A. 2002. V. 106. P. 5851. https://doi.org/10.1021/jp014081c
Rose P.M., Cantrill V., Benohoud M. et al. // J. Agric. Food Chem. 2018. V. 66. P. 6790. https://doi.org/10.1021/acs.jafc.8b01044
Дейнека В.И., Кульченко Я.Ю., Дейнека Л.А. // Журн. физ. химии. 2019. Т. 93. С. 459.
Kurtin W.E., Song P.-S. // Tetrahedron. 1968. V. 24. P. 2255. https://doi.org/10.1016/0040-4020(68)88127-X
Sakata K., Saito N., Honda T. // Tetrahedron. 2006. V. 62. P. 3721. https://doi.org/10.1016/j.tet.2006.01.081
Anouar E.H., Gierschner J., Duroux J.-L. et al. // Food Chem. 2012. V. 131. P. 79. https://doi.org/10.1016/j.foodchem.2011.08.034
Freitas A.A., Shimizu K., Dias L.G. et al. // J. Braz. Chem. Soc. 2007. V. 18. P. 1537.
Terranova U., Bowler D.R. // J. Chem. Theory Comput. 2013. V. 9. P. 3181. https://doi.org/10.1021/ct400356k
Rusishvili M., Grisanti L., Laporte S. et al. // Phys. Chem. Chem. Phys. 2019. V. 21. P. 8757. https://doi.org/10.1039/C9CP00747D
Stewart J.J.P. // J. Comput. Chem. 1989. V. 10. P. 209. https://doi.org/10.1002/jcc.540100208
Brouillard R., Chassaing S., Isorez G. et al. / Recent Advances in Polyphenol Research, V. 2. Ed. C. Santos-Buelga, M.T. Escribano-Bailon, V. Lattanzio. Blackwell Publ. Ltd., 2010. P. 1.
Khoo H.E., Azlan A., Tang S.T. et al. // Food Nutr. Res. 2017. V. 61. P.1361779. https://doi.org/10.1080/16546628.2017.1361779
He J., Li X., Silva G.T.M., Quina F.H. et al. // J. Braz. Chem. Soc. 2019. V. 30. P. 492. https://doi.org/10.21577/0103-5053.20180233
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии