Журнал физической химии, 2021, T. 95, № 7, стр. 1089-1094
Адсорбция и каталитическая активность щелочной фосфатазы на поверхности галлуазита
Л. Ф. Атякшева a, *, Т. И. Ибрагимзаде a, И. А. Касьянов a, А. Ю. Фастов b, С. А. Фастов c
a Московский государственный университет имени М.В. Ломоносова, Химический факультет
Москва, Россия
b ООО “Молекулярные технологии и новые материалы”
Москва, Россия
c ООО “Нанотехнологии и инновации”
Москва, Россия
* E-mail: Atyaksheva@phys.chem.msu.ru
Поступила в редакцию 24.09.2020
После доработки 24.09.2020
Принята к публикации 09.11.2020
Аннотация
Показано, что величина адсорбции и тип изотерм адсорбции, а также каталитическая активность и термостабильность щелочной фосфатазы на поверхности галлуазита зависят от текстуры алюмосиликатных нанотрубок. Максимальные величины предельной адсорбции получены на образцах с наименьшей удельной поверхностью (28 и 50 м2/г) и составляют соответственно 18 и 23 мг/г или 0.69 и 0.54 мг/м2. Установлено, что адсорбционные слои щелочной фосфатазы на поверхности галлуазита более стабильны, чем фермент в растворе; эффективные константы скорости инактивации при температуре 59°С для гетерогенных образцов изменяются в пределах 0–2.3 × 10–4 с–1, а в растворе в оптимуме рН стабильности фермента – 12.5 × 10–4 с–1; каталитическая активность адсорбционных слоев щелочной фосфатазы составляет не более 1% активности нативного фермента.
Природный глинистый минерал галлуазит состоит из слоев оксидов алюминия и кремния, закрученных в трубки, причем слой кремнезема находится на внешней стороне трубки, а слой оксида алюминия – на внутренней [1]. Галлуазит является высокоэффективным адсорбентом благодаря уникальной трубчатой структуре и способности иметь различные заряды на внутренней и наружной поверхности нанотрубок. Первыми ферментами, иммобилизованными на галлуазите, были α-амилаза и уреаза [2]. В последние 10 лет иммобилизацией на галлуазитах получены активные и стабильные биокатализаторы на основе хлоропероксидазы [3], лакказы [4], липазы [5, 6], α-амилазы [7], пероксидазы [8]. На щелочной фосфатазе, интеркалированной в нанотрубки проведена реакция биоминерализации [9].
Цель данной работы – исследовать адсорбцию щелочной фосфатазы на образцах галлуазита, различающихся параметрами пористой структуры, и сравнить каталитические свойства и термостабильность фермента в растворе и на поверхности образцов галлуазита.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Исследована адсорбция щелочной фосфатазы слизистой кишечника быка. Щелочная фосфатаза – димерный фермент, относительная молекулярная масса протомера 69000, pI 5.7. Использован лиофилизированный препарат (SIGMA) с содержанием белка 25%.
Адсорбционные измерения. Адсорбцию проводили из водных растворов фермента в интервале концентраций 50–800 мкг/мл. К 50 мг адсорбента добавляли 5 мл раствора фермента и оставляли в холодильнике на 5 суток. Величину адсорбции рассчитывали по разности концентраций фермента в исходном и конечном растворах. После окончания адсорбции образцы промывали несколько раз водой для удаления остатков фермента, добавляли по 5 мл воды и оставляли в холодильнике на 5 суток для проверки обратимости адсорбции. Величина десорбции фермента не превышала 2%, т.е. в исследованных условиях адсорбция щелочной фосфатазы практически необратима.
Определение концентрации щелочной фосфатазы. Содержание активного фермента определяли по скорости гидролиза динатриевой соли п-нитрофенилфосфата в 0.05 М карбонатном буфере (рН 8.5). Использовали насыщающие концентрации субстрата (3.5 мМ). Ферментативную реакцию проводили в стеклянной кювете (l = 1 см). Скорость накопления окрашенного продукта реакции – п-нитрофенола – определяли фотометрированием при λ = 400 нм. Предварительно строили калибровочные зависимости.
Определение параметров уравнения Михаэлиса–Ментен. Константа Михаэлиса (КМ) и максимальная скорость (V), характеризующие каталитические свойства ферментов, определяли для щелочной фосфатазы в растворе и на поверхности образцов галлуазита в реакции гидролиза синтетического субстрата (динатриевая соль п-нитрофенилфосфата, SIGMA). Ферментативную реакцию проводили в фосфатном буфере (рН 7.5), интервал концентраций субстрата 0.15–1 мМ. Для обработки экспериментальных данных использовали линейное уравнение Лайнуивера–Берка.
Термоинактивация щелочной фосфатазы. Растворы фермента в фосфатном буфере (рН 7.5, оптимум рН стабильности фермента) и гетерогенные образцы подвергали термообработке при 59°С. Время термообработки варьировали от 15 мин до 2 ч. Полученные зависимости активности фермента от времени термообработки обрабатывали в координатах кинетического уравнения первого порядка и определяли эффективные константы скорости термоинактивации.
Физико-химические методы исследования. Определение параметров пористой структуры галлуазита проводили на сорбтометре АSАР 2010 (Micromeritics, США). Предварительно образцы вакуумировали при 50°С в течение 10 ч.
Электронные микрофотографии образцов галлуазита получали на сканирующем электронном микроскопе JEOL JSM-6000 NeoScope.
Адсорбенты. Исследовали 4 образца галлуазита (производитель ООО “МТиНМ”, Россия), текстурные параметры которых приведены в табл. 1.
Таблица 1.
Текстурные параметры исследованных образцов галлуазита
| Образец | SБЭТ, м2/г | Sмикро, м2/г | Vпор, см3/г | D1, нм | D2, нм |
|---|---|---|---|---|---|
| Галлуазит-1 | 28 | 2 | 0.14 | 3.5 | 50 |
| Галлуазит-2 | 50 | 7 | 0.15 | 3.5 | 12 |
| Галлуазит-3 | 250 | 80 | 0.18 | 3.5 | 25 |
| Галлуазит-4 | 215 | 25 | 0.19 | 3.5 | 50 |
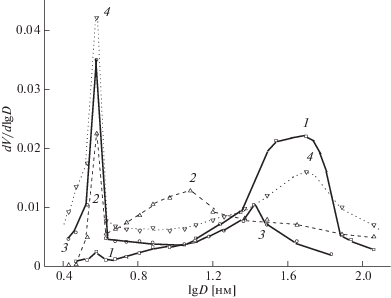
Значения D1 и D2 – положения максимумов на кривых распределения объемов пор по их размерам (рис. 1). Считается, что первый максимум соответствует порам внутренней поверхности галлуазита, включая и межслоевые пространства, а второй максимум – среднему размеру внутренних диаметров нанотрубок [10]. Приведенные на рис. 2 электронные микрофотографии свидетельствуют о различной морфологии исследованных образцов галлуазита. Образец 1 состоит в основном из трубчатых структур, тогда как в других образцах помимо трубчатых структур присутствуют сферические и пластинчатые структуры, а также их агломераты.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
На рис. 3 приведены изотермы адсорбции щелочной фосфатазы на образцах галлуазита. При адсорбции на образцах 1 и 4 получены изотермы L-типа, а на образцах 2 и 3 – двухступенчатые изотермы. Все изотермы адсорбции обработаны в линейных координатах уравнения Ленгмюра и рассчитаны предельные величины адсорбции фермента. В случае образцов галлуазит-2 и галлуазит-3 определены два значения предельной адсорбции. Полученные величины приведены в табл. 2.
Рис. 3.
Изотермы адсорбции щелочной фосфатазы на образцах галлуазита в расчете на единицу массы (а) и единицу поверхности (б). Номер зависимости соответствует номеру образца.
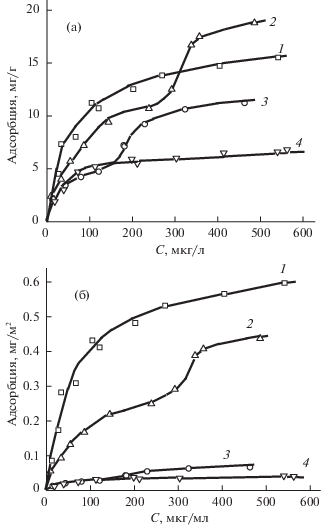
Таблица 2.
Предельные адсорбции щелочной фосфатазы и площадки, приходящиеся на молекулу фермента на поверхности галлуазита
| Образец | SБЭТ – ‒ Sмикро, м2/г* | Предельная адсорбция | Sмолекулы, нм2 |
|
|---|---|---|---|---|
| мг/г | мг/м2 | |||
| Галлуазит-1 | 26 | 18 | 0.69 | 330 |
| Галлуазит-2 | 43 | 23 (12**) | 0.54 | 430 |
| Галлуазит-3 | 170 | 14 (6**) | 0.08 | 2800 |
| Галлуазит-4 | 190 | 8 | 0.04 | 5500 |
Изотермы адсорбции ферментов на образцах галлуазита ранее получены для липазы [5, 6], лизоцима [6] и пероксидазы [8], однако авторы этих публикаций изотермы никак не обрабатывали.
Из приведенных на рис. 3 и в табл. 2 данных следует, что максимальные адсорбции получены на образцах, обладающих меньшей удельной поверхностью. Причем, если в расчете на единицу массы адсорбция различается в 2–3 раза, то в расчете на единицу поверхности – практически на порядок. На порядок различаются и рассчитанные из предельной адсорбции площадки, приходящиеся на одну молекулу фермента на поверхности этих образцов (табл. 2). По-видимому, наличие значительных количеств микропор в образцах 2 и 3 препятствует закреплению молекул белка на поверхности. Полученные нами предельные адсорбции можно сравнить с величинами адсорбции α-амилазы и уреазы на галлуазите (SБЭТ = 60 м2/г и внутренний диаметр 20 нм [2]). Величины адсорбции составили 15 и 11.7 мг/г соответственно для уреазы и α-амилазы. В расчете на единицу поверхности – 0.25 и 0.20 мг/м2, что вполне укладывается в найденную нами тенденцию уменьшения адсорбции с увеличением удельной поверхности. К сожалению, в других работах по адсорбции ферментов на галлуазитах [3–9] нет сведений о текстурных характеристиках образцов.
В табл. 3 приведены параметры уравнения Михаэлиса–Ментен, характеризующие каталитические свойства фермента в растворе и на поверхности исследованных образцов галлуазита.
Таблица 3.
Параметры уравнения Михаэлиса–Ментен (KМ и V) и эффективные константы скорости инактивации фермента (kэфф) при 59°С в буферном растворе (рН 7.5) и на поверхности образцов галлуазита
| Фермент | KМ, мМ | Vmax, мкмоль/(мин мг белка) | kэфф × 104, с–1 |
|---|---|---|---|
| В растворе, рН 7.5 | 0.1 | 146 | 12.3 |
| На галлуазите-1 | 0.3 | 0.4 (~0.3%*) | стабилен** |
| На галлуазите-2 | 0.8 | 1.4 (~1%*) | 1.2 |
| На галлуазите-3 | 0.7 | 1.2 (~0.8%*) | 2.3 |
| На галлуазите-4 | 0.6 | 0.2 (~0.1%*) | стабилен** |
Проведенное исследование показало, что щелочная фосфатаза на поверхности галлуазита сохраняет не более 1% по сравнению с активностью в растворе (см. табл. 3). По литературным данным лакказа на поверхности галлуазита сохраняла ~20% активности [4], липаза – до 80% [5]. Константа Михаэлиса в случае гетерогенных образцов возрастает в несколько раз по сравнению с полученной для фермента в растворе, что характерно для иммобилизованных ферментов. В литературе приведены параметры уравнения Михаэлиса–Ментен для хлоропероксидазы, иммобилизованной на галлуазите в реакции хлорирования монохлордимедона [3]. Аналогичные параметры для нативного фермента не сообщаются.
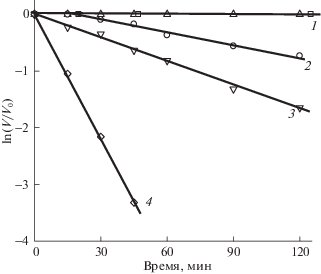
Интересные результаты получены при проведении ферментативной реакции последовательно на одном и том же образце. Как видно из рис. 4, образцы, сохранившие минимальную активность (галлуазит-1 и галлуазит-4) не теряют активности при проведении шести последовательных циклов на одном и том же образце. Два других образца, сохранивших активность в большей степени, постепенно теряли активность, если каталитическую реакцию проводили последовательно на одном и том же образце. Различается и термостабильность гетерогенных биокатализаторов. Кинетические зависимости термоинактивации щелочной фосфатазы при 59°С в буферном растворе (7.5) и фермента на поверхности исследованных образцов галлуазита приведены на рис. 5. Рассчитанные из экспериментальных данных эффективные константы скорости термоинактивации приведены в табл. 3. Полученные результаты свидетельствуют о том, что фосфатаза на поверхности галлуазита более стабильна при воздействии повышенных температур. В буферном растворе в оптимуме рН стабильности (рН 7.5) при 59°С фермент теряет половину активности менее, чем за 15 мин, а фосфатаза на поверхности образцов 1 и 4 не теряет первоначальной активности, по крайней мере, в течение 2 ч. Фермент на поверхности образца галлуазит-2 не теряет активности после 15 мин выдержки при 59°С, а на галлуазит-3 потеря активности начинается с первых минут термообработки. Константа скорости инактивации щелочной фосфатазы в растворе в 5–10 раз выше, чем на образцах 3 и 2 (соответственно 12.3 × 10–4, 2.3 × 10–4 и 1.2 × 10–4 с–1). Термостабильность адсорбционных слоев ферментов – одно из преимуществ гетерогенных биокатализаторов. Это свойство отмечено ранее и для ферментов, иммобилизованных на поверхности галлуазита [3, 5, 6].
Рис. 4.
Каталитическая активность щелочной фосфатазы на поверхности галлуазита при последовательном проведении эксперимента. Номер зависимости соответствует номеру образца.
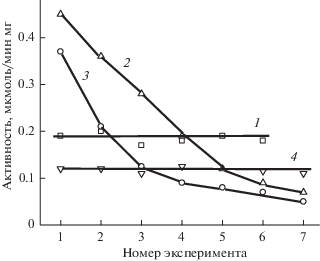
Рис. 5.
Кинетические зависимости в координатах уравнения первого порядка для термоинактивации щелочной фосфатазы на поверхности галлуазита-1 и галлуазита-4(1), галлуазита-3 (2), галлуазита-2(3) и в растворе (4).
Таким образом, максимальные величины адсорбции щелочной фосфатазы (в расчете на единицу массы и на единицу поверхности) получены на образцах галлуазита с небольшой величиной удельной поверхности (28 и 50 м2/г). Установлено, что десорбция ферментов с поверхности галлуазитов составляет не более 2%, а каталитическая активность – не более 1% по сравнению с активностью нативного фермента. Щелочная фосфатаза на поверхности всех исследованных образцов галлуазита более устойчива к воздействию повышенных температур, чем в растворе. По другим свойствам образцы можно разделить на две группы и выделить общие свойства адсорбционных слоев щелочной фосфатазы для каждой группы.
К первой группе отнесены образцы, у которых внутренние диаметры нанотрубок максимальные, – галлуазит-1 (SБЭТ = 28 м2/г, Dмах = 50 нм) и галлуазит-4 (SБЭТ = 215 м2/г, Dмах = 50 нм). Для этих образцов характерны изотермы адсорбции L-типа и постоянство активности фермента при многократном проведении реакции на одном и том же образце, а также сохранение каталитической активности фермента на поверхности образцов после обработки при 59°С в течение 3 ч.
Ко второй группе отнесены образцы с меньшими внутренними диаметрами нанотрубок – галлуазит-2 (SБЭТ = 50 м2/г, Dмах = 12 нм) и галлуазит-3 (SБЭТ = 250 м2/г, Dмах = 25 нм). Для этих образцов характерны двухступенчатые изотермы адсорбции, падение каталитической активности при многократном проведении ферментативной реакции на одном и том же образце и значительно меньшая термостабильность фермента на поверхности этих образцов по сравнению с образцами галлуазит-1 и галлуазит-4.
Проведенное исследование показало, что особенности адсорбции щелочной фосфатазы (а, возможно, и других ферментов) и свойства адсорбционных слоев ферментов в значительной степени определяются текстурными параметрами образцов галлуазита.
Исследование текстурных и морфологических характеристик образцов галлуазитов выполено за счет гранта Российского научного фонда (проект № 19-73-10160).
Список литературы
Joussein E. // Developments in Clay Science 2016. V. 7. P. 13. https://doi.org/10.1016/B978-0-08-100293-3.00023-6
Zhara. K., Zhanga B., Liua L. et al. // Catal. Commun. 2010. V. 12. P. 259.
Fan H., Hu M., Li S. et al. // Appl. Clay Sci. 2018. V. 163. P. 92. https://doi.org/10.1016/j.clay.2018.07.016
Kadam A.A., Jang J., Jee S.C. et al. // Carbohydrate Polymers. 2018. V. 194. P. 208. https://doi.org/10.1016/j.carbpol.2018.04.046
Wang H., Zhao X., Wang S. et al. // J. Chromatogr. A. 2015. V. 1392. P. 20. https://doi.org/10/1016/j.chroma.201503002
Sun J., Yendluri R., Liu K. et al. // Phys. Chem. Chem. Phys. 2016.
Pandey G., Munguambe D.M., Tharmavaram M. et al. // Appl. Clay Sci. 2017. V. 136. P. 184. https://doi.org/10.1016/j.clay.201611034
Zhai R., Zhang B., Wan Y. et al. // Chem. Eng. J. 2013. V. 214. P. 304.https://doi.org/10.1016/j.cej.2012.10.073
Pietraszek A., Karewich A., Widnic M. et al. // Colloids and Surfaces B: Bioiterfaces. 2019. V. 173. P. 1. https://doi.org/10.1016/j.colsurfb.2018.09.040
Pasbakhsh P., Churchman G.J., Keeling J.L. //Appl. Clay Sci. 2013. V. 74. P. 47. https://doi.org/10.1016/j.clay.2012.06.014
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии