Журнал физической химии, 2021, T. 95, № 7, стр. 1095-1100
Закономерности поглощения СО2 известковым сорбентом в проточном адсорбере
В. С. Деревщиков a, b, c, *, Е. Д. Казакова a, b, Ж. В. Веселовская a, Д. А. Яценко a, Д. В. Козлов a
a Российская академия наук, Сибирское отделение, Институт катализа им. Г.К. Борескова
Новосибирск, Россия
b Новосибирский государственный технический университет
Новосибирск, Россия
c Новосибирский государственный университет
Новосибирск, Россия
* E-mail: derevshchikov@mail.ru
Поступила в редакцию 17.09.2020
После доработки 17.09.2020
Принята к публикации 07.10.2020
Аннотация
Исследованы закономерности хемосорбции СО2 сорбентом диоксида углерода известковым гранулированным поглотителем Draeger 800+. Изучена динамика изменения текстурных характеристик, фазового и химического составов материала в процессе хемосорбции на уровне индивидуальных гранул сорбента. Проведено исследование зависимости времени защитного действия сорбента от высоты его слоя, а также от скорости потока и концентрации углекислого газа в исходной газовоздушной смеси. На основе экспериментальных данных получено эмпирическое уравнение, которое можно использовать для предсказания защитного времени слоя гранул поглотителя Draeger 800+ при известных значениях времени контакта и концентрации диоксида углерода в газовой смеси.
В современной медицинской анестезиологической практике для проведения ингаляционного наркоза используют наркозные аппараты, работающие по принципу полузакрытого и закрытого контуров. При этом наркозно-дыхательная смесь циркулирует между пациентом и наркозной установкой [1]. Накопление углекислого газа в наркозно-дыхательной смеси, происходящее в результате дыхания, отрицательно влияет на здоровье пациента. В частности, было показано, что углекислый газ в концентрации более 1 об. % увеличивает частоту дыхания человека, которая нормализуется при снижении концентрации CO2 во вдыхаемом воздухе [2]. Для предотвращения роста концентрации диоксида углерода в газовой смеси в контуры наркозных установок встраивают адсорберы со сменным известковым поглотителем (сорбентом) углекислого газа [3–7].
К сорбентам диоксида углерода для применения в процессах ингаляционной анестезии предъявляют следующие основные требования: сорбент должен иметь высокую сорбционную динамическую емкость по СО2, сорбент должен быть механически прочным и не образовывать пыли, сорбент должен обеспечивать цветоиндикацию при дезактивации.
В настоящее время наиболее часто в качестве твердого сорбента для удаления CO2 в наркозных аппаратах используют гранулированные материалы на основе натронной извести [7]. В ее состав входят Ca(OH)2 (основной компонент), NaOH (активатор) и вода. Массовая доля NaOH в натронной извести обычно составляет около 3 мас. %, при этом влажность материала находится в пределах от 10 до 20 мас. %. Следует отметить, что известковые хемосорбенты применяют не только в наркозных аппаратах, но также и в других дыхательных системах с замкнутым контуром, таких как гипербарические камеры и ребризеры, а также в устройствах противопожарной безопасности и горноспасательном оборудовании [8–13].
Процесс поглощения диоксида углерода натронной известью можно представить следующими стадиями:
1) внешняя диффузия СО2 через пограничный (газовый) слой к поверхностной пленке водного щелочного раствора, содержащего ионы Ca2+ и Na+;
2) растворение углекислого газа в поверхностной водной пленке и его превращение в гидрокарбонат-ионы и карбонат-ионы;
3) взаимодействие карбонат-ионов с катионами кальция, находящимися в поверхностной водной пленке, с образованием карбоната кальция;
4) продвижение зоны химической реакции внутрь зерна.
Растворение углекислого газа в щелочных водных растворах сопровождается протеканием следующих процессов [14]:
(1)
${\text{C}}{{{\text{O}}}_{2}}({\text{г}}.) + {{{\text{H}}}_{{\text{2}}}}{\text{O}}({\text{ж}}.) = {\text{C}}{{{\text{O}}}_{2}}({\text{водн}}{\text{.}}),$(2)
${\text{С}}{{{\text{O}}}_{2}}({\text{водн}}{\text{.}}) + {\text{O}}{{{\text{H}}}^{ - }}({\text{водн}}{\text{.}}) = {\text{HCO}}_{3}^{ - }({\text{водн}}{\text{.}}),$(3)
$\begin{gathered} {\text{HCO}}_{3}^{ - }({\text{водн}}{\text{.}}) + {\text{O}}{{{\text{H}}}^{ - }}({\text{водн}}{\text{.}}) = \\ = {\text{CO}}_{3}^{{2 - }}({\text{водн}}{\text{.}}) + {{{\text{H}}}_{{\text{2}}}}{\text{O}}({\text{ж}}{\text{.}}). \\ \end{gathered} $Растворимость гидроксида натрия существенно выше растворимости гидроксида кальция, поэтому в NaOH-cодержащих известковых сорбентах концентрация OH– в поверхностной водной пленке выше, чем в известковых сорбентах без добавления щелочного гидроксида. В связи с этим, добавление гидроксида натрия в состав поглотителя существенно ускоряет реакцию (3). Далее происходит регенерация гидроксид-ионов по реакции:
(4)
$\begin{gathered} {\text{CO}}_{3}^{{2 - }}({\text{водн}}{\text{.}}) + {\text{Ca}}{{({\text{OH}})}_{2}}({\text{тв}}{\text{.}}) = \\ = 2{\text{O}}{{{\text{H}}}^{ - }}({\text{водн}}{\text{.}}) + {\text{CaC}}{{{\text{O}}}_{3}}({\text{тв}}{\text{.}}). \\ \end{gathered} $Таким образом, гидроксид натрия выступает катализатором поглощения СО2: ускоряет процесс образования продукта реакции по реакции (3) и регенерируется по (4).
В целом, процесс поглощения газообразного CO2 натронной известью можно описать следующей суммарной реакцией:
(5)
${\text{Ca}}{{({\text{OH}})}_{2}}({\text{тв}}{\text{.}}) + {\text{C}}{{{\text{O}}}_{2}}({\text{г}}{\text{.}}) = {\text{CaC}}{{{\text{O}}}_{3}}({\text{тв}}{\text{.}}) + {{{\text{H}}}_{{\text{2}}}}{\text{O}}({\text{ж}}{\text{.}}).$Процесс хемосорбции CO2 сопровождается изменением текстуры материала, но до сих пор эволюция характеристик пористой структуры хемосорбентов на основе натронной извести в ходе сорбционного процесса не была детально исследована. В данной работе представлены результаты изучения хемосорбции СО2 коммерческим известковым сорбентом Draeger 800+ на уровне отдельных гранул и слоя сорбента. Подробно обсуждается влияние процесса сорбции СО2 на изменения химического и фазового составов материала, а также его текстуры и пористой структуры. Кроме того, в работе получены зависимости защитного времени сорбента от высоты слоя, скорости потока газа и концентрации CO2 в газовоздушной смеси, на основе которых предложено универсальное уравнение, которое можно использовать при проектировании дыхательных систем с замкнутым контуром.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе мы исследовали известковый сорбент Draeger 800+ фирмы Draegererwerk (Германия), широко распространенный на российском медицинском рынке поглотителей СО2. Гранулы Draeger 800+ представляют собой полусферические частицы диаметром 4 мм.
Массовое содержание элементов в образцах сорбентов (Li, K, Ca, Y, Al и др.) было определено с помощью метода рентгенофлюоресцентного анализа на приборе ARL Perform’X (Thermo Scientific). Химический состав сорбентов был также охарактеризован методом синхронного термического анализа (СТА) на приборе STA 449 Jupiter (Netzsch, Германия). Образцы нагревали в токе воздуха со скоростью 10°С мин–1.
Данные по пористой структуре материалов в области микро-мезопор были получены из изотерм адсорбции-десорбции азота, измеренных при 77 К на анализаторе площади поверхности и размера пор Nova 1200e. Перед измерением образцы дегазировали при 120°С в вакууме не менее 2 ч. Распределение пор по размерам рассчитывали по методу Барретта–Джойнера–Халенды. Для характеризации пористой структуры образцов в области мезопор и макропор использовали метод ртутной порометрии. Эксперименты проводили на установке Micromeritics Autopore VI2500.
Морфологию образцов сорбента изучали с использованием сканирующей электронной микроскопии (СЭМ), микроскоп Jeol JSM-6460 LV.
Рентгенофазовый анализ (РФА) в процессе хемосорбции СО2 проводили in situ на дифрактометре Bruker D8 Advance (Германия). Источником излучения является рентгеновская трубка с медным анодом, средняя длина волны излучения CuKα = 0.154184 нм (CuKα1 = 0.15406 нм, CuKα2 = = 0.154439 нм), ток генератора 40 мА, напряжение 40 кВ. Измерения проводились в камере Anton Paar XRK 900. В камере сорбент насыщали 10 об. % CO2 в токе увлажненного гелия при комнатной температуре. Фазовый анализ проводился с использованием базы данных ICSD: использовались карточки 34240 для Ca(OH)2 и 73446 для CaCO3. Размер областей когерентного рассеяния (ОКР) для фаз оценивали из уширения дифракционных максимумов (ширина на половине высоты) по формуле Шеррера с коэффициентом 0.9. Количественный фазовый анализ проводился методом Ритвельда в программе Топаз (Bruker).
Сорбционную динамическую емкость хемосорбентов определяли с помощью проточной установки. Принцип работы установки основан на пропускании потока газа с известным содержанием диоксида углерода и паров воды через слой сорбента, помещенного в вертикальный реактор. В качестве реактора был использован адсорбер от детского наркозного аппарата Chirana (Словакия). Внутренний диаметр реактора – 66 мм. Высоту слоя сорбента варьировали от 10 до 58 мм. Объемная скорость подачи СО2 и воздуха в реактор задавалась двумя регуляторами расхода газов РРГ-12 производства ООО “Элточприбор”. Скорость подачи газовоздушной смеси варьировали в диапазоне от 52 до 1075 л/ч. Время контакта газовой смеси с сорбентом (τ) рассчитывали как отношение объема слоя хемосорбента к объемной скорости подачи газовоздушной смеси.
Влажность воздуха при испытании сорбента поддерживали на уровне 80% при 37°С с помощью увлажнителя “Fisher&Paykel”. Содержание СО2 в потоке варьировали в диапазоне от 1 до 7 об. %. Для определения содержания уровня СО2 в газовоздушной смеси на выходе из реактора использовали преобразователь ИПДУ-02 и газоанализатор ПКУ-8 компании “ ЭкоСис”.
Время защитного действия сорбента tзащ (в минутах) в данной работе определяли как время пропускания газовоздушной смеси, соответствующее выходной проскоковой концентрации диоксида углерода, равной 1 об. %. Сорбционную динамическую емкость Адин (в мас. %) рассчитывали по следующей формуле:
где U – скорость подачи газовоздушной смеси в реактор, л мин–1; С0 и С – концентрации СО2 на входе и на выходе из реактора, об. %; M – молярная масса СО2, г моль–1; Vм – мольный объем газа, л моль–1; mсорб – масса сорбента, г.ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Элементный состав коммерческого сорбента Draeger 800+ был установлен методом рентгеновской флюоресценции. Основным элементом, входящим в состав коммерческого поглотителя, является кальций. При пересчете на гидроксид кальция содержание последнего составляет 75–80 мас. %. Содержание Na в составе образцов Draeger 800+ превышает 1 мас. % – такое высокое значение связано с тем, что производители вводят в состав материала едкий натр для улучшения его сорбционной способности [7].
Из данных СТА следует, что при 100°С происходит удалением воды с поверхности сорбента, далее в области 500°С происходит разложение гидроксида кальция по реакции:
(7)
${\text{Ca}}{{({\text{OH}})}_{2}}({\text{тв}}{\text{.}}) = {\text{CaO}}({\text{тв}}{\text{.}}) + {{{\text{H}}}_{{\text{2}}}}{\text{O}}({\text{г}}{\text{.}}).$Кроме того, наблюдается небольшая потеря массы образца в области 750°С в результате термического разложения карбоната кальция:
(8)
${\text{CaC}}{{{\text{O}}}_{3}}({\text{тв}}{\text{.}}) = {\text{CaO}}({\text{тв}}{\text{.}}) + {\text{C}}{{{\text{O}}}_{2}}({\text{г}}.).$Сопоставление результатов СТА и рентгенофлюоресцентного анализа позволяет заключить, что исследованный сорбент содержит 80 мас. % гидроксида кальция, 16 мас. % воды, 1.5 мас. % гидроксида натрия и 1 мас. % карбоната кальция. Остальное (1.5 мас. %) – компоненты, состав которых нам установить не удалось.
Для определения скорости хемосорбции СО2 отдельными гранулами сорбционный процесс изучали в дифференциальном реакторе. Гранулы сорбента равномерно распределяли в один слой по решетке реактора (масса сорбента – 3 г). Далее, через реактор пропускали газовоздушную смесь с объемной скоростью подачи 100 л ч–1 при температуре 37°С. Концентрация СО2 в газовоздушной смеси составляла 1 об. % или 7 об. %. Каждый образец сорбента выдерживали в реакторе заданное время, после чего его извлекали из реактора и помещали в герметичный бюкс.
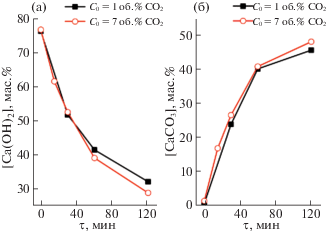
Скорость накопления СаСО3 в гранулах сорбента определяли с использованием метода СТА. Содержание CaCO3 и Ca(OH)2 в образцах определяли по соответствующей области потери массы на кривых в термогравиметрическом эксперименте (см. реакции (7) и (8)). Из рис. 1 видно, что скорость образования продукта существенно снижается после 1 ч хемосорбции и практически не зависит от концентрации углекислого газа в исследованном диапазоне концентраций (1–7 об. %).
Рис. 1.
Динамика изменения массового содержания Ca(OH)2 (a) и CaCO3 (б) в ходе хемосорбции CO2 на грануле сорбента.
Согласно данным РФА in situ (рис. 2), исходный образец содержит частицы гидроксида кальция и небольшое количество CaCO3 с размерами ОКР 25–30 нм для обеих кристаллических фаз. Изменения интенсивности дифракционных максимумов во время процесса хемосорбции CO2 указывает на снижение содержания гидроксида кальция с 84 до 16 мас. % и стехиометрическое увеличение содержания карбоната кальция в образце. Из РФА следует, что образец после хемосорбции содержит кристаллиты Сa(OH)2 с размерами ОКР 50 нм и CaCO3 с размерами ОКР 10 нм.
Рис. 2.
Дифракционные картины (сверху) и СЭМ микрофотографии (снизу) образцов сорбента до (a) и после (б) 120 мин хемосорбции СО2. Штрих-диаграммы соответствуют пикам кристаллических фаз Ca(OH)2 (1) и CaCO3 (2).
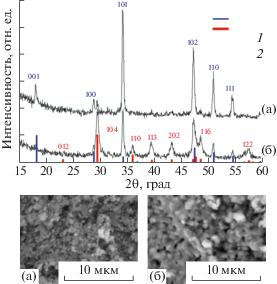
Текстура образцов сорбента до и после сорбции CO2 была исследована методами низкотемпературной адсорбции азота, ртутной порометрии и CЭМ. По данным низкотемпературной адсорбции азота образцы сорбента до и после сорбции CO2 не содержат микропор и характеризуются преимущественно макропористой структурой, причем в образцах присутствуют макропоры с размером более 200 нм. По результатам исследования образцов сорбента методом ртутной порометрии было установлено, что в процессе хемосорбции СО2 происходит уменьшение общего объема пор и удельной площади поверхности материала (табл. 1). В результате хемосорбции CO2 уменьшается объем пор сорбента с размером в диапазоне 0.03–0.1 мкм, но увеличивается объем пор с размером 0.1–0.5 мкм. Сравнение изображений СЭМ до и после 120 мин сорбции CO2 (рис. 2) указывает на укрупнение частиц на поверхности сорбента, что согласуется с данными ртутной порометрии.
Таблица 1.
Зависимость удельной площади поверхности (S) и общего объема пор (V) сорбента от времени сорбции CO2 (τ)
| τ, мин | S, м2 г–1 | V, см3 г–1 |
|---|---|---|
| 0 | 26 | 0.36 |
| 15 | 22 | 0.33 |
| 30 | 22 | 0.33 |
| 60 | 18 | 0.31 |
| 120 | 15 | 0.29 |
Наблюдаемые изменения в текстуре сорбента связаны с протеканием реакции (5), которая характеризуется увеличением мольного объема твердого тела. Критерий Пиллинга–Бедворта (КП-Б) для этой реакции составляет 1.1. Таким образом, при полном протекании реакции (5) общий объем твердого тела увеличится на 10%. Это согласуется с данными РФА, по которым размер кристаллитов агрегатов увеличивается.
Вероятно, что именно рост кристаллитов и увеличение мольного объема твердого тела в ходе реакции (5) приводит к частичному заполнению пор материала. Образование дополнительного объема макропор с размерами 0.1–0.5 мкм может быть следствием перераспределения частиц для релаксации напряжений, возникающих в грануле сорбента из-за увеличения объема агрегатов в результате протекания химической реакции (5).
По результатам сорбционных экспериментов были определены времена защитного действия слоя сорбента (tзащ – время до проскоковой концентрации 1 об. %) при различной скорости подачи газовоздушной смеси U, высоте слоя сорбента L и концентрации CO2 на входе в реактор C0 (табл. 2). В таблице также представлены значения динамической сорбционной емкости материала (Aдин) на момент достижения проскоковой концентрации 1 об. % CO2 на выходе из адсорбера. Первая серия экспериментов (№ 1–6 в табл. 2) была направлена на варьирование скорости подачи газовой смеси при постоянстве остальных параметров эксперимента. Было показано, что при увеличении скорости подачи газа время защитного действия сорбента и динамическая емкость сорбента уменьшаются. При самой высокой скорости подачи газовой смеси (1075 л ч–1) выходная концентрация СО2 не опускалась до нуля, т.е. СО2 проходит через слой хемосорбента, который не успевает его полностью поглотить.
Таблица 2.
Результаты исследования сорбции CO2 слоем сорбента Draeger 800+
| № | U, л ч–1 | L, см | C0, об. % | τ, с | tзащ, мин | Адин, мас. % |
|---|---|---|---|---|---|---|
| 1 | 52 | 5.8 | 7 | 14.5 | 445.1 | 34.7 |
| 2 | 97 | 5.8 | 7 | 7.8 | 207.5 | 30.9 |
| 3 | 155 | 5.8 | 7 | 4.9 | 128.5 | 29.1 |
| 4 | 342 | 5.8 | 7 | 2.2 | 50 | 26.4 |
| 5 | 538 | 5.8 | 7 | 1.4 | 25.5 | 20.9 |
| 6 | 1075 | 5.8 | 7 | 0.7 | 4 | 5.7 |
| 7 | 100 | 1.0 | 7 | 1.3 | 21.8 | 2.8 |
| 8 | 100 | 3.0 | 7 | 3.9 | 105.3 | 15.0 |
| 9 | 100 | 5.0 | 7 | 6.5 | 187.5 | 28.7 |
| 10 | 250 | 5.8 | 7 | 3.0 | 73.5 | 26.8 |
| 11 | 250 | 5.8 | 5 | 3.0 | 115.2 | 28.6 |
| 12 | 250 | 5.8 | 1 | 3.0 | 1263.5 | 51.0 |
Также были проведены эксперименты с различной высотой слоя сорбента (№ 7–9 в табл. 2). При использовании слоя сорбента с высотой 1 см выходная концентрация не опускается до нуля и очень быстро достигает значения 1 об. %. Результаты экспериментов № 1–9 укладываются в общую тенденцию: чем больше время контакта, тем выше значение защитного времени слоя сорбента. Результаты серии сорбционных экспериментов с различной концентрацией СО2 (№ 10–12 в табл. 2) указывают на то, что при уменьшении концентрации СО2 в смеси увеличивается время защитного действия слоя сорбента.
Для описания динамики сорбции слоем сорбента мы использовали уравнение Шилова [15]:
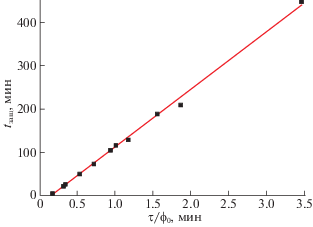
где tзащ – защитное время слоя сорбента до заданной проскоковой концентрации газа-сорбтива; τ – время контакта газовой смеси со слоем сорбента (мин); ϕ0 – объемная доля газа-сорбтива в исходной смеси (ϕ0 = С0/100%); K – константа, зависящая от предельной сорбционной емкости и насыпной плотности материала; τ0 – время формирования фронта сорбции (мин).На рис. 3 представлены результаты экспериментов № 1–11 в координатах уравнения Шилова (tзащ – τ/ϕ0). Можно видеть, что экспериментальные данные хорошо аппроксимируются линейной зависимостью. Из уравнения линейной аппроксимации были определены значения констант уравнения Шилова (9): K = 133, τ0 = 21 мин. Полученные константы можно использовать на практике для расчета времени защитного действия сорбента Draeger 800+ (до выходной концентрации 1 об. %), если известны значения времени контакта газовой смеси со слоем сорбента и объемной доли CO2 в исходной газовой смеси.
Рис. 3.
Зависимость защитного времени сорбента (tзащ) от параметра τ/ϕ0 (τ – время контакта газовой смеси со слоем сорбента, ϕ0 – объемная доля CO2 в исходной смеси): символы – экспериментальные значения (табл. 2), прямая – результат линейной аппроксимации по методу наименьших квадратов.
Таким образом, изучены закономерности изменения состава и структурных характеристик сорбента Draeger 800+, широко используемого в Российской Федерации для очистки воздушно-дыхательных смесей от диоксида углерода для анестезиологии, в процессе сорбции СО2. Показано, что образование более крупных кристаллитов СaCO3 чем у предшественника и его последующее накопление в процессе хемосорбции CO2 приводит к перестройке текстуры, уменьшению общего объема пор материала от 0.36 до 0.29 см3 г‒1 и площади удельной поверхности от 26 до 15 м2 г–1. Скорость накопления СаСО3 из-за уменьшения поверхности доступной газу существенно уменьшается после 60 мин хемосорбции. Размер ОКР по данным РФА кристаллитов Са(ОH)2 увеличивается с 10 до 50 нм.
Полученные экспериментальные зависимости времени защитного действия сорбента от входной скорости потока, концентрации СО2 в газовой смеси и высоты слоя хорошо описываются эмпирическим уравнением Шилова. По результатам линейной аппроксимации экспериментальных данных были определены коэффициенты уравнения Шилова, полученная зависимость может быть использована для оценки времени защитного действия сорбента.
Исследование выполнено при финансовой поддержке Российского фонда фундаментальных исследований и Правительства Новосибирской области РФ в рамках научного проекта № 19-43-543013. Работа выполнена при частичной финансовой поддержке Российского научного фонда в рамках научного проекта № 19-73-00079, а также при частичной финансовой поддержке в рамках государственного задания ФГБУН ИК СО РАН (проект АААА-А17- 117041710087-3).
Авторы заявляют об отсутствии конфликта интересов, требующего раскрытия в данной статье.
Список литературы
Морган-мл. Дж.Э., Мэгид С.М. Клиническая анестезиология. Кн. 1 / пер. с англ. 2-е изд., испр. М.: Бином, 2001. С. 28.
Jonathan L.S., David G.K., Randal J.K. // J. Chem. Health Safety. 2009. V. 16. P. 18. https://doi.org/10.1016/j.jchas.2008.06.003
Гладышев Н.Ф., Гладышева Т.В., Путин Б.В. и др. Известковые поглотители нового поколения. – М.: Изд. дом “ Спектр”, 2012. С. 9.
Гладышева Т.В., Гладышев Н.Ф., Дворецкий С.И. и др. Известковые хемосорбенты. Получение. Свойства. Применение. М.: Издательский дом “Спектр”, 2015. С. 5.
Murray J.M., Renfrew C.W., Bedi A. et al. // Anesthesiology. 1999. V. 91. P. 1342.
Виталев Н.А., Родионов В.Я., Прокофьев А. Д. // Новости хирургии. 1997. № 4. С. 21.
Каташинский О.Ю., Золотарев А.И., Графов А.П. и др. // Акт. проб. транс. мед. 2012. № 4 (30). С. 91.
Harvey D., Pollock N.W., Gant N. et al. // Diving Hyperb. Med. 2016. V. 46. № 2. P. 92.
Sieber A., Pyle R. // Underwater Tech. 2010. V. 29. № 2. P. 73. https://doi.org/10.3723/ut.29.073
Gai W.M., Deng Y.F., Du Y. // Ind. Eng. Chem. Res. 2016. V. 40. 10794. https://doi.org/10.1021/acs.iecr.6b02314
Du Y., Gai W.M., Jin L.Z. // J. Clean. Prod. 2018. V. 176. P. 216. https://doi.org/10.1021/acs.iecr.6b02314
Isa M.C., Yusoff N.H.N., Yati M.S.D. et al. // Defence S&T Tech. Bull. 2012. V. 5. № 1. P. 1–10.
Юркевич А.А., Ивахнюк Г.К., Федоров Н.Ф. Технологические основы производства химических компонентов систем жизнеобеспечения. СПб.: Менделеев. 2014. С. 288.
Danckwerts P.V., Kennedy A.M. // Chem. Eng. Sci. 1958. V. 8. №. 3–4. P. 201.
Фенелонов В.Б. Введение в физическую химию формирования супрамолекулярной структуры адсорбентов и катализаторов. Новосибирск: СО РАН, 2002. С. 371.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии


