Журнал физической химии, 2021, T. 95, № 7, стр. 975-981
Фазовые равновесия и термодинамика сплавов системы Ni–Pr
В. Г. Кудин a, Л. А. Романова b, М. А. Шевченко c, В. С. Судавцова b, *
a Киевский национальный университет имени Тараса Шевченко
Киев, Украина
b Институт проблем материаловедения им. И.Н. Францевича
Киев, Украина
c The University of Queensland
Brisbane, Australia
* E-mail: sud.materials@ukr.net
Поступила в редакцию 26.06.2020
После доработки 26.10.2020
Принята к публикации 13.11.2020
Аннотация
Методом изопериболической калориметрии исследованы энтальпии смешения расплавов системы Ni–Pr (0 < xNi < 0.6) при 1600 ± 1 K. Энтальпии смешения расплавов системы Ni–Pr характеризуются значительными экзотермическими величинами. Минимум энтальпий смешения расплавов изученной системы составляет –35.3 ± 0.9 кДж/моль при xNi = 0.6. Используя модель идеальных ассоциированных растворов (ИАР), оценены активности компонентов и мольные доли наиболее стабильных ассоциатов в расплавах системы Ni–Pr. При этом использованы как полученные нами термохимические данные, так и литературные (энтальпии образования соединений PrmNin, диаграмма состояния системы Ni–Pr). Для расчетов выбрано пять ассоциатов. Показано, что активности компонентов в расплавах этой системы проявляют большие отрицательные отклонения от закона Рауля и в них преобладает ассоциат PrNi2.
Сплавы никеля являются основой большинства жаропрочных и конструкционных материалов, применяемых в авиационной промышленности, турбиностроении и других важных отраслях народного хозяйства. Изделия из них нуждаются в высоком качестве сплавов, которые формируются преимущественно на стадии выплавки. При производстве и сварке никелевых сплавов важно использовать оптимальные, научно обоснованные технологии, основанные на их физико-химических свойствах. Сплавы двойных систем Ni–Ln (Ln–лантаноид) перспективны как материалы с широким комплексом уникальных механических и физико-химических свойств (особенно как накопители водорода), а также являются основой ряда аморфных материалов. Для разработки наиболее рациональных методов получения и применения этих сплавов и лигатур, в частности систем Ni–Ln, необходима точная информация об их диаграммах состояния и тесно связанных с ними термодинамических характеристиках. Это также важно для углубления представлений о фазах тройных систем [1].
В [2–19] описана диаграмма состояния системы Ni–Pr. В одной из последних работ по этой теме [2] методом дифференциального термического анализа (ДТА) были исследованы пять отожженных сплавов. Из данных [2–6], а также из энтальпий образования интерметаллидов системы Ni–Pr с помощью программного обеспечения WinPhad получен оптимальный набор термодинамических параметров. В работе [3] диаграмма состояния системы Ni–Pr со стороны Pr была пересмотрена с использованием результатов ДТА, дифференциальной сканирующей калориметрии и сканирующей электронной микроскопии.
Также оценена диаграмма состояния системы Ni–Pr [19], основанная преимущественно на данных ДТА и РФА [4, 5]. Рассчитанная диаграмма представлена в [20]; она основана на экспериментальных данных [4–6]. В [21] сопоставлены диаграммы состояния системы Ni–Pr, полученные в [2, 20].
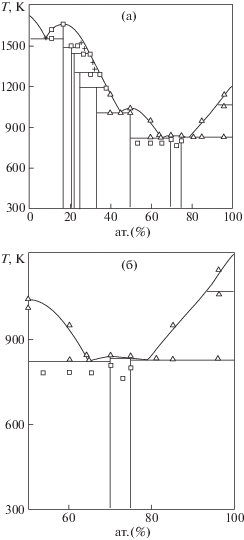
Установлено, что диаграммы состояния системы Ni–Pr , полученные в [2, 20], в основном, согласуются, кроме области ликвидуса вблизи интерметаллидов Pr7Ni3 и Pr3Ni. На рис. 1а, б приведена оптимизированная диаграмма состояния системы Ni–Pr [22], в полном и ограниченном интервале составов. Значения температур и составы фаз в нонвариантных реакциях нами взяты из табл. 4 работы [22] и нанесены на рис. 1а, б. Оптимизированная [22] диаграмма состояния системы Ni–Pr корреллирует с известной из литературы.
Энтальпии образования интерметаллида PrNi2 определены методом ДТА при изучении кинетики реакции их образования [23] и PrNi, PrNi2, PrNi5 разными вариантами калориметрических исследований [24–28]. Только в работе [29] методом калориметрии проведены исследования термохимических свойств расплавов никеля с некоторыми лантаноидами, в том числе и с празеодимом. Полученные первые парциальные и минимальные интегральные энтальпии смешения расплавов никеля с некоторыми лантаноидами приведены в [29]. Данные представлены также в виде коэффициентов ортогональных полиномов. Так, минимальное значение энтальпии образования расплавов системы Ni–Pr равно –30.7 ± 1.6 кДж/моль при хPr = = 0.42, а первые парциальные энтальпии для Ni и Pr соответственно равны –83 ± 7 и –161 ± ± 6 кДж/моль при 1750 К.
Новое термодинамическое моделирование диаграммы состояния системы Ni–Pr с использованием метода CALPHAD выполнено в [22] на основе экспериментальных данных о фазовых равновесиях [3, 5, 6], энтальпиях образования интерметаллидов и расплавов [24–27, 29]. Рассчитанная в [22] диаграмма состояния системы Ni–Pr согласуется с данными [3, 5, 6] (рис. 1б), а энтальпии образования интерметаллидов с аналогичными данными [24–27]. Однако отсутствует корреляция с расположением минимума энтальпий смешения этих расплавов с данными [29]. В [22] минимум энтальпии смешения расплавов приходится на состав хPr = 0.6, а в [29] – на хPr = = 0.42. Но из термохимических свойств расплавов многих систем Ni–Ln известно, что минимум энтальпий смешения сдвинут в сторону Ni, так как наиболее тугоплавким соединением в этих системах является фаза LnNi.5 и фазы близкие к ней по составу. Так как ассоциатов такого сложного состава в расплавах образуется мало, то минимум энтальпий смешения расплавов многих систем Ni–Ln находится при хLn от 0.38 до 0.42, а не при 0.6, как в [22]. Кроме того, в [22] не учтены значения энтальпий образования интерметаллида PrNi2, определенные методом калориметрии в работе [28]. Поэтому на зависимости энтальпий образования никелидов Pr в интервале составов от хPr = 0.18 до хPr = 0.6 в [22] получился размытый минимум, который не совпадает с данными [28].
В ряде исследований были синтезированы соединения: Ln5Co19 и Ln5Ni19, где Ln представляют собой: La, Ce, Pr, Nd, Sm, например [30–35], но только для некоторых они представлены на диаграммах состояния двойных систем Co(Ni)–Ln. Из этих работ ясно, что их Тобр ~ на 40–60 К выше, чем для соответствующих фаз со стехиометрией 2/7 – Ln2Ni7. Принимая во внимание этот факт, мы представили на диаграмме состояния системы Ni–Pr фазу Pr5 Ni19, которая до этого отсутствовала на ней (рис. 1a). Надеемся, что вскоре температура ее образования будет определена более точно.
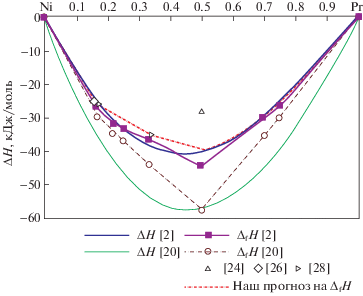
В [2] рассчитаны с помощью программного обеспечения WinPhad энтальпии и энтропии образования расплавов и интерметаллидов системы Ni–Pr. Методом CALPHAD были критически оценены свойства сплавов систем Co–Pr, Er–Ni и Ni–Pr [20]. Термодинамические свойства фаз этих систем (жидких, ОЦК, ГЦК, ГПУ и ДГПУ) аппроксимированы уравнением Редлиха–Кистера, а интерметаллические соединения рассматривались, как стехиометрические. В результате получены самосогласованные термодинамические параметры систем Co–Pr, Er–Ni и Ni–Pr. По вычисленным в [20] полиномам, мы рассчитали значения энтальпий образования интерметаллидов и расплавов системы Ni–Pr (рис. 2). Вычисленные в работах [2, 20] энтальпии и энтропии образования интерметаллидов системы Ni–Pr представлены в табл. 1. Все результаты работы [2] менее экзотермичны, чем [20]. Это характерно и для энтальпий смешения расплавов этой системы, рассчитанных в этих работах. Поэтому, безусловно, требуется их экспериментальная проверка.
Исследование кинетики реакции образования соединений редкоземельных металлов (Pr, Gd, Dy или Er) с переходными металлами (Fe, Co или Ni) выполнено методом ДТА в [22]. Все полученные соединения AB2 имели структуру типа MgCu2, то есть являются фазами Лавеса. Из полученных кинетических характеристик реакций были рассчитаны энтальпии образования соединений AB2. Так, энтальпия образования PrNi2 равна ‒8.1 кДж/моль. Данные для PrNi2 [23] намного менее экзотермичны, чем [28], Поэтому их не следует учитывать, так как они определены косвенным методом и имеют большую экспериментальную ошибку.
Сравнение энтальпий образования интерметаллидов PrNi5, PrNi2 и PrNi, рассчитанных в работах [2, 20], с определенными методом калориметрии [23–28] на рис. 2 показало, что более близкими к экспериментальным являются результаты, рассчитанные в [2].
В связи с этим, цель настоящей работы – определение энтальпий смешения расплавов системы Ni–Pr методом калориметрии, расчет активностей компонентов в расплавах по модели идеальных ассоциированных растворов (ИАР), прогноз термодинамических свойств при 1600 и 1750 К расплавов двойных систем Mn(Fe, Co, Ni, Cu) – Pr, а также сопоставление энтальпий образования соединений LnNi5 и минимальных значений расплавов систем Ni–Ln (лантаноид).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Опыты проводили в изопериболическом калориметре в атмосфере очищенного гелия под давлением выше атмосферного (1.5 атм) при температуре 1600 ± 1 K. Техника проведения эксперимента и обработки результатов были описаны ранее [36]. Чистота использованных металлов составляла 99.85% (Pr), 99.99% (Ni) и 99.96% (Mo и W). Вольфрам использовали как калибровочный материал в средине и конце опыта, а молибден для изготовления тиглей-контейнеров, которые не растворялись в расплавах с высоким содержанием празеодима. Также для проведения опытов использовали корундовые тигли, футерованные Y2O3. Перед опытом образцы Pr механически очищались от оксидной пленки и содержались в петролейном эфире. В ходе опытов автоматически в цифровом виде регистрировалось изменение температуры ($\Delta T$) жидкого металла-растворителя при введении в него навесок твердого компонента с начальной температурой 298 K. Масса металла-растворителя (Pr) в тигле составляла 1.2–1.4 г, а масса образцов Pr и Ni изменялась от 0.01 до 0.05 г, а W 0.06–0.07 г. Потери массы сплавов в опытах составляли менее 0.3 мас. %.
Регистрируемый в ходе опыта тепловой эффект возникает как сумма двух вкладов – эффекта нагрева образца от 298 K до температуры опыта T ($\Delta H_{{298}}^{T}$) для 1 моль образца, [37]) и собственно эффекта смешения ($\Delta {{\bar {H}}_{i}}$):
(1)
$ \pm k\int\limits_0^{{{t}_{\infty }}} {\Delta T(t)dt = \Delta H_{{298}}^{T} + \Delta {{{\bar {H}}}_{i}}} ,$ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Термохимические свойства расплавов системы Ni–Pr, установленные нами, приведены на рис. 3, а также в табл. 2 при округленных концентрациях, рассчитанных по полиномам, аппроксимирующих экспериментальные данные. Минимум энтальпии смешения расплавов изученной системы составляет –35.3 ± 0.9 кДж/моль при xNi = 0.6.
Таблица 2.
Парциальные и интегральные энтальпии смешения расплавов системы Ni–Pr при округленных концентрациях (1600 ± 1 К) в кДж/моль
| ${{x}_{{{\text{Ni}}}}}$ | $ - \Delta H$ ± 2σ | $ - \Delta \bar {H}_{{\Pr }}^{{}}$ ± 2σ | $ - \Delta \bar {H}_{{{\text{Ni}}}}^{{}}$ ± 2σ |
|---|---|---|---|
| 0 | 0 | 78 ± 4.6 | |
| 0.1 | 8.1 ± 0.6 | 0.1 ± 0.1 | 82 ± 4.6 |
| 0.2 | 16.2 ± 0.9 | 0.4 ± 0.5 | 79 ± 3.8 |
| 0.3 | 23.7 ± 1.4 | 3.0 ± 1.2 | 72 ± 3.3 |
| 0.4 | 29.8 ± 2.1 | 9.0 ± 2.6 | 61 ± 3 |
| 0.5 | 33.9 ± 2.8 | 20 ± 2.8 | 48 ± 2.8 |
| 0.6 | 35.3 ± 2.8 | 36 ± 3.4 | 34 ± 1.1 |
| 0.7 | 33.3 ± 1.9 | 62 ± 3.6 | 21 ± 0.5 |
| 0.8 | 27.2 ± 1.2 | 94 ± 3.7 | 10.4 ± 0.2 |
| 0.9 | 16.3 ± 0.7 | 137 ± 5.6 | 2.8 ± 0.1 |
| 1.0 | 0 | 193 ± 6.7 | 0 |
В [2] получены следующие полиномы для энтальпий и энтропий смешения расплавов расплавов системы Ni–Pr:
Из этих полиномов мы рассчитали значения энтальпий смешения расплавов и представили их на рис. 3. На рис. 3 приведены также парциальные и интегральные энтальпии смешения расплавов системы Ni–Pr, оцененные методом CALPHAD в [20].
Установленные энтальпии смешения расплавов системы Ni–Pr характеризуются значительными экзотермическими величинами и коррелируют с рассчитанными [2]. Аналогичные данные [20] являются наиболее экзотермичными и их нельзя считать достоверными.
Используя модель идеальных ассоциированных растворов (ИАР), мы также оценили активности компонентов и мольные доли наиболее стабильных ассоциатов в расплавах системы Ni‒Pr (рис. 4). При этом были использованы как полученные нами термохимические данные, так и литературные (энтальпии образования соединений PrmNin, диаграмма состояния системы Ni‒Pr). Для расчетов выбрано пять ассоциатов.
Рис. 4.
Активности компонентов и мольные доли ассоциатов в жидких или переохлажденных жидких сплавах системы Ni–Pr при 1600 ± 1 К, рассчитанные по модели ИАР.
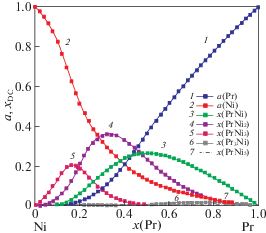
Активности компонентов в расплавах этой системы проявляют большие отрицательные отклонения от закона Рауля (рис. 4). Как и следовало ожидать, в них преобладает ассоциат PrNi2, а не PrNi5, который высоко координированный и вероятность его образования невелика.
Для подтверждения достоверности установленных нами термохимических параметров жидких сплавов системы Ni–Pr и выявления влияния природы 3d-металла на энергию межкомпонентного взаимодействия в них, мы сопоставили их с аналогичными данными, имеющимися в литературе для двойных систем Mn(Fe, Co, Ni, Cu)–Pr [28, 38–40] (табл. 3).
Таблица 3.
Первые парциальные для компонентов и минимальные интегральные энтальпии смешения расплавов двойных систем Mn(Fe, Co , Ni, Cu)–Pr (кДж/моль) по данным [29, 38–40]
| Система | Ат. № (Z) 3d-M |
$\bar {H}_{{}}^{\infty }$ | ${{\bar {H}}^{\infty }}$ | $ - \Delta H_{{\min }}^{{}}$ | T, K | Источник |
|---|---|---|---|---|---|---|
| Mn–Pr | 25 | –16.4 | –9 | –2.6 | 1600 | [29] |
| Fe–Pr | 26 | 3.6 | 5.4 | –0.7 | 1829 | [38] |
| Co–Pr | 27 | 40.2 | 33.8 | 12.0 | 1800 | [39] |
| Ni–Pr | 28 | 160.7 | 84 | 30.7 | 1750 | [29] |
| Ni–Pr | 28 | 192.8 | 78.7 | 35.3 | 1600 | Наши |
| Cu–Pr | 29 | 80 | 36.5 | 13.4 | 1523 | [40] |
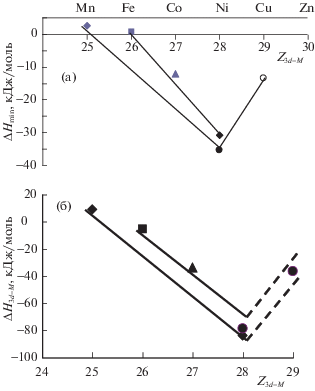
Представив ΔHmin в зависимости от порядкового номера 3d-металла, нам удалось аппроксимировать их различными линиями тренда для низких (1523, 1600 К) и более высоких температур (1750–1800 К), рис. 5а.
Как видно из рис. 5а, зависимости для расплавов двойных систем Mn(Fe, Co, Ni)–Pr при различных температурах почти параллельны, что позволяет прогнозировать ΔHmin рассмотренных систем для других температур, при которых не были проведены исследования. Причем с учетом Т опытов, наши данные согласуются с [29]. Представив же первые парциальные энтальпии смешения для 3d-металлов в расплавах двойных систем Mn(Fe, Co , Ni)–Pr (кДж/моль) по нашим и данным [28, 38–40] в зависимости от порядкового номера 3d-металла, (рис. 5б) видно, что значение для первой парциальной мольной $\Delta \bar {H}_{{{\text{Ni}}}}^{{}}$ [28] практически совпадает с полученным нами, хотя оно определено при более высокой температуре (1750 К). Это можно объяснить экспериментальными сложностями, связанными с работой с химически активными РЗМ при высоких температурах. Из полученной нами зависимости (рис. 5б) значение $\Delta \bar {H}_{{{\text{Ni}}}}^{{}}$ при 1750 К должно быть близким к ‒60 кДж/моль.
Из этих зависимостей также ясно, что энергия межкомпонентного взаимодействия в жидких сплавах рассмотренных систем возрастает в ряду; Mn–Pr < Fe– Pr < Cu–Pr ~ Co–Pr < Ni– Pr. Это можно объяснить электронным строением 3d-металлов. Известно, что Mn имеет стабильную, наполовину заполненную 3d-орбиталь, поэтому взаимодействовать с Pr он может с дополнительной затратой энергии, причем довольно большой. Наоборот, атом Ni имеет почти заполненную 3d-орбиталь, поэтому он при образовании сплавов с Pr будет стремиться застроить ее и перейти в стабильное состояние за счет перетягивания внешних электронов последнего. Это согласуется с тем, что сильная энергия межкомпонентного взаимодействия чаще всего наблюдается в расплавах, содержащих Ni и большинство РЗМ (за исключением систем Ni–Eu, Ni–Yb, в которых она существенно меньше [36]). Так как для расплавов некоторых систем Ni–РЗМ определены энтальпии смешения нами и другими авторами [29, 42–44] мы построили зависимости ΔHmin от порядкового номера РЗМ при 1750 K на рис. 6.
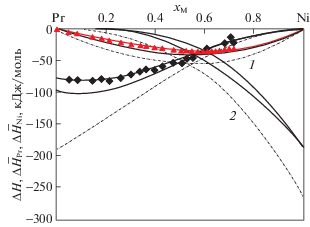
Рис. 6.
Зависимости ΔHmin расплавов и энтальпий образования соединений LnNi5 систем Ni–Ln от порядкового номера Ln. Точки: $\blacksquare $, $\vartriangle $, $\square $,  – экспериментальные для ΔHmin (наши, [29, 42–44]) и экспериментальные для ΔfH:$\bigcirc $ – [24],
– экспериментальные для ΔHmin (наши, [29, 42–44]) и экспериментальные для ΔfH:$\bigcirc $ – [24],  – [27], $\blacktriangle $ – [41]; сплошные и штриховые линии тренда – наш прогноз.
– [27], $\blacktriangle $ – [41]; сплошные и штриховые линии тренда – наш прогноз.
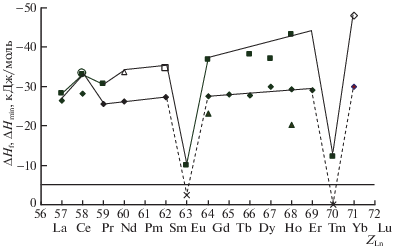
Наблюдаемая монотонная зависимость имеет отклонения для систем, содержащих Ce, Eu, Yb. Это связано с тем, что Ce может проявлять валентность четыре, а Eu и Yb – два.
Наиболее тугоплавкими интерметаллидами систем Ni–Ln являются LnNi5, и для большинства из них известна экспериментальная информация и теоретические оценки их энтальпий образования. В связи с этим было целесообразно сопоставить их в зависимости от порядкового номера Ln используя данные [23, 25, 41] (рис. 6). Ясно, что большинство точек укладываются на прямую линию, за исключением энтальпий образования соединений двойных систем Ni–Gd(Er) [41] и для двойных систем Ce(Eu, Yb)–Ni. Последнее можно объяснить электронным строением Ce, Eu, Yb и Ni, а заниженные по абсолютным значениям энтальпии образования соединений двойных систем Ni–Gd(Er) [41] – экспериментальными неточностями. Так как энтальпии образования Eu(Yb)Ni5 были рассчитаны нами по модели ИАР [36], мы для их проверки сопоставили построенные последние две зависимости от порядкового номера Ln на одном рис. 6. Выявлено, что обе зависимости практически симбатны, без учета энтальпий образования соединений Eu(Yb)Ni5. Чтобы сделать их симбатными, энтальпии образования соединений Eu(Yb)Ni5 должны быть менее экзотермичными, чем рассчитанные нами по модели ИАР [36]. Это вполне возможно, так как информация о свойствах фаз и диаграммах состояния двойных систем Eu(Yb)–Ni практически отсутствует. Как видно из рис. 6, энтальпии образования соединений Eu(Yb)Ni5 должны быть близки к –2 и –12 кДж/моль соответственно.
Следует отметить, что энтальпии образования LnNi5 немного менее экзотермичны, чем ΔHmin расплавов систем Ln–Ni. Это несколько не коррелирует с аналогичными данными для других систем, например, Al–Ln и требует объяснения на базе новых теоретических и экспериментальных данных.
Таким образом, установлено, что энтальпии смешения расплавов системы Ni–Pr являются значительными экзотермическими величинами во всем интервале концентраций и согласуются с литературными с учетом температур исследования (1600 и 1750 К). Рассчитанные по модели ИАР активности компонентов, в расплавах этой системы проявляют большие отрицательные отклонения от закона Рауля. Как и следовало ожидать, в них преобладает ассоциат PrNi2.
Сопоставление зависимостей ΔHmin расплавов и энтальпий образования соединений LnNi5 систем Ni–Ln от порядкового номера Ln выявило, что обе зависимости практически симбатны. Причем большинство точек укладываются на прямые линии тренда, кроме данных для двойных систем Eu(Yb)–Ni.
Список литературы
Rogl P., in: Gschneidner K.A. Jr., Eyring L.R. (Eds.) // Handbook on the Physics and Chemistry of Rare Earths. V. 7. North-Holland Physics Publishing, Amsterdam, 1987. P. 1.
Huang M., Lograsso T.A. //J. of Alloys and Compounds. 2005. V. 395. P. 75.
Huang M., Wu D., Dennis K.W., Anderegg J.W. et al. // Phase Equilib. 2005. V. 26. P. 209.
Vogel R., Fülling W. // Metallforschung. 1947. № 2. P. 97.
Pan Y.Y., Cheng C.S. // Chinese National Symposium on Phase Diagrams, Kunming, September, 1984 (in Chinese).
Qi G., Li Z., Itagaki K., Yazawa A. // Mater. Trans. JIM. 1989. V. 30. P. 583.
Gschneidner K.A. // Rare Earth Alloys A Critical Review of the Alloy Systems of the Rare Earth, Scandium, and Yttrium Metals. Van Nostrand Princeton, N.J. 1961.
Buschow K.H.J., Van der Goot A.S. // Less-Comm J. Met. 1970. V. 22. P. 419.
Wernick J.H., Geller S. // Acta Cryst. 1959. V. 12. P. 662.
Dwigh A.E. // Trans. Am. Soc. Metals. 1961. V. 53. P. 479.
Paccard D., Pauthenet R. // C.R. Acad. Sci. Ser. A. B. 1967. V. 264B. P. 1056.
Wernick J.H., Geller S.// Trans. Metall. Soc. AIME. 1960. V. 218. P. 866.
Dwight A.E., Conner R.A. Jr., Downey J.W. // United States Clearinghouse for Federal Scientific and Technical Information. AD Report. 1965. P. 35.
Abrahams S.C., Bernstein J.L., Sherwood R.C. et al. // Phys. Chem. Solids. 1964. V. 25. P. 1069.
Walline R.E., Wallace W.E. // J. Chem. Phys. 1964. V. 41. P. 1587.
Lemaire R., Paccard D. // Bulletin de la Societe Francaise de Mineralogie et de Cristallographie. 1967. V. 90. P. 311.
Kissell F., Tsuchida T., Wallace W.E. // J. Chem. Phys. 1966. V. 44. P. 4651.
Olcese G.L. Less-Comm J. // Met. 1973. V. 33. P. 71.
Pan Y.Y., Nash P. Bull. Alloy Phase Diag. // 1989. V. 10. P. 253.
Du Z., Wang D., Zhang W. J. Alloys Compd. // 1999. V. 284. P. 206.
Okamoto H. // J. Phase Equilibri. 2005. V. 26. № 6. P. 650.
Rahou Z., Mahdouk K., Moustain D. et al. // J. Alloys Compd. 2015. V. 620. P. 204.
Deodhar S.S., Ficalora P.J. Metall. Trans. A: Phys. Metall. Mater. Sci. 1975. V. 6. P. 1909.
Pasturel A., Colinet C., Allibert C. et al. // Physica Status Solidi B: Basic Res. 1984. V.125. P. 101.
Colinet C., Pasturel A., Buschow K.H.I. // Met. Trans. 17A. 1986. P. 777.
Guo Qi, Kleppa O.L. //Met. Mater. Trans. 25B. 1994. P. 73.
Guo Qi, Kleppa O.L. // J. Alloys Compd. 1998. V. 270. P. 212.
Delsante S., Stifanese R., Borzone G. // J. Chem. Thermodyn. 2013. V. 65. P. 73.
Nikolaenko I.V. // J. Alloys Compd. 225. 1995. 474–479.
Khan Y., Feldmann D. // J. Less-Com. Met. 1973. V. 33. P. 305.
Yamamoto T., Inui H., Yamaguchi M. et al. // Acta Mater. 1997. V. 45. P. 5213.
Lemort L. et al. // J. Alloys Compd. 2011. V. 509. P. S823.
Iwase K., Sakaki K., Matsuda J. et al. Inorg. Chem. 2011. V. 50. P. 4548. https://doi.org/10.1021/ic200253w
Mardani M., Fartushna I., Khvan A. et al. //J. Alloys Compd. V. 781. 2019. P. 524.
Fartushna I., Mardani M., Bajenova I. et al. // J. Alloys Compd. 2020. V. 845. P. 15635.
Березуцкий В.В., Шевченко М.А., Иванов М.И., Судавцова В.С. // Журн. физ. химии. 2014. Т. 88. № 9. С. 1297. https://doi.org/10.1134/S0036024414090064
Dinsdale A.T. // Calphad. 1991. V. 15. № 4. P. 319.
Ivanov M., Berezutski V., Usenko N., Kotova N. // Intern. J. of Materials Research. 2013. V. 104 (9). P. 849.
Судавцова В.С., Шевченко М.А., Кудин В. Г. и др. Порошковая металлургия. 2017. № 1–2. С. 110.
Николаенко И.В., Турчанин М.А. О закономерностях энергетики смешения меди с РЗМ. Расплавы. 1988. Т. 2. № 6. С. 75.
Schott J., Sommer F. // J. Less-Common Metals. 1986. V. 119. P. 307.
Судавцова В.С., Шевченко М.О., Іванов М.I. и др. // Порошкова металургія. 2019. № 9/10. С. 107.
Березуцкий В.В., Иванов М.И. // Там же. 2009. № 7/8. С. 111.
Ivanov M., Berezutski V., Usenko N., Kotova N. // Int. J. Mater. Res. 2017. V. 108. № 1. P. 29. https://doi.org/10.3139/146.111445
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии