Журнал физической химии, 2021, T. 95, № 7, стр. 982-986
Экспериментальное изучение высокотемпературной области системы Ca3(PO4)2–CaKPO4–CaNaPO4
Н. К. Орлов a, b, *, А. К. Киселева a, П. А. Милькин a, П. В. Евдокимов a, c, d, В. И. Путляев a, c, Yaxiong Liu e
a Московский государственный университет имени М.В. Ломоносова, Факультет наук о материалах
119991 Москва, Россия
b Federal Institute for Materials Research and Testing (BAM), Unter den Eichen 44-46
12203 Berlin, Germany
c Московский государственный университет имени М.В. Ломоносова,
Химический факультет
119991 Москва, Россия
d Российская академия наук, Институт общей и неорганической химии им. Н.С. Курнакова
119071 Москва, Россия
e Institute of Advanced Manufacturing Technology
710049 Xi’an, Shanxi, P.R. China
* E-mail: nicolasorlov174@gmail.com
Поступила в редакцию 03.09.2020
После доработки 12.10.2020
Принята к публикации 13.10.2020
Аннотация
Изучена высокотемпературная область фазовой диаграммы Ca3(PO4)2–CaNaPO4–CaKPO4. Определены составы фазовых полей при температуре 1200°C. Показано, что область трикальциевого состава при данной температуре состоит из двух однофазных областей – высокотемпературного α-Ca3(PO4)2 и низкотемпературного β-Ca3(PO4)2. Определены верхние температуры существования некоторых фазовых полей сечения фазового треугольника при 1200°C.
Исследование материалов для костного имплантирования ведется уже долгое время и направлено, в своей основной массе, на увеличение уровня резорбируемости в среде организма. На данный момент предложено несколько решений этой задачи, наиболее перспективные из которых – уменьшение объема имплантата, а если точнее – количество материала в имплантате (изготовление имплантата в виде каркаса с объемом пустого пространства до 70%) [1–3], и изменение состава материала [4–6]. В последнем методе речь идет об отходе от используемых в настоящий момент различных форм апатита общей формулой Ca10(PO4)6X(2) (где чаще всего X = OH-, но также встречаются F–, ${\text{CO}}_{2}^{{2 - }}$) и трикальциевого фосфата (ТКФ) Ca3(PO4)2 [7–11] к соединениям с менее стабильной решеткой. Таковыми являются, например, соединения замещенного ТКФ Ca3 ‒ xM2x(PO4)2, в котором часть ионов кальция замещена щелочными металлами (M = Na+, K+). Такие материалы показывают лучший уровень резорбции, а варьирование соотношения Са/К/Na предоставляет свободу выбора фазового состава и регулирования уровня резорбции [12].
Однако, при использовании любого из вышеперечисленных подходов – создании каркаса или изменении химического состава материала – происходит падение прочностных свойств. Одной из причин такого поведения являются фазовые переходы, которые начинают происходить в процессе нагревания/охлаждения в материале при изменении при внедрении в решетку посторонних ионов. Знание фазовых отношений и границ существования твердых фаз необходимо при спекании в том числе для выбора оптимального температурного режима.
Упрощая, можно сказать, что соединения Ca3 ‒ xM2x(PO4)2 (M = Na+, K+, х = 0–1) представляют собой смесь трех основных компонентов: Ca3(PO4)2 (ТКФ), CaNaPO4 (натриевый ренанит) и CaKPO4 (калиевый ренанит). Соответственно, для успешного спекания необходимо знание фазовых отношений в системе Ca3(PO4)2–CaNaPO4–CaKPO4. В литературе представлены сведения для части этой системы [13–16], но некоторые из указанных данных нуждаются в перепроверке, в то время как некоторые данные полностью отсутствуют.
Целью данной работы было выяснение фазовых отношений в высокотемпературной области системы Ca3(PO4)2–CaNaPO4–CaKPO4.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Смешанные тройные фосфаты были синтезированы в соответствии со следующим уравнением твердофазной реакции:
(1)
$\begin{gathered} (1 - x){\text{С}}{{{\text{а}}}_{3}}{{({\text{Р}}{{{\text{О}}}_{{\text{4}}}})}_{2}} + 2xy{\text{CaKP}}{{{\text{O}}}_{4}} + \\ + \;2x(1 - y){\text{CaNaP}}{{{\text{O}}}_{4}} \to \\ \to {\text{C}}{{{\text{a}}}_{{3 - x}}}{{({{{\text{K}}}_{y}}{\text{N}}{{{\text{a}}}_{{1 - y}}})}_{2}}_{x}{{({\text{P}}{{{\text{O}}}_{4}})}_{2}}, \\ \end{gathered} $Получение двойных фосфатов кальция и щелочных металлов осуществляли твердофазным методом по уравнению реакции:
(2)
$\begin{gathered} {\text{C}}{{{\text{a}}}_{{\text{2}}}}{{{\text{P}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{7}}}} + {{{\text{M}}}_{{\text{2}}}}{\text{C}}{{{\text{O}}}_{3}} \to 2{\text{CaMP}}{{{\text{O}}}_{4}} + {\text{C}}{{{\text{O}}}_{2}}{\kern 1pt} \uparrow \\ ({\text{M}} = {\text{Na}},{\text{K}},{\text{Ca}}), \\ \end{gathered} $(3)
$\begin{gathered} {\text{Ca}}{{({\text{N}}{{{\text{O}}}_{3}})}_{2}} + {{({\text{N}}{{{\text{H}}}_{4}})}_{2}}{\text{HP}}{{{\text{O}}}_{4}} + 2{{{\text{H}}}_{{\text{2}}}}{\text{O}} = \\ = {\text{CaHP}}{{{\text{O}}}_{4}} \cdot 2{{{\text{H}}}_{{\text{2}}}}{\text{O}}{\kern 1pt} \downarrow + \;2{\text{N}}{{{\text{H}}}_{{\text{4}}}}{\text{N}}{{{\text{O}}}_{3}}, \\ \end{gathered} $Смеси были размолоты в планетарной мельнице в течение 10 мин в среде ацетона, а затем подвергнуты обжигу в интервале температур 800–1200°C продолжительностью до 36 часов. Полученные после отжига порошки дезагрегировали помолом в планетарной мельнице Рulverisette (Fritsch, Германия).
Исследования фазового состава образцов проводили с помощью X-ray diffraction (XRD) на дифрактометре Rigaku D/Max-2500 с вращающимся анодом (Япония). Съемку проводили в режиме на отражение (геометрия Брегга−Брентано на отражение) с использованием CuKα. излучения (длина волны λ = 1.54183 Å). Для коррекции спектра в качестве внутреннего стандарта использовали порошок кремния (ASTM). Качественный анализ полученных рентгенограмм проводили с помощью программы WinXPOW (STOE, Germany) при использовании базы данных ICDD PDF-2.
Дифференциально-термический (ДТА) и термогравиметрический (ТГ) анализ образцов проводили с использованием синхронного термоанализатора с вертикальной загрузкой образцов STA 409 PC Luxx (Netzsch, Германия).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
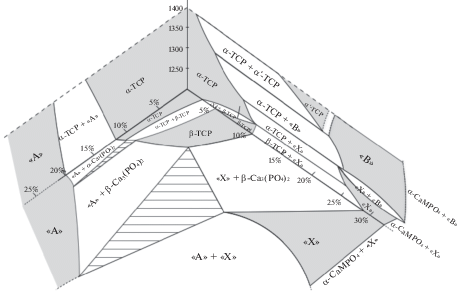
В качестве исследуемой области фазовой диаграммы Ca3(PO4)2–CaNaPO4–CaKPO4 была выбрана область от 1200 до 1400°С. Это связано с особенностями спекания кальций-фосфатных материалов. Как показывают исследования [11, 15] оптимальная температура спекания замещенных фосфатов кальция лежит не ниже 1200°С ввиду недостаточной диффузии ионов при температуре ниже. В то же время ограничение в 1400°С обусловлено температурами плавления компонентов – при данной температуре. Исследование границ фазовых полей проводилось для температуры 1200°С.
Точки на фазовой диаграмме выбирались линиями из вершины, в которой расположен ТКФ к стороне CaNaPO4–CaKPO4. Таким образом удалось в лучшей степени изучить область, ближнюю к ТКФ, так как именно она, а если точнее, ее левая верхняя часть является, на наш взгляд наиболее перспективной с точки зрения производства костных имплантатов. Близость к большему содержанию кальция позволяет сохранить скорость резорбции на адекватном уровне (при больших значениях содержания K и Na скорость растворения становится слишком высокой [15]), а удаленность от стороны Ca3(PO4)2–CaKPO4 позволяет избежать чрезмерной цитотоксичности. Соответственно, были выбраны направления ТКФ–CaK0.2Na0.8PO4, ТКФ–CaK0.4Na0.6PO4 и ТКФ–CaK0.6Na0.4PO4 (рис. 1).
Рис. 1.
Фазовый треугольник Ca3(PO4)2–CaNaPO4–CaKPO4 со схематично нанесенными точками (1–9), соответствующих исследованным составам (табл. 1).

Таблица 1.
Фазы найденные в процессе исследований
| N | Линия ТКФ–CaK0.2Na0.8PO4 | Линия ТКФ–CaK0.4Na0.6PO4 | Линия ТКФ–CaK0.6Na0.4PO4 |
|---|---|---|---|
| 1 | β-Ca3(PO4)2 | β-Ca3(PO4)2 | β-Ca3(PO4)2 |
| 2 | β-Ca3(PO4)2 + “А” | β-Ca3(PO4)2 | β-Ca3(PO4)2 + “Х” |
| 3 | β-Ca3(PO4)2 + “А” | β-Ca3(PO4)2 + “А” | “Х” + “А” |
| 4 | β-Ca3(PO4)2 + “А” | β-Ca3(PO4)2 + “А” + “Х” | β-Ca3(PO4)2 + “А” + “Х” |
| 5 | β-Ca3(PO4)2 + “А” | β-Ca3(PO4)2 + “А” + “Х” | “Х” + α-Rh* |
| 6 | “А” | β-Ca3(PO4)2 + “А” + “Х” | “Х” + α-Rh* |
| 7 | “А” | “А” + “Х” | α-Rh* |
| 8 | “А” | – | – |
| 9 | “А” + α-Rh* | – | – |
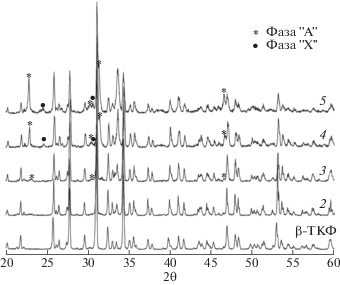
Исследования фазового состава проводились методом закалки образцов на металлических пластинах с интересующей температуры. Таким образом удавалось предотвратить протекание достаточно быстро проходящих фазовых превращений – при обычной закалке на воздухе рентгенофазовый анализ показывал присутствие низкотемпературных фаз. Скорость закалки составляла порядка 50 К/мин в случае закалки на воздухе и порядка 1000 К/мин в случае закалки порошков между металлическими пластинами. Результаты фазового анализа представлены на рис. 2. Видно, что во всех приведенных составах присутствует фаза β-ТКФ. По мере добавления щелочных металлов появляются фазы “А” и “Х”, что говорит о дестабилизации решетки трикальциевого фосфата и начале процессов его распада.
Рис. 2.
Фазовый состав образцов (2–5) по линии ТКФ–CaK0.4Na0.6PO4. Найденные в процессе исследований фазы указаны в табл. 1.
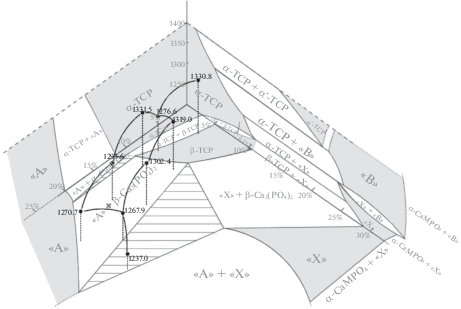
Полученные результаты были также представлены в более наглядном виде – сечения трехкомпонентной фазовой диаграммы при 1200°С. Для большей наглядности и проверки полученных результатов к сечению были дополнительно добавлены диаграммы Ca3(PO4)2–CaKPO4 и Ca3(PO4)2–CaNaPO4. Получившаяся область показана на рис. 3.
Стоит отметить, что при анализе рентгенограмм полученных образцов не было обнаружено фазы α-ТКФ, тем не менее, она указана на рис. 3, что связано с тем, что данная фаза существует при 1200°С в системе Ca3(PO4)2–CaKPO4, что означает, что она должна также уходить внутрь фазового треугольника Ca3(PO4)2–CaKPO4–CaNaPO4. Очевидно, область ее существования достаточно узкая, что не позволило установить ее наличие экспериментально при выбранном шаге составов. То же касается и двухфазной области “А” + α-ТКФ и трехфазной области “А” + α-Ca3(PO4)2 + β-Ca3(PO4)2.
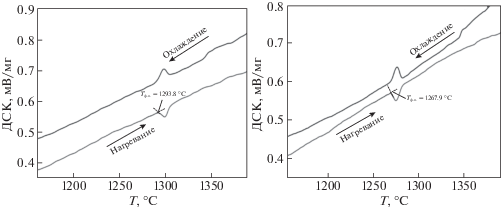
Исследование верхних границ найденных фазовых областей проводилось методом ДТА. Вид кривых ДТА представлен на рис. 4.
Различие в температурах начала тепловых эффектов обусловлено явлением переохлаждения, в связи с чем температура эффекта определялась по кривой нагрева. Полученные температуры не позволяют построить поверхности границ существования указанных фазовых полей, однако они дают представление о примерных температурных интервалах, возможных для спекания материалов из этой системы (рис. 5). Кроме того, исходя из слабой интенсивности, а также визуальных наблюдений образцов после исследования ДТА, полученные эффекты соответствуют переходам твердое–твердое, что говорит об отсутствии плавления ниже температуры 1400°С.
Таким образом, исследованы фазовые отношения в системе Ca3(PO4)2–CaKPO4–CaNaPO4 при температуре 1200°С. Область трикальциевого фосфата состоит из двух полей твердых растворов на основе α-Ca3(PO4)2 и β-Ca3(PO4)2, разделенные двухфазной областью. Помимо этого, при указанной температуре становятся стабильными три структуры на основе α-CaMPO4 (структура ренанита), “А” (структура нагельшмидтита) и “Х” (апатитоподобная структура). Выяснено, что в высокотемпературной области присутствуют две трехфазных области, содержащих фазы “А” + + α-Ca3(PO4)2 + β-Ca3(PO4)2 и “А” + β-Ca3(PO4)2 + + “Х”. Указанные поля становятся нестабильными при температурах ниже 1350°С и претерпевают переход в другие конденсированные фазы. Образование жидкой фазы при превышении указанных температур не наблюдалось.
Исследование выполнено при поддержке Российского фонда фундаментальных иследований в рамках проектов № 19-38-90199 и № 19-38-60063.
Список литературы
Ievlev V.M., Putlyaev V.I., Safronova T.V., Evdokimov P.V. // Inorg. Mater. 2015. T. 51. C. 1297. https://doi.org/10.1134/S0020168515130038
Hing K.A. // Int. J. Appl. Ceram. Technol. 2005. V. 2. P. 184. https://doi.org/10.1111/j.1744-7402.2005.02020.x
Zocca A., Colombo P., Gomes C.M., Günster J. // J. Am. Ceram. Soc. 2015. V. 98. P. 1983. https://doi.org/10.1111/jace.13700
Berger G., Gildenhaar R., Ploska U. // Biomaterials. 1995. V. 16. P. 1241. https: // doi.org/.https://doi.org/10.1016/0142-9612(95)98131-W
Bredig M.A. // J. Phys. Chem. V. 46 (1942) P. 747. https://doi.org/10.1021/j150421a009
Ando J. // Bull. Chem. Soc. Jpn. 1958. V. 31 P. 201.
Jarcho M. // Clin. Orthop. Relat. Res. 1981 P. 259. http: // www.ncbi.nlm.nih.gov/pubmed/7018783 (accessed March 25, 2019).
Jarcho M., Bolen C.H., Thomas M.B. et al. // J. Mater. Sci. 1976. V. 11. P.2027.https://doi.org/10.1007/PL00020328
Dorozhkin S.V., Epple M. // Angew. Chemie-International Ed. 2002. V. 41. P. 3130.
Kanazawa T. Inorganic phosphate materials. New-York: Elsevier, 1989.
Champion E. // Acta Biomater. 2013. V. 9 P. 5855. https://doi.org/10.1016/j.actbio.2012.11.029
Orlov N.K., Putlayev V.I., Evdokimov P.V. et al. // Inorg. Mater. 2018. V. 54. https://doi.org/10.1134/S0020168518050096
Znamierowska T. // Zesz. Nauk. Politech. Sl. 1982. V. 709. P. 33.
Znamierowska T. // Zesz. Nauk. Politech. Sl. 1982. V. 709. P. 45.
Orlov N.K., Evdokimov P.V., Milkin P.A. et al. // J. Eur. Ceram. Soc. 2019. V. 39. P. 5410. https://doi.org/10.1016/j.jeurceramsoc.2019.07.044.
Evdokimov P.V., Putlyaev V.I., Ivanov V.K. et al. // Russ. J. Inorg. Chem. 2014. V. 59. P. 1219. https://doi.org/10.1134/S0036023614110084
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии