Журнал физической химии, 2021, T. 95, № 8, стр. 1269-1277
Выявление аномалий газохроматографических индексов удерживания гомологов на основании их гомологических инкрементов
a Санкт-Петербургский государственный университет, Институт химии
198504 Санкт-Петербург, Россия
* E-mail: izenkevich@yandex.ru
Поступила в редакцию 01.08.2020
После доработки 01.08.2020
Принята к публикации 24.09.2020
Аннотация
Показано, что особенности газохроматографических индексов удерживания (RI) гомологов маскируются их “нормальной” гомологической зависимостью (~100 ед. индекса на гомологическую разность СН2), осложняя выявление их возможных аномалий. При сравнении значений RI гомологов в форме их гомологических инкрементов iRI = RI – 100x, где х = int(M/14), int – целая часть числа (эквивалентно M = 14x + yМ, уМ – номер гомологической группы соединения, yМ ≡ M($\bmod 14$)), выявлены две ранее специально не обсуждавшиеся аномалии хроматографического удерживания: первая из них – аномальное уменьшение значений iRI ди-н-алкилфталатов при увеличении числа атомов углерода в алкильных фрагментах, не связанное с вариациями их полярности или поляризуемости. Наиболее вероятной причиной представляется положение конформационных равновесий алкильных фрагментов молекул (преимущественно “свернутых” в клубки Гаусса) в молекулах орто-дизамещенных ароматических соединений. Среди многочисленных теоретически возможных структур такого типа наибольшее число гомологов с разным числом атомов углерода, позволяющее проследить аномалии их газохроматографических свойств, охарактеризовано только в ряду диалкилфталатов. Вторая аномалия относится к полиметилзамещенным ароматическим соединениям, содержащим заместители в орто-положениях друг к другу. Наличие такого структурного фрагмента приводит к аномальному увеличению значений iRI гомологов, что также не связано с их полярностью или поляризуемостью, а может быть объяснено стерическими препятствиями внутримолекулярному вращению заместителей относительно простых связей С(sp2)–C(sp3) (“эффект шестеренок”). Оба эффекта сопоставлены с обсуждавшимся в 1980-х гг. так называемым “эффектом пропильной группы”, величина которого для алифатических диенов не превышает 10 ед. индекса; в рассматриваемых же случаях аномалии RI диалкилфталатов достигают 160, а метилбензолов и метилнафталинов – 150 ед. индекса.
Привлечение газохроматографических индексов удерживания (RI) на стандартных неподвижных фазах в дополнение к масс-спектрам электронной ионизации органических соединений существенно увеличивает правильность хромато-масс-спектрометрической идентификации неизвестных аналитов (снижает уровни ошибок I-го и II-го рода). Число соединений, охарактеризованных справочными значениями RI, в настоящее время достигает ~140 тысяч [1]. Однако это количество не может охватить всего многообразия органических соединений, а процедуры непосредственного сравнения, как масс-спектров, так и RI со справочными данными, представляют собой важный, но всего лишь простейший уровень их интерпретации. Важное применение массивов справочной информации – их использование для идентификации еще не охарактеризованных соединений.
Один из возможных подходов к решению подобных задач предполагает выявление инвариантов гомологических рядов по значениям RI ранее охарактеризованных соединений с целью последующего применения для отнесения неизвестных аналитов к этим рядам (так называемая групповая идентификация). К подобным инвариантам относятся гомологические инкременты газохроматографических индексов удерживания, iRI [2]:
где х = int(M/14), int – функция, обозначающая целую часть числа (эквивалентно выражению M = 14x + yМ, уМ – номер гомологической группы соединения, yМ ≡ M(mod14)).Главная особенность iRI – компенсация гомологических вариаций самих индексов удерживания. Переход от предыдущих к следующим гомологам приводит к увеличению молекулярных масс на 14 Да, а значений RI – на ~100 (для так называемых нормальных линейных гомологов). Гомологические инкременты позволяют сравнивать молекулярные массы и индексы удерживания разных гомологов. В значениях iRI проявляется их зависимость от суммарного числа разветвлений sp3-углеродного скелета молекул (Z), которую в первом приближении можно аппроксимировать линейными уравнениями вида iRI = aZ + b. Такие зависимости – убывающие (a < 0), т.е. чем больше разветвлений углеродного скелета молекул, тем меньше значения iRI. Если области вариаций iRI для разных Z не перекрываются друг с другом, то это означает возможность определения величин Z [3]. Существование зависимостей iRI(Z) в некоторой степени усложняет групповую идентификацию аналитов, так как приходится рассматривать несколько альтернативных значений iRI, но подобная проверка нескольких гипотез представляется типичным приемом интерпретации данных в масс- и хромато-масс-спектрометрии.
Еще одно применение гомологических инкрементов индексов удерживания – оценка молекулярных масс гомологов, относящихся к определенным рядам, в масс-спектрах которых сигналы молекулярных ионов не регистрируются или малоинтенсивны [3, 4]. Подстановка в выражение х = (М – уМ)/14 [см. расшифровку обозначений в уравнении (1)] соотношения M = 14x + yМ и решение полученного уравнения относительно М приводят к следующему выражению:
Округление вычисляемых значений М проводят не до ближайших целых чисел, а до ближайших значений М, сравнимых с уМ по модулю 14, или, в символике теории вычетов, М ≡ уМ($\bmod 14$). Аналогичным образом, если варьируемым структурным параметром в пределах ряда структурных аналогов является число циклов в молекуле, то значения iRI оказываются эффективными и при решении таких задач [5].Таким образом, применение гомологических инкрементов индексов удерживания наиболее эффективно для гомологов одних и тех же рядов без вариаций числа разветвлений sp3-углеродного скелета их молекул. Проверка этого условия для нескольких сотен рядов подтверждает его корректность. Однако, вместе с тем, обнаружены примеры аномальных вариаций значений iRI в сериях гомологов, проявление и рассмотрение причин которых – цель настоящей работы.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Газохроматографические индексы удерживания на стандартных неполярных фазах. В качестве источника статистически обработанных значений газохроматографических индексов удерживания (RI) соединений разных классов на стандартных неполярных полидиметилсилоксановых неподвижных фазах, приведенных в табл. 1–6, использовали базу данных [1] (версия 2017 г.). При отсутствии информации в этой базе дополнительно привлекали сведения из коллекции автора. Единичные значения RI указаны без стандартных отклонений. В качестве источника справочных данных по дипольным моментам (μ, D), диэлектрическим проницаемостям (ε), а также относительным плотностям ($d_{4}^{{20}}$) и показателям преломления ($n_{{\text{D}}}^{{20}}$), необходимым для вычисления удельных рефракций ($r_{{\text{D}}}^{{20}}$), использовали справочное издание [6] и результаты поиска в Google.
Таблица 1.
Гомологические инкременты индексов удерживания ди-н-алкилфталатов 1,2-C6H4(CO2R)2 в сравнении с их дипольными моментами (μ, D), диэлектрическими проницаемостями (ε) и удельными рефракциями ($r_{{\text{D}}}^{{20}}$), М – молекулярная масса
| R | М | RI | iRI | μ, D | ε | $r_{{\text{D}}}^{{20}}$ |
|---|---|---|---|---|---|---|
| CH3 | 194 | 1425 ± 10 | 125 | 2.7–2.8 | 8.7 | 0.252 |
| C2H5 | 222 | 1564 ± 13 | 64 | 2.8 | – | 0.263 |
| C3H7 | 250 | 1744 ± 8 | 44 | – | – | 0.271 |
| C4H9 | 278 | 1924 ± 12 | 24 | 2.8–3.0 | 6.4–6.6 | 0.277 |
| C5H11 | 306 | 2122 ± 3 | 22 | 2.7 | 5.8–6.0 | 0.281 |
| C6H13 | 334 | 2306 ± 42 | 6 | – | 5.6 | 0.291 |
| C7H15 | 362 | 2475 ± 4 | –25 | – | – | 0.290 |
| C8H17 | 390 | 2686 ± 3 | –20 | 3.1 | 5.1–5.2 | 0.293 |
| C9H19 | 418 | 2876 ± 0 | –24 | – | 4.5–4.6 | 0.298 |
| C10H21 | 446 | 3067 | –33 | – | – | 0.297 |
Таблица 2.
Гомологические инкременты индексов удерживания диалкиловых эфиров бензол-1,4-дикарбоновой кислоты (диалкилтерефталатов) 1,4-C6H4(CO2R)2
| R | М | RI | iRI |
|---|---|---|---|
| CH3 | 194 | 1475 ± 7 | 175 |
| C2H5 | 222 | 1649 ± 1 | 149 |
| C3H7 | 250 | 1845 ± 10* | 145 |
| C4H9 | 278 | 2059 ± 9* | 159 |
| C5H11 | 306 | 2260 ± 2 | 160 |
| C6H13 | 334 | 2463 ± 3 | 163 |
| C7H15 | 362 | 2663 ± 3* | 163 |
| C8H17 | 390 | 2860* | 160 |
| Среднее значение: | 159 ± 9 | ||
* Значения в базе [1] отсутствуют, использован массив данных автора.
Таблица 3.
Гомологические инкременты индексов удерживания н-алкилбензоатов C6H5CO2R в сравнении с их диэлектрическими проницаемостями (ε)
| R | М | RI | iRI | ε |
|---|---|---|---|---|
| CH3 | 136 | 1072 ± 7 | 172 | 6.59–6.64 |
| C2H5 | 150 | 1150 ± 6 | 150 | 6.0 |
| C3H7 | 164 | 1249 ± 7 | 149 | 5.8 |
| C4H9 | 178 | 1354 ± 7 | 154 | 5.5 |
| C5H11 | 192 | 1454 ± 6 | 156 | 5.1 |
| C6H13 | 206 | 1556 ± 5 | 156 | 4.8 |
| C7H15 | 220 | 1660 ± 6 | 160 | – |
| C8H17 | 234 | 1762 ± 7 | 162 | – |
| C9H19 | 248 | 1859 ± 4* | 159 | – |
| C10H21 | 262 | 1963 ± 8* | 163 | – |
| C11H23 | 276 | 2067 ± 8 | 167 | – |
| C12H25 | 290 | 2170 ± 5* | 170 | – |
| Среднее значение | 160 ± 7 | |||
* Значения в базе [1] отсутствуют, использован массив данных автора.
Таблица 4.
Гомологические инкременты индексов удерживания н-алканкарбоновых кислот RCO2H в сравнении с их дипольными моментами (μ, D), диэлектрическими проницаемостями (ε) и удельными рефракциями ($r_{{\text{D}}}^{{20}}$)
| R | М | RI | iRI | μ, D | ε | $r_{{\text{D}}}^{{20}}$ |
|---|---|---|---|---|---|---|
| H | 46 | 512 ± 7 | 212 | 1.4 | 56–58 | 0.185 |
| CH3 | 60 | 624 ± 21 | 224 | 1.3–1.7 | 6.1–6.3 | 0.217 |
| C2H5 | 74 | 714 ± 15 | 214 | 1.7 | 3.1–3.4 | 0.237 |
| C3H7 | 88 | 807 ± 17 | 207 | 0.93 | 2.8–3.0 | 0.252 |
| C4H9 | 102 | 901 ± 15 | 201 | – | 2.7 | 0.263 |
| C5H11 | 116 | 982 ± 16 | 182 | – | 2.6 | 0.271 |
| C6H13 | 130 | 1078 ± 10 | 178 | – | 2.6 | 0.283 |
| C7H15 | 144 | 1194 ± 15 | 194 | – | 3.2 | 0.283 |
| C8H17 | 158 | 1272 ± 11 | 172 | – | – | 0.286 |
| C9H19 | 172 | 1362 ± 10 | 162 | – | – | 0.290 |
| C10H21 | 186 | 1472 ± 14 | 172 | – | – | 0.291 |
| C11H23 | 200 | 1556 ± 8 | 156 | – | – | –* |
| C12H25 | 214 | 1660 ± 9 | 160 | 0.76 | – | – |
| C13H27 | 228 | 1752 ± 10 | 152 | – | – | – |
| C14H29 | 242 | 1848 ± 9 | 148 | – | 2.3–2.4 | – |
| C15H31 | 256 | 1954 ± 11 | 154 | – | – | – |
| C16H33 | 270 | 2039 ± 1 | 139 | – | – | – |
| C17H35 | 284 | 2153 ± 16 | 153 | 1.7 | 2.3 | – |
| C18H37 | 298 | – | – | – | – | – |
| C19H41 | 312 | 2366 ± 7 | 166 | – | – | – |
Таблица 5.
Гомологические инкременты индексов удерживания н-алкил- и метилбензолов в сравнении с их удельными рефракциями $r_{{\text{D}}}^{{20}}$
| Заместители | М | RI | iRI | $r_{{\text{D}}}^{{20}}$ |
|---|---|---|---|---|
| Нет | 78 | 654 ± 7 | 154 | 0.335 |
| СН3 | 92 | 757 ± 6 | 157 | 0.338 |
| C2H5 | 106 | 850 ± 6 | 150 | 0.337 |
| C3H7 | 120 | 945 ± 5 | 145 | 0.337 |
| C4H9 | 134 | 1047 ± 6 | 147 | 0.336 |
| C5H11 | 148 | 1145 ± 3 | 145 | 0.336 |
| C6H13 | 162 | 1247 ± 6 | 147 | 0.335 |
| C7H15 | 176 | 1348 ± 2 | 148 | |
| C8H17 | 190 | 1454 ± 2 | 154 | |
| C9H19 | 204 | 1555 ± 3 | 155 | |
| C10H21 | 218 | 1659 ± 4 | 159 | |
| Среднее значение: | 151 ± 5 | 0.336 ± 0.001 | ||
| Нет | 78 | 654 ± 7 | 154* | 0.335 |
| СН3 | 92 | 757 ± 6 | 157* | 0.338 |
| 1,2-(CH3)2 | 106 | 881 ± 6 | 181 | 0.337 |
| 1,3-(CH3)2 | 106 | 860 ± 6 | 160* | |
| 1,4-(CH3)2 | 106 | 860 ± 6 | 160* | |
| 1,2,3-(CH3)3 | 120 | 1010 ± 6 | 210 | 0.337 |
| 1,2,4-(CH3)3 | 120 | 983 ± 5 | 183 | |
| 1,3,5-(CH3)3 | 120 | 962 ± 6 | 162* | |
| 1,2,3,4-(CH3)4 | 134 | 1139 ± 7 | 239 | 0.337 |
| 1,2,3,5-(CH3)4 | 134 | 1110 ± 6 | 210 | |
| 1,2,4,5-(CH3)4 | 134 | 1107 ± 5 | 207 | |
| Пентаметил | 148 | 1265 ± 5 | 265 | 0.347 |
| Гексаметил | 162 | 1431 ± 6 | 331 | –** |
| Среднее значение | 159 ± 3 | |||
Таблица 6.
Гомологические инкременты индексов удерживания н-алкил- и стерически затрудненных метилнафталинов
| Заместители | М | RI | iRI |
|---|---|---|---|
| Нет | 128 | 1162 ± 8 | 262 |
| 1-СН3 | 142 | 1290 ± 12 | 290 |
| 2-СН3 | 142 | 1273 ± 11 | 273 |
| 1-C2H5 | 156 | 1378 ± 11 | 278 |
| 2-C2H5 | 156 | 1381 ± 13 | 281 |
| 1-C3H7 | 170 | 1462 ± 1 | 262 |
| 2-C3H7 | 170 | 1459 ± 15* | 259 |
| 1-C4H9 | 184 | 1555 | 255 |
| 2-C4H9 | 184 | 1567 ± 3 | 267 |
| 1-C5H11 | 198 | – | – |
| 2-C5H11 | 198 | 1657 ± 23* | 257 |
| Среднее значение: | 268 ± 12 | ||
| Нет | 128 | 1162 ± 8 | 262 |
| 1-СН3 | 142 | 1290 ± 12 | 290 |
| 2-СН3 | 142 | 1273 ± 11 | 273 |
| 1,2-(CH3)2 | 156 | 1440 ± 7 | 340 |
| 1,8-(CH3)2 | 156 | 1457 ± 8 | 357 |
| 2,3-(CH3)2 | 156 | 1426 ± 7 | 326 |
| 1,4,5-(CH3)3 | 170 | 1515 ± 28 | 315 |
| 1,6,7-(CH3)3 | 170 | 1545 ± 10 | 345 |
| 1,3,5-(CH3)3 | 170 | 1529 ± 6 | 329 |
| 1,2,3,4-(СН3)4 | 184 | 1767* | 467 |
* Значения в базе [1] отсутствуют, использован массив данных автора.
Обработка результатов. Статистическую обработку значений гомологических инкрементов индексов удерживания (iRI), построение графиков и вычисление параметров регрессионных уравнений выполняли с использованием ПО Origin (версии 4.1 и 8.2).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Характеристика аномалий газохроматографических параметров удерживания, как отдельных соединений, так и совокупностей гомологов, даже если их проявления выражены в незначительной степени, представляет интерес с многих позиций: 1) выявление структурных факторов, определяющих такие аномалии; 2) возможность проследить и в отдельных случаях предсказать проявление подобных аномалий в других свойствах органических соединений; 3) их подробное рассмотрение представляет интерес для совершенствования теорий хроматографического удерживания.
В качестве примера аномалии индексов удерживания, активно обсуждавшейся в начале 1980-х гг. [7], можно упомянуть “эффект пропильной группы” (“Propyl effect”). При этом следует заметить, что он был выявлен только для узкой группы аналитов, а его проявления весьма незначительны. Кроме того, неподвижная фаза (сквалан), для которой он был описан, в настоящее время практически вышла из употребления из-за низкой термостабильности. Суть эффекта состоит в отклонениях индексов удерживания содержащих пропильные фрагменты непредельных соединений (алкенов и алкадиенов) от их аддитивных оценок. Для алкенов такие отклонения составляют всего –1…–5 ед. индекса и лишь незначительно больше для диенов (–4…–10 ед. индекса). По современным представлениям, столь малые вариации RI не представляют особого интереса для практических целей, так как они не превышают межлабораторных вариаций индексов удерживания [1]. Кроме того, к стандартным неполярным неподвижным фазам в настоящее время относят полидиметилсилоксаны [1], которые несколько полярнее сквалана. Однако проявления эффекта пропильной группы для полидиметилсилоксанов не были подтверждены.
Рассматриваемые в настоящей работе аномалии гомологических инкрементов диалкилфталатов и метилбензолов выражены в значительно большей степени. Структурными предпосылками обеих аномалий является наличие в молекулах “жесткого” ароматического ядра и фиксированных в таком ядре алкильных (метильных) заместителей или функциональных групп, содержащих такие фрагменты, способных к внутримолекулярному вращению.
Аномалии гомологических инкрементов газохроматографических индексов удерживания диалкилфталатов и их интерпретация. В работах [8, 9] были рассмотрены параметры для хромато-масс-спектрометрической идентификации моноалкиловых эфиров бензол-1,2-дикарбоновой (фталевой) кислоты – моноалкилфталатов. Хроматографическим характеристикам этого ряда не присущи какие-либо аномалии: значения iRIн-алкилфталатов достаточно хорошо воспроизводимы (среднее значение ± стандартное отклонение составляет 341 ± 14); при наличии одного разветвления в алкильном фрагменте эти оценки закономерно уменьшаются до 255 ± 25.
Данные для моноалкилфталатов сопоставляли с аналогичными характеристиками их ближайших структурных аналогов – диалкиловых эфиров бензол-1,2-дикарбоновой (фталевой) кислоты – диалкилфталатов [8, 9]. При этом неожиданно было выявлено, что значения iRI ди-н-алкилфталатов демонстрируют отсутствие воспроизводимости и существенно уменьшаются по мере увеличения числа атомов углерода в н-алкильных фрагментах, а именно от +125 (диметилфталат) до –33 (дидецилфталат), т.е. на ~160 ед. индекса. Столь значительный диапазон вариаций iRI делает усреднение их значений лишенным смысла. Однако при этом индексы удерживания моно- и ди-н-алкилфталатов хорошо коррелируют между собой [8], что можно рассматривать как одно из подтверждений корректности их значений для обоих рядов. Индексы удерживания ди-н-алкилфталатов и их гомологические инкременты приведены в табл. 1 в сравнении с рассматриваемыми ниже некоторыми физико-химическими характеристиками этих соединений.
Столь значительные вариации величин iRI не характерны для нормальных линейных гомологов большинства рядов. Эту особенность можно дополнительно проиллюстрировать отсутствием подобных аномалий для изомеров фталатов – ди-н-алкиловых эфиров бензол-1,4-дикарбоновой (терефталевой) кислоты, приведенными в табл. 2 (среднее значение iRI и его стандартное отклонение равны 159 ± 9). То же наблюдается для других структурных аналогов диалкилфталатов, содержащих только одну алкоксикарбонильную группу в молекуле – н-алкилбензоатов (табл. 3), для которых iRI ± s(iRI) составляет 160 ± 7. С другой стороны, подобное уменьшение значений iRI при переходе от простейших к высшим гомологам наблюдается в ряду алканкарбоновых кислот, содержащих полярную карбоксильную группу –СО2Н (табл. 4), хотя при одинаковых изменениях числа атомов углерода в молекуле (ΔnС = 20) вариации iRI в этом ряду вдвое меньше (224–139 = = 85 ед. индекса), чем в случае диалкилфталатов.
Газохроматографическое удерживание аналитов на неполярных фазах в первую очередь определяется их дисперсионными взаимодействиями с фазой. Энергии дисперсионных взаимодействий (Едисп) пропорциональны произведению электронных поляризуемостей фазы и аналитов (αi) [10, с. 453]. Макроскопической характеристикой поляризуемостей служат молярные рефракции (MRD) [11]. Следовательно, для фиксированной фазы можно записать11:
Относительно небольшие различия в хроматографическом удерживании изомеров с близкими значениями MRD определяются их полярностью, которую чаще всего характеризуют дипольными моментами (μ) и/или диэлектрическими проницаемостями (ε). Следует заметить, что гомологические инкременты индексов удерживания также можно рассматривать как дополнительную характеристику полярности органических соединений [12].
Так как предметом обсуждения служат не абсолютные значения индексов удерживания, а соответствующие им дифференциальные характеристики – гомологические инкременты индексов удерживания [2], не зависящие от молекулярных масс гомологов (М), то их целесообразно сопоставлять не с молярными рефракциями MRD, а с удельными величинами, также не зависящими от молекулярных масс – удельными рефракциями rD [11]:
Тем не менее, такая характеристика полярности как диэлектрическая проницаемость, демонстрирует отчетливо выраженную корреляцию со значениями iRI. Диапазон вариаций (уменьшения) ε при увеличении числа атомов углерода в каждом из алкильных фрагментов от одного до десяти составляет 8.7–4.5 ≈ 4.2. График этой зависимости представлен на рис. 1; параметры уравнения линейной регрессии приведены в подписи к рисунку. Обращает на себя внимание достаточно высокое значение коэффициента корреляции (R = 0.985). Такую корреляцию можно было бы принять в качестве объяснения аномалий гомологических инкрементов индексов удерживания диалкилфталатов, если бы не ее отсутствие в других рядах. Так, для серии н-алкилбензоатов (табл. 3) значения ε уменьшаются от 6.6 до 4.8 для эфиров С1–С6, что в расчете на переменное число атомов углерода в ~2 раза больше, чем в ряду ди-н-алкилфталатов, однако это не оказывает почти никакого влияния на хорошо воспроизводимые значения iRI (160 ± 7).
Рис. 1.
Корреляция гомологических инкрементов индексов удерживания ди-н-алкилфталатов (iRI) и значений диэлектрической проницаемости (ε). Параметры линейной регрессии: a = 36.9 ± 3.2, b = –202 ± 20, R = 0.985, S0 = 10.4.
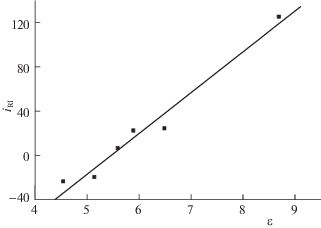
Сходное уменьшение значений iRI наблюдается в ряду н-алканкарбоновых кислот (табл. 4). Значения ε в серии соединений с R = С1–С17 убывают с 6.2 до 2.3, но их корреляция с величинами iRI выражена хуже (R = 0.69). Аналогичным образом, значения rD возрастают от 0.185 до 0.291, но, как было отмечено выше, не этот фактор определяет аномалии гомологических инкрементов. Убывание iRI в случае н-алканкарбоновых кислот на качественном уровне может быть объяснено возрастающим экранированием полярной функциональной группы –СО2Н по мере увеличения алкильных фрагментов молекул. Подобный эффект хорошо прослеживается для различных замещенных в циклах гетероциклических соединений, содержащих алкильные заместители в α- (экранирование гетероатома) и в более удаленных положениях к гетероатомам (нет экранирования). Так, например, RI для 2-метилфурана на стандартных неполярных фазах равен 594 ± 3, а для 3-метилфурана – 602 ± 1 [1]. При этом первый изомер полярнее второго, что подтверждается обратным порядком значений их RI на стандартных полярных фазах, равных 869 ± 7 и 853 ± 2 соответственно. Для алкилфуранов, содержащих более объемные алкильные заместители, различия индексов удерживания 2- и 3-замещенных изомеров больше.
Таким образом, аномальное уменьшение значений iRI на неполярных фазах при переходе от простейших к высшим гомологам ди-н-алкилфталатов не связано с различиями энергий дисперсионных взаимодействий или поляризуемостей молекул. В ограниченной мере (без обобщения на другие ряды) такая аномалия может быть объяснена некоторым уменьшением полярности гомологов с бóльшими молекулярными массами. Однако проявление аналогичного эффекта в ряду н-алканкарбоновых кислот позволяет предположить, что его основной причиной могут быть положения конформационных равновесий алкильных цепей. Иными словами, статистически наиболее вероятными конформациями длинноцепочечных алкильных фрагментов молекул являются так называемые клубки Гаусса [13, 14], что делает н-алкильные фрагменты молекул структурно подобными разветвленным алкильным фрагментам, что и объясняет уменьшение газохроматографических индексов удерживания.
Наиболее заметно такой эффект выражен для соединений, содержащих два алкильных фрагмента, локализованные в орто-положениях плоских жестких ароматических структур. К таким соединениям должны относиться не только фталаты, но и диалкиловые эфиры различных орто-арендикарбоновых кислот (например, пиридин-2,3-дикарбоновой, нафталин-2,3-дикарбоновой и т.п.), N,N'-диалкил-орто-фенилендиамины, простые и сложные эфиры пирокатехина и др. Однако из всех возможных объектов именно диалкилфталаты оказываются наиболее подробно охарактеризованным классом соединений, так как совокупность гомологов только этого ряда (не отдельные представители, а именно их совокупность) представляет наибольший интерес в современной химической промышленности. Широкий диапазон вариаций реологических свойств диалкилфталатов с различными молекулярными массами определяет их главное применение в качестве пластификаторов полимерных композиций.
Как можно судить по результатам применения использованной при создании базы данных [1] аддитивной схемы [15] оценки газохроматографических индексов удерживания диалкилфталатов, существование рассматриваемых аномалий RI делает использование подобных алгоритмов их оценки неприменимым.
Аномалии гомологических инкрементов газохроматографических индексов удерживания метилбензолов. Алкилбензолы относятся к соединениям, наиболее подробно охарактеризованным газохроматографическими параметрами по сравнению с другими классами органических соединений, что обусловлено присутствием этих углеводородов в разнообразных образцах. Уже в одном из первых справочных изданий по индексам удерживания [16] заметно преобладание данных для соединений именно этого класса. В версии базы данных 2017 г. [1] число усредненных значений RI из различных источников на стандартных неполярных фазах составляет для толуола 323, этилбензола – 230, о-ксилола – 182, м-ксилола – 180, п-ксилола – 210 и т.д. Тем не менее, рассмотрение именно гомологических инкрементов индексов удерживания позволяет выявить ранее не обсуждавшуюся важную особенность их параметров удерживания. Лишь в публикации 1982 г. было упомянуто, что увеличение RI в результате введения алкильного заместителя в ароматическое ядро больше, чем в результате добавки такого же заместителя в боковую цепь [17].
Неполярные алкилароматические углеводороды, не содержащие полярных функциональных групп, характеризуются практически постоянными значениями диэлектрической проницаемости (диапазон вариаций всего 2.2–2.4) и малыми дипольными моментами (небольшое число известных значений в диапазоне 0.3–0.6 D). Почти одинаковые для них значения $r_{{\text{D}}}^{{20}}$ (0.336 ± 0.001) незначительно отличаются от теоретического предела 0.330 [10]. В табл. 5 приведены значения RI и их гомологические инкременты для двух подгрупп гомологов ряда алкиларенов: н-алкилпроизводных C6H5–CnH2n + 1 и метилбензолов C6H6 – n(CH3)n с числом метильных групп до шести.
Если значения iRI для всех перечисленных гомологов бензола представить графически как функцию числа атомов углерода в алкильных заместителях молекул, то получаем “рой” точек, изображенный на рис. 2. Среди них можно отчетливо выделить три совокупности точек, соответствующих трем подгруппам гомологов. Первую из них (рис. 2а) образуют моно-н-алкилбензолы C6H5–CnH2n + 1 (0 ≤ n ≤ 6), которым соответствует незначительно убывающая линейная зависимость iRI(n) (параметры уравнения линейной регрессии указаны в подписи к рис. 2а). Вариации iRI(n) в данном случае настолько малы, что их вполне можно охарактеризовать стандартным отклонением среднего арифметического значения 151 ± 5 (табл. 5).
Рис. 2.
Графические представления значений iRIн-алкил- и метилбензолов. В общем массиве выделены совокупности точек для трех подгрупп гомологов: а – моно-н-алкилбензолы C6H5–CnH2n + 1 с 0 ≤ n ≤ 6; параметры уравнения линейной регрессии: a = –1.7 ± 0.6, b = 154 ± 2, R = –0.80, S0 = 3.1; б – метилбензолы, не имеющие метильных групп в орто-положениях друг к другу (всего пять гомологов: незамещенный бензол, толуол, м-ксилол, п-ксилол и мезитилен); параметры уравнения линейной регрессии: a = 2.7 ± 0.2, b = 154.2 ± 0.3, R = 0.995, S0 =0.4; в – метилбензолы, имеющие метильные группы в орто-положениях друг к другу; параметры регрессионного полинома (iRI = a2N2 + a1N + a0, где N – число метильных групп): a2 = 3.1 ± 0.8, a1 = 7.5 ± 5.2, a0 = 155 ± 7, R2 = 0.988, S0 = 7.6.
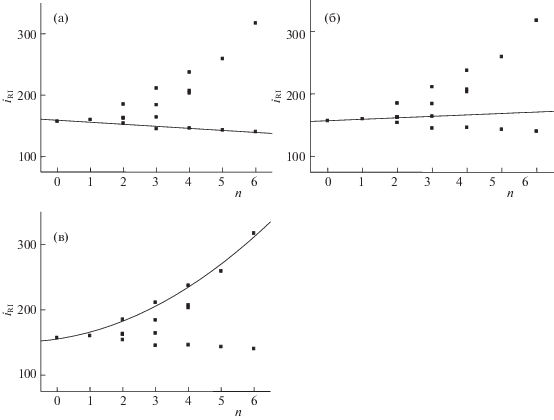
Вторую подгруппу гомологов образуют метилбензолы, не имеющие метильных групп в орто-положениях друг к другу. Таких соединений, содержащих не более трех метильных групп, всего пять: незамещенный бензол, толуол, м-ксилол, п-ксилол и мезитилен. Им соответствует слабо возрастающая зависимость iRI(n) (рис. 2б); наблюдаемое некоторое возрастание можно сопоставить с незначительным увеличением поляризуемости метилбензолов за счет положительного индуктивного эффекта метильных групп.
Если же метилзамещенные бензолы содержат одну или несколько метильных групп в орто-положениях друг к другу (о-ксилол, 1,2,3- и 1.2,4-триметилбензолы, все тетраметилбензолы, пента- и гексаметилбензолы), то значения iRI(n) демонстрируют резко возрастающую нелинейную зависимость (от 181 для о-ксилола до 331 для гексаметилбензола, ΔRI = 150 ед. индекса) (рис. 2в). Из сравнения с зависимостью для подгруппы гомологов (рис. 2б) следует, что причиной такого увеличения значений iRI не являются электронные эффекты метильных групп. Поскольку орто-расположение заместителей способствует их отчетливо выраженному стерическому взаимодействию (термин “орто-эффект” известен, в том числе, в масс-спектрометрии [18]), то наиболее вероятной причиной аномального увеличения iRI представляется затрудненное внутримолекулярное вращение метильных групп вокруг простых связей С(sp2)–C(sp3) при их расположении в орто-положениях. В конформационном анализе такой эффект известен под названием “эффект шестеренок” (метильные группы при вращении “цепляются” друг за друга), но специально его обсуждают достаточно редко [19].
Аналогичное аномальное увеличение значений iRI наблюдается и в других рядах ароматических и гетероароматических соединений, содержащих алкильные заместители в орто- или вицинальных положениях: нафталинах, хинолинах, пирролах, оксазолах, тиофенах и других. По объективным причинам число охарактеризованных гомологов в таких рядах заметно меньше, чем для алкиларенов. В качестве дополнительного подтверждения можно привести данные для н-алкил- и стерически затрудненных метилнафталинов (табл. 6). Графическое представление соответствующих им значений iRI приведено на рис. 3 (параметры регрессионных уравнений указаны в подписи к рисунку). Так же, как и на рис. 2, совокупности точек для двух подгрупп гомологов иллюстрируют две отличных друг от друга закономерности. В случае метилнафталинов С10H8 ‒ n(CH3)n, имеющих метильные группы в стерически затрудненных орто- или вицинальных положениях, наблюдается нелинейная возрастающая зависимость iRI(n) (рис. 3а), тогда как 1- и 2-н-алкилнафталины Cn + 10H2n + 8 характеризуются типичной для большинства рядов незначительно убывающей зависимостью iRI(n) (рис. 3б). Причины наблюдаемого аномального увеличения гомологических инкрементов газохроматографических индексов удерживания в данном случае те же, что и в случае алкилбензолов.
Рис. 3.
Графические представления значений iRIн-алкил- и некоторых метилнафталинов. Cовокупности точек для двух подгрупп гомологов: а – метилнафталины С10H8 – n(CH3)n, имеющие метильные группы в стерически затрудненных орто- или вицинальных положениях друг к другу; параметры регрессионного полинома (iRI = a2N2 + a1N + a0, где N – число метильных групп): a2 = 9.0 ± 2.4, a1 = 12.8 ± 10.3, a0 = 266 ± 8, R2 = 0.991, S0 = 9.3; б – 1-н-алкил- и 2-н-алкилнафталины Cn + 10H2n + 8 с 0 ≤ n ≤ 5; параметры уравнения линейной регрессии: a = –7.8 ± 2.0, b = 291 ± 6, R = –0.88, S0 = 7.9.

Аналогичную аномалию индексов удерживания можно наблюдать не только для полиметилзамещенных ароматических соединений, но и при наличии в молекулах других алкильных групп, однако уровень характеристики таких гомологов значениями RI в настоящее время значительно ниже, чем более простых и чаще встречающихся в аналитической практике метилзамещенных.
В заключение можно отметить, что выявление упомянутого выше (для сравнения) эффекта пропильной группы [7] также основано на сравнении индексов удерживания разных гомологов одних и тех же рядов. Использование концепции гомологических инкрементов индексов существенно упрощает эту операцию, так что эффект пропильной группы вполне мог бы быть выявлен с использованием таких инкрементов.
Обсуждаемые экспериментальные данные получены с использованием оборудования ресурсных центров по направлению “Химия” и “Методы анализа свойств веществ” при Институте химии Санкт-Петербургского государственного университета. Автор благодарит сотрудников центров за содействие.
Список литературы
The NIST Mass Spectral Library (NIST/EPA/NIH EI MS Library, 2020 Release). Software/Data Version; NIST Standard Reference Database, Number 69, May 2020. National Institute of Standards and Technology, Gaithersburg, MD 20899: http://webbook.nist.gov (дата обращения: июль 2020 г.).
Зенкевич И.Г., Иоффе Б.В. Интерпретация масс-спектров органических соединений. Л.: Химия, 1986. 176 с.
Зенкевич И.Г., Носова В.Э. // Журн. аналит. химии. 2018. Т. 73. № 12. С. 906. https://doi.org/10.1134/S1061934818090150
Зенкевич И.Г., Носова В.Э. // Масс-спектрометрия. 2018. Т. 15. № 2. С. 119. https://doi.org/10.25703/MS.2018.15.27
Елисеенков Е.В., Зенкевич И.Г. // Там же. 2020. Т. 20. № 1. С. 40.
Handbook of Chemistry and Physics. Ed. by D.R. Lide. Boca Raton, FL: Taylor & Francis, Version 2006. (CD-ROM).
Sojak L., Ostrowsky I., Janak J. // J. Chromatogr. A. 1984. V. 406. P. 43. https://doi.org/10.1016/S0021-9673(00)94016-0
Зенкевич И.Г., Фахретдинова Л.Н. // Журн. анал. химии. 2016. Т. 71. № 12. С. 1296. https://doi.org/10.7868/S004445021612015X
Зенкевич И.Г. // Там же. 2020. Т. 75. № 10. С. 921. https://doi.org/10.1134/S1061934820100160.
Даниэльс Ф., Олберти Р. Физическая химия. Пер. с англ. М.: Мир, 1978. 646 с.
Иоффе Б.В. Рефрактометрические методы химии. Л.: Химия, 1974. 400 с.
Зенкевич И.Г. // Журн. общ. химии. 2019. Т. 89. № 3. С. 331. https://doi.org/10.1134/S1070363219030010
Дашевский В.Г. Конформационный анализ макромолекул. М.: Наука, 1987. 283 с.
Дашевский В.Г. Конформации органических молекул. М.: Химия, 1974. 432 с.
Stein S.E., Babushok V.I., Brown R.L., Linstrom P.J. // J. Chem. Inf. Model. 2007. V. 47. P. 975. https://doi.org/10.1021/ci600548y
Богословский Ю.Н., Анваер Б.И., Вигдергауз М.С. Хроматографические постоянные в газовой хроматографии. Углеводороды и кислородсодержащие соединения. Справочник. М.: Изд-во стандартов, 1978. 192 с.
Macak J., Nabivach V., Buryan P., Sindler S. // J. Chromatogr. A. 1982. V. 234. P. 285. https://doi.org/10.1016/S0021-967(00)81867-1
Вульфсон Н.С., Заикин В.Г., Микая А.И. Масс-спектрометрия органических соединений. М.: Химия, 1986. 312 с.
Шевченко С.М. Внутреннее вращение с участием тетраэдрического углерода В сб. Современные проблемы органической химии. Вып. 6. Л.: Изд-во ЛГУ. 1978. С. 5–21.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии


