Журнал физической химии, 2021, T. 95, № 8, стр. 1278-1283
Хроматографическое разделение и определение антоцианов в условиях обращенно-фазовой хроматографии при использовании в качестве подвижных фаз систем ацетонитрил–муравьиная кислота/фосфорная кислота–вода
В. И. Дейнека a, *, Е. Ю. Олейниц a, Я. Ю. Саласина a, И. П. Блинова a, Л. А. Дейнека a
a Белгородский государственный национальный исследовательский университет
308015 Белгород, Россия
* E-mail: deineka@bsu.edu.ru
Поступила в редакцию 08.11.2020
После доработки 08.11.2020
Принята к публикации 15.12.2020
Аннотация
Исследовано влияние различных изменений в составах подвижных фаз систем ацетонирил–муравьиная/фосфорная кислота–вода концентрации ацетонитрила и кислоты на хроматографическое поведение антоцианов в условиях обращенно-фазовой ВЭЖХ.
Ацетонитрил является одним из лучших органических модификаторов, определяющих удерживание сорбатов в обращенно-фазовой хроматографии в водно-органических подвижных фазах, благодаря уникальным физико-химическим свойствам: прозрачности в широком диапазоне длин волн, невысокой вязкости растворителя и его смесей с водой, низкой летучести. Недостаток этого растворителя – высокая токсичность для человека и окружающей среды [1]. Если к этому добавить высокую стоимость, то становятся понятными тенденции к отказу от использования ацетонитрила в пользу более экологически благоприятных растворителей; это направление известно под термином “зеленая” хроматография [2].
Ацетонитрил чаще всего применяют и при разделении антоцианов, но в этом случае раствор обязательно дополнительно подкисляют, используя ряд кислот, из которых наиболее часто применяют муравьиную кислоту [3]. Подкисление необходимо для перевода всех форм антоцианов во флавилиевую – аналитическую окрашенную в красные тона форму [4], позволяющую определять эти соединения в реальных многокомпонентных растительных экстрактах, содержащих большое число не имеющих окраски иных экстрактивных веществ. И хотя известно, что переход всех форм антоцианов практически полностью во флавилиевую форму наблюдается только при рН ≤ 1, по литературным данным добавки муравьиной кислоты составляют от 10 об. % (что обеспечивает рН менее 1.5) до 1 об. % [3]. Высокое содержание летучей, едкой и удушливой муравьиной кислоты тоже трудно считать экологически благоприятным фактором. Поэтому замена муравьиной кислоты на более экологически приемлемую также является проблемой “зеленой” хроматографии. Некоторые результаты изменения хроматографического поведения антоцианов при замене муравьиной кислоты на фосфорную были определены в работе [5]. Но при этом уширению пиков на хроматограммах не было уделено должного внимания. В то же время анализ найденных зависимостей удерживания антоцианов от их строения [6, 7] позволил предложить для антоцианов “поплавочный” механизм удерживания [8], объясняющий различия в чувствительности структуры к строению флавилиевой и углеводной частей антоцианов.
При оценке эффективности новых растворителей в качестве замены ацетонитрила необходимо знать важнейшие закономерности поведения сорбатов в водно-ацетонитрильных подвижных фазах. Цель настоящей работы – возможно более полная характеризация подвижных фаз “ацетонитрил–муравьиная кислота/фосфорная кислота–вода” для разделения антоцианов в условиях обращенно-фазовой ВЭЖХ, как референтного материала для оценки эффективности иных, экологически более благоприятных органических модификаторов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Пять 3-глюкозидов основных антоцианидинов (дельфинидина, цианидина, петунидина, пеонидина и мальвидина) экстрагировали из листьев багрянника канадского (Cercis canadensis L., [9]) и 3-глюкозида пеларгонидина – из плодов барбариса обыкновенного [10]. Экстракты очищали от сопутствующих экстрактивных веществ полимерного и олигомерного характера на концентрирующих патронах ДИАПАК С18 (БиоХимМак СТ, Москва).
Разделение антоцианов в растворах (после твердофазной очистки динамическим методом) осуществляли на оборудовании Agilent 1200 Infinity с диодно-матричным детектором. Хроматограммы записывали при 515 нм. В работе использовали хроматографическую колонку: 150 × 4.6 мм Symmetry C18 (3.5 мкм); при заданной температуре термостата колонок. Мертвое время определяли по щавелевой кислоте. Разделение осуществляли в изократических режимах в подвижных фазах с заданным содержанием ацетонитрила, муравьиной или фосфорной кислот в дистиллированной воде. Хроматограммы регистрировали и обрабатывали программой Agilent ChemStation.
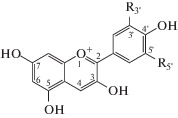
Для сокращенного обозначения антоцианов в работе использованы буквенные обозначения антоцианидинов: Dp – дельфинидин (3,5,7,3',4',5'-гексагидроксофлавилий), Cy – цианидин (3,5,7,3',4'-пентагидроксофлавилий), Pt – петунидин (3,5,7,3',4'-пентагидроксо-5'-метоксифлавилий), Pn – пеонидин (3,5,7,4'-тетрагидроксо-3'-метоксифлавилий), Mv – мальвидин (3,5,7,4'-тетрагидроксо-3',5'-диметоксифлавилий), см. схему 1. При этом 3-глюкозиды антоцианидинов обозначали как, например, Cy3G.
Параметр липофильности miLogP рассчитывали интерактивно на сайте Molinspiration.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Разделение 3-глюкозидов шести основных антоцианидинов
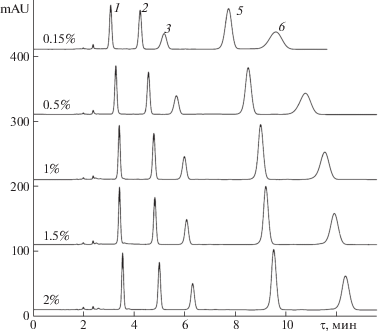
Разделение шести 3-глюкозидов основных антоцианидинов в двух типах составов подвижных фаз на одной и той же стационарной фазе представлено на рис. 1.
Рис. 1.
Разделение 3-глюкозидов шести основных антоцианидинов в двух условиях. Условия А – подвижная фаза 10 об. % муравьиной кислоты и 9.5 об. % CH3CN в воде; условия Б – подвижная фаза 0.5 об. % муравьиной кислоты и 12 об. % CH3CN в воде; 0.8 мл/мин; температура 40°С. Детектор 515 нм. Вещества: 1 – Dp3G, 2 – Cy3G, 3 – Pt3G, 4 – Pg3G, 5 – Pn3G, 6 – Mv3G.

Порядок элюирования всех шести компонентов в любых приемлемых составах подвижных фаз выбранных систем для стационарной фазы Symmetry C18 оставался таким же, как и для ранее исследованных стационарных фаз [6, 7], и практически не изменялся при изменении концетрации ацетонитрила. Исключение – для очень “медленных” элюентов постепенно уменьшается степень разделения производных пеларгонидина и петунидина до инверсии времен удерживания. При этом времена удерживания (как и факторы удерживания) не всех сорбатов пропорциональны расчетным значениям липофильности, найденным по программе miLogP (приведены в ряду в скобках после обозначения антоциана):
Согласованные изменения времен удерживания и miLogP наблюдаются только при последовательном добавлении ОН-групп в кольцо В, указывая на очевидное увеличение гидрофильности веществ при таких изменениях структуры. Однако программа miLogP неправильно оценивает изменение удерживания при добавлении СН3О-групп: программа явно недооценивает изменение липофильности веществ в таких случаях. Впрочем, это не удивительно для однопараметрической системы оценок, не учитывающей баланс гидрофильно-гидрофобных свойств. В этом отношении полезно воспользоваться картой разделения антоцианов, построенной по методу относительного удерживания, рис. 2, в которой удерживание антоцианов (как десятичный логарифм фактора удерживания) определяется регрессионным уравнением относительного удерживания с Pg3G, выбранным в качестве реперного соединения:
Рис. 2.
Карта разделения 3-глюкозидов шести основных антоцианидинов в системе СH3CN – (10 об. %) HCOOH – H2O. Обозначение антоцианов – см. подписи к рис. 1.
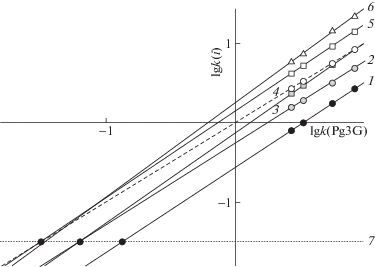
По карте разделения следует, что добавление ОН-групп приводит к перемещению линий тренда вниз, что соответствует росту гидрофильности. При этом, однако, общее падение удерживания сопровождается заметным увеличением наклона линий тренда, табл. 1, вследствие увеличения числа дисперсионных взаимодействий при росте числа атомов в структурах. Это можно интерпретировать как некоторый рост гидрофобной составляющей гидрофильно-гидрофобного баланса. Добавление СН3О-групп при этом всегда приводит к перемещению линий тренда вверх и несколько большему изменению наклона линий тренда, что соответствует росту гидрофобной составляющей. В этом случае, строго говоря, гидрофильная составляющая также должна в некоторой мере возрасти, поскольку СН3О-группа способна образовывать водородные связи, но только в качестве акцептора. Степень этого роста оценить проблематично, но допустимость пренебрежения вкладом метокси-группы в гидрофильную составляющую в первом приближении позволяет классифицировать линии трендов по числу ОН‑групп, – по положению точек конвергенции в экстраполированные на очень “быстрые” подвижные фазы условия. Поведение линий тренда близко к поведению гомологов (но при добавлении CH3О-групп вместо СН2-групп), – с ростом гидрофильной составляющей за счет числа ОН-групп точки конвергенции смещаются вправо по прямой 7 на рис. 2.
Таблица 1.
Параметры уравнений (1) относительного удерживания антоцианов для подвижных фаз на основе ацетонитрила, подкисленных двумя типами кислот
| № | Антоциан | HCOOH | H3PO4 | ||
|---|---|---|---|---|---|
| a | b | a | b | ||
| 1 | Dp3G | 1.072 | –0.566 | 1.139 | –0.585 |
| 2 | Cy3G | 1.028 | –0.260 | 1.053 | –0.262 |
| 3 | Pt3G | 1.134 | –0.126 | 1.129 | –0.141 |
| 4 | Pn3G | 1 | 0 | 1 | 0 |
| 5 | Pn3G | 1.089 | 0.148 | 1.072 | 0.128 |
| 6 | Mv3G | 1.188 | 0.258 | 1.152 | 0.225 |
Влияние концентрации муравьиной кислоты
Кислота, как указывали выше, вводится в подвижную фазу для перевода всех форм антоцианов во флавилиевую. Однако по литературным данным только при рН 1 и менее все антоцианы находятся в растворах в этой форме, причем такие рН лежат за пределами устойчивости обычных обращенных фаз (рН 2–8) [11, 12]. 10 об. %, приходящихся на муравьиную кислоту, обеспечивают рН только около 1.3, что также за пределами рекомендуемых для обычных стационарных фаз рН, но именно такая концентрация кислоты используется для разделения антоцианов в большом числе известных публикаций [3]. Частое использование муравьиной кислоты с существенно меньшей концентрацией в составе подвижных фаз достаточно неожиданно, поскольку по данным, полученным в нашей лаборатории [7], это должно привести к уширению пиков антоцианов и, как следствие, к проблемам в разделении веществ с близкой хроматографической подвижностью. В настоящей работе влиянию концентрации муравьиной кислоты на хроматографические процессы уделено особое внимание.
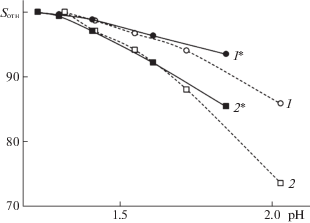
На рис. 3 представлены данные об изменении доли флавилиевой формы антоцианов в подвижной фазе, рассчитанной по изменению площадей пиков одинаковых порций пробы при изменении рН за счет уменьшения содержания муравьиной кислоты от 10 до 1 об. % (рН определен для растворов с заданной концентрацией муравьиной кислоты без добавок ацетонитрила). Для пяти 3‑глюкозидов основных антоцианидинов (в данной серии экспериментов от добавок Pg3G отказались из-за проблем его отделения от Pt3G) доля флавилиевых форм уменьшается, и не одинаково: приведенные графики для цианидин-3-глюкозида и мальвидин-3-глюкозида ограничивают набор полученных данных сверху и снизу. При этом наиболее быстро (до 74%) снижалась доля флавилиевой формы мальвидин-3-глюкозида, что может быть интерпретировано как следствие более высокой кажущейся константы гидратации производного мальвидина. При сопоставлении таких результатов с литературными данными следует учитывать, что в случае ВЭЖХ, во-первых, соотношение между формами может быть далеким от равновесных, поскольку изменения спектров антоцианов в растворах обычно наблюдаются в течение нескольких часов. Во-вторых, следует учитывать, что состояние равновесий может быть различным в стационарной и в подвижной фазах, поскольку зависит от липофильности среды (концентрации органических компонентов) [13].
Рис. 3.
Изменение доли флавилиевой формы при изменении рН (доли кислот по площадям пиков) подвижной фазе: 1 – изменение для Cy3G в элюентах с добавкой муравьиной кислоты, 1* – для Cy3G в элюентах с добавкой фосфорной кислоты, 2 – изменение для Mv3G в элюентах с добавкой муравьиной кислоты, 2* – для Mv3G в элюентах с добавкой фосфорной кислоты.
В табл. 2 показано изменение эффективности (по числу теоретических тарелок) хроматографической системы при аналогичном снижении концентрации муравьиной кислоты в подвижной фазе. На рис. 2 приведены данные, рассчитанные не по обычно рекомендуемой формуле:
где 5.54 ($8\ln 2$) – коэффициент, tR(i) – время удерживания сорбата i, Δ1/2(i) – ширина пика на половине высоты, а по формуле (2), учитывающей изменения факторов удерживания сорбатов, k(i):(3)
$N = 5.54\frac{{k(i)}}{{k(i) + 1}}\left( {\frac{{{{t}_{R}}(i)}}{{{{{{\Delta }}}_{{1/2}}}(i)}}} \right).$Таблица 2.
Зависимость эффективности хроматографических систем (по числу теоретических тарелок) от концентрации кислот в подвижной фазе
| № | Антоциан | Эффективность при указанной концентрации муравьиной кислоты, об. % | ||||
|---|---|---|---|---|---|---|
| 10 | 7.75 | 5.5 | 3.25 | 1 | ||
| 1 | Dp3G | 4134 | 3648 | 2825 | 1817 | 737 |
| 2 | Cy3G | 6493 | 5802 | 4779 | 3361 | 1505 |
| 3 | Pt3G | 5685 | 4473 | 3070 | 1752 | 641 |
| 4 | Pn3G | 8048 | 6686 | 5054 | 3249 | 1300 |
| 5 | Mv3G | 5834 | 4337 | 2816 | 1652 | 572 |
| № | Антоциан | Эффективность при указанной концентрации фосфорной кислоты, об. % | ||||
| 2 | 1.5 | 1 | 0.5 | 0.25 | ||
| 1 | Dp3G | 4450 | 3926 | 3465 | 2494 | 1719 |
| 2 | Cy3G | 6920 | 6243 | 5712 | 4577 | 3248 |
| 3 | Pt3G | 6462 | 5490 | 4476 | 2814 | 1691 |
| 4 | Pn3G | 9010 | 7979 | 6807 | 4639 | 2967 |
| 5 | Mv3G | 6696 | 5188 | 3964 | 2141 | 1360 |
В работе [14] показано, что формула (3) является верным дискретным решением дискретной задачи в методе теоретических тарелок и ее применение для ВЭЖХ обязательно, поскольку формула (2) является асимптотически предельной формулой для больших значений фактора удерживания, и обычно применима в газовой хроматографии.
Результаты расчета по формуле (3) оказываются существенно ближе друг к другу, чем рассчитанные по формуле (2). При этом эффективность хроматографической системы для всех 3-глюкозидов существенно снижалась с уменьшением концентрации муравьиной кислоты в подвижной фазе – в несколько раз сильнее, чем уменьшались площади пиков, но причины этого снижения требуют специальной серии исследований и в данной работе не будут рассмотрены. В любом случае снижение концентрации муравьиной кислоты ниже 10–8 об. % трудно признать оправданным шагом при составлении подвижной фазы.
Влияние скорости подвижной фазы
Для всех 3-глюкозидов высота эквивалентной теоретической тарелки снижалась с уменьшением скорости подачи подвижной фазы до 0.1–0.2 мл/мин примерно в полтора раза. Однако, при этом существенно возрастало время, необходимое на одно хроматографирование. Скорость 0.8 мл/мин использовали в качестве компромиссного решения. При необходимости в некоторых случаях скорость подачи подвижной фазы можно изменить как в большую (если степень разделения соседних антоцианов достаточно высока), так и в меньшую сторону (если соседние пики частично перекрываются).
Влияние температуры на эффективность разделения
Установлено, что при уменьшении температуры от 40 до 30°С эффективность хроматографической системы (по числу теоретических тарелок) уменьшается на 9 (для Pn3G) – 20 (для Mv3G) %. Рост температуры способствует увеличению этой характеристики, но с учетом термической нестабильности антоцианов [15] 40°С является неплохим компромиссным решением.
Результат замены муравьиной кислоты на фосфорную
При замене муравьиной кислоты на фосфорную, как было найдено в работе [5], концентрация ацетонитрила для достижения тех же времен удерживания должна быть увеличена, поскольку элюирующая способность фосфорной кислоты примерно равна нулю. Как можно судить по параметрам уравнений относительного удерживания, представленных в табл. 1, шесть 3-глюкозидов элюируются в несколько меньшем диапазоне времен удерживания – добавки ОН-групп в кольцо В приводят к небольшому росту удерживания (по сравнению с добавками муравьиной кислоты), тогда как при добавлении СН3О-групп удерживание несколько уменьшается. Следовательно, разделительная способность подвижной фазы на основе ацетонитрила при замене муравьиной кислоты на фосфорную снижается, но в относительно небольшой степени.
При этом эффективность хроматографической системы также уменьшается с увеличением рН (т.е. при уменьшении концентрации фосфорной кислоты), рис. 4 и табл. 2, что естественно вследствие снижения доли флавилиевой формы при такой замене. Однако при некоторых различиях в поведении антоцианов на рис. 3 и табл. 2 кардинальных изменений при замене муравьиной кислоты на фосфорную не обнаружено. Таким образом, такая замена может рассматриваться, как положительные варианты изменения состава подвижной фазы по направлению “зеленая” хроматография.
Рис. 4.
Изменение ширины пиков 3-глюкозидов пяти основных антоцианидинов при изменении концентрации фосфорной кислоты (об. %, указано на рисунке) при содержании ацетонитрила 12 об. %, 0.8 мл/мин. Нумерация пиков как на рис. 1.
Таким образом, установлено, что корреляции логарифм-фактора удерживания vs miLogP удовлетворительны при добавлении ОН-групп в кольцо В, но ошибочны при введении в это кольцо СН3О-групп. Показано, что двухпараметрическая система относительного удерживания более корректно описывает экспериментальные результаты с учетом гидрофильно-гидрофобного баланса. Уменьшение эффективности (по числу теоретических тарелок) при уменьшении концентрации кислоты связано со снижением доли флавилиевой формы антоцианов в подвижной фазе, что подтверждается уменьшением площадей пиков антоцианов. По этой причине снижение концентрации муравьиной кислоты ниже 10 об. %, как и фосфорной ниже 1 об. %, приводят к значительной потере эффективности хроматографической системы. Установлено, что эффективность хроматографической системы уменьшается при росте числа заместителей в кольце В флавилиевой основы. Показано, что замена резко пахнущей и летучей муравьиной кислоты на экологически более благоприятную фосфорную кислоту приемлема по хроматографическим параметрам.
Работа поддержана грантом Российского фонда фундаментальных исследований “Аспиранты”, номер 20-33-90031.
Список литературы
Geller R.J., Ekins B.R., Iknoian R.C. // Amer. J. Emergency Medicine. 1991. V. 9. P. 268.
Giné-Bordonaba J., Crespo P., Terry L.A. // Food Chem. 2011. V. 129. P. 1265–1273
Welch C.R., Wu Q., Simon J.E. // Curr. Anal. Chem. 2008. V. 4. P. 75.
Dangles O., Fenger J.-A. // Molecules. 2018. V. 23. 1970.
Deineka V.I., Deineka L.A., Saenko I.I. // J. Anal. Meth. Chem. 2015. V. 2015. ID 732918.
Дейнека В.И., Григорьев А.М. // Журн. аналит. химии. 2004. Т. 59. С. 305.
Дейнека В.И., Григорьев А.М. // Журн. физ. химии. 2005. Т. 79. С. 900.
Дейнека В.И., Дейнека Л.А., Саенко И.И. и др. // Там же. 2015. Т. 89. С. 1172.
Doronin A.G., Deineka V.I., Deineka L.A. et al. // Advances in Biological Sciences Research. 2019. V. 7. P. 90.
Сорокопудов В.Н., Хлебников В.А., Дейнека В.И. // Химия растительного сырья. 2005. № 4. С. 57.
Trammell B.C., Boissel C.A., Carignan C. et al. // J. Chromat. A. 2004. V. 1060. P. 153.
Claessens H.A., van Straten M.A., Kirkland J.J. // Ibid. 1996. V. 728. P. 259.
Coutinho I.B., Freitas A., Maçanita A.L. et al. // Food Chem. 2015. V. 172. P. 476.
Дейнека В.И. // Журн. физ. химии. 2004. Т. 78. № 1. С. 144–147.
Loypimai P., Moongngarm A., Chottanom P. // J. Food Sci. Technol. 2016. V. 53. P. 461.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии