Журнал физической химии, 2021, T. 95, № 8, стр. 1194-1199
Сорбция пиридин-3-карбоновой кислоты Fe-содержащим сульфокатионитом КУ-2
Г. Н. Альтшулер a, *, Е. В. Остапова a, О. Г. Альтшулер a, b
a Российская академия наук, Сибирское отделение, Федеральный исследовательский центр угля и углехимии
Кемерово, Россия
b Кемеровский государственный университет
Кемерово, Россия
* E-mail: altshulerh@gmail.com
Поступила в редакцию 08.10.2020
После доработки 04.12.2020
Принята к публикации 04.12.2020
Аннотация
Исследовано равновесное распределение пиридин-3-карбоновой кислоты и железа (III) между водным раствором и сульфокатионитом КУ-2. Концентрации индивидуальных компонентов в растворе рассчитаны по программе HySS 2009, в полимерной фазе они определены на основе материального баланса сорбционных процессов. Показано, что в полимерной фазе анионы пиридин-3-карбоновой кислоты (L–) входят в состав комплексных катионов [FeL]2+и [H2L]+. Определены константы равновесия ионного обмена и лигандной сорбции с участием пиридин-3-карбоновой кислоты, сульфокатионита КУ-2, протонов и катионов железа (III).
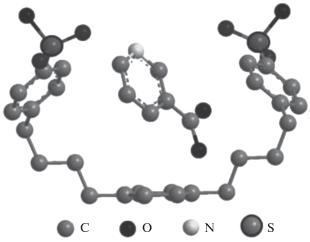
Пиридин-3-карбоновая кислота (C6H5NO2, никотиновая кислота, витамин В3, ниацин, HL) играет радикальную роль в обмене веществ в организме человека, выступая в качестве важного предшественника окислительно-восстановительных коферментов – никотинамидадениндинуклеотида и никотинамидадениндинуклеотидфосфата – ключевых компонентов в клеточных метаболических реакциях [1, 2]. Включение биологически активной субстанции в наноконтейнеры создает неограниченные возможности для консервации лекарственных препаратов, изменения их фармакокинетических свойств, векторной доставке лекарственного средства в очаг патологического поражения. Мы предположили [3], что инкапсуляция пиридин-3-карбоновой кислоты в ионообменниках позволит осуществлять целевую доставку лекарственного вещества только в желудок или кишечник при пероральном введении. Известно [4], что элементарное звено сульфокатионита КУ-2-8 (сульфированного сополимера стирола с дивинилбензолом) является наноконтейнером для пиридин-3-карбоновой кислоты (рис. 1). Изучены кинетика десорбции пиридин-3-карбоновой кислоты из катионита КУ-2-8 [5], термодинамика и кинетика сорбции пиридин-3-карбоновой кислоты на анионите АВ-17-8 [6, 7].
Рис. 1.
Структура наноконтейнера (элементарного звена сульфокатионита КУ-2), содержащего пиридин-3-карбоновую кислоту [2], минимизированная по внутренней энергии в рамках программы МОРАС 2016.
Пиридинкарбоновые кислоты в растворах участвуют в протолитических реакциях [8], взаимодействуют с переходными и тяжелыми металлами с образованием комплексных соединений [9–13], что может оказывать как положительное, так и разрушительное влияние на живой организм. Показано [14], что стабильность комплексов пиридин-3-карбоновой кислоты в водных растворах возрастает в ряду катионов Cd(II), Co(II) < Ni(II) < Cu(II) < Fe(III), достигая наибольшего значения для катионов железа (III).
Для создания препаратов пролонгированного действия на основе пиридин-3-карбоновой кислоты представляет интерес изучение сорбции пиридин-3-карбоновой кислоты из многокомпонентных водных растворов сульфокатионитом КУ-2, содержащим катионы металлов. Цель данной работы – определение стехиометрии комплексов пиридин-3-карбоновой кислоты с катионами Fe3+ в фазе сульфокатионита КУ-2 и значений констант равновесия сорбционных процессов с участием пиридин-3-карбоновой кислоты, Fe3+, H+ на основе экспериментальных данных о равновесном распределении компонентов между сульфокатионитом и водным раствором.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Сульфокатионит КУ-2 – сульфированный сополимер стирола с 4% дивинилбензола. Полная динамическая ионообменная емкость составляет 5.0 мэкв. на 1 г Н-формы сухого полимера. Полимер кондиционировали последовательной обработкой растворами NaCl, NaOH, HCl и H2О по известной методике [15] подготовки ионитов и затем промывали дистиллированной водой до рН фильтрата 5.5. Пиридин-3-карбоновая кислота соответствовала требованиям Международной фармакопеи [16], содержала не менее 99.0% основного вещества. Растворы электролитов готовили из FeCl3 ⋅ 6H2O квалификации “ч.д.а.”, HCl, NaCl, NaOH – квалификации “х.ч.”.
Равновесное распределение компонентов между водными растворами пиридин-3-карбоновой кислоты, хлорида железа (III) и сульфокатионитом КУ-2 изучали динамическим методом при температуре 298 К. Через ионообменную колонку, заполненную Н- или Fe(III)-формой полимера, пропускали многокомпонентные водные растворы до установления равновесия (до совпадения составов, pH исходного раствора и фильтрата). Интервал концентраций пиридин-3-карбоновой кислоты составлял 0.001–0.01 моль/л. После достижения состояния равновесия проводили десорбцию пиридин-3-карбоновой кислоты дистиллированной водой.
Для получения Fe(III)-формы полимера через ионообменную колонку, содержащую сульфокатионит КУ-2 в Н-форме, пропускали раствор 0.1 М FeCl3 при pH 1.5–2.5. Концентрацию пиридин-3-карбоновой кислоты в растворах определяли с помощью спектрофотометра СФ-46 при λ = 262.7 нм, рН 6.86. Эквивалентную долю компонента в полимере ${{\bar {x}}_{{\text{i}}}}$ рассчитывали как отношение количества эквивалентов компонента i к общему содержанию эквивалентов противоионов в сульфокатионите.
ИК-фурье-спектры получены на спектрометре “Инфралюм ФТ-801” в таблетках с KBr. Соотношение компонентов в растворе рассчитаны с использованием компьютерной программы HySS 2009 (Hyperquad Simulation and Speciation) [17].
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Известно, что в водном растворе пиридин-3-карбоновая кислота может находиться в виде молекул HL, катионов [H2L]+ и анионов (L–), анионы пиридин-3-карбоновой кислоты образуют с катионами Fe3+ комплексы состава 1:1 [14]. В водном растворе смеси пиридин-3-карбоновой кислоты с хлоридом железа (III) могут присутствовать молекулы HL и Fe(OH)3, катионы Fe3+, [FeOH]2+, [Fe(OH)2]+, [FeL]2+, [H2L]+ и H+, анионы L– и ОН–. Концентрации всех компонентов в водном растворе смеси пиридин-3-карбоновой кислоты и соли железа (III) позволяет рассчитать программа HySS 2009. Например, расчетный состав водного раствора, содержащего 0.01 моль/л пиридин-3-карбоновой кислоты и 0.003 моль/л FeCl3, приведен на рис. 2.
Рис. 2.
Зависимости концентрации компонентов в растворе, содержащем 0.01 моль/л пиридин-3-карбоновой кислоты и 0.003 моль/л FeCl3, от рН: [H2L]+ (1); HL (2); L– (3); Fe3+ (4); [FeL]2+ (5); [FeOH]2+ (6); [Fe(OH)2]+ (7); Fe(OH)3 (8).

В рассмотренных в данной работе гетерогенных системах, включающих сульфокатионит, водный раствор пиридин-3-карбоновой кислоты и соли железа (III), могут протекать реакции
(3)
$\overline {{{{\text{H}}}^{ + }}} + {\text{HL}} \to \overline {{{{{\text{[H}}_{{\text{2}}}^{{}}{\text{L]}}}}^{ + }}} ,$(5)
${\text{F}}{{{\text{e}}}^{{{\text{3}} + }}} + {{{\text{L}}}^{ - }} \to {{{\text{[FeL]}}}^{{{\text{2}} + }}},$(6)
$\overline {{\text{F}}{{{\text{e}}}^{{{\text{3}} + }}}} + {{{\text{L}}}^{ - }} \to \overline {{{{{\text{[FeL]}}}}^{{{\text{2}} + }}}} ,$(7)
$\overline {{\text{F}}{{{\text{e}}}^{{{\text{3}} + }}}} + {{{\text{[FeL]}}}^{{{\text{2}} + }}} \to \overline {{{{{\text{[FeL]}}}}^{{{\text{2}} + }}}} + {\text{F}}{{{\text{e}}}^{{{\text{3}} + }}},$(8)
${\text{F}}{{{\text{e}}}^{{{\text{3}} + }}} + {\text{O}}{{{\text{H}}}^{ - }} \to {{{\text{[FeOH]}}}^{{{\text{2}} + }}}.$По данным о константах равновесий (1)–(8) можно рассчитать противоионный состав сульфокатионита КУ-2, приведенного в равновесие с многокомпонентным водным раствором, содержащим пиридин-3-карбоновую кислоту и хлорид железа (III). Значения констант равновесий (1), (2), (5), (8) известны (табл. 1). Константа равновесия (3) лигандной сорбции пиридин-3-карбоновой кислоты H-формой катионита равна произведению констант равновесий (2) и (4), т.е K(3) = = K(2)K(4). Значения константы равновесия ионного обмена (4), рассчитанные по экспериментальным данным о равновесном распределении катионов Н+ и [H2L]+ между КУ-2 и водным раствором, приведены на рис. 3. Как видно, в исследованном интервале составов полимера значение константы ионного обмена K(4) составляет 3.5 ± 0.7. Следовательно, $\lg {{K}_{{(3)}}}$ = lg(K(2)K(4)) = 2.8 ± 0.1.
Таблица 1.
Константы равновесия реакций комплексообразования, лигандной сорбции и ионного обмена с участием пиридин-3-карбоновой кислоты, протонов и катионов железа (III)
Рис. 3.
Зависимость константы равновесия K(4) ионного обмена Н+ на [H2L]+ от эквивалентной доли катиона [H2L]+ в КУ-2 при 298 К.

Принимая во внимание, что в изученном интервале значений pH растворов:
а) концентрации Fe(OH)3, HL, Н+, [Fe(OH)2]+ в полимере и концентрации [Fe(OH)2]+, Fe(OH)3 в растворе стремятся к нулю;
б) полная концентрация пиридин-3-карбоновой кислоты в полимере равна сумме концентраций комплексных катионов [FeL]2+, [H2L]+;
в) полная концентрация железа в полимере равна сумме концентраций катионов Fe3+, [Fe(OH)2]+ и [FeL]2+;
г) полная концентрация противоионов в катионите (E), рассчитанная в молях однозарядных катионов в дм3 полимерной фазы, равна сумме концентраций H+, Fe3+, [Fe(OH)2]+, [FeL]2+ и [H2L]+, рассчитаем эквивалентные доли компонентов в полимере ${{\bar {x}}_{{{{{[{{{\text{H}}}_{{\text{2}}}}{\text{L}}]}}^{ + }}}}}$, ${{\bar {x}}_{{{{{[{\text{FeL}}]}}^{{2 + }}}}}}$, ${{\bar {x}}_{{{{{{\text{[FeOH]}}}}^{{2 + }}}}}}$ по уравнениям:
(9)
${{\bar {x}}_{{{{{[{{{\text{H}}}_{{\text{2}}}}{\text{L}}]}}^{ + }}}}} = \frac{{{{K}_{{(2)}}}{{K}_{{(4)}}}{{{\overline C }}_{{\text{H}}}}{{C}_{{{\text{HL}}}}}}}{E},$(10)
$\begin{gathered} {{{\bar {x}}}_{{{{{[{\text{FeL}}]}}^{{2 + }}}}}} = \\ = \frac{{2{{K}_{{(5)}}}{{K}_{{(7)}}}{{C}_{{\text{L}}}}}}{{{{K}_{{(2)}}}{{K}_{{(4)}}}{{C}_{{{\text{HL}}}}}{{{\bar {C}}}_{{\text{H}}}}{\text{/}}{{{\bar {C}}}_{{{\text{Fe}}}}} + 2{{K}_{{(5)}}}{{K}_{{(7)}}}{{C}_{{\text{L}}}} + 2{{K}_{{(8)}}}{{C}_{{{\text{OH}}}}}}}, \\ \end{gathered} $(11)
$\begin{gathered} {{{\bar {x}}}_{{{{{[{\text{FeOH}}]}}^{{2 + }}}}}} = \\ = \frac{{2{{K}_{{(8)}}}{{C}_{{{\text{OH}}}}}}}{{{{K}_{{(2)}}}{{K}_{{(4)}}}{{C}_{{{\text{HL}}}}}{{{\bar {C}}}_{{\text{H}}}}{\text{/}}{{{\bar {C}}}_{{{\text{Fe}}}}} + 2{{K}_{{(5)}}}{{K}_{{(7)}}}{{C}_{{\text{L}}}} + 2{{K}_{{(8)}}}{{C}_{{{\text{OH}}}}}}}. \\ \end{gathered} $На рис. 4 представлены зависимости эквивалентной доли в полимере компонентов, содержащих пиридин-3-карбоновую кислоту, от концентрации различных форм кислоты в водном растворе, рассчитанные с использованием значений констант равновесий, приведенных в табл. 1. Как видно, расчетные и экспериментальные данные практически совпадают. Это подтверждает правильность выбора реакций (1)–(8) и значений констант (табл. 1) для описания состояния термодинамического равновесия в многокомпонентной гетерофазной системе, содержащей КУ-2 и водный раствор смеси пиридин-3-карбоновой кислоты с хлоридом железа (III). Поэтому по константам равновесий комплексообразования, лигандной сорбции и ионного обмена, приведенным в табл. 1, можно провести расчет равновесного состава раствора, необходимого для получения сульфокатионита КУ-2 с заданным противоионным составом. Например, можно рассчитать состав равновесного раствора, позволяющего получить сульфокатионит КУ-2, в котором вся обменная емкость будет занята комплексами пиридин-3-карбоновой кислоты с железом ([FeL]2+), т.е. сумма эквивалентных долей остальных компонентов (${{\bar {x}}_{{{{{\text{H}}}^{ + }}}}}$, ${{\bar {x}}_{{{\text{F}}{{{\text{e}}}^{{3 + }}}}}}$, ${{\bar {x}}_{{{{{{\text{[FeOH]}}}}^{{2 + }}}}}}$и ${{\bar {x}}_{{{{{[{{{\text{H}}}_{{\text{2}}}}{\text{L}}]}}^{ + }}}}}$) будет стремиться к нулю, а соотношение металл/кислота в полимере будет равно 1 : 1. Согласно расчетам по уравнениям (9)–(11), полимер, содержащий в качестве противоионов только комплекс [FeL]2+ (${{\bar {x}}_{{{\text{[FeL]}}{}^{{{\text{2}} + }}}}}$ → 1), может быть получен из Н- и Fe(III)-форм КУ-2, приведенных в равновесие с растворами, имеющими соотношение молярностей катионов Н+ : [H2L]+ : Fe3+ : [FeL]2+, равное 1 : 1 : : 0.16 : 0.1. Вычисления по программе HySS 2009 показывают, что этим требованием удовлетворяет водный раствор 0.02 М пиридин-3-карбоновой кислоты и 0.003 М железа (III) при pH 2.0.
Рис. 4.
Зависимости эквивалентной доли соединений пиридин-3-карбоновой кислоты в КУ-2 от молярности различных форм кислоты в водном растворе: эквивалентная доля комплексов [FeL]2+ в полимере от молярности анионов пиридин-3-карбоновой кислоты L– в растворе (1); суммарная доля пиридин-3-карбоновой кислоты в полимере от ее суммарной молярности в растворе (2); эквивалентная доля катионов пиридин-3-карбоновой кислоты [H2L]+ в полимере от молярности молекул HL в растворе (3). Кривые – расчет по константам равновесия (уравнения (9), (10)), маркеры – эксперимент.

Для экспериментального подтверждения правильности выполненных расчетов катионит КУ-2 в исходных Н- или Fe(III)-формах поместили в ионообменные колонки и привели в равновесие с водными растворами расчетного состава. Анализ равновесного распределения пиридин-3-карбоновой кислоты и железа (III) между водным раствором и сульфокатионитом КУ-2 (табл. 2) показывает, что независимо от исходной противоионной формы в катионите, приведенном в равновесие с водным раствором, имеющими соотношение молярностей катионов Н+ : [H2L]+ : : Fe3+ : [FeL]2+, равное 1 : 1 : 0.16 : 0.1, все обменные центры заняты двухзарядным комплексом пиридин-3-карбоновой кислоты с железом. Содержание комплекса [FeL]2+ в сульфокатионите КУ-2 составляет 44.5% от массы полимера.
Таблица 2.
Равновесные составы раствора и сульфокатионита КУ-2, содержащего комплекс пиридин-3-карбоновой кислоты (HL) и железа (III) (ε – полная емкость колонки)
| КУ-2 | ε, мэкв | Равновесный раствор | Содержание в полимере | ||||
|---|---|---|---|---|---|---|---|
| [HL], моль/л | [Fe(III)], моль/л | рН | [Fe(III)], ммоль | [HL], ммоль |
[Me]/[А] | ||
| Н-форма | 4.0 | 0.02 | 0.00305 | 2.05 | 2.00 | 2.05 | 0.98 |
| Fe(III)-форма | 4.0 | 0.02 | 0.0028 | 2.06 | 1.97 | 2.08 | 0.95 |
В табл. 3 представлено отнесение полос в Фурье-ИК-спектре образца сульфокатионита КУ-2 в [FeL]2+-форме. Как видно, в спектрах КУ-2 (независимо от типа противоиона) интенсивные полосы в области 1000–1200 см–1 отвечают колебаниям в сульфокатионите на полистирол-дивинилбензольной матрице.
Таблица 3.
Волновые числа полос поглощения в фурье-ИК-спектрах пиридин-3-карбоновой кислоты (HL), ее натриевой соли (NaL) и сульфокатионита КУ-2 в различных противоионных формах в диапазоне 1800–1000 см–1
| HL | NaL | КУ-2 в противоионной форме | Отнесение | |||
|---|---|---|---|---|---|---|
| Н+ | [H2L]+ | Fe3+ | [FeL]2+ | |||
| 1712 s | – | – | 1728 s | – | – | νst (C=O)- группы СООН [21–23] |
| – | 1613 s | – | – | – | 1640 s | ${{\nu }_{{{\text{st as}}}}}$(COO–) [24, 25] |
| 1596 s | 1558 s | – | 1602 w | – | 1597 s | колебания пиридинового кольца [24] |
| 1416 s | 1407 s | – | 1411 s | – | 1421 s | ${{\nu }_{{{\text{st\;sy}}}}}$ (COO–) [24, 26] |
| – | – | 1212 s | 1212 s | – | 1214 s | колебания в сульфокатионите на полистирол-дивинилбензольной матрице [27] |
| – | – | 1150 s | 1160 s | 1148 s | 1153 s | |
| – | – | 1125 s | 1125 s | 1125 s | 1125 s | |
| – | – | 1033 s | 1033 s | 1034 s | 1033 s | |
| – | – | 1006 s | 1006 s | 1006 s | 1006 s | |
В спектрах всех соединений, содержащих пиридин-3-карбоновую кислоту, присутствуют полосы в диапазоне 1407–1421 см–1 (${{\nu }_{{{\text{st\;sy}}}}}$ COO–) и около 1600 см–1 (колебания пиридинового кольца). Интенсивная полоса 1712 см–1 в спектре пиридин-3-карбоновой кислоты HL, соответствующая валентным колебаниям C=O группы СООН, смещается до значения 1728 см–1 в спектре КУ-2, содержащем катионы протонированной пиридин-3-карбоновой кислоты [H2L]+. Эта полоса исчезает в спектре полимера в [FeL]2+-форме. В спектре кристаллической натриевой соли пиридин-3-карбоновой кислоты (NaL) отсутствует полоса 1712 см–1, но содержится интенсивная полоса 1613 см–1, соответствующая валентным колебаниям COO–. В спектре полимера, содержащем в качестве противоионов комплексы железа с анионами пиридин-3-карбоновой кислоты ([FeL]2+), полоса ${{\nu }_{{{\text{st}}\;{\text{as}}}}}$ (COO–) смещается до значения 1640 см–1. Фурье-ИК-спектры показывают, что в полимерной фазе анионы (L–) координируются с катионами Fe3+ через карбоксилатные атомы кислорода, образуя комплексные катионы [FeL]2+.
Таким образом, из данных материального баланса сорбционных процессов и Фурье-ИК-спектроскопии следует, что в фазе сульфокатионита анионы пиридин-3-карбоновой кислоты с Fe3+ образуют комплексы состава 1 : 1. Найденные значения констант равновесия ионного обмена и лигандной сорбции с участием пиридин-3-карбоновой кислоты, сульфокатионита КУ-2, протонов и катионов железа (III) позволяют рассчитывать равновесный состав раствора, необходимого для заполнения сульфокатионита КУ-2 заданным противоионным составом. Возможность получения сульфокатионита КУ-2, содержащего иммобилизованные комплексы пиридин-3-карбоновой кислоты и железа до 45% от массы полимера, на наш взгляд, представляет физико-химическую основу создания таргетных биологически активных препаратов пролонгированного действия на основе пиридин-3-карбоновой кислоты.
Работа выполнена в рамках государственного задания Института углехимии и химического материаловедения Федерального исследовательского центра угля и углехимии Сибирского отделения Российской академии наук (проект № АААА-А17-117041910146-5) с использованием оборудования Центра коллективного пользования Федерального исследовательского центра угля и углехимии Сибирского отделения Российской академии наук.
Список литературы
Smith K.E., Callahan M.P., Gerakines P.A. et al. // Geochim. Cosmochim. Acta. 2014. V. 136. P. 1. https://doi.org/10.1016/j.gca.2014.04.001
McMurtry B.M., Turner A.M., Saito S.E. et al. // J. Chem. Phys. 2016. V. 472. P. 173. https://doi.org/10.1016/j.chemphys.2016.03.010
Альтшулер Г.Н., Остапова Е.В., Альтшулер О.Г. и др. // Журн. прикладной химии. 2019. Т. 92. № 4. С. 484. https://doi.org/10.1134/S004446181904008X
Altshuler H., Ostapova E., Altshuler O. et al. // ADMET and DMPK. 2019. V. 7. № 1. P. 76. https://doi.org/10.5599/admet.626
Альтшулер Г.Н., Шкуренко Г.Ю., Остапова Е.В. и др. // Изв. АН. Сер. хим. 2017. № 7. С. 1177.
Альтшулер Г.Н., Остапова Е.В., Альтшулер О.Г. // Журн. физ. химии. 2019. Т. 93. № 4. С. 579. https://doi.org/10.1134/S0044453719040034
Альтшулер Г.Н., Остапова Е.В., Малышенко Н.В., Альтшулер О.Г. // Изв. АН. Сер. хим. 2017. № 10. С. 1854.
Куранова Н.Н., Чеснокова Н.А., Гущина А.С., Граждан К.В., Шарнин В.А. // Журн. физ. химии. 2020. Т. 94. № 10. С. 1496. https://doi.org/10.31857/S0044453720100179
Kumar M., Yadav K.A. // Spectrochimica Acta Part A. 2011. V. 79. P. 1316. https://doi.org/10.1016/j.saa.2011.04.062
Ерина О.В., Хохлов В.Ю., Бутырская Е.В., Нечаева Л.С. // Журн. общ. химии. 2013. Т. 83. № 3. С. 379.
Lal A., Shukla N., Singh D.K. // J. Chem. Pharm. Res. 2015. V. 7. № 9. P. 590.
Fei H., Lin Y. // Journal of Colloid and Interface Science. 2016. V. 481. P. 256. https://doi.org/10.1016/j.jcis.2016.07.056
Marsh J.L., Wayman A.E., Smiddy N.M. et al. // Langmuir. 2017. V. 33. № 46. P. 13224. https://doi.org/10.1021/acs.langmuir.7b03338
Shaikh Abdul Rahim, Sayyed Hussain, Mazahar Farooqu // Int. J. Chem. Sci. V. 12. № 4. 2014. P. 1299.
Мархол М. Ионообменники в аналитической химии. M.: Мир, 1985. Ч. 1. 264 с.
The International Pharmacopoeia, Fifth Edition. http://apps.who.int/phint/en/p/docf.
HySS 2009. Hyperquad Simulation and Speciation, Protonic Software, Leeds (UK), Universita di Firenze, Firenze (Italy), 2009. http://www.hyperquad.co.uk/hyss.htm.
Rajhi Aisha Y., Ju Yi-Hsu, Angkawijaya Artik E. et al. // J. Solution Chem. 2013. V. 42. P. 2409.
The IUPAC Stability Constants Database. http://www.acadsoft.co.uk/scdbase/scdbase.htm.
El-Dessouky M.A., El-Ezaby M.S., Shuaib N.M. // Inorganica Chimica Acta. 1980. V. 46. P. 7. https://doi.org/10.1016/S0020-1693(00)84161-4
Fazary Ahmed E., Ju Yi-Hsu, Rajhi Aisha Q. et al. // Open Chem. 2016. V. 14. P. 287. https://doi.org/10.1515/chem-2016-0028
Lal A., Shukla N., Singh V.B. et al. // J. Chem. Pharm. Res. 2016. V. 8. № 4. P. 136.
Singh Priyanka, Singh N.P., Yadav R.A. // J. Chem. Pharm. Res. 2011. V. 3. № 1. P. 737.
Morsy A.M. Abu-Youssef // Polyhedron. 2005. V. 24. № 14. P. 1829. https://doi.org/10.1016/j.poly.2005.05.026
Абрамова Л.П., Альтшулер О.Г., Малышенко Н.В. и др. // Химия в интересах устойчивого развития. 2015. Т. 23. № 2. Р. 151.
Taqa A.A., Al-Kassar I.A., Iyoob Sh. A. // Intern. J. for Research in Applied Science & EngineeringTechnology (IJRASET). 2014. V. 2. № XI. P. 350. https://www.ijraset.com/fileserve.php?FID=1311.
Free Online Spectral Library from Bio-Rad. https://spectrabase.com/compound/7SSYqD9hehI.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии


